水培营养液离子浓度对脱毒马铃薯生长发育和光合性能的影响
2017-04-13张晓勇唐道彬王季春蒋玉春敬夫卢会翔罗玉龙黄廷荣舒进康
张晓勇,唐道彬*,王季春*,蒋玉春,敬夫,卢会翔,罗玉龙,黄廷荣,舒进康
(1.西南大学农学与生物科技学院,重庆北碚400715;2.重庆市酉阳县农业委员会,重庆酉阳408800;3.重庆市巫溪县农业委员会,重庆巫溪405800)
水培营养液离子浓度对脱毒马铃薯生长发育和光合性能的影响
张晓勇1,唐道彬1*,王季春1*,蒋玉春1,敬夫1,卢会翔1,罗玉龙1,黄廷荣2,舒进康3
(1.西南大学农学与生物科技学院,重庆北碚400715;2.重庆市酉阳县农业委员会,重庆酉阳408800;3.重庆市巫溪县农业委员会,重庆巫溪405800)
通过研究不同离子浓度的营养液对水培马铃薯植株生长发育、叶片光合性能和结薯性能的影响,明确水培马铃薯在各个生长发育期对营养液离子浓度的要求,为水培马铃薯高效栽培营养液管理技术提供理论依据。本试验以早熟马铃薯品种“渝薯1号”和晚熟马铃薯品种‘鄂薯5号’为材料,研究了营养液的离子浓度对水培脱毒马铃薯植株生长发育、根系活力、光合作用、叶绿素荧光和微型薯产量的影响。当营养液离子浓度为3186.38 mg·L-1,EC值为2.91 ms·cm-1时,2个品种的微型薯数量和产量最高;在块茎膨大期,该处理下的根系活力、净光合速率(Pn)、最大光化学效率(Fv/Fm)、PSⅡ实际量子产额(ΦPSⅡ)、光合电子传递速率(ETR)和光化学猝灭(qP)等均提高。4248.51 mg·L-1的高浓度处理虽然可以促进地上部分生长、叶绿素合成和匍匐茎形成,但不利于块茎形成,推迟结薯,还会引起早熟品种渝薯1号叶片和根系早衰。低营养液离子浓度(C≤2124.26 mg·L-1)处理可促进块茎提早形成,但植株叶面积、根系活力、Pn、Fv/Fm、ΦPSⅡ、ETR和qP较低,降低叶片光合速率和光化学效率,匍匐茎形成少,使微型薯产量降低。营养液离子浓度为3186.38 mg·L-1时最适合马铃薯全程生长,而在马铃薯植株块茎形成前可适当提高营养液浓度,块茎形成期和膨大期应适度降低营养液浓度,可有效提高水培马铃薯微型薯产量。
脱毒马铃薯;微型薯;离子浓度;水培;根系生长;光合特性;叶绿素荧光
马铃薯(Solanum tuberosum L.)是世界上继水稻、小麦和玉米之后的第四大农作物。脱毒种薯的生产是提高马铃薯产量的一项重要技术。目前生产上主要采用基质栽培生产脱毒微型薯,但基质栽培最大的缺点就是结薯较少,一般每株结微型薯1~2粒,还需要大量的脱毒苗来进行密植才能保证产量,生产费时费力,繁殖效率低下[1],随着脱毒原原种的推广,急需要探寻繁殖率更高的生产技术。近年来,马铃薯雾化栽培技术的应用,扩大了单株繁殖率,单株结薯数可达到几十个甚至上百个,而且可以连续收获[2],但雾培设施复杂,成本和生产管理技术要求高,最致命的缺点是喷头容易堵塞,水泵启闭频繁容易损坏,以及由水分蒸发而造成的营养液浓度骤变。Dong Chil Chang等[3]比较了雾培、半雾培和水培3种方式来生产脱毒微型薯,发现与雾培相比,水培设备简易,成本较低,管理方便,短时间断电不影响植株生长,最重要的是其营养液pH值和EC值稳定,营养液缓冲能力更好,更加便于营养液管理。前人研究发现,营养液中的无机离子营养水平特别是氮素水平可以调节地上部分营养生长和地下部分结薯生长[2,4];营养液离子浓度会改变根系形态结构而影响无机离子吸收和利用,影响植物生长发育[5]。水培植物高产的关键就是要保证植株有庞大的根系和较高的根系活力,根系活力越高,根系对营养液中营养的吸收越强。马铃薯的生长发育特性,有别于其他观赏类和叶菜类植物,水培营养液既要保证马铃薯地上枝叶健壮生长,还要有利于地下匍匐茎和块茎的生长。目前,针对微型薯生产营养液浓度的研究主要从马铃薯植株的生长发育和微型薯产量来进行,而不同营养液浓度处理对马铃薯植株根系发育、叶片光合速率和叶绿素荧光特性等还鲜有报道。本实验采用营养液膜水培技术(Nutrient flow technical,NFT),设置一系列离子浓度的营养液进行脱毒马铃薯苗的培育,来研究不同离子浓度的营养液对马铃薯水培苗生长发育、根系生长、叶片光合性能、叶绿素荧光特性和微型薯产量的影响,并进行各个指标间的相关性分析,研究适宜不同熟性马铃薯品种的营养液离子浓度,为微型薯水培生产过程中营养液管理提供理论依据。
1 材料与方法
1.1 供试马铃薯材料
采用鄂薯5号(E’shu No.5)和渝薯1号(Yushu No.5)2个马铃薯品种的脱毒苗进行试验。鄂薯5号为晚熟品种,渝薯1号为中早熟品种,脱毒苗由西南大学薯类作物研究所提供。
1.2 试验方法
试验于2014年9月至2015年2月在西南大学薯类作物研究所马铃薯设施栽培温室内进行。水培槽由钢材焊接而成,规格为120 cm×370 cm×20 cm,底部和侧边铺设防水不易变形板材,槽内铺设塑料防渗薄膜(图1)。供试材料的脱毒组培苗揭掉瓶盖在室温下炼苗23 d,再将苗从组培瓶中取出后去掉老根并洗净,在50 mg·L-1IBA溶液中浸泡20 min后定植于马铃薯脱毒种薯生产专用定植板上,定植密度10 cm×10 cm,同一槽中随机种植2个马铃薯品种。在微量元素和铁盐浓度[6]保持不变的前提下,相同配方的大量元素母液以一定浓度梯度配制离子浓度约为4000、3000、2000和1000的4种营养液,编号为M1、M2、M3和M4,每个栽培槽提供一种营养液,4种营养液大量元素配方及其实际离子浓度和电导率(Electrical conductivity,EC)如表1所示,每个栽培槽内配制200 L营养液。试验设计采用随机区组设计,2次重复。配制好后调节pH至5.8±0.2。待植株生长20 d根系发达后,在栽培板下架设特制支架,将栽培板撑起离槽底5 cm,保证有充足结薯空间。栽培槽底前期保持2~3 cm营养液膜,中后期降至1 cm左右,保证根与空气充分接触,营养液每隔30 min强制循环1次,每次流动3 min。营养液池内安装液体恒温机组,保证营养液温度在18~20℃。营养液每7 d全部更换1次。
1.3 测定项目
营养液的pH值和电导率(EC值)用pH计和电导仪测定。定植30 d后,在每个小区随机选取3株来测定植株生长情况,重复2次,植株生长发育指标包括植株的叶面积,地上鲜重,地上干重,地下鲜重,地下干重(地下部分包括根系、匍匐茎和块茎)以及地下干重/地上干重。根系长度和体积用植物根系形态分析系统(LC-4800,加拿大)测定。叶绿素含量每隔15 d采马铃薯植株倒四叶去掉主叶脉后剪碎,用分析天平称取0.1000 g碎叶片放入干洁的25 mL离心管中,再加入10 mL的丙酮︰乙醇=2︰1的混合提取液,盖紧盖子后放至黑暗的环境中浸提48 h直至叶片变白。抽取上清液至分光光度计中分别在663和645 nm读取吸光值A663和A645。则提取液中叶绿素a和叶绿素b浓度(mg·L-1)为:
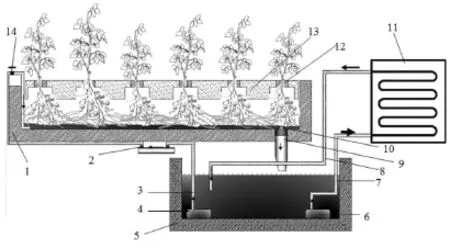
图1 马铃薯脱毒苗营养液膜水培系统Fig.1 NFT system for growing potatoes
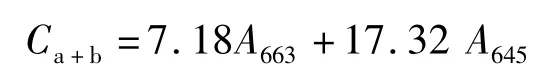
则新鲜叶片组织中叶绿素含量W(mg·g-1)为:
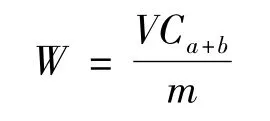
式中,V为提取液体积(10 mL),m为叶片样品鲜重;根系活力测定采用TTC法[8]。植株倒四叶的气体交换参数用Li-6400便携式光合测定系统(Li-Cor Inc,美国)测定,采用开放气路,光量子通量密度(PFD)设定为1000μmol·m-2·s-1,叶室温度控制在25℃,内置CO2浓度设定为400μmol·m-2· s-1。叶片叶绿素荧光动力学参数用Mini-PAM便携式叶绿素荧光仪(WALZ,德国)测定,最大光化学效率(Fv/Fm),实际光化学效率(ΦPSⅡ),电子传递速率(ETR)和光化学猝灭系数(qP)4个荧光参数由荧光仪系统软件计算得出。
1.4 数据处理
试验据采用DPS v7.55软件进行数据统计、方差分析和多元相关性分析,图表用Microsoft Excel 2010绘制。
2 结果与分析
2.1 不同营养液浓度对马铃薯植株生长的影响
如表2所示,在定植30 d时,2个马铃薯品种的地上部分鲜重、地上部分干重和单株叶面积在M1和M2 2个离子浓度处理下最大;在定植45 d时,M2处理下2个马铃薯品种植株的地下鲜重和地下干重均显著显著高于其他3个浓度处理。低浓度营养液处理下的植株地下干重/地上干重大于高浓度营养液处理。2个时期的整株干重都是在M2离子浓度处理下最大,说明M2离子浓度处理最有利于水培马铃薯植株的干物质积累。2个时期在M1和M2
2个浓度处理下植株叶面积均显著大于M3和M4 2个低浓度处理。
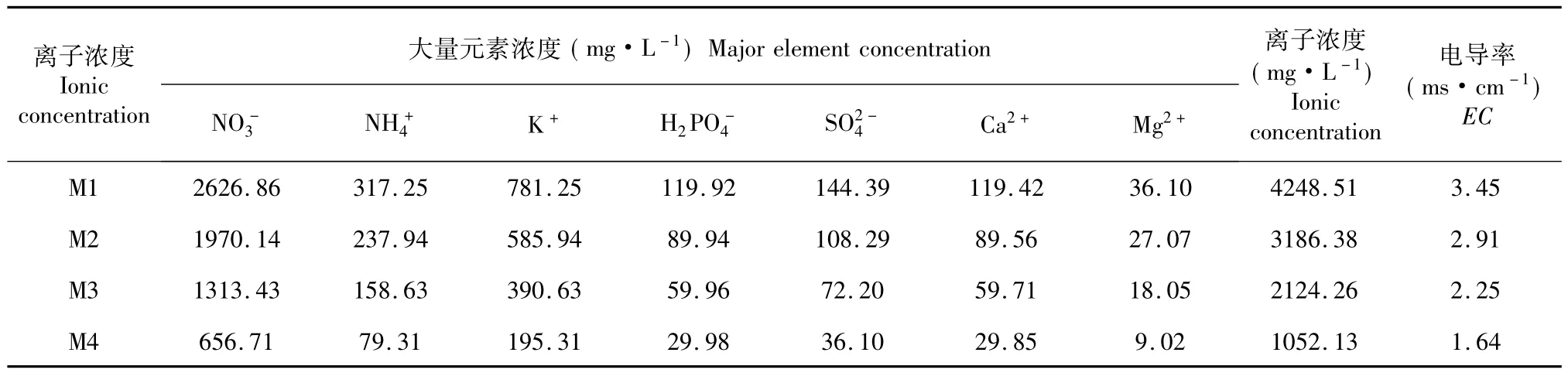
表1 4种浓度营养液大量元素配方Table 1 Macro-element concentration of four nutrient solutions
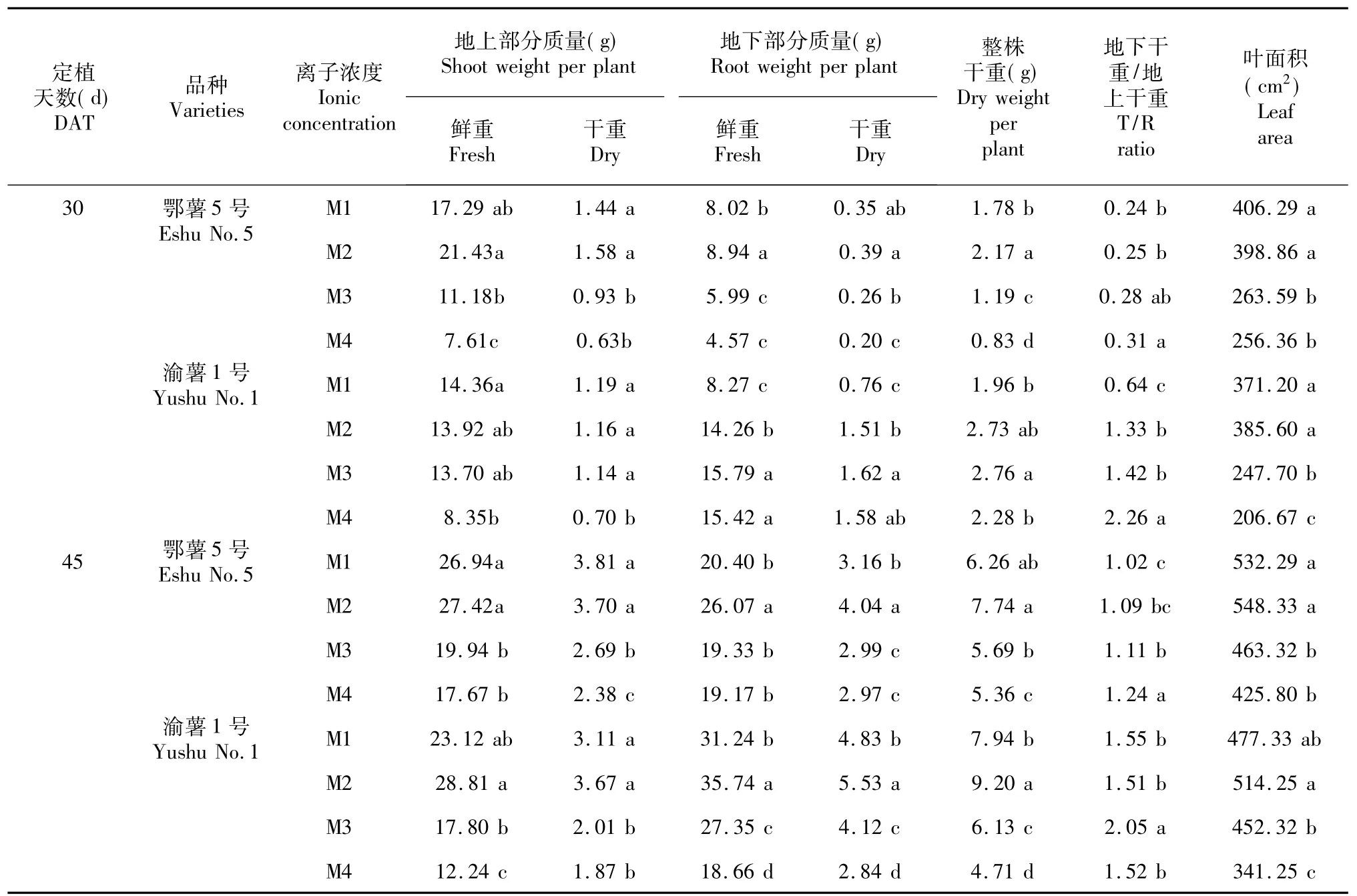
表2 不同离子浓度对马铃薯植株生长的影响Table 2 Effects of different ionic concentration on potato plant growth and development of two cultivars
2.2 不同浓度营养液处理的植株叶绿素含量变化
如表3所示,马铃薯叶绿素含量在定植时(DAT =0)幼苗的叶绿素含量较低,在30 d时达到最大值,45 d后又逐渐下降,60 d时最低,特别是早熟品种渝薯1号显著降低。定植30~60 d 2个品种的叶绿素含量基本上都是随着营养液浓度的降低而下降,说明丰富的营养液能促进叶片叶绿素的合成,延缓叶片衰老。
2.3 不同浓度营养液下植株根系生长和根系活力的变化
如表4所示,鄂薯5号根系活力在定植60 d时显著下降,渝薯1号根系活力在定植45 d时就开始下降,至60 d时根系还原力极低。30~45 d时,鄂薯5号在M2离子浓度处理下根长最长,而根体积在M1下最大;渝薯1号的根长在M1、M2和M3浓度处理下无显著差异,M4最低,根体积在M1和M2处理下高于M3和M4处理。说明水培马铃薯根系在高浓度营养液中偏向于径向增粗使体积增大,营养液浓度较低不利于根系生长。60 d时,鄂薯5号的根长和根体积都在M1营养液下最大,且根长和根体积值随营养液浓度降低而减小,说明晚熟品种在后期提供充足的营养可减弱根系衰老。定植30~60 d内,植株根系活力在M2离子浓度处理下最高,说明在马铃薯生长中期营养液离子浓度过高过低都会对根系代谢造成影响。
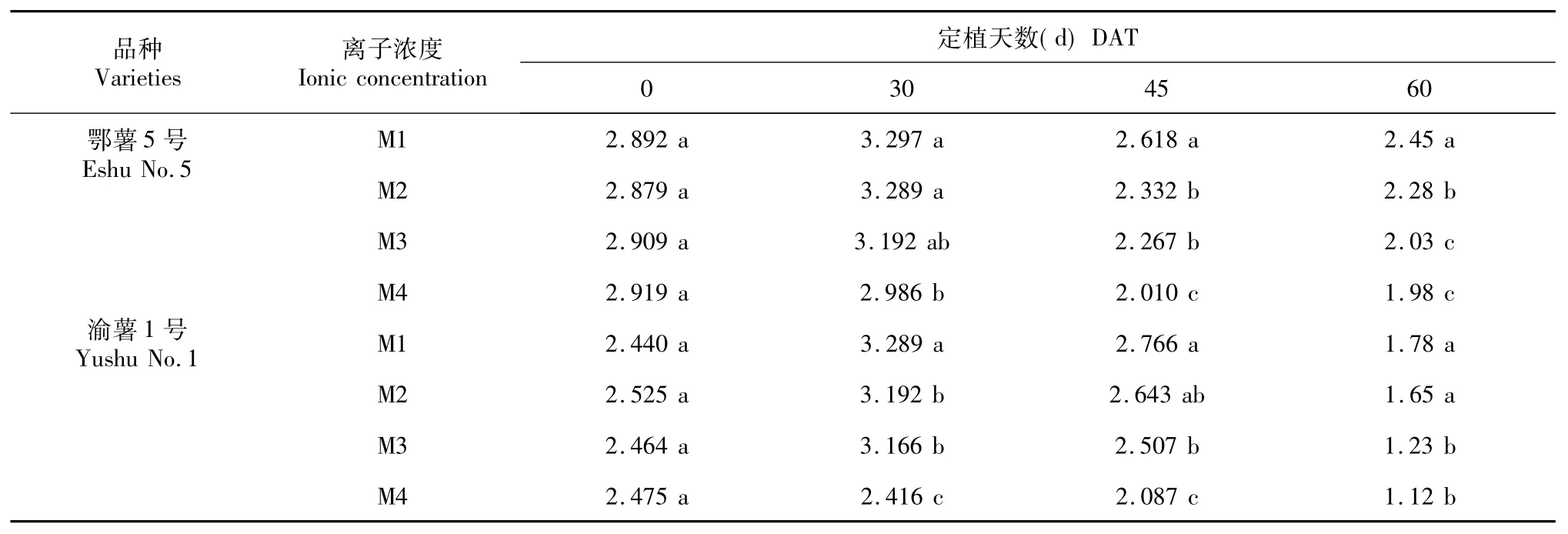
表3 不同离子浓度对马铃薯叶绿素总含量的影响Table 3 Effects of different ionic concentration on potato leaves content of chlorophyll (mg·g-1)
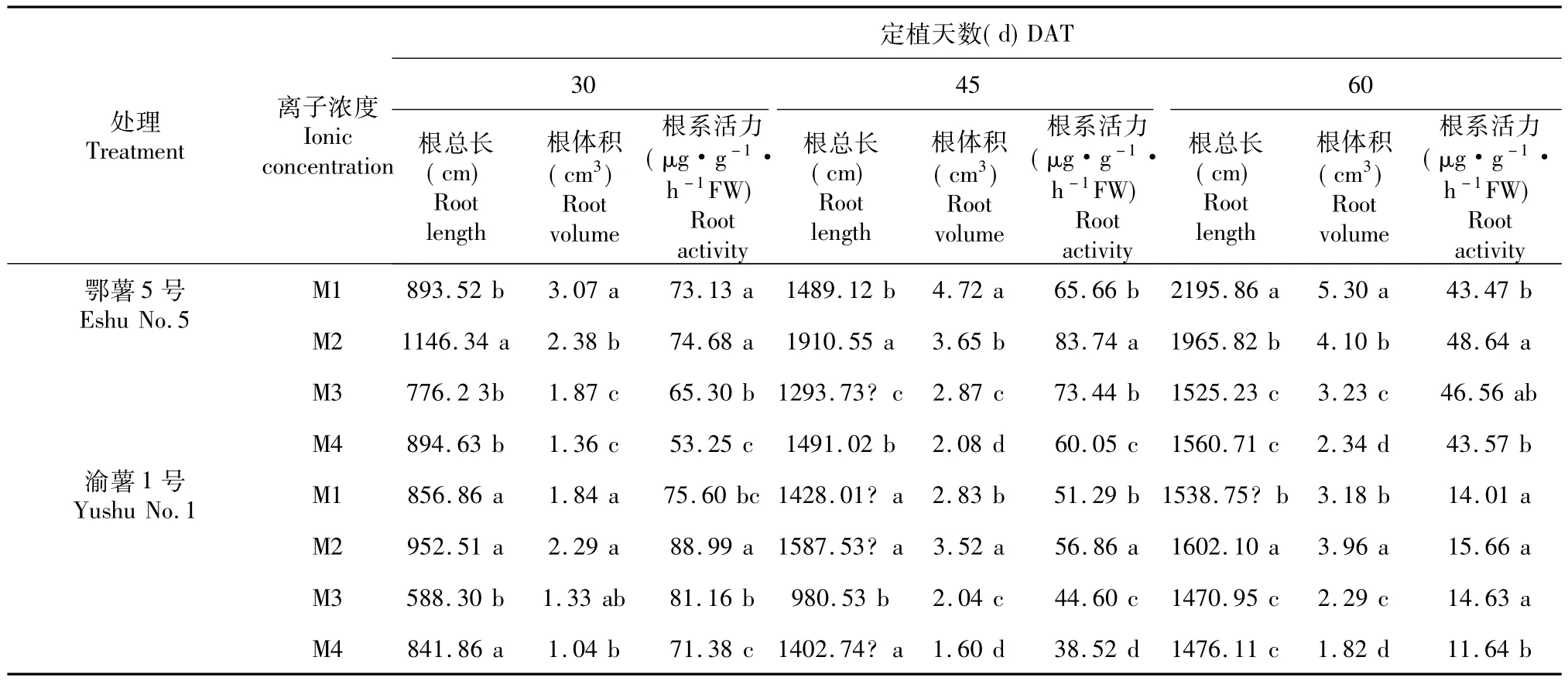
表4 不同离子浓度对马铃薯4个生长期根长,根体积和根系活力的影响Table 4 Effects of different ionic concentration on total root length,root volume and root activity of two cultivars
2.4 不同离子浓度营养液下植株气体交换
不同离子浓度处理下马铃薯植株净光合速率(Pn)和气孔导度(Gs)变化如图2A~D所示。在3个时期,晚熟品种鄂薯5号的Pn和Gs在M1和M2 2个离子浓度处理下显著高于M4处理,早熟品种渝薯1号在30~45 d的Pn在M2离子浓度处理下最大,M1处理下的Pn反而下降。低离子浓度M4处理后植株的Pn和Gs都显著降低。
2.5 不同离子浓度处理下的叶片荧光动力学参数
叶绿素动力学荧光参数如图3A~H所示。定植30 d时,2个品种在M1和M2处理下的Fv/Fm、ΦPSⅡ和ETR无显著差异,但qP在M2处理下最高。45 d时M2处理下的Fv/Fm、ΦPSⅡ、ETR和qP都显著高于高浓度营养液M1。2个低浓度M3和M4处理的植株Fv/Fm、ΦPSⅡ、ETR和qP均显著下降。
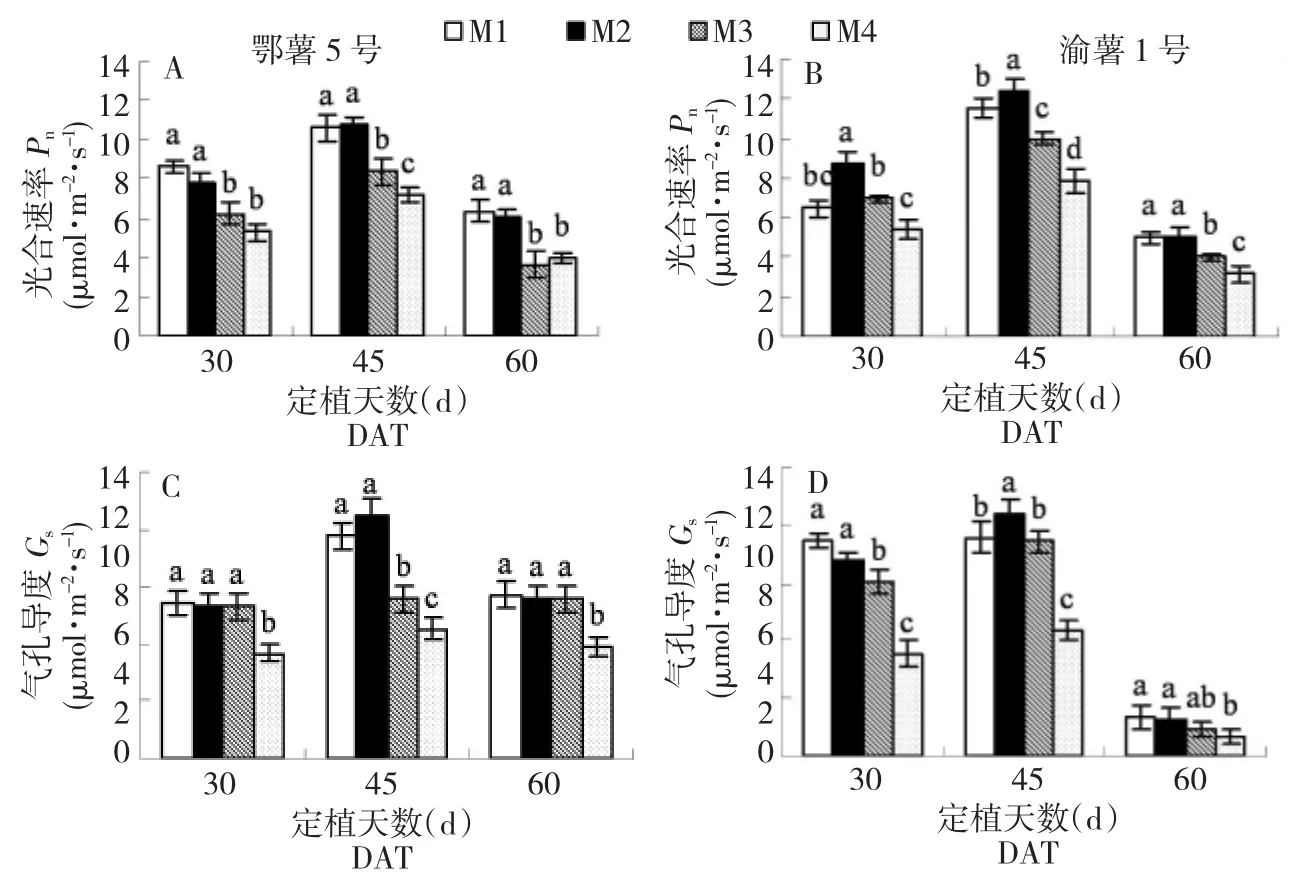
图2 不同营养液浓度对马铃薯3个生长期光合速率(Pn)和气孔导度(Gs)的影响Fig.2 Effects of four nutrient solutions on photosynthetic rate(Pn)and stomatal conductance(Gs)of two cultivars in three periods
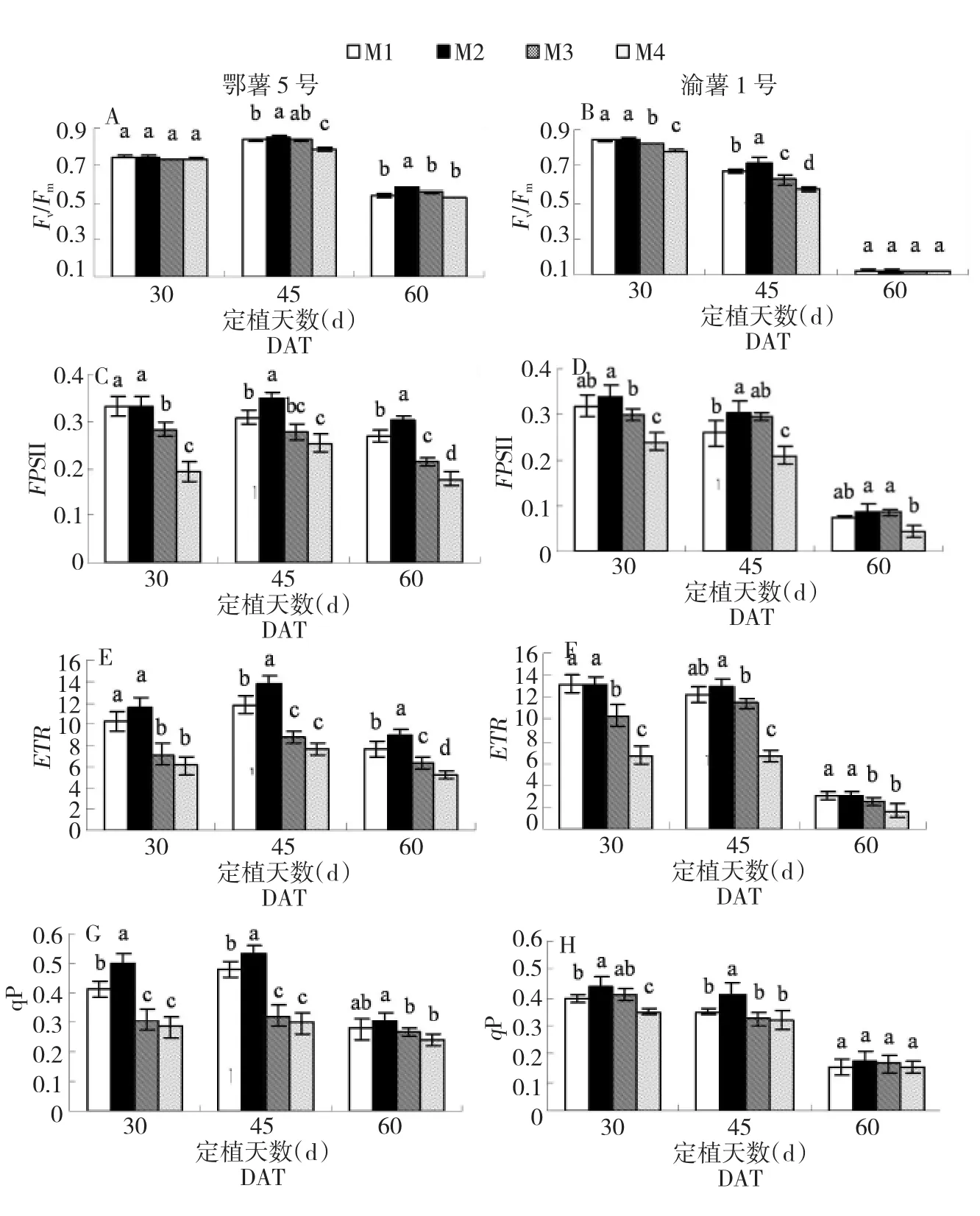
图3 不同浓度处理下马铃薯叶片Fv/Fm、ΦPSⅡ、ETR和qP的变化Fig.3 Effects of four nutrient solutions on Fv/Fm,ΦPSⅡ,ETR and qP of two cultivars in three periods
2.6 不同离子浓度处理的马铃薯单株产量
如表5所示,鄂薯5号在M1营养液处理下单株匍匐茎数分别比M2、M3和M4高17.12%、73.42%、150.08%;渝薯1号在M1营养液处理下单株匍匐茎数分别比M2、M3和M4高17.19%、83. 80%和117.25%。而M2营养液下的单株结薯最多,鄂薯5号在M2营养液处理下单株结薯数分别比M1、M3和M4高23.24%、32.22%、124.31%;渝薯1号在M2营养液处理下单株结薯数分别比M1、M3和M4高19.21%、33.54%和74.48%。鄂薯5号的单株结薯质量在M2营养液处理下最大,达到了48.99 g,分别比M1、M3和M4重15.54 %、58.65%和205.80%,达到了5%显著水平;渝薯1号的单株结薯质量在M1处理下最大,分别比M2、M3和M4重5.3%、71.69%和167.96%。M1处理下的平均单薯重最大。
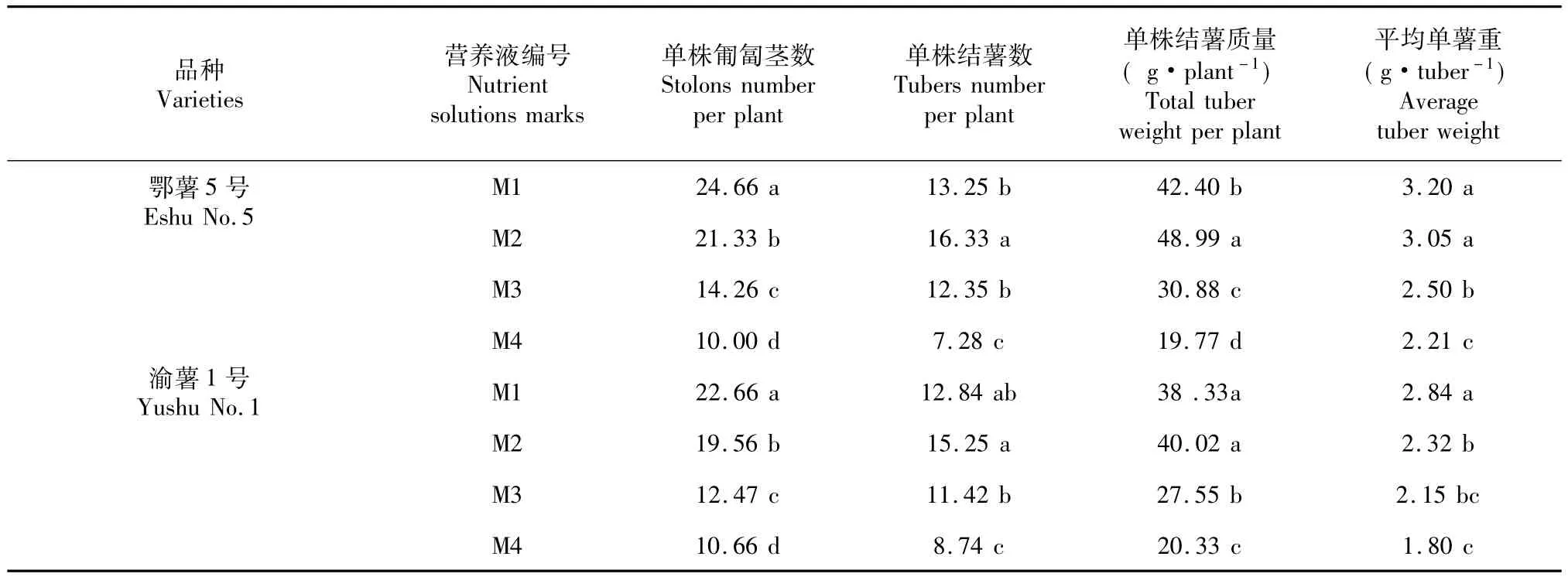
表5 不同营养液处理对微型薯产量的影响Table5 Effects of four nutrient solutions onmicro-tuber yields of two cultivars
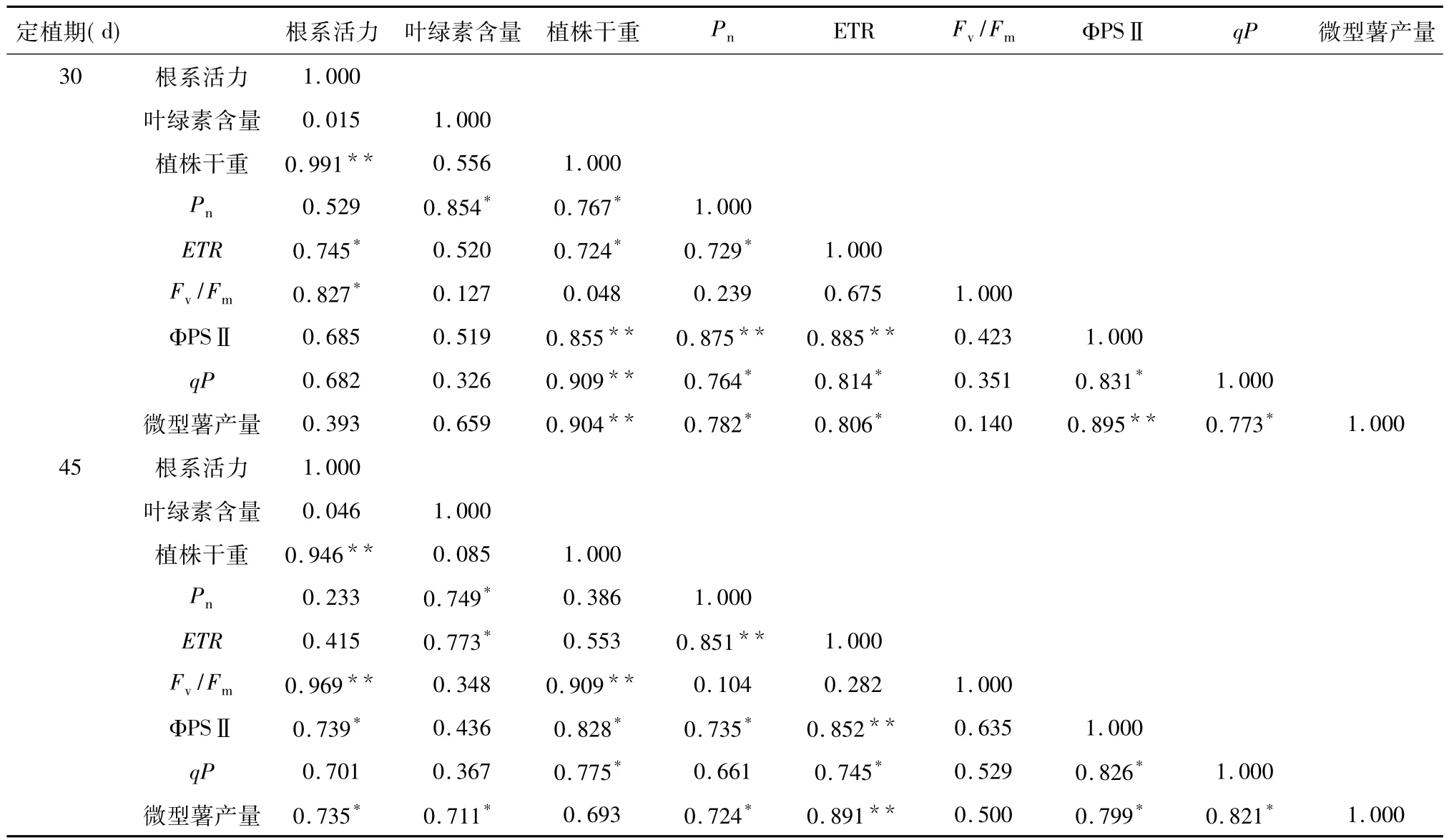
表6 2个生育期植株生理特性、光合指标、叶绿素荧光参数与微型薯产量的相关性分析Table 6 Correlation analysis of yield ofmicro-tuber,physiological and plant growth and development indexes in two periods
2.7 各指标间相关性分析
水培马铃薯在不同生育阶段,各个指标间的相关系数差异显著性水平不同(表6)。在定植30 d时,植株根系活力与植株干重、ETR和Fv/Fm呈显著或极显著正相关关系;叶绿素含量只与Pn呈显著正相关;植株干重与根系活力、Pn、ETR、ΦPSⅡ和qP等指标呈显著正相关,说明马铃薯植株块茎形成期的干物质积累受根系活力和植株光合性能的影响。定植45 d时,植株干重与根系活力、Fv/Fm、ΦPSⅡ和qP等指标呈显著或极显著正相关,说明植株块茎膨大期的干物质积累受根系活性和植株光合系统开放性的影响。微型薯的产量在块茎形成期与植株干重、Pn、ETR、ΦPSⅡ和qP等指标呈显著正相关关系,而块茎膨大期与根系活力、叶绿素含量、Pn、ETR、ΦPSⅡ和qP呈显著正相关关系,说明在块茎形成期块茎产量主要受到植株植株地上部分健壮程度和光合性能的影响,而块茎膨大期块茎产量主要受到植株根系活力、叶绿素含量和光合性能的影响。
3 讨论
地下干重与地上干重之比能反映出马铃薯地下部分和地上部分相对生长发育情况。本实验中,M3和M4 2个低离子浓度营养液不利于地上部分茎叶生长,但可诱导块茎提早形成,使地下干重与地上干重之比增大。M1和M2 2个浓度营养处理的植株地上部分生长健壮,但块茎形成推迟,因此30 d的地下干重与地上干重之比很低。在M1高浓度处理下结薯显著推迟,地下干重与地上干重之比较低。外界不良生长条件如缺氮、低温、低pH值和干旱胁迫等会抑制地上茎叶生长,加快同化物运至块茎[2,4],使块茎提早形成,最终因为作为“源”的地上叶片生长不良而限制块茎产量形成。高离子浓度营养液中高水平氮素供应会提高马铃薯内源GA含量,使ABA/GA比值下降,促进植株地上枝叶徒长,延迟微型薯的形成[2,5,7]。因此,从植株地上地下生长情况和营养液肥料利用率来考虑,M2营养液就适合马铃薯水培苗营养生长期的需求。
水培植株发达的根系和较高的根系活力是保证微型薯高产优质的关键。植物根系对水分和养分有趋向性,从而改变根系的形态[5]。除了氮素,营养液中钙[9]、磷[10]和钾[11]等元素都对根系生长有影响。实验结果表明,高浓度营养液有利于扩大根系体积,根系径向增粗,而在低浓度下根系细弱,这与刘世全等[13]的研究结果一致。植物在低营养环境中的植物根系横向伸长是趋肥性的表现[14]。根系活力表征根系对养分和水分吸收能力的强弱,影响水培植物根系活力主要的因素是营养液含氧量[15]、pH值[16-17]以及无机离子浓度[18]。M1高浓度营养液处理虽有利于根体积增大,但进入生长中后期根系活力显著下降快,也许是因为植株过多的氮素供应对根系活力的负效应[19]。营养液养分亏缺,特别是氮磷钾供应不足,导致根系发育缓慢,相关代谢酶和功能蛋白合成不足,物质和能量交换缓慢,从而影响根系活力[20-22]。
气孔是叶片光合作用吸收CO2的主要入口,因此气孔导度Gs对光合速率具有重要影响。本研究中,马铃薯在M1和M2 2个高离子营养液处理下可促进叶绿素合成。晚熟品种鄂薯5号在M1和M2 2个营养液处理下Gs,Pn水平一直都最高;早熟品种渝薯1号定植30 d时在M1浓度处理的Pn显著低于M2处理,45 d时M1营养液处理下的Gs也显著下降,说明高离子浓度营养液不适宜渝薯1号叶片光合,生长中后期气孔限制是Pn下降的主要因素。M1和M2 2个营养液中氮含量较高,可促进叶绿素合成,提高叶绿体内类囊体蛋白的水平[23],提高RubisCO酶的活性和增强光合电子传递[24],从而提高植物光合速率。马铃薯植株的Pn和Gs从定植30~45 d其光合速率均呈上升趋势,这与黄承建等[25]的研究结果相似,Pn在马铃薯块茎形成期和膨大期增大可为马铃薯块茎生长提供充足的碳水化合物。
最大光化学效率(Fv/Fm)是经暗适应处理后测得的值,可用作表征PSⅡ原初光能转换效率的高低,若Fv/Fm大幅度降低,则反映出植物受到生长胁迫[26]。实际光化学效率(ΦPSⅡ)是PSⅡ反应中心部分关闭的情况下电子在PSⅠ和PSⅡ的实际传递效率,电子传递速率(ETR)衡量实际条件下的表观光化学电子传递速率;光化学猝灭系数(qP)是PSⅡ天然色素吸收的光能用于光化学电子传递的份额[27]。本实验中,定植30 d时M1和M2浓度处理下Fv/Fm无显著差异,但45 d时M1浓度处理的Fv/Fm显著下降,说明高浓度营养液处理的植株在块茎膨大时出现了渗透胁迫,导致Gs减小,Pn下降,这与孙璐等[28]和李学孚等[29]人工模拟水分胁迫所得到的结果相似,这一变化在早熟品种渝薯1号上尤为明显。在M1营养液处理下,定植30 d qP显著下降,45 d时ΦPSⅡ、ETR和qP均下降,说明高离子浓度在块茎形成期影响PSⅡ开放,而块茎膨大期不仅影响PSⅡ开放,还影响光合电子传递,使非光化学能量耗散加强[30-31]。低离子浓度营养液处理下,由于元素亏缺而影响叶绿素合成、光合酶活性[31]和光合电子传递系统构建[32],导致CO2同化率和PSⅡ开放程度下降,非光合能量耗散增强。
马铃薯的块茎形成可分为匍匐茎形成期、块茎诱导期、块茎形成期3个时期,其形成过程受到一系列植物激素的调控[33]。很多外界因素如光照、温度、施肥等都会影响马铃薯内源激素的合成及分配,从而影响块茎的形成[34]。实验结果表明,最适宜块茎形成及膨大的营养液离子浓度为3186.38 mg· L-1,过高的离子浓度不利于块茎形成,产生很多无效匍匐茎;过低离子浓度处理养分亏缺,匍匐茎和块茎数量少,块茎膨大缓慢,影响微型薯产量[35]。高氮水平促进植物内源GA合成,使ABA/GA比值降低,促进匍匐茎大量发生,不利于块茎的形成[36],打破马铃薯“库”和“源”的平衡,促进枝叶的繁茂生长,而作为“库”的块茎分配到的同化物少,因而延缓块茎的形成和膨大[9]。Gregory[4]认为,水培马铃薯到结薯期后减少营养元素特别是氮素供应,可加快光合同化物向块茎转移,并提高氮利用率。
4 结论
马铃薯微型薯水培生产中提供合适的离子浓度的营养液,不仅可以改善马铃薯块茎和叶片“库”和“源”的供需矛盾,还能改善叶片的光合性能以及提高根系活力。本实验研究表明,当营养液离子浓度为3186.38 mg·L-1,EC值为2.91 ms·cm-1时,块茎膨大期的叶面积和根体积较大,匍匐茎形成量较多,成薯率较高,根系活力、光合速率和PSⅡ电子传递速率较高,PSⅡ开放程度大,光化学电子传递速率增强,微型薯数量和产量最高。营养液离子浓度过高过低都会影响叶片光合性能和降低根系生长代谢,不利于微型薯产量的提高。较低营养液离子浓度营养液可提高成薯率,但植株叶面积和根体积小,匍匐茎形成少,光合速率低,使微型薯产量和数量下降。在马铃薯植株块茎形成前可适当提高营养液浓度培育壮苗,增加叶面积,促进匍匐茎形成,改善光合性能;块茎形成期和膨大期应适度降低营养液浓度,促进匍匐茎尖端形成块茎,提高根系活力和改善叶片光合性能是提高微型薯产量的关键措施。
[1]杨元军,孙慧生.马铃薯脱毒小薯雾培结薯特点及增产效果[J].园艺学报,2002,29(4):333-336.
[2]Hesham Oraby,AndréLachance,Yves Desjardins.A low nutrient solution temperature and the application of stress treatment increase potatomini-tubers production in an aeroponic system[J].American Journal of Potato Research,2015,92(3):387-397.
[3]Dong Chil Chang,Choun Soo Park,Sung Yeul Kim,et al.Growth and tuberization of hydroponically grown potatoes[J].Potato Research,2012,55:69-81.
[4]Gregory D Goins,Neil C Yorio,Raymond M Wheeler.Influence of nitrogen nutrition management on biomass partitioning and nitrogen use efficiency indices in hydroponically grown potato[J].Journal of the American Society for Horticultural Science,2004,129(1):134-140.
[5]陈志杰,张锋,梁银丽,等.不同灌溉方式对温室嫁接黄瓜根系分布影响的研究[J].中国生态农业学报,2008,16(4):874-877.
[6]Murashige T,Skoog F.A revisedmedium for rapid growth and bioassayswith tobacco tissue cultures[J].Plant Physiology,1962,15: 473-497.
[7]Krauss A,Marschner H.Influence of nitrogen nutrition,day length and temperature on contents of gibberellic and abscisic acid and on tuberization in potato plants[J].Potato Research,1982,25:13-21.
[8]李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:119-120.
[9]Jackson SD.Multiple signaling pathways control tuber induction in potato[J].Plant Physiology,1999,119:1-8.
[10]Bradfield E G,Guttridge C G.Effects of night-time humidity and nutrient solution concentration on the calcium content of tomato fruit[J].Scientia Horticulturae,2003,22(3):207-217.
[11]Jackmana RH,Mouata M CH.Competition between grassand clover for phosphate[J].New Zealand Journal of Agricultural Research,1972,15(4):667-675.
[12]Ismail Cakmak,Christine Hengeler,Horst Marschner.Partitioning of shoot and root drymatter and carbohydra tes in bean plants suffering from phosphorus,potassium and magnesium deficiency[J].Journal of Experimental Botany,1994,45(9):245-1250.
[13]刘世全,曹红霞,张建青,等.不同水氮供应对小南瓜根系生长产量和水氮利用效率的影响[J].中国农业科学,2014,47(7): 1362-1371.
[14]闫小莉,戴腾飞,邢长山,等.水肥耦合对欧美108杨幼林表土层细根形态及分布的影响[J].生态学报,2015,35(11): 3692-3701.
[15]郭超,牛文全.根际通气对盆栽玉米生长与根系活力的影响[J].中国生态农业学报,2010,18(6):1194-1198.
[16]王青青,周强,於丙军.水培条件下不同pH值对香根草幼苗形态和生理特性的影响[J].植物资源与环境学报,2014,23 (3):59-64.
[17]徐开杰,史丽丽,王勇锋,等.水培条件下pH值对柳枝稷幼苗生长发育的影响[J].生态学报,2015,35(23):7690-7698.
[18]宁建凤,郑青松,杨少海,等.高盐胁迫对罗布麻生长及离子平衡的影响[J].应用生态学报,2010,21(2):325-330.
[19]陈雄伟,郑春梅,李晓丹,等.不同氮营养水平对水葫芦根系活力的影响[J].安徽农业科学,2012,40(3):1657-1659.
[20]Kang Jong Goo,Marc,Van Iersel.Nutrientsolution concentration affects shoot:poot ratio,leaf area ratio,and growth of subirrigated salvia(Salvia splendens)[J].Hort Science,1994,39(1):49-54.
[21]翟丙年,孙春梅,王俊儒,等.氮素亏缺对冬小麦根系生长发育的影响[J].作物学报,2003,29(6):913-918.
[22]谭勇,梁宗锁,王渭玲,等.氮、磷、钾营养对膜荚黄芪幼苗根系活力和游离氨基酸含量的影响[J].西北植物学报,2006,26(3):478-483.
[23]Evans JR,Terashima I.Effects of nitrogen nutrition on electron transport components and photosynthesis in spinach[J].Australian of Journal Plant Physiology,1987,14:59-68.
[24]Makino A,Sakashita H,Hidema J,et al.Distinctive responses of ribulose-1,5-bisphosphate carboxylase and carbonic anhydrase in wheat leaves to nitrogen nutrition and their possible relationships to CO2transfer resistance[J].Plant Physiology,1992,100:1737-1743.
[25]黄承建,赵思毅,王龙昌,等.马铃薯/玉米套作对马铃薯品种光合特性及产量的影响[J].作物学报,2013,39(2):330-342.
[26]周艳虹,黄黎锋,喻景权.持续低温弱光对黄瓜叶片气体交换叶绿素荧光猝灭和吸收光能分配的影响[J].植物生理与分子生物学学报,2004,30(2):153-160.
[27]Van Kooten O,Snel J.The use of chlorophyll fluorescence nomenclature in plant stress physiology[J].Photosynthesis Research,1990,25:147-150.
[28]孙璐,周宇飞,李丰先,等.盐胁迫对高粱幼苗光合作用和荧光特性的影响[J].中国农业科学,2012,45(16):3265-3272.
[29]李学孚,倪智敏,吴月燕,等.盐胁迫对‘鄞红’葡萄光合特性及叶片细胞结构的影响[J].生态学报,2015,35(13):4436-4443.
[30]Pooja Mehta,Anjana Jajoo,Sonal Mathur,etal.Chlorophyll a fluorescence study revealing effects of high salt stress on Photosystem II in wheat leaves[J].Plant Physiology and Biochemistry,2010,48 (1):16–20.
[31]Mauromicale G,Ierna A,Marchese M.Chlorophyll fluorescence and chlorophyll content in field-grown potato as affected by nitrogen supply,genotype and plant age[J].Photosynthetica,2006,44:76-82.
[32]Zhouping Shangguan,Mingan Shao,Jens Dyc km ans.Effects of nitrogen nutrition and water deficit on net photosynthetic rate and chlorophyll fluorescence in winterwheat[J].Journal of Plant Physiology,2000,156(1):46–51.
[33]Aksenova N P,Konstantinova T N,Golyanovskaya SA.Hormonal regulation of tuber formation in potato plants[J].Russian Journal of Plant Physiology,2012,59(4):451-466.
[34]Dick Vreugdenhil,Lidiya ISergeeva.Gibberellins and tuberization in potato[J].Potato Research,1999,42:471-481.
[35]Ojala JC,Stark JC,Kleinkopf G E.Influence of irrigation and nitrogen management on potato yield and quality[J].American Potato Journal,1990,67(1):29-43.
[36]Sushruti Sharma,Chanemougasoundharam A,Debabrata Sarkar,et al.Carboxylic acids affect induction,development and quality of potato(Solanumn tuberosum L.)micro-tubers grown in vitro from single-node explants[J].Plant Growth Regulation,2004,44:219-229.
(责任编辑 陈虹)
Effects of Different Ionic Concentration on Plant Grow th and Photosynthetic Characteristics in Virus-free Potato by Hydroponic System
ZHANG Xiao-yong1,TANG Dao-bin1*,WANG Ji-chun1*,JIANG Yu-chun1,JING Fu1,LU Hui-xiang1,LUO Yu-long1,HUANG Ting-rong2,SHU Jin-kang3
(1.College of Agronomy and Biotechnology,Southwest University,Chongqing Beibei400716,China;2.Youyang Agriculture Commission,Chongqing Youyang 408800,China;3.Wuxi Agriculture Commission,Chongqing Wuxi405800,China)
Effects of different ironic concentration of nutrient solution on the growth and photosynthetic characteristics of potatowere analyzed to clarify the physiologicalmechanisms of adaptability of virus-free potato,which would provide a theoretical basis for the potato cultivation under hydroponic system.Taken earlymaturing variety‘Yushu No.5’and late season variety‘E`shu No.1’as plantmaterials,the effectsof different ironic concentration of nutrient solution on growth and development,rootactivity,photosynthetic characteristicsand chlorophyll fluorescence of virus-free potato by hydroponic were studied.The result showed that the numbers and production ofmicro-tuber per plantwere the highest at an integrate ionic concentration of3475.00 mg·L-1(EC=2.91 ms·cm-1)compared with ultra treatments;During tuber expansion period,the root activity,net photosynthetic rate(Pn),maximal photochemical efficiency(Fv/Fm),actual photochemical efficiency(ΦPSⅡ),electron transport rate(ETR)and photochemical quenching(qP)of this treatmentwere all increased as well.Under high ironic concentration of4248.51 mg·L-1,the vegetative growth and chlorophyll synthesiswere promoted,and the number of stolons per plantwere increased,but the tuber initiation was inhibited,and the stage of tuber formation was delayed;With low concentration of nutrient solution(C≤2124.26 mg·L-1),the early initiation and formation of tuber,but leaf area per plant,root activity,Pn,Fv/Fm,ΦPSⅡ,ETR,qP and numbers of stolons per plant were all decreased significantly so that the produc-tion ofmicro-tuber was reduced.Optimum ionic concentration of nutrient solution was 3475.00 mg·L-1(EC=2.91 ms·cm-1)in the whole period;Improving the ionic concentration in vegetative period and reducing during tuber expansion period was a key method to raise the yield ofmicro-tuber by hydroponic.
Virus-free Potato;Micro-tuber;Ionic concentration;Hydroponic;Rootgrowth;Photosynthetic characteristics;Chlorophyll fluorescence
S532
A
1001-4829(2017)2-0345-09
10.16213/j.cnki.scjas.2017.2.018
2016-03-10
重庆市应用开发重点项目“马铃薯脱毒种苗种‘薯水培一体化’高倍繁育新技术研发”(cstc2014yykfB80002);科技部星火计划“马铃薯脱毒种薯‘三级’量繁关键技术集成与示范”(2012GA8110021)
张晓勇(1990-),男,硕士研究生在读,云南昆明人,主要研究方向为设施农业,E-mail:uohchanghao3@sina.cn,*为通讯作者:唐道彬(1974-),男,硕士,副研究员,重庆荣昌人,主要研究方向为马铃薯栽培育种,E-mail:tdbin741023@163.com,王季春(1964-),男,博士,教授,四川南充人,主要研究方向为马铃薯育种,E-mail:wjchun1963@163.com。
