决明胰蛋白酶抑制剂2基因的克隆与不同胁迫条件下的表达模式
2017-04-13丁超琼李娟娟李洋洋俞继华王万军廖海周嘉裕
丁超琼,李娟娟,李洋洋,俞继华,王万军,廖海,周嘉裕
(西南交通大学生命科学与工程学院,四川成都610031)
决明胰蛋白酶抑制剂2基因的克隆与不同胁迫条件下的表达模式
丁超琼,李娟娟,李洋洋,俞继华,王万军,廖海*,周嘉裕*
(西南交通大学生命科学与工程学院,四川成都610031)
克隆决明胰蛋白酶抑制剂2(Cassia obtusifolia trypsin inhibitor 2,COTI2)基因序列,并考察其在不同环境下的表达模式。利用RACE方法克隆了COTI2基因的部分序列,利用定量PCR考察其在盐、低温、干旱及ABA处理下的表达模式。从决明种子cDNA中克隆出了长度为565 bp的基因片段,该片段具有典型的Kunitz蛋白酶抑制剂基因家族的结构域。将得到的序列提交Gen-Bank,序列号为ku745416。对获得的COTI2的氨基酸序列进行比较分析,发现COTI2的P1位残基为Ser38。COTI2与其它植物KTI的氨基酸序列的进化分析表明,其与杨树的同源性较近。定量PCR结果表明COTI2在不同环境下具有不同的表达模式。这为研究COTI2基因的功能及分子调控机制奠定了基础。
决明;Kunitz蛋白酶抑制剂;克隆;表达模式
Kunitz胰蛋白酶抑制剂(Kunitz trypsin inhibitor,KTI)是一类主要存在于植物贮存器官中的天然多肽,能够特异性地抑制(类)胰蛋白酶的活性。KTI属于丝氨酸蛋白酶抑制剂家族中的成员,由1条或2条肽链组成,分子量在20 000 Da左右,主要由β-折叠与Loop结构组成其三维结构(Wang et al.2013)[1]。
KTI与植物抗逆能力息息相关,是植物响应生物与非生物胁迫的重要抗逆因子,其生理功能涉及保护储存蛋白、调节内源蛋白酶的活性、保护个体免受昆虫和病原体的侵害、抑制癌细胞侵袭扩散、抗炎、抗真菌等作用。通过转基因技术,将外源KTI基因导入烟草等植物,不仅能够明显提高转基因植物抗御微生物、病虫害的能力,也能够提高对干旱、盐与低(高)温的低抗能力[2]。近期还发现,KTI与植物组织器官的发育存在紧密联系,含有KTI基因的转基因植物发生了表型改变[3]。然而,由于KTI氨基酸序列同源性较低,通过设计简并引物完成基因克隆较为困难,这极大限制了KTI的深入研究与应用。
决明子为豆科植物决明(Cassia obtusifolia)的干燥成熟种子,为传统中药材,在我国有着悠久的药食两用历史[4]。笔者在前期研究中已发现决明子中含有KTI[5]。近期,我们首次获得了决明转录组数据,通过功能注释从中筛选出决明KTI的候选Unigene,并将其命名为决明胰蛋白酶抑制剂2(Cassia obtusifolia trypsin inhibitor 2,COTI2)[6]。该Unigene长度为404个碱基,含有不完整的3'与5'-末端。本文从决明种子中提取总RNA,根据该Unigene的序列信息设计引物,通过3'-RACE获得了COTI2完整的3'-末端,并利用定量PCR分析COKTI3基因在低温、盐、干旱等不同胁迫与ABA处理条件下的表达模式,这为研究该基因的功能及生物学作用奠定了基础。
1 材料与方法
1.1 植物组织的准备与不同处理
成熟种子购自四川省中医药公司,经鉴定为豆科植物决明(Cassia obtusifolia)种子。决明种子经70%乙醇消毒30 s后,浸泡于含0.1%氯化高汞的溶液中10 min,蒸馏水冲洗3遍,接种于MS培养基。培养条件为25℃恒温,16 h光照和8 h黑暗交替。种子萌发一周后的决明幼苗即作为不同胁迫与激素处理实验的植物材料。低温胁迫是以4℃培养;干旱与盐胁迫是将决明幼苗分别培养于含有PEG 6000(100 mg/mL)与NaCl(200 mM)的MS液体培养基;生长激素处理是将决明幼苗置于含有ABA(100μM)的液体培养液中。分别于处理前0、1、6、12、24和48 h收集决明叶片,液氮速冻,保存于-70℃低温冰箱待用。
1.2 决明总RNA的提取与cDNA的制备
决明叶片总RNA的提取按照试剂盒说明进行(OMEGA,USA),并加入终浓度为1 U/μg的DNaseⅠ去除DNA污染。利用核酸定量仪与1%琼脂糖凝胶电泳来检测RNA的浓度与完整性。cDNA的合成按照试剂盒说明进行(Takara,Japan),oligo (dT)18引物由上海生工合成。
1.3 COTI2基因克隆与序列分析
根据决明转录组中COTI2基因的部分序列,设计两条正向引物3RW与3RN(引物序列请参见表1),采用巢氏PCR。第1轮PCR的引物为Oligo dT (18)和3RW;第2轮引物为3RP和3RN,反应体系为cDNA 1μl、dNTP 4μl、2个引物各0.5μl、10× Ex Taq Buffer2.5μl、MgCl22μl、Ex Taq 0.25μl、用双蒸水补足25μl。PCR扩增步聚为95℃预变性5 min,94℃变性30 s、57℃退火30 s、72℃延伸3 min,进行35个循环,72℃充分延伸10 min,4℃保存。第2轮PCR除退火温度改为53℃以外,其余条件均不变。用1%琼脂糖凝胶检测及回收PCR产物,连接至PMD19-T载体中,转化进DH5α感受态细胞中,筛选阳性克隆送上海生工生物工程技术服务有限公司测序。将获得的3’Race结果与转录组数据进行拼接后,得到决明COTI2基因的部分cDNA序列。通过BLAST比对确认结果的正确性。
1.4 定量PCR表达分析
按方法1.2分别提取各种胁迫及激素处理的叶片RNA并逆转录成cDNA,以延伸因子EFla为内参基因(正向引物为EF1a F,反向引物为EF1a R),设计一对定量PCR引物(正向引物为COTI2F,反向引物为COTI2R),在RNA转录水平上比较COTI2基因的表达情况。所有定量PCR引物均确保溶解曲线为单峰。PCR扩增体系包括5μl SYBRPremix Ex Taq TM II,1μl cDNA,引物(10μM)各0.4μl,总体积为15μl,PCR扩增程序为:95℃预变性1 min,95℃变性10 s,60℃退火10 s,72℃延伸20 s,反应40个循环,采用LightCycler96软件提供的ΔΔCt-法分析实验数据(Liu et al 2015b)[7]。
2 结果与分析
2.1 COTI2基因序列的克隆
以决明转录组中COTI2基因的部分序列设计引物,经过3'-Race,产物经琼脂糖凝胶电泳分离出一条长约565 bp的片段,测序后,与转录组中的序列信息进行比对、拼接,获得COTI2基因序列,Gen-Bank登录号(图1)。
NCBI在线分析结构域和功能位点表明,COTI2具有KTI基因家族的序列特征(图2),同时含有一个靠近N-末端的活性中心环,说明所获得的基因序列属于KTI基因家族。
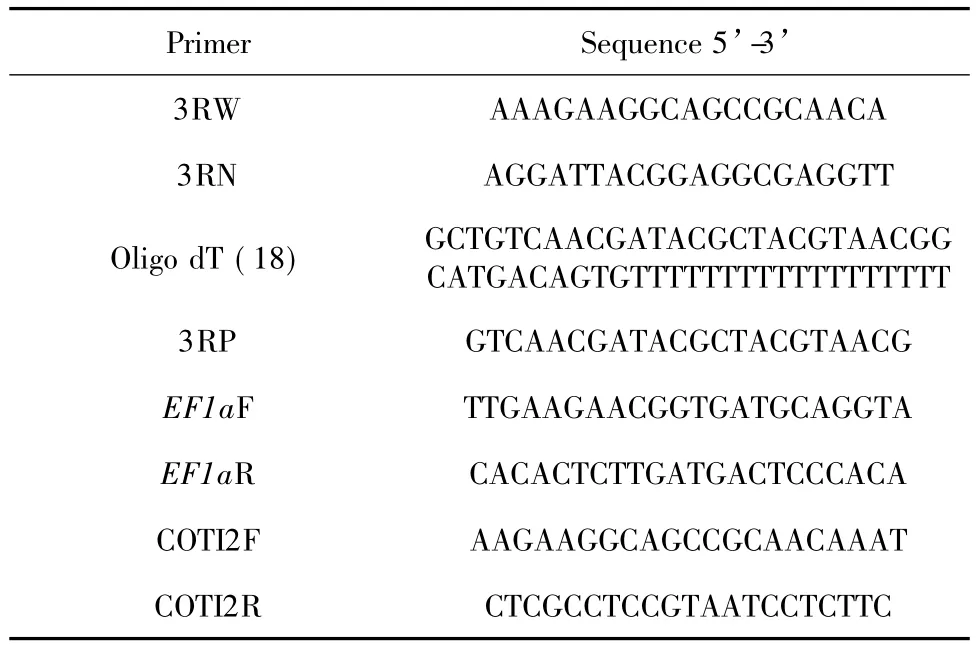
表1 本文采用的引物Table 1 Primers used in the paper

图1 COTI2的核酸序列与蛋白质序列Fig.1 Nucleic acid and protein sequence of COTI2
2.2 COTI2与其它植物来源KTI的序列比对
同源性分析发现,COTI2与其它植物KTI氨基酸序列同源性较高,具有植物KTI的3个保守Cys残基,分别为Cys64、Cys108与Cys156。COTI2编码的氨基酸序列与杨树trypsin protein inhibitor 3氨基酸序列同源性最高,为46%。将COTI2蛋白与其它物种中已报道胰蛋白酶抑制剂进行比对(图3)并绘制系统发生树,发现其与豆科植物花生AhTI的亲缘关系较近(图4)。
2.3 CoTI2的表达模式分析
为了验证定量PCR引物的有效性,首先利用琼脂糖凝胶电泳检测定量PCR产物。图5所示,定量PCR产物的长度在180~200 bp左右,与实际定量PCR产物长度(188 bp)基本吻合。该定量PCR产物经过序列测定,与目的片段的一致性为100%,表明引物设计正确、合理,能够用于后续的定量PCR实验。对决明幼苗进行低温、盐、干旱和ABA处理后,分析COTI2的表达情况。COTI2对逆境胁迫的响应随时间的变化不同。在干旱胁迫下,随着时间的延长,COTI2的表达明显上升,表达量峰值出现在24 h。在低温胁迫与ABA处理下,COTI2的表达变化相同,即表达量逐渐增加,在12 h时表达量达峰值。COTI2对盐胁迫不敏感,表达比较稳定(图6)。
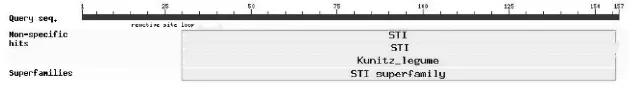
图2 COTI2基因的保守区分析Fig.2 Conserved domains of COTI2

图3 COTI2基因的序列比对Fig.3 Sequence alignment of COTI2

图4 COTI2基因的系统发生树Fig.4 Phylogenetic tree of COTI2
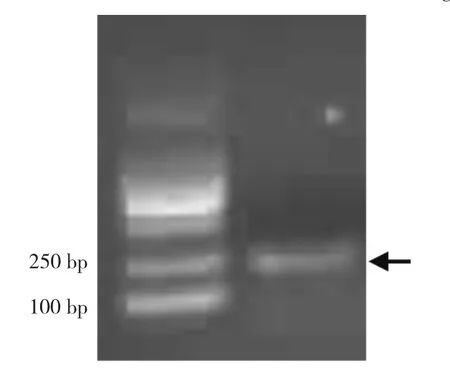
图5 定量PCR产物的琼脂糖凝胶电泳图Fig.5 Agarose gel of product of realtime-PCR
3 讨论
植物来源的KTI通常形成多基因家族,比如在鹰嘴豆、三叶草、拟南芥及苜蓿等植物中分别含有2、4、6与13条Kunitz蛋白酶抑制剂基因[8-10]。对决明转录组数据进行分析,已从中发现2条KTI基因,分别命名为COTI1与COTI2。目前,笔者已成功克隆了COTI1基因,其编码蛋白能够有效抑制棉铃虫等鳞翅目害虫肠道内消化酶的活性,该基因表达量在盐胁迫、干旱条件下均呈现出上调趋势,在ABA条件下呈现上调-下降-再上调的趋势,而在低温胁迫下表达比较稳定[11]。

图6 决明叶片中COTI2在不同胁迫及激素处理后的表达Fig.6 COTI2 expression in leaves under various stress and hormone treatment
本文首次克隆了决明COTI2基因的部分序列,所获序列包括了COTI2基因编码蛋白的抑制中心,即Ala36-Arg37-Ser38-Gly29-Ala40,其中P1位点残基为Ser38。P1位点氨基酸残基在Kunitz蛋白酶抑制剂抑制靶酶的过程中,发挥了关键作用。该位点通常是碱性的Arg或Lys(如大豆STI的Arg87,银合欢Kunitz蛋白酶抑制剂的Arg64,决明COTI1的Arg86),能够与(类)胰蛋白酶底物口袋中的Asp残基形成氢键,从而发挥特异性抑制作用。然而P1位点残基并非绝对保守,比如凤凰木与甘薯Kunitz蛋白酶抑制剂P1位氨基酸残基是Glu,该残基可能与Ser形成一个口袋并与胰蛋白酶的Arg和(或)Lys结合[12-13]。而在鹰嘴豆Kunitz蛋白酶抑制剂的分子结构中,Gly/Glu-Ileu-Ser基序取代Arg/Lys残基,行使P1位点功能[14]。进一步比对COTI1与COTI2的氨基酸序列,发现它们的氨基酸序列一致性仅为47%,推测COTI家族属于“快速”进化蛋白,其序列的变异性赋予了该家族蛋白的功能多样化。Islam(2015)等发现三叶草中存在4种KTI基因,同源性介于46%~64%,它们在三叶草不同组织中的表达量存在明显差异,赋予三叶草抗逆能力的多样化。
比较COTI1与COTI2在不同环境下的表达模式,发现COTI1对低温胁迫不敏感,而COTI2对盐胁迫不敏感;在ABA处理后,COTI1基因的表达量在24 h时到达最高,而COTI2基因的表达量在12 h时到达最高。这种表达模式的差异也同样表明COTI家族的不同成员可能具有不同的生理作用。因此,研究COTI1与COTI2的表达调控机制及它们在决明抗逆分子机制中的作用将成为下一步研究工作的重点。
[1]Wang R,Sun J,He S,et al.Recent Advance in Research on the Structure and Function of Trypsin Inhibitor[J].Food Science,2013,34(9):364-368.
[2]Srinivasan T,Kumar K R,Kirti P B.Constitutive expression of a trypsin protease inhibitor confersmultiple stress tolerance in transgenic tobacco[J].Plant Cell Physiol,2009,50(3):541-553.
[3]Mosolov V V,Valueva T A.Proteinase inhibitors and their function in plants:a review[J].Appl.Biochem.Microbiol.,2005,41:261-282.
[4]郝延军,桑育黎,赵余庆.决明子的研究进展[J].中草药,2001,32(9):858.
[5]Liao H,Ren W,Kang Z,et al.A trypsin inhibitor from Cassia obtusifolia seeds:isolation,characterization and activity against Pieris rapae[J].Biotechnol Lett,2007,29(4):653-658.
[6]Liu Z,Song T,Zhu Q,et al.De novo assembly and analysis of Cassia obtusifolia seed transcriptome to identify genes involved in the biosynthesis of active metabolites[J].Biosci Biotechnol Biochem,2014,78(5):791-799.
[7]Liu Z,Zhu Q,Li J,et al.Selection and evaluation of reference genes for expression analysis of Cassi[J].Biosci Biotechnol Biochem.,2015b,79(11):1818-1826.
[8]Hernández-Nistal J,Martín I,Jiménez T,etal.Two cellwall Kunitz trypsin inhibitors in chickpea during seed germination and seedling growth[J].Plant Physiol Biochem.,2009,47(3):181-187.
[9]Islam A,Leung S,Burgess E P,et al.Knock-down of transcript abundance of a family of Kunitz proteinase inhibitor genes in white clover(Trifolium repens)reveals a redundancy and diversity of gene function[J].New Phytol.,2015,208(4):1188-1201.
[10]Philippe R N,Ralph SG,Kulheim C,etal.Poplar defense against insects:genome analysis,full-length cDNA cloning,and transcriptome and protein analysis of the poplar Kunitz-type protease inhibitor family[J].New Phytologist,2009,184:865-884.
[11]Liu Z,Zhu Q,Li J,et al.Isolation,structuremodeling and function characterization of a trypsin inhibitor from Cassia obtusifolia[J].Biotechnol Lett,2015a,37(4):863-869.
[12]Pando SC.Primary sequence determination of a Kunitz inhibitor isolated from Delonix regia seeds[J].Phytochemistry,2001,57(5): 625-631.
[13]Senthilkumar R,Yeh K W.Multiple biological functions of sporamin related to stress tolerance in sweet potato(Ipomoea batatas Lam)[J].Biotechnol Adv,2012,30(6):1309-1317.
[14]Srinivasan A P,Giri A M,Harsulkar JA,et al.A Kunitz trypsin inhibitor from chickpea(Cicer arietinum L.)that exerts anti-metabolic effect on podborer(Helicoverpa armigera)larvae[J].Plant Mol Biol,2005,57:359-374.
(责任编辑 陈虹)
Cloning of Trypsin Inhibitor Gene from Cassia obtusifolia and Its Expression under Various Stresses
DING Chao-qiong,LIJuan-juan,LIYang-yang,YU Ji-hua,WANGWan-jun,LIAO Hai*,ZHOU Jia-yu*
(Southwest Jiaotong University,School of Life Science and Engineering,Sichuan Chengdu 610031,China)
The present paper is to clone a trypsin inhibitor gene from Cassia obtusifolia(COTI2)and study itsexpression under various stresses.The partial cDNA,including the complete3-terminal cDNA of the COTI2 genewas isolated by RACE technique.The expression under various stresseswas studied with real time-PCR.The result showed that COTI2 gene contained 565 bp and contained typical domain of Kunitz inhibitors.The P1 residue of COTI2 was composed of Ser38.Multiple alignment analysis based on amino acids of Kunitz inhibitor genes from various plants indicated that COTI2 had the highest similaritywith Populus trichocarpa.Therewere the expression patternsof COTI2 under various stresses.The research would provide a basis for further study on genetic function and regulatorymechanism of COTI2.
Cassia obtusifolia;Kunitz trypsin inhibitor;Clone;Expression patterns
Q943.2
A
1001-4829(2017)2-0251-05
10.16213/j.cnki.scjas.2017.2.002
2016-03-10
国家自然科学基金(31371232,31500276);成都市科技技术研发项目(2015-HM01-00051-SF);国家级大学生创新创业训练计划资助项目(201510613070)
丁超琼(1995-),女,陕西紫阳人,研究方向为生物制药工程,Tel:18380135338,E-mail:1628772333@qq.com,*为通讯作者:廖海,Tel:(028)87600965,E-mail:ddliaohai@ home.swjtu.edu.cn,周嘉裕,Tel:(028)87600965,E-mail:spinezhou@home.swjtu.edu.cn。
