沉默茉莉酸甲基转移酶(GhJMT)基因对棉花幼苗生理指标的影响
2017-04-13安汶铠严晓红包秋娟张富春
安汶铠,严晓红,包秋娟,张富春
(新疆大学生命科学与技术学院/新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
沉默茉莉酸甲基转移酶(GhJMT)基因对棉花幼苗生理指标的影响
安汶铠,严晓红,包秋娟,张富春
(新疆大学生命科学与技术学院/新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
【目的】通过病毒诱导的基因沉默技术(VIGS)沉默棉花茉莉酸甲酯转移酶(GhJMT)基因,分析GhJMT基因在干旱胁迫下的功能。【方法】利用PCR技术扩增获得450 bp的GhJMT沉默基因片段,与pTRV-RNA2质粒连接构建成重组载体pTRV-GhJMT,转化农杆菌(GV3101),侵染的棉花幼苗1个月后再进行PEG6000干旱胁迫处理24 h,检测干旱胁迫下棉花幼苗的含水量、光合色素含量及渗调物质、抗氧化物、丙二醛(MDA)浓度和酶活性的变化。【结果】显示沉默GhJMT后棉花幼苗叶片中可溶性糖、抗坏血酸(ASA)、甜菜碱、脯氨酸含量和超氧化物气化酶(SOD) 活力分别降低了42.1%、36.6%、69.4%、71.6% 和16.67%,而MDA、O2-和H2O2含量则分别增加了0.43、1.45和0.59倍。【结论】棉花GhJMT基因的沉默能够直接影响干旱胁迫后棉花幼苗的抗旱生理生化特性,降低棉花的抗旱能力。
棉花;干旱胁迫;VIGS;生理生化特性;基因表达
0 引 言
【研究意义】棉花是关系国计民生的战略物资,也是重要的经济农作物。新疆作为中国的棉花主产区,年产量占到全国产量的一半。但新疆的干旱少雨的气候条件,成为影响新疆棉花产量的主要因素[1]。干旱能够导致棉花的生长发育受抑制、大幅度降低产量[2],因此研究棉花的抗旱调控机制,提高棉花的抗旱特性,有助于提高新疆棉花的产量和品质,对棉花产业的丰收保证具有重要的意义。【前人研究进展】茉莉酸甲酯是一种新型的植物激素,参与植物生长发育和抗逆调控的众多过程。近年来研究发现茉莉酸甲酯能够参与植物的多种抗逆反应,当植物受到胁迫时,植物体内茉莉酸甲酯的合成显著升高,从而诱导抗逆相关基因的表达[3-5]。【本研究切入点】已有研究表明茉莉酸甲酯可以提高植物的抗冻[6]、耐旱[7]和抗病虫[8]的作用。而茉莉酸甲酯的合成是由茉莉酸通过茉莉酸甲酯转移酶(JMT)的催化生成的,因此通过沉默JMT基因可以探讨茉莉酸甲酯在逆境条件下对植物的抗逆性的调节功能。【拟解决的关键问题】研究应用病毒诱导的基因沉默技术(virus-induced gene silencing,VIGS)沉默棉花‘新陆早17号’的茉莉酸甲酯转移酶(GhJMT)基因,研究沉默后棉花幼苗的含水量、渗调物质、抗氧化物质量摩尔浓度及酶活性的变化,为阐明GhJMT的功能提供实验依据,也为研究茉莉酸甲酯在棉花中的抗旱功能奠定基础。
1 材料与方法
1.1 材 料
1.1.1 沉默所用实验苗的无菌种植
棉花种子是由新疆农业科学院经济作物研究所玛纳斯实验站提供的棉花栽种品种新陆早17号(Gossypiumhirsutumvariety)。挑取大小一致籽粒饱满的棉花种子,先用70%乙醇消毒1 min,蒸馏水冲洗多次,接着用15%的双氧水浸种5 h,再蒸馏水冲洗多次,最后播种到固体MS培养基中,进行无菌培养,10 d后打开封口膜炼苗2 d,然后将棉花幼苗转至Hoagland营养液[9-10]中继续培养2~3 d后作为研究材料。
1.2 方 法
1.2.1 棉花幼苗的处理
以子叶平展的棉花幼苗为注射材料,沉默注射后10~15 d时,阳性组(注射 pTRV-CAL1)的棉花幼苗的1~2片真叶陆续出现漂白现象。统计注射pTRV-CAL1的棉花幼苗白化率为25/30=83.34%,沉默成功。30 d后再用2.5%的PEG6000模拟干旱胁迫处理24 h后,分别采取叶片,放置于-80℃冰箱,备用。
1.2.2 VIGS重组载体的构建与注射棉花
实验所用的pTRV(pTRV-RNA1和pTRV-RNA2)载体与携带CAL1基因病毒载体由中国农业大学馈赠。CLA1基因(Cloroplastosalterados1 gene)编码1-脱氧木酮糖-5-磷酸合成酶,该酶参与叶绿体的发育,在进化中高度保守,棉花中将CLA1基因沉默后植株叶片表现出光漂白症状[11],因此以漂白性状作为VIGS体系操作成功与否的评判标准。
VIGS重组载体的构建是根据GhJMT干涉位点分析结果设计特异性引物,以cDNA 为模板进行RT-PCR扩增,扩增产物和pTRV-RNA2 载体分别进行双酶切(KpnⅠ和EcoRⅠ)后,进行转化感受态农杆菌;测序鉴定出阳性克隆。VIGS重组载体转化农杆菌GV3101:pTRV-RNA1、pTRV-RNA2、pTRV-CLA1、pTRV-GhJMT分别转化农杆菌GV3101。
VIGS重组载体注射棉花叶片的步骤如下:倒置培养农杆菌36~48 h后,挑选单克隆与7 mL LB培养基(LB+50g/mL 卡那霉素+50g/mL 庆大霉素),28 ℃、200 r/min过夜培养;将菌液接种于50 mL YEB培养基(YEB+20mol/L 乙酰丁香酮+50g/mL 卡那霉素+50g/mL 庆大霉素+100 mmol/L MES),28 ℃、200 r/min过夜培养,OD600=1.5;酶标仪测量菌液OD600=0.6左右时,将菌液置于无菌离心管,4 000 r/min,离心8 min,弃上清液,合并几次沉淀的菌体于无菌烧杯中;利用转化液(YEB+200mol/L 乙酰丁香酮+10 mmol/L MES+10 mmol/L MgCl2)悬浮菌体至OD600=1.5;再将pTRV-RNA1分别与pTRV-CLA1、pTRV-RNA2、pTRV-GhJMT的悬浮液等体积混合,置于室温3 h,分别构成预处理组(pTRV-CLA1)、对照组(pTRV-00)和实验组(pTRV-GhJMT)。最后将棉花幼苗子叶展平,每株幼苗分别注射2片子叶,每片子叶注射10L左右,每组30株,3次重复。
1.2.3 棉花幼苗的生化指标的测定
1.2.3.1GhCLA1和GhJMT基因沉默效率的检测
棉花幼苗注射10 d时,可以观察到pTRV-CLA1的处理的棉花幼苗出现白化现象。幼苗注射30 d后,将对照组(pTRV-00)和实验组(pTRV-GhJMT)棉花苗的第2片真叶采样,提取总RNA,逆转录为cDNA,对GhJMT和Gh18s(实验选用棉花的18s为内参基因)分别设计荧光定量PCR的特异性引物分别为:
Gh18s-F:5′-CAACTTGCGTTCAAAGACTCGATGGTT -3′;
Gh18s-R: 5′-CAAGGAATCGAA ACGAAAGAAGG-3′ ;
GhJMT-F: 5′- GGAATTCCCCACCACCGAAAATAGCTGC -3′;
GhJMT-R: 5′- GGGGTACCGGCCATCACCAAATTG-3′。
实时荧光定量(RT-PCR)参照带有ROX的Platinum SYBR Green qPCR SuperMix-UDG(美国Invitrogen公司)试剂盒说明书进行。RT-PCR反应参数为:94 ℃ 15 s;94 ℃ 30 s,59 ℃ 30 s,72 ℃ 45 s,40 个循环;72 ℃延伸2 min。采用ABI PRISM 7500实时定量PCR仪进行RT-PCR及检测,数据采用2-ΔΔCt法进行分析。
1.2.3.2 含水量、光和色素、渗透物质和丙二醛(MDA)的测定[12-14]
棉花幼苗注射35 d后,分别干旱胁迫对照组(pTRV-00) 和实验组(pTRV-GhJMT)棉花幼苗,方法为用2.5%的PEG6000干旱胁迫棉花幼苗24 h,分别取对照组和实验组注射棉花幼苗的第二片真叶,对棉花幼苗采样分别用烘干法测定相对水含量。
干旱胁迫处理后,对棉花幼苗采样分别测定叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量;用酸性茚三酮显色法测定脯氨酸;蒽酮比色定测定可溶性糖;雷氏盐法测定甜菜碱;用硫代巴比妥酸比色法测定MDA。
1.3 数据统计
各个实验均为独立重复3次,实验数据的处理与作图分别为Excel 97-2003和GraphPad Prism 5软件处理分析。
2 结果与分析
2.1 重组载体pTRV-GhJMT的构建
根据沉默干涉位点分析结果得到干涉片段为450 bp,以棉花新陆早17号叶片所提取的cDNA为模板,由设计特异性引物扩增后进行琼脂糖凝胶电泳,在450 bp左右出现,扩增产物和pTRV-RNA2 载体分别进行双酶切(KpnⅠ和EcoRⅠ)后,转化感受态农杆菌GV3101后测序鉴定出阳性克隆。图1

M:DL 2000; 1~5: pTRV-GhJMT的扩增(左图): 1~2: pTRV-GhJMT质粒的KpnⅠ和EcoRⅠ双酶切鉴定(右图)
M:DL 2000; 1-5: The amplification of pTRV-GhJMT(left);1-2: pTRV-GhJMTdigested withKpnⅠandEcoRⅠ(right)
图1 pTRV-GhJMT的扩增和酶切鉴定
Fig.1 The amplification and digestion analysis of pTRV-GhJMT
2.2GhCLA1和GhJMT基因沉默效率的检测
棉花幼苗注射30 d后,研究表明,阳性对照GhCLA1植株的第1和2片真叶出现白化现象,白化率达到25/30=83.3%,表明实验注射成功。图2A
荧光定量检测对照组和实验组中GhJMT基因的表达,研究表明,相对于对照组,实验组棉花幼苗叶片中GhJMT的表达量仅仅为空载中的32.03%,由此表明棉花苗的GhJMT基因沉默成功。图2B

注: 沉默GhCLA1后一个月棉花苗的性状图 (沉默后使得叶录素合成受阻叶片表现为漂白),***表示差异极显著(P<0.001)
The figure A shows after a month of silenceGhCLA1 traits of cotton seedlings (silence makes leaf blade recorded prostaglandin synthesis hindered the performance of bleach),***indicates significant differences (P<0.001)
图 2 沉默GhCLA1后的性状表型(A)及沉默GhJMT后棉花叶片中GhJMT的表达(B)
Fig.2 The phenotypes of cotton after silencingGhCLA1 (A) and effects of silencingGhJMTon expression ofGhJMT(B) in leaves of cotton
2.3 沉默GhJMT基因后对植株含水量及可溶性糖的影响
棉花幼苗对照组和实验组同在2.5%的PEG6000干旱胁迫24 h后,测量植株含水量结果显示(图3A),相对于对照组,实验组植株的含水降低2.9%,二者无显著性差异。图3
测定棉花叶片中可溶性糖含量显示(图3B),实验组叶片中每克干质量可溶糖含量为126 ug/g,相对于对照组的叶片中降低42.1%,具有显著性差异(P<0.05)。图3

图3 沉默GhJMT对棉花的含水量和可溶性糖含量变化
Fig.3 Effect of silencedGhJMTon the change of water content and soluble sugar content in leaves of cotton
2.4 沉默GhJMT基因后对棉花叶片抗氧化物质含量的影响
PEG6000干旱胁迫处理棉花幼苗24 h,测定实验组和对照组棉花叶片中每克干质量含AsA和GSH的变化。研究表明,实验组叶片中含188.47mol/g(每克干物质中的量) AsA,仅仅为对照组中的36.6%。且二者呈极显著性差异(P<0.01)(图4A)。实验组叶片中GSH为42.27mol/g(图4B),与对照组相比较增加53%。二者无显著性差异。图4
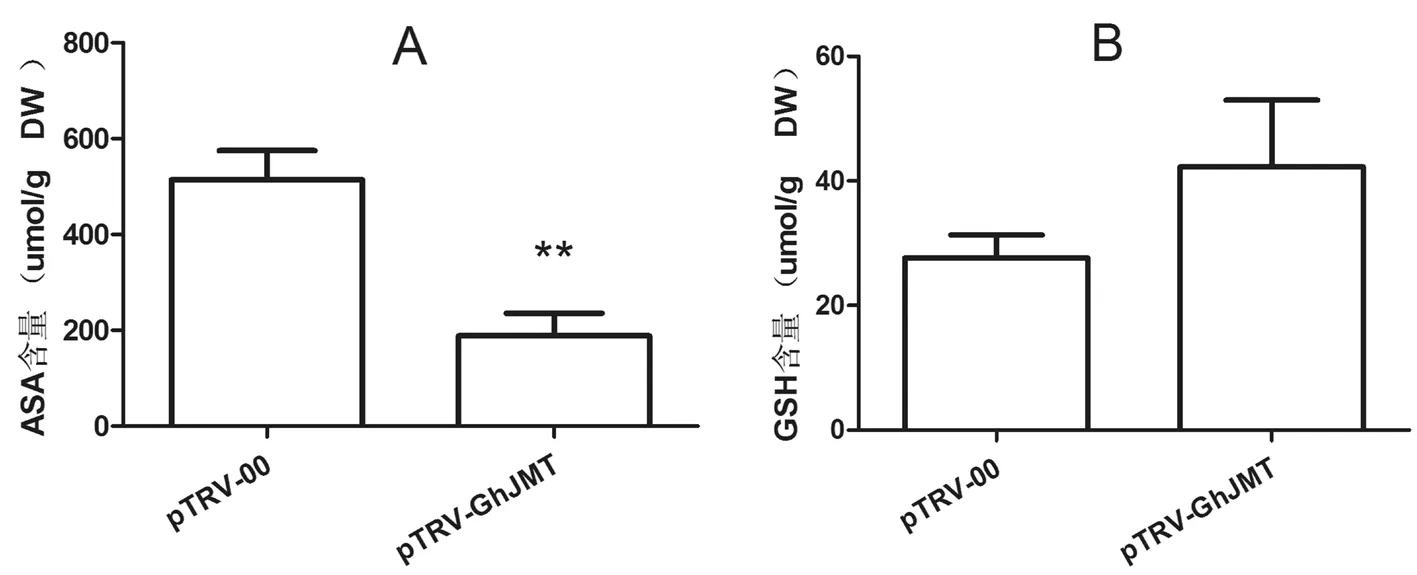
**表示差异大显著水平(P<0.01)
**indicates significant differences (P<0.01)
图4 沉默GhJMT后棉花的抗氧化物质含量变化
Fig. 4 Effects of silencedGhJMTon antioxidant content level in leaves of cotton
2.5 沉默GhJMT基因后对棉花叶片光和色素含量的影响
棉花幼苗在2.5%的PEG6000干旱胁迫24 h后,分别对实验组和对照组的幼苗叶片的叶绿素a、b和类胡萝卜素测量,结果表明,与对照组相比,实验组的棉花叶片中的叶绿素a、b、和类胡萝卜素以及叶绿素总量分别减少9.1%、10.7%、1.4%和9.6%。二者无显著性差异。图5

图5 沉默GhJMT后棉花的叶绿素含量
Fig.5 Effects of silencedGhJMTon chlorophyllcontentin leaves of cotton
2.6 沉默GhJMT基因后对棉花叶片丙二醛(MDA)含量的影响
PEG6000干旱胁迫24 h后分别进行对照组和实验组棉花幼苗叶片中的MDA含量进行测定,研究表明,沉默GhJMT基因后,实验组叶片中每克蛋白质含0.765 7mol MDA,相对于对照组叶片中升高0.43倍,二者无显著性差异。图6

图6 沉默GhJMT对棉花的MDA含量
Fig.6 Effect of silencedGhJMTon MDA content in leaves of cotton
2.7 沉默GhJMT基因后对棉花叶片中渗透调节物质的影响
PEG6000干旱胁迫24 h后,对棉花叶片中的渗透调节物质(脯氨酸和甜菜碱)的含量测定表明,实验组每克叶片干质量含脯氨酸25.12g/g,相对于对照组叶片中明显降低,降为对照组叶片中的28.3%,二者差异极显著(图7A)。实验组每克叶片干质量中甜菜碱为107.5 mg/g,相对于对照组也明显降低,降低69.4%,二者差异极显著(图7B)。图7

**表示差异大显著水平(P<0.01),***表示差异大显著水平(P<0.001)
**indicates significant differences (P<0.01),***indicates significant differences (P<0.001)
图7 沉默GhJMT对棉花的脯氨酸和甜菜碱含量
Fig.7 SilencedGhJMTon proline and betaine content in leaves of cotton
2.8 沉默GhJMT基因后对棉花叶片中过氧化物含量的影响
PEG6000干旱胁迫24 h后,测量棉花幼苗叶片中氧自由基和过氧化氢含量,研究表明,实验组每克叶片鲜重中氧自由基含量为417.1mol/g,相对于对照组叶片中增加1.45倍,二者差异显著(P<0.05)(图8A)。实验组每克叶片鲜重中过氧化氢含量为5.97mol/g,相对于对照组叶片中有所升高,二者无显著性差异(图8B)。图8

*表示差异大显著水平(P<0.05)
*indicates significant differences (P<0.05)
图8 沉默GhJMT后棉花的氧化物胁迫水平
Fig.8 SilencedGhJMTon oxidative stress in leaves of cotton
2.9 沉默GhJMT基因后对棉花叶片中抗氧化物酶活性的影响
PEG6000干旱胁迫24 h后,对幼苗叶片的抗氧化酶活性进行测定,结果表明,沉默GhJMT后实验组棉花叶片SOD活性为209.6 U/min·g,与对照组相比较显著降低,为对照组的16.67%,二者差异显著(P<0.05)(图9A)。沉默GhJMT后实验组棉花叶片中POD活性为495.9 U/min·g,与相对照组相比较有一定的增加,二者差异显著(P<0.05)(图9B)。图9

*表示差异大显著水平(P<0.005)
*indicates significant differences (P<0.005)
图9 沉默GhJMT对棉花抗氧化物酶活性
Fig.9 SilencedGhJMTon activities of antioxidant enzymes in leaves of cotton
3 讨 论
已有大量的研究表明,茉莉酸甲酯对植物胁迫响应和生理发育具着重要的作用。当植物受到干旱胁迫时,植物可以利用茉莉酸合成茉莉酸甲酯来抵抗逆境。而茉莉酸甲基转移酶(GhJMT)为茉莉酸甲酯生物合成的重要酶类,也是其合成过程的限速步骤[15-16]。因此,实验利用基因沉默方法来研究茉莉酸甲酯在植物抗逆调节中发挥的功能。
基因沉默是研究基因功能的方法之一,目前病毒诱导基因沉默的技术已经成功地应用于烟草[17]、番茄[18]、辣椒[19]、矮牵牛[20]等植物相关基因功能的研究,王丽等[21]最新报道利用VIGS技术对棉花幼苗GhCPS基因的沉默。实验参照其方法,用VIGS技术沉默GhJMT基因,对其基因的功能进行初步摸索。流程为将棉花幼苗注射含有pTRV-GhJMT的重组载体35 d后,提取其总RNA后反转成cDNA,做Real time-PCR检测GhJMT基因的表达量,仅为对照组 的32.03%,表明GhJMT基因的沉默成功,最后用PEG6000模拟干旱胁迫24 h,测定其生化指标来探讨研究茉莉酸甲酯的功能。
植物在干旱胁迫下导致细胞失水,而且导致活性氧和过氧化氢的生成,作为抵抗和清除活性氧类物质的抗氧化物如AsA、GSH和抗氧化酶如SOD、POD,它们能够减轻或消除氧自由基对植物细胞膜的破坏[22]。研究结果表明,与空载相比,沉默GhJMT基因后棉花苗的氧自由基、过氧化氢以及MDA含量明显升高,AsA含量和SOD活性明显降低。进而表明沉默GhJMT后可能使得棉花的抗旱相关物质的合成受到抑制,减弱棉花抗旱能力。
叶片是植物光合作用的最主要的场所,而叶绿素质量摩尔浓度也表明着光合作用的强弱和效率,研究沉默GhJMT和空载后,棉花叶片中叶绿素含量的变化,结果表明,二者叶绿素含量没明显变化,表明茉莉酸甲酯可能不参与棉花幼苗的叶绿素的合成或光合作用相关的反应。
渗透调节是植物适应干旱逆境重要的生理调节机制,渗透调节的相溶性物质主要有甜菜碱、脯氨酸和可溶性糖[23]。董桃杏等[24]研究结果表明水稻在干旱胁迫下经茉莉酸甲酯处理显著性地增加其体内的渗调物质。研究结果表明沉默GhJMT后棉花幼苗相对于空载对照,其叶片的可溶性糖、甜菜碱脯氨酸分别显著性降低42.1%、69.4%和71.6%。沉默棉花的GhJMT基因后,降低茉莉酸甲酯的合成,可能导致减少渗调物质的合成,进而表明GhJMT基因在抗旱调控过程发挥重要作用。近些年关于茉莉酸、茉莉酸甲酯提高植物的抗逆越来越多,但更深的研究茉莉酸信号通路的调控机制的研究很少,从而进一步研究其对植物抗旱调控机制尤为重要。
4 结 论
研究利用VIGS技术沉默GhJMT基因抑制了茉莉酸甲酯的合成,结果显示与对照组相比能够减少棉花植株渗调物质含量(脯氨酸、甜菜碱和可溶性糖),棉花叶片脯氨酸25.12g/g,降低28.3%,甜菜碱为107.5 mg/g,降低69.4%,可溶糖含量为126 ug/g,降低42.1%。棉花植株过氧化物的含量增高SOD酶活减少,与对照组相比棉花叶片中氧自由基含量为417.1mol/g,增加1.45倍,过氧化氢含量为5.97mol/g,也有一定升高,而棉花叶片SOD活性为209.6 U/min·g,降低16.67%。此外还能增加棉花植株的MDA含量,棉花叶片中每克蛋白质含0.765 7mol MDA,升高0.43倍。茉莉酸甲酯对渗透调节、氧化胁迫和维持细胞膜的稳定性十分重要,是棉花逆境调节通路中的重要激素,深入研究茉莉酸的信号通路有助于阐明茉莉酸甲酯的抗逆分子机制。
References)
[1] 周守华,刘忠礼,韩欢庆,等.新疆博州气象条件对棉花产量的影响分析[J].沙漠与绿洲气象,2014,8(2):70-74.
ZHOU Shou-hua , LIU Zhong-li, HAN Huan-qing, et al. (2014). Influence analysis of meteorological condition on cotton yield in Bortala Mongol autonomous prefecture of Xinjiang [J].DesertandOasisMeteorology, 8(2):70-74. (in Chinese )
[2] 陈丽萍,何道一.植物抗旱耐盐基因的研究进展[J].基因组学与应用生物学,2010,29(3):542-549.
CHEN Li- ping, HE Dao-yi. (2010). Research advance drought and salt resistant genes in transgenic plant[J].GenomicsandAppliedBiology, 29(3):542-549.(in Chinese)
[3] Creelman, R. A., & Mullet, J. E. (1995). Jasmonic acid distribution and action in plants: regulation during development and response to biotic and abiotic stress.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 92(10):4,114-4,119.
[4] 朱家红,彭世清.茉莉酸及其信号传导研究进展[J].西北植物学报,2006,26(10):2 166-2 172.
ZHU Jia-hong, PENG Shi-qing. (2006). Jasmonic acid its signal transmission [J].ActaBotanicaBoreali-OccidentaliaSinica, 26(10):2,166-2,172. (in Chinese)
[5] Creelman, R. A., Tierney, M. L., & Mullet, J. E. (1992). Jasmonic acid/methyl jasmonate accumulate in wounded soybean hypocotyls and modulate wound gene expression.ProceedingsoftheNationalAcademyofSciences, 89(11):4,938-4,941.
[6] 徐伟,严善春.茉莉酸在植物防御中的作用[J].生态学报,2005,25(8):2 074-2 082.
XU Wei, YAN Shan-chun. (2005).The function of jasmonic acid in induced plant defense [J].ActaEcologicaSnica, 25(8):2,074-2,082. (in Chinese)
[7] 董桃杏,蔡昆争,张景欣,等.茉莉酸甲酯(MeJA)对水稻幼苗抗旱生理效应[J].生态环境,2007,16(4):1 261-1 265.
DONG Tao-xing, CAI Kun-zheng, ZHANG Jing-xin, et al. (2007). The physiological roles of methyl jasmonate (MeJA) in drought resistance of rice seedlings [J].EcologyandEnvironment, 16(4):1,261-1,265.(in Chinese)
[8] 桂连友,刘树生,陈宗懋.外源茉莉酸和茉莉酸甲酯诱导植物抗虫作用及其机理[J].昆虫学报, 2004,47(4):507-514.
GUI Lian-you, LIU Shu-sheng, CHEN Zong-mao. (2004). Plant resistance to insects induced by application of exogenous jasmonic acid and methl jasmonate[J].ActaEntomdogicaSinica, 47(4):507-514.(in Chinese)
[9] 安汶铠,常丹,张富春.干旱胁迫下棉花幼苗转录因子BES1/BZR1对外源油菜素内酯的响应表达特征[J].西北植物学报,2015,35(7):1 311-1 316.
AN Wen-kai, CHANG Dan, ZHANG Fu-chun. (2015). Expression characteristics of transcription factor BES1/BZR1 of cotton seeding in response to Brassinosteroind under drought stress [J]. Acta Botanica Boreali-Occidentalia Sinica, 35(7):1,311-1,316. (in Chinese)
[10] 常丹,杨艺,王艳,等.24-表油菜素内酯对PEG胁迫与盐胁迫棉花种子萌发的影响[J].西北农业学报, 2015,24(3):96-101.
CHANG Dan, YANG Yi, WANG Yan, et al. (2015). Effects of 24-Epi Brassinline on seed germination understresses of slat and PEG in cotton [J].ActaAgriculturaeBoreali-occidentalisSinica, 24(3):96-101.(in Chinese)
[11] Gao, X., Wheeler, T., Li, Z., Kenerley, C. M., He, P., & Shan, L. (2011). Silencing ghndr1 and ghmkk2 compromises cotton resistance to verticillium wilt.PlantJournalforCell&MolecularBiology, 66(2):293-305.
[12] 木合热皮亚·艾尔肯,张富春. 盐穗木HcVP1转基因棉花耐盐性的生理生化分析[J].新疆农业科学,2013.50(6):1 016-1 023.
Muherpiya, A., ZHANG Fu-chun. (2013). Physiological and biochemical analysis for the salt tolerance of transgenic cotton transformed byVacuolarH+ -Pyrophosphatasegene(VP1) fromHalostachyscaspica[J].XinjiangAgriculturalSciences, 50(6):1,016-1,023. (in Chinese)
[13] 姚世响. 藜科植物藜(Chenopodiumalbum)种子异型性及后代耐盐生理生化机理的研究[D]. 乌鲁木齐:新疆大学硕士论文, 2010.
YAO Shi-xiang. (2010).StudiesonseedheteromorphismofChenopodiumalbumandthebiochemicalandphysiologicalmechanismofsalttoleranceinitsdescendants[D]. Master Dissertation. Xinjiang University, Urumqi. (in Chinese)
[14] 王瑜. 灰绿藜液泡膜焦磷酸酶V-PPase基因增强烟草和拟南芥耐盐性的研究[D].乌鲁木齐:新疆大学硕士论文,2008.
WANG, Yu. (2008).Studiesonsalt-toleranceoftransgenicNicotianatabaccumandArabidopsisthalianawiththevacuolarH+ -pyrophosphatasegengfromhalophytechenopodiumglaucum[D]. Master Dissertation. Xinjiang University, Urumqi. (in Chinese)
[15] 安汶铠,常丹,张富春.喷施2,4- 表油菜素内酯(EBR)提高棉花抗旱生理响应性的研究[J].基因组学与应用生物学, 2015.34(10):2 217-2 234.
AN Wen-kai, CHANG Dan, ZHANG Fu-chun. (2015). Improving the physiological response of cotton by 2,4-epibrassinolide(EBR) under drought [J].GenomicsandAppliedBiology, 34(10):2,217-2,224. (in Chinese)
[16] 李清清, 李大鹏, 李德全. 茉莉酸和茉莉酸甲酯生物合成及其调控机制[J].生物技术通报,2010,(1):53-57.
LI Qing-qing, LI Da-peng, LI De-quan. (2010). The research progress in biosynthesis and regulation of jasmonates [J].BiotechnologyBulletin, (1):53-57.(in Chinese)
[17] Ratcliff, F., Martinhernandez, A. M., & Baulcombe, D. C. (2001). Technical advance. tobacco rattle virus as a vector for analysis of gene function by silencing.PlantJournal, 25(25):237-245.
[18] Liu, Y., Schiff, M., Dinesh-kumar, S. P. (2002). Virus-induced gene silencing in tomato [J].ThePlantJournal, 31(6):777-786.
[19] Chung, E., Seong, E., Kim, Y. C., Chung, E. J., Oh, S. K., & Lee, S., et al. (2013).Amethodofhighfrequencyvirus-inducedgenesilencinginchilipepper(CapsicumannuumL.cv.Bukang)..Virus-inducedgenesilencing:. Humana Press.
[20] Chen, J. C., Jiang, C. Z., Gookin, T., Hunter, D., Clark, D., & Reid, M. (2004). Chalcone synthase as a reporter in virus-induced gene silencing studies of flower senescence.PlantMolecularBiology,55(4):521-530.
[21] 王丽,穆春,张明才,等. GhCPS基因沉默对棉花幼苗生长和内源激素含量的影响[J].棉花学报,2014,26(3):189-196.
WANG Li, MU Chun, ZHANG Ming-cai, et al. (2014). Effect of silencingGhCPSon growth and endogenous hormone content of cotton seedings (GossypiumhirsutumL. ) [J].CottonScience, 26(3):189-196. (in Chinese)
[22] 卢少云,郭振飞,彭新湘,等.干旱条件下水稻幼苗的保护酶活性及其与耐旱性关系[J].华南农业大学学报,1997,18(4):21-25.
LU Shao-yun, GUO Zhen-fei, PEN Xin-xiang, et al. (1997). The activities of protective enzymes of rice seedlings subjected to drought and their relationship to drought tolerance [J].JournalofSouthChinaAgriculturalUniversity, 18(4):21-25. (in Chinese)
[23] Cabuslay, G. S., Ito, O., & Alejar, A. A. (2002). Physiological evaluation of responses of rice (OryzasativaL.) to water deficit.PlantScience, 163(4):815-827.
[24] 董桃杏,蔡昆争,张景欣,等.茉莉酸甲酯(MeJA)对水稻幼苗的抗旱生理效应[J].生态环境,2007,16(4):1 261-1 265.
DONG Tao-xing, CAI Kun-zheng, ZHANG Jing-xin, et al. (2007). The physiological roles of methyl jasmonate (MeJA) in drought resistance of rice seedlings [J].EcologyandEnvironment, 16(4):1,261-1,265. (in Chinese)
Supported by:Joint key fund of National Natural Science Foundation of China and Xinjiang "Exploring key genes related to high-efficiency water utilization and creating of drought resistant materials in cotton" (U1303282)
Silencing Effect of Jasmonic Acid Carboxyl Methyl Transferase(JMT) Gene on Physiological Indexes of Cotton Seedlings
AN Wen-kai, YAN Xiao-hong, BAO Qiu-juan, ZHANG Fu-chun
(XinjiangKeyLaboratoryofBiologicalResourcesandGeneticEngineering,CollegeofLifeScienceandTechnology,XinjiangUniversity,Urumqi830046,China)
【Objective】 Jasmonic methylester transferase (JMT) can effectively facilitate the production of jasmonic methylester, so that it enhances plant drought resistance.【Method】A 450 bp silence fragment ofGhJMTwas cloned from cotton XLZ17 (Gossypiumhirsutum) using PCR amplification, and then constructed into vector pTRV. The recombinant plasmid pTRV-GhJMTwas transformed into competentAgrobacteriumtumefaciens(GV3101). Cotton seedlings in hydroponic conditions were infected with the transformedA.tumefaciensGV3101. After one month, the growing cotton seedlings were treated with PEG6000 for 24 h. The water content, the molality of osmotic adjustment substances, photosynthetic pigments, antioxidants and malondialdehyde (MDA) as well as enzymes activities in cotton leaves under drought stress were measured.【Result】The results showed that content of soluble sugar, ASA, betaine, proline and SOD were reduced by 42.1%, 36.6%, 69.4% and 71.6% compared with the pTRV-00, and MDA, O2-and H2O2were increased 0.43, 1.45 and 0.59 times compared with pTRV-GhJMT, respectively.【Conclusion】Our results demonstrate thatGhJMTgene silencing can directly affect the physiological and biochemical characteristics of cotton seedlings treated with drought stress and reduce drought resistant ability of cotton.
Gossypiumhirsutum; drought stress; virus-induced gene silencing (VIGS); physiological and biochemical characteristics; gene expression
10.6048/j.issn.1001-4330.2017.02.003
2016-11-07
国家自然科学基金-新疆联合基金重点项目“棉花水分高效利用的关键基因的挖掘及分子机理的研究”(U1303282)
安汶铠(1990-),男,硕士研究生,研究方向为分子生物学,(E-mail)873788221@qq.com
张富春(1962-),男,教授,博士,研究方向为分子生物学,(E-mail)zfcxju@xju.edu.cn
S562
A
1001-4330(2017)02-0213-10
