膜苞鸢尾花粉形态、活力与柱头可授性研究
2017-04-13马玉梅张云秦景逸王秀梅朱甜甜
马玉梅,张云,秦景逸,王秀梅,朱甜甜
(新疆农业大学林学与园艺学院,乌鲁木齐 830052)
膜苞鸢尾花粉形态、活力与柱头可授性研究
马玉梅,张云,秦景逸,王秀梅,朱甜甜
(新疆农业大学林学与园艺学院,乌鲁木齐 830052)
【目的】研究野生膜苞鸢尾(Irisscariosa.)花粉活力和柱头可授性动态变化规律,为进一步研究其有性繁殖提供基础资料。【方法】采用扫描电镜观察其花粉形态,染色及离体萌发法测定花粉活力,联苯胺-过氧化氢法测定开花不同时段柱头可授性,并利用人工授粉验证传粉成功的最佳时期。【结果】膜苞鸢尾花粉形态近球形,属远极单沟-拟沟类型,花粉外壁表面零星分布有柱状颗粒;开花当天花粉活力最高,开花4 h达到最高值,而柱头在开花前1 d直至开花32 h均保持较强可授性。【结论】膜苞鸢尾花粉形态属较原始类型,雌性器官柱头先熟于花药,花粉活力与柱头可授期部分重叠,开花当天与次日为人工授粉最佳时期。
膜苞鸢尾;花粉形态;花粉活力;柱头可授性
0 引 言
【研究意义】野生鸢尾属植物生态幅广,抗逆性突出,观赏价值高,容易栽培、管理,是增加城市生态多样性的重要类群,开展野生鸢尾属植物研究是发展的必然趋势。野生膜苞鸢尾(IrisscariosaWilld.)又名镰叶马蔺,国外分布于哈萨克斯坦和俄罗斯[1],在国内主要分布于新疆哈密、伊宁等海拔1 500~2 100m石质山坡向阳处及前山荒漠化草原上,其花大、色艳、种下类型繁多,积雪融化即可萌动,花期可与郁金香同步,是绿化、美化、彩化城市不可多得的园林绿化与育种资材,其根及根状茎还是新疆中药镰叶马蔺根的基源药材,具有清热解毒、利咽的药效,具较高的开发利用价值。【前人研究进展】目前对膜苞鸢尾的研究仅限于在膜苞鸢尾的根及根状茎药用化学成分的提取[2],贺海洋[3]曾在乌鲁木齐市植物园对其进行引种栽培,可正常越冬越夏,正常生长开花,并繁育后代,周源[4]对其抗旱性进行研究,其他相关研究未见报道。显然,该野生植物资源的价值没有引起足够的重视。【本研究切入点】摸清植物在自然条件下的生殖生长特点应是野生植物引种驯化及繁殖研究的基本点和出发点[5],目前关于膜苞鸢尾花粉活力及柱头可授性等相关基础研究未见报道。研究野生膜苞鸢尾花粉活力和柱头可授性动态变化规律。【拟解决的关键问题】通过对膜苞鸢尾花粉活力及柱头可授性试验观测,找出快速、有效的测定花粉活力的方法,研究花粉活力和柱头可授性变化规律,为进一步摸清其在自然条件下的生殖生长特点提供基础资料,为该种质资源杂交育种和资源利用提供理论依据和参考。
1 材料与方法
1.1 材 料
供试材料为野生膜苞鸢尾,地处新疆哈密地区巴里坤县鸣沙山附近,地理位置E 93°43′32″,N 43°23′21″,海拔2 080 m。该区域属温带亚干旱气候区,盛行西北风,年均降水量203.0 mm,年均气温1.0℃,年均积温(≥10℃)1 735.0℃。
1.2 方 法
1.2.1 花粉形态测定
采用JSM-T300 型扫描电子显微镜,选取形态较为典型的花粉群体、花粉个体及花粉粒的局部纹饰进行拍照。用 Motic Images Advanced 3.2显微图像分析系统软件,测量花粉粒的极轴P和赤道轴E长度,结合电镜显微标尺计算其实际长度。极赤比=P/E。
1.2.2 活力检测
花粉采集:2015年5月在原生地附近将开花0、4、8、24、28、32、44、48和52 h等8个时段花朵带回室内,将花药从花蕾中取出放在硫酸纸上,在室温条件下,任花药自然开裂散粉,并将散落的花粉收集用于试验。
1.2.3 花粉活力测定
(1) 染色法:采用TTC[6]、联苯胺[7]、醋酸洋红[8]3种染色法,以经过高温杀死后的无活力花粉的着色能力为对照[9]。以花粉着色率计算花粉活力。
花粉活力=染色的花粉数/花粉总数×100%.
(2) 花粉萌发法:培养基配置方法参见文献[10]并作相应改动,其中琼脂质量分数为10 g/L,蔗糖设置50、100、150和200 g/L四个梯度,硼酸设置 0.1、0.3和0.5 g/L三个梯度,采用完全随机组合,共配制12组培养基。以开花0 h 散粉后的花粉进行萌发,于25℃恒温箱培养4 h,统计花粉活力,以花粉管长度超过花粉粒直径为萌发标准,以上处理均设置3次重复,每个重复随机选取5个视野,筛选最适培养基,其他时段花粉于最适培养基下进行萌发。表1
花粉萌发率=花粉管长度大于花粉直径的花粉数量/视野内花粉总数×100%
1.2.4 柱头可授性检测
随机选取花蕾期膜苞鸢尾花朵27朵进行标记,分别在开花前1 d(-1 d),0、4、8、24、28、32、48和52 h等时段采集花朵,每时段选取3朵。利用联苯胺-过氧化氢法[11,12]在显微镜下观察柱头可授性情况,用-和+表示观察到的情况,-表示柱头不具有可授性,即柱头上无腺毛,无气泡与变蓝情况;+表示柱头具有可授性,即柱头上少量腺毛,有气泡产生与轻微的变蓝;++表示柱头具有较强可授性,即柱头上较多的腺毛,气泡丰富且变蓝情况较明显;+++表示柱头具有极强可授性,即柱头上大量清晰而长的腺毛,有大量连续的气泡和明显的变蓝情况。
1.2.5 人工授粉与坐果率统计
选择花蕾期膜苞鸢尾180株,摘除同一花葶上未开放小花,去雄套袋并标记,于第2 d分别在开花前1 d(-1 d),0、4、8、24、28、32、48和52 h时段,取异株雄花花粉进行人工异花授粉,每处理20朵。在柱头完全萎蔫,心皮明显增大时及时去袋,25 d后统计座果率和结籽数(以种子中有胚形成作为结籽的标准)。
坐果率 = 坐果数量/处理花朵总数×100%.
利用SPSS 20.0进行数据的统计分析,One-way ANOVA检验数据间的差异。
2 结果与分析
2.1 花粉形态
研究表明,膜苞鸢尾花粉近球形,极面观为裂圆形,赤道面观近圆形,极轴68.43 μm(63.710~79.570),赤道轴61.71 μm(56.452~66.129), 极赤比=P/E= 1.11 ,属具远极单沟—拟沟类型,外壁表面零星分布有柱状颗粒,多为单个着生,少数为2~3个合生。图1
2.2 花粉活力的测定
2.2.1 染色法
利用TTC溶液对刚开裂的膜苞鸢尾花粉进行染色,镜检观察花粉未被染色,而醋酸洋红染色法无论何时取样均可使花粉全部染成粉红色;采用联苯胺法染色花粉分别呈现红色、粉红色、淡粉红色和没有活力的灰白色。由此可得,TTC、醋酸洋红染色效果不佳,不适于膜苞鸢尾花粉活力的检测,而联苯胺呈现明显变色反应,利于统计花粉活力,可作为快速、简便的方法测定膜苞鸢尾的花粉活力。
2.2.2 离体萌发法
研究表明,不同组分及浓度的培养基对膜苞鸢尾花粉离体萌发有显著的影响,其中8号萌发效果最好,萌发率为45.2%,与10号相比差异显著(P<0.05),与 1,2,3,4,5,6,7,9 号相比差异极显著(P<0.01),可见琼脂10 g/L+蔗糖150 g/L+硼酸0.3 g/L可作为膜苞鸢尾花粉萌发培养基。表1
该模块整体结构如图6所示:首先数据通过两级FIFO缓存存储图像的两行数据,加上当前行的数据,行成三行图像的数据流,采用D触发器将之前的6个数据存储形成一个3×3滤波窗口。
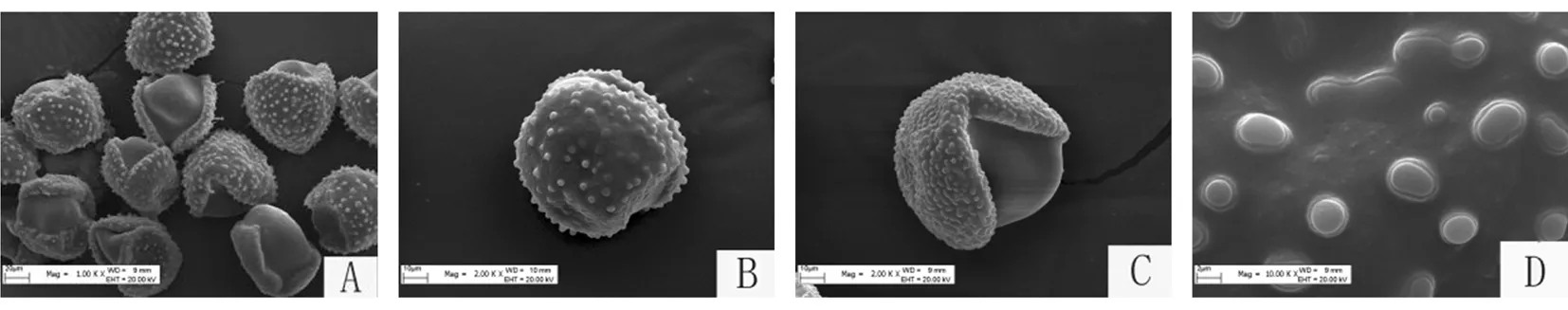
注:A:群体花粉形态;B:个体花粉极面观;C:赤道面观;D:外壁纹饰
Note: A: Population pollen grains; B: the polar view of pollen grains; C: the equatorial view of pollen grains; D: exine omamentation of pollen grains
图1 膜苞鸢尾花粉形态
Fig.1 Pollen morphology ofIrisscariosagermplasm resources
表1 不同培养基组分下花粉萌发率变化
Table 1 The effect of different medium component on pollen germination
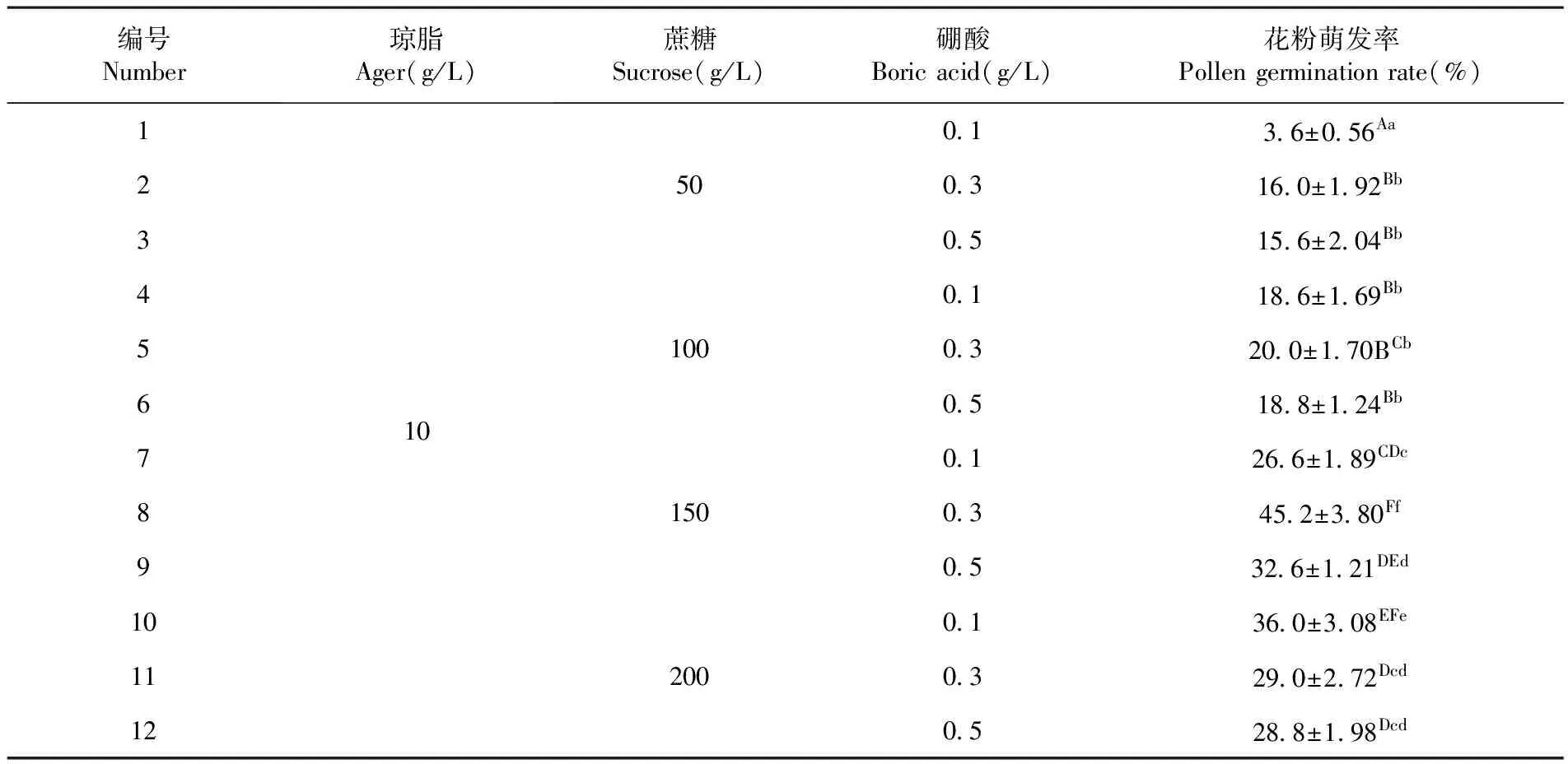
编号Number琼脂Ager(g/L)蔗糖Sucrose(g/L)硼酸Boricacid(g/L)花粉萌发率Pollengerminationrate(%)12345678910111210501001502000136±056Aa03160±192Bb05156±204Bb01186±169Bb03200±170BCb05188±124Bb01266±189CDc03452±380Ff05326±121DEd01360±308EFe03290±272Dcd05288±198Dcd
注:数据后的小写和大写字母分别表示0.05和0.01水平差异显著性,下同
Note:The capital and small letters indicate significant difference at 0.05 and 0.01 respectively at same colume, the same as below
2.3 花粉活力及寿命
膜苞鸢尾花期2~2.5 d,研究表明,联苯胺染色法测得的花粉活力高于萌发法,但两种方法在不同开花时段测得花粉活力规律一致,即开花当天花粉活力最强,开花4 h时花粉活力达到最大值(染色法为78.8 %,萌发法为48.7%),此后花粉活力每天呈阶梯性下降,但在单花花期结束时花粉仍然具有部分活力,两种方法测得花粉活力均呈现先升高后下降的趋势。表2
2.4 柱头可授性与人工授粉坐果率
柱头可授期是花朵成熟过程中的一个重要时期,研究表明,用联苯胺-过氧化氢溶液对开花前1 d柱头进行处理,可检测到柱头已经具有较强可授性,开花当天与第2 d柱头均保持较强的可授性,直到第3 d(开花48 h)花被片逐渐卷曲,柱头可授性下降,开花52 h时柱头萎蔫,失去可授性。而从开花前1 d至开花32 h的人工授粉坐果率均可达90%以上,说明该时段为传粉成功的最佳时段,开花48 h后坐果率开始迅速下降,但52 h仍有30%坐果,可见联苯胺染色与人工异花授粉结果基本一致,仅在开花52 h结果略有差异,造成差异的原因可能是套袋的柱头比暴露在自然环境下的柱头可授性略有延长。单枚果实结籽数表明每天中午授粉的结籽数均优于其他时段。霍宏亮等[13]认为花粉管生长速度受环境温、湿度的影响较大,与种质无关,因此,推测当时中午时段的温度、湿度可能更适合授粉后的花粉管的生长,受精成功的可能性高于其他时段。表3
表2 开花不同时段花粉活力与花粉萌发率
Table 2 Pollen vitality and germination in different blossom periods of theIrisscariosa

处理Treatment(h)花粉活力Pollenviability(%)联苯胺法BenzidineTTC法TriphenylTetrazoliumchloride醋酸洋红法Acetocarmine花粉萌发率Pollengermination(%)离体萌发法Invitrogermination1d061980±552CDc--432±134EFe47880±357Ed--487±221Ff87335±414DEd--403±159Ee2d245430±300BCc--262±149Dd284213±187ABb--232±150CDcd323708±327Aab--191±096Cc3d483270±219Aab--124±120Bb522778±463Aa--43±092Aa
表3 膜苞鸢尾柱头可授性与人工异花授粉座果率检测
Table 3 The test result of stigma receptivity and manual outcrossing ofIrisscariosa

开花时间Floweringtime柱头可授性Stigmareceptivity坐果率fruitsetrate(%)结籽数Seedsperfruit-1d+++100516±3721d0h+++100339±5384h+++100415±2728h++100373±2602d24h++100450±31628h++100465±27732h+90375±2923d48h+/-50358±65352h-30437±606
注:①+++具强可授性;++具较强可授性;+具可授性;+/-部分具可授性;-不具可授性
Note:①+++with very strong stigma receptivity; ++with quite strong stigma receptivity; +with stigma receptivity; -/+with partial stigma receptivity; -without stigma receptivity
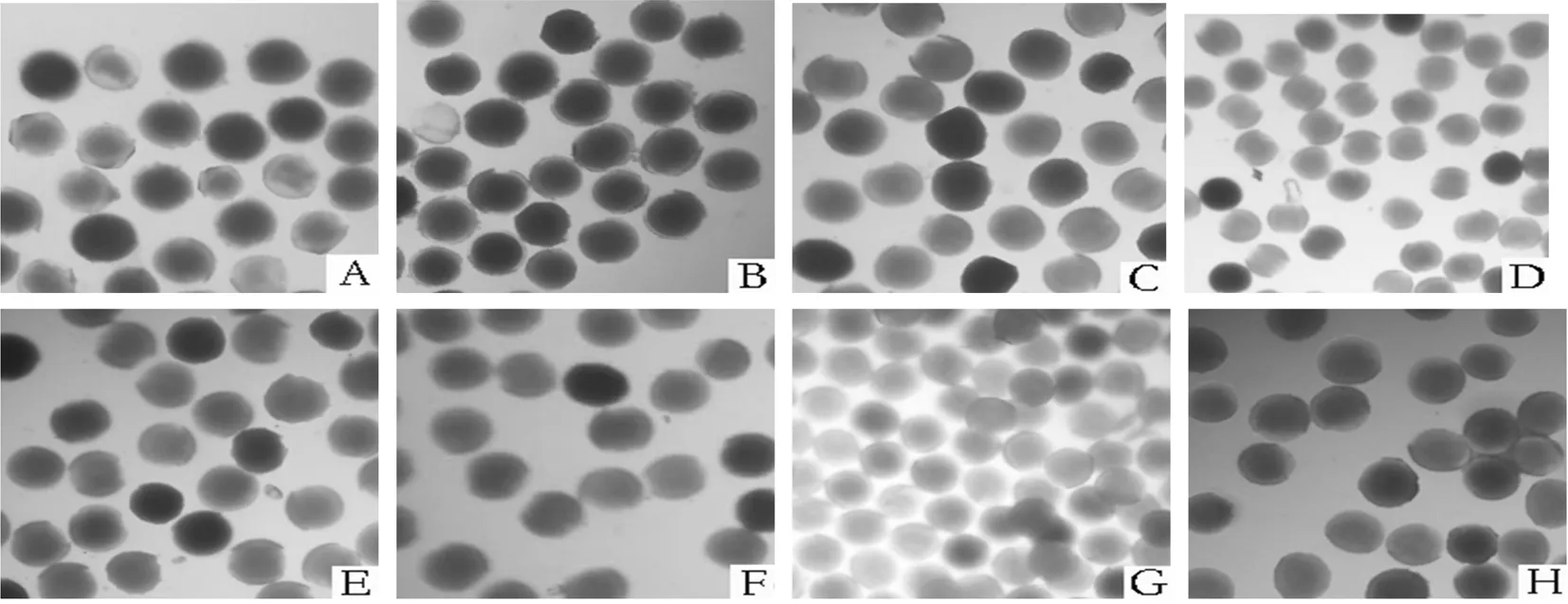
注:图A-H分别为开花0、4、8、24、28、32、48、52h的联苯胺染色结果。
Note:Fig A-H respectively represent dyeing results with benzidine method, the flowering time was about 0、4、8、24、28、32、48、52h.
图2 联苯氨染色膜苞鸢尾花粉结果
Fig.2 The dying results with benzidine method ofIrisscariosa
3 讨 论
鸢尾属植物的花粉形态特征基本相似,但在花粉表面纹饰的细微结构上有所差别[14,15]。鸢尾属植物的花粉多为舟状或近球形,花粉分两侧对称或辐射对称,萌发孔可分为远极单沟、远极单沟-拟沟、二合沟及无萌发孔等类型[16]。研究表明,膜苞鸢尾花粉形态近球形,两侧对称,属远极单沟-拟沟类型,是本属的较原始类型,花粉外壁稀疏分布有柱状颗粒,多单生,偶有合生,这一结果与余小芳、姜忠国[8,17]等研究其他鸢尾属花粉外壁纹饰多为穿孔状或网状不同。
花粉活力是植物生殖研究的主要内容之一,染色法测定花粉活力具有快速简便的优点,但受花粉自身特性的影响较大,不同的染色法只适合某些植物花粉活力的测定[6],余小芳等[8]用醋酸洋红法检测马蔺、四川鸢尾、薄叶鸢尾和锐果鸢尾的花粉活力,董玉芝[18]用TTC染色法对中亚鸢尾花粉活力进行研究,但许玉凤[11]、王文元等[19]认为TTC法和醋酸洋红染色法均不稳定。试验表明,TTC、醋酸洋红染色法不适用于膜苞鸢尾花粉活力的检测,而联苯胺染色法呈现明显变色反应,可作为野外快速测定的便捷方法。离体萌发法操作复杂,耗时长,适用于所有植物的花粉生活力测定,但不同的植物材料需要培养基组分不同,膜苞鸢尾最适培养基浓度组合为琼脂10 g/L+蔗糖150 g/L+硼酸0.3 g/L。
膜苞鸢尾单花花期2~2.5 d,开花当天花粉活力最强,开花4 h花粉活力达到最大值,此后花粉活力逐渐下降,但单花花期结束时花粉仍然具有部分活力。繁育能力除了与花粉活力有关外,还明显受到柱头可授性的影响:膜苞鸢尾柱头从开花前1 d至开花第2 d均保持较强的可授性。膜苞鸢尾花粉活力与柱头可授期有部分重叠,时间上具备了自交的可能。田间观测发现90%以上柱头位置始终高于花药,存在空间隔离,属探出式雌性异位的生长方式[20]。而膜苞鸢尾雌性器官柱头先熟于花药可以优先接受异株植物花粉从而实现异交,所以雌性先熟机制可以为异交的繁育系统提供良好的保证[21-23],膜苞鸢尾是否具有避免自花传粉而向异花传粉机制演化,还需进一步研究。
4 结论
4.1 膜苞鸢尾花粉形态近圆形,极轴68.43 μm (63.710~79.570),赤道轴61.71 μm (56.452~66.129),极赤比=P/E= 1.11 ,属远极单沟-拟沟类型,是本属的较原始类型。
4.2 TTC、醋酸洋红染色法均不能对不同开花时段的花粉染色,因此这两种方法不能用作膜苞鸢尾花粉活力的检测;联苯胺染色法能快速反映不同开花时段花粉活力的染色情况,但染色结果过高,不能准确的代表花粉活力;离体萌发法适用于大多数植物花粉活力的检测,测定值较准确,因此可作为膜苞鸢尾花粉活力的有效检测方法,且最佳培养基组合浓度为琼脂10 g/L+蔗糖150 g/L+硼酸0.3 g/L。
4.3 通过田间观测发现,膜苞鸢尾雌性器官柱头在空间位置上明显高于花药,这种空间分离的生长方式不利于自花授粉;通过试验测定,膜苞鸢尾柱头在开花前1 d已具有较强的可授性,即柱头先熟于花药,花粉活力与柱头可授期有部分重叠,其具备自花授粉的可能;其次,开花前1 d至第2 d进行人工授粉均得到90%以上的坐果率,收获的籽粒多而饱满,开花第3 d坐果率降为50%以下,且籽粒少而小,此外,中午14:00左右进行授粉的结籽率均高于早晨和下午,温度能够促进花粉管的生长从而快速到达子房,形成有效的胚珠。
References)
[1] 赵毓堂. 中国植物志(第十六卷·第一分册)[M]. 北京:科学出版社,1985.
ZHAO Yu-tang. (1985).FloraofChina(16 Volumes, the First Volume) [M]. Beijing: Science Press. (in Chinese)
[2] 杨阳,陈洁君,王辉,等. 膜苞鸢尾和蓝花喜盐鸢尾的化学成分研究[J]. 中草药,2013,44(11):1 371-1 375.
YANG Yang, CHEN Jiejun, WANG Hui, et al. (2013). Chemical constituents fromIrisscariosaandIrishalophilavar. Sogdiana [J].ChineseTraditionalandHerbalDrugs, 44(11):1,371-1,375. (in Chinese)
[3] 贺海洋,董玉芝,昝少平,等. 新疆野生鸢尾的引种驯化及应用研究[J].园林科技信息, 2005,(4):2-8.
HE Hai-yang, DONG Yu-zhi, ZAN Shao-ping, et al. (2005).Plant introduction cultivation and application study of Xinjiang-wild Iris [J].GardenScienceandInformation, (4):2-8. (in Chinese)
[4] 周源. 七种鸢尾的抗旱性研究[D]. 新疆:新疆农业大学硕士学位论文,2006.
ZHOU Yuan. (2006).Studiesonthedroughtresistanceof7Irisspecies[D]. Master Dissertatin. Xinjiang Agricultural University, Urumqi. (in Chinese)
[5] 林辰壹,韩文娟,祁晨霞,等. 新疆高葶韭雄蕊开花动态特征与花粉育性研究[J]. 草业科学,2012,29(4):561-566.
LIN Chen-yi, HAN Wen-juan, QI Chen-xia, et al. (2012).Stamen dynamics and pollen fertility of Allium obliquum in Xinjiang Province, China [J].PrataculturalScience, 29(4):561-566. (in Chinese)
[6] 王永周,古松,江莎. 臭椿花粉生活力的测定方法及对比实验[J].内蒙古农业大学学报(自然科学版),2008,29(1):88-92.
WANG Yong-zhou, GU Song, JIANG Sha. (2008). The testing methods and comparison of pollen vitality [J].JournalofInnerMongoliaAgriculturalUniversity(natural science ed.), 29(1),88-92. (in Chinese)
[7] 左丹丹,明军,刘春,等. 植物花粉生活力检测技术进展[J]. 安徽农业科学,2007,35(16):4 742-4 745.
ZUO Dan-dan, MING Jun, LIU Chun, et al. (2007). Advance in technique of plant pollen viability [J].JournalofAnhuiAgri.Sci., 35(16):4,742-4,745.(in Chinese)
[8] 余小芳,张海琴,蒋天仪,等. 鸢尾属5种植物的花粉活力及柱头可授性研究[J]. 中国中药杂志,2009,(5):34(10):1 204-12 06.
YU Xiao-fang, ZHANG Hai-qin, JIANG Tian-yi, et al. (2009).Study on pollen viability and stigma receptivity of 5 Iris plants [J].ChinaJournalofChineseMateriaMedica, (5):34(10):1,204-1,206. (in Chinese)
[9] Kalinganire, A., Harwood, C. E., Slee, M. U., & Simons, A. J. (2000). Floral structure, stigma receptivity and pollen viability in relation to protandry and self-incompatibility in silky oak (grevillea robusta a. cunn.).AnnalsofBotany, 86(1):133-148.
[10] 刁永强,耿文娟,廖 康,等. 新疆野生杏花粉量及花粉活力研究初报[J]. 新疆农业科学,2012,49(1):40-45.
DIAO Yong-qiang, GENG Wen-juan, LIAO Kang, et al. (2012).Preliminary study on the pollen amount and its viability of wild apricot in Xinjiang [J].XinjiangAgriculturalSciences, 49(1):40-45. (in Chinese)
[11] 许玉凤,韩静,海风,等. 鸢尾属植物花粉活力和柱头可授性的研究[J]. 北方园艺,2010,(16):129-131.
XU Yu-fang, HAN Jing, HAI Fang, et al. (2010).Study on stigma receptivity and pollen viability ofIris[J].NorthernHorticulture, (16):129-131. (in Chinese)
[12] 刘宗才,焦铸锦,董旭升,等. 鸢尾的花部结构及繁育系统特征[J]. 园艺学报,2011,(7):1 333-1 340.
LIU Zong-cai, JIAO Zhu-jin, DONG Xu-sheng, et al. (2011). Floral syndrome and breeding system ofIristectorum[J].ActaHorticulturaeSinica, 38(7):1,333-1,340. (in Chinese)
[13] 霍宏亮,张日清,马庆华,等. 川榛柱头可授性及花粉管生长特性的研究[J]. 林业科学研究,2014,27(3):403-409.
HUO Hong-liang, ZHANG Ri-qing, MA Qing-hua, et al. (2014). Stigam receptivity and characteristics of pollen tube growth ofCoryluskweichowensis[J].ForestResearch, 27(3):403-409. (in Chinese)
[14] 齐耀斌,赵毓棠. 中国鸢尾属花粉形态研究[J]. 植物分类学报,1987,25(6):430-436.
QI Yaobin, ZHAO Yu-tang. (1987). Studies on the pollen morphology of the genus Iris in China [J].ActaPhytotaxonomicaSinica, 25 (6):430-436. (in Chinese)
[15] 许玉凤,张 轲,王文元,等. 9种鸢尾植物花粉形态的扫描电镜观察[J]. 沈阳农业大学学报,2008,39(6):733-736.
XU Yu-feng, ZHANG Ke, WANG Wen-yuan, et al. (2008). Pollen morphology of 9 species of genus Iris with scanning electron microscope [J].JournalofShenyangAgriculturalUniversity, 39(6): 733-736. (in Chinese)
[16] 杨瑞林. 射干和马蔺的花粉形态[J]. 广西植物,2002,22(3):237-238.
YANG Rui-lin. (2002). Examination on pollen morphology ofBelam-candachinensis(L.)DC. andIrisLacteavar.chinensisKoidz [J].Guihaia, 22(3):237-238. (in Chinese)
[17] 姜忠国,董丹,张琪,等. 玉蝉花花粉生活力检测和超低温保存研究[J]. 安徽农业科学,2016,44(1):216-219,222.
JIANG Zhong-guo, DONG Dan, ZHANG Qi, et al. (2016). The viability detection and pollen cryopreservation ofIrisensataThunb [J].JournalofAnhuiAgri.Sci. , 44(1): 216-219,222. (in Chinese)
[18] 董玉芝,昝少平,李宁,等. 中亚鸢尾的花粉生活力及其授粉[J]. 东北林业大学学报,2003,(6):78-79.
DONG Yu-zhi, ZAN Shao-ping, Li Ning, et al. (2003). The pollen living ability and pollination ofIrisbloudowii[J].JournalofNortheastForestryUniversity, (6):78-79. (in Chinese)
[19] 王文元,许玉凤,李楠,等. 不同温度和保存条件对鸢尾属植物花粉活力的影响[J]. 安徽农业科学,2006,34(23):6 103-6 104.
WANG Wen-yuan, XU Yu-feng, LI Nan, et al. (2006). Effect of different temperature and preserved condition on the pollen viability of Iris [J].JournalofAnhuiAgri.Sci. , 34(23):6,103-6,104. (in Chinese)
[20] 张晓嘉,宁伟,马铭,等. 3种生殖方式蒲公英花粉活力和柱头形态及可授性对比[J]. 西北植物学报,2014,(8):1 565-1 569.
ZHANG Xiao-jia, NING Wei, MA Ming, et al.(2014). Comparation of Pollen Viability and Stigma surface morphology and receptivity in three reproductive strategies ofTaraxacum[J].ACTABot.Boreal-OccidentSin, (8):1,565-1,569. (in Chinese)
[21] 郭红超,严成,魏岩. 木地肤的开花动态与花粉活力及柱头可授性研究[J]. 草业学报,2014,(4):87-93.
GUO Hong-chao, YAN Cheng, WEI Yan. (2014).Study on the flowering dynamic, pollen viability and stigma receptivity ofKochiaprostrate[J].ActaPratacultureSinica, (4):87-93.(in Chinese)
[22] Barrett, S. C. H., Jesson, L. K., & Baker, A. M. (2000). The evolution and function of stylar polymorphisms in flowering plants.AnnalsofBotany,85(3):253-265.
[23] Barrett SCH. (2004).FlowerdiversityandparbookofScience&Technology[M]. New York:McGraw Hill Inc :110-113.
Fund project: Autonomous Region Key Technology R&D Program"Studies on the Reproductive Biology ofIrisscariosa."(2014211A035)
Pollen Morphology, Viability and Stigma Receptivity ofIrisscariosaWilld
MA Yu-mei,ZHANG Yun, QIN Jing-yi, WANG Xiu-mei, ZHU Tian-tian
(CollegeofForestryandHorticulture,XinjiangAgriculturalUniversity,Urumqi, 830052,China)
【Objective】 To explore the dynamic variation rule with pollen viability and stigma receptivity ofIrisscariosaWilld., in order to provide a reliable basic data for sexual reproduction.【Method】Scanning electron microscope was used to observe pollen morphology, in vitro pollen germination and staining method were applied to test the pollen viability, and the stigma receptivity of different flowering period was evaluated with the benzidine-α-naphtho method, and the artificial-pollinate method was employed to test the best period of pollination.【Result】The pollen morphology of aperture is monocolpate, belonging to the distal single groove-quasi groove type, the outer wall of pollen surface had scattered columnar grains; The higher pollination held in the first flowering day and flowering after 4 h reached the highest peak, the stigma had receptivity from the first day to flowering after 32 h.【Conclusion】The pollen morpho-gy is a more primitive type, female flower matured before male, Pollen viability and stigma overlap. The day of flowering and the next day are the best time for artificial pollination.
Irisscariosa;pollen morphology;pollen viability;stigma receptivity
2016-11-14
新疆维吾尔自治区自然科学基金“膜苞鸢尾繁殖生物学研究”资助(2014211A035)
马玉梅(1991-),女,新疆人,硕士,研究方向为野生植物繁殖生物学,(Email)1425562945@qq.com
张云(1965-),女,河北沧州人,副教授,硕士生导师,研究方向为植物繁殖生物学及种质资源应用,(E-mail)zy8128282@163.com
10.6048/j.issn.1001-4330.2017.01.014
S682.1+9
A
1001-4330(2017)02-0110-07
