人工老化对大麦种子活力及其萌发早期淀粉分解和内源激素的影响
2017-04-13王凤齐军仓郑许光郭亚南龚磊王少玉陈阿龙黄湘怡李忠豪宋瑞娇
王凤,齐军仓,郑许光,郭亚南,龚磊,王少玉, 陈阿龙,黄湘怡,李忠豪,宋瑞娇
(石河子大学农学院,新疆石河子 832003)
人工老化对大麦种子活力及其萌发早期淀粉分解和内源激素的影响
王凤,齐军仓,郑许光,郭亚南,龚磊,王少玉, 陈阿龙,黄湘怡,李忠豪,宋瑞娇
(石河子大学农学院,新疆石河子 832003)
【目的】研究老化处理对大麦种子活力及其萌发早期胚乳淀粉粒类型、淀粉含量、淀粉酶活性及内源激素的影响。【方法】采用高温高湿的人工老化处理方法。【结果】人工老化使4个大麦品种的发芽特性指标和种胚活力均逐渐降低。萌发72 h的种子胚乳中小淀粉粒数目增加,大淀粉粒数目减少,淀粉质量分数增加。随着老化时间的延长,α-淀粉酶、β-淀粉酶和极限糊精酶活性均呈降低的趋势,且老化15 d的种子淀粉酶活性显著低于对照;萌发24 h,GA3含量显著低于对照,萌发48~72 h,GA3含量均高于对照。ABA含量在萌发过程中均高于对照。【结论】人工老化打破了萌发过程中GA3和ABA间的平衡,导致淀粉酶活性降低,淀粉分解减缓,进而使大麦种子活力降低,萌发受到抑制。
大麦;人工老化;种子活力;淀粉粒;淀粉酶;内源激素
0 引 言
【研究意义】目前有关老化对种子萌发过程中生理生化影响的报道较多,但对于种子老化机理的研究仍处于探索阶段。研究人工老化对大麦种子活力及其萌发早期淀粉分解和内源激素的影响,对完善大麦种子老化机理的研究具有重要意义。【前人研究进展】老化会影响种子活力及可溶性糖、蛋白质等贮藏物质含量的变化[1-2]。淀粉是大麦种子中最主要的贮藏物质,在大麦胚乳中以淀粉粒的形式存在且大小差别较大。Kang 等[3]将大麦淀粉粒分为大和小2种类型,而Takeda 等[4]将大麦淀粉粒分为A型、B型和C型(即大、中和小型)3种类型,但由于B和C型淀粉粒大小差别较小,且二者的发生发育相似,在观察结构时很难将 B、C型淀粉粒明显区分开[5]。目前,大麦胚乳淀粉质量分数及淀粉粒研究集中在籽粒发育的早期[6-8],但是老化处理对大麦种子萌发过程中的淀粉质量分数及淀粉粒的研究较少。老化处理对大麦种子萌发过程中的淀粉含量研究较少。大麦种子中淀粉的降解以水解途径为主,淀粉磷酸化途径为辅,α-淀粉酶和β-淀粉酶是主要的水解酶,α-淀粉酶是内切型淀粉酶,分解淀粉的产物是麦芽糖和麦芽三糖或麦芽糖、麦芽三糖和α-糊精。β-淀粉酶是外切淀粉酶,不能分解支链淀粉的分支点,淀粉经β-淀粉酶分解的产物是麦芽糖和α-糊精。在种子萌发过程中α-淀粉酶活性呈增加的趋势,β-淀粉酶活性水平在整个种子萌发过程中均要高于α-淀粉酶活性[9]。然而,老化对于大麦种子淀粉分解过程中水解酶的研究鲜见报道。此外,种子的萌发是多种激素相互作用的结果。在种子萌发时,发育中的胚会向糊粉细胞中释放赤霉素,进而促进这些细胞中多个水解酶基因的表达,如α-淀粉酶,这些水解酶会被分泌到胚乳中去分解淀粉和蛋白质,从而为胚的发育供给营养[10]。但是在大麦糊粉层细胞中脱落酸抑制赤霉素诱导的α-淀粉酶的过程[11]。目前,老化对种子内源激素影响的研究仅在在柔枝松种子[12]、毛竹种子[13]、油松种子[14]等。【本研究切入点】老化对大麦种子内源激素影响的研究鲜见报道。研究采用高温高湿人工加速老化法,对大麦种子进行老化处理,模拟其自然老化和劣变过程。【拟解决的关键问题】研究老化处理对大麦种子活力、淀粉粒、淀粉质量分数、淀粉酶活性及胚乳内源激素的影响,揭示大麦种子老化劣变对种子活力、淀粉分解和内源激素产生的影响,为完善大麦种子老化生理研究提供理论参考。
1 材料与方法
1.1 材 料
选取春性二棱皮大麦:甘啤4号、垦啤7号、P12-8和9810,均于2014年7月采自石河子大学实验站,保存于15℃种子库。
1.2 方 法
1.2.1 人工老化处理
采用高温高湿法[15],略作修改。将RP-250A型智能人工气候培养箱分5层,中间3层架子铺上尼龙网,预先将所有培养箱的内部、白瓷盘以及尼龙网等用75%乙醇消毒。用40 cm×30 cm白瓷盘盛满蒸馏水置于培养箱的最上层和最底层,将培养箱温度调至40℃,平衡1 d,待培养箱内的温湿度稳定在40℃、80%相对湿度。次日,分别将各品种种子单层平铺于培养箱中间3层,之后每隔0、3、9、15 d后取出种子并及时适量补水。最后,将老化处理后的种子置于室温下自然风干,待其含水量降至原始水平后进行相关试验。
1.2.2 萌发处理
参照《国际种子检验规程》[16]规定的大麦种子发芽条件,采用发芽盒纸上法。
1.2.3 取样
所有处理从种子吸水24、48和72 h取样,共3次,3次重复。
1.2.4 种子活力
1.2.4.1 标准发芽试验
参照《国际种子检验规程》规定的大麦种子发芽条件,采用发芽盒纸上法。
发芽势=第4 d发芽种子数/种子总数×100%.
发芽率=第7 d发芽种子数/种子总数×100%.
发芽指数(GI)=∑Gt/Dt.
活力指数(VI)=GI×S.
式中Dt为相应的发芽天数,Gt为与Dt相对应的不同时间(td)的发芽数,S为发芽7 d幼苗的鲜重(g)。
1.2.4.2 种胚活力测定
采用氯化三苯基四氮唑(TTC)染色的方法[17]。各处理3次重复。
1.2.5 淀粉粒类型的检测
1.2.5.1 淀粉粒提取
大麦胚乳淀粉粒的提取参照Peng等[19],略作修改。随机选取萌发72 h的大麦种子50粒,剥去种胚、根和芽,在10 mL蒸馏水中研磨。将混合物转入50 mL离心管,4 000 g离心5 min。移去沉淀上部的黄色胶状物,过60目筛,并将沉淀悬浮在10 mL H2O中。将悬浮液平铺在15 mL 80% (w/v)的氯化铯水溶液上(氯化铯的体积是悬浮液体积的2~3倍),4 000 g离心5 min,移去上清液。重复2次上述氯化铯离心步骤。用10 mL漂洗缓冲液洗沉淀3~4次,再用水和丙酮漂洗沉淀各3~4次。常温干燥沉淀,将干燥的淀粉研磨成细粉,过100目筛,储存于-20℃备用。
1.2.5.2 淀粉粒的观察
淀粉粒类型的变化采用荧光显微镜(Olympus BX51,Japan)观察[20]。各处理3次重复,每个处理观察10个视野,求平均值。
1.2.5.3 淀粉含量测定
淀粉含量采用双波长法[20],略作修改。用U3900分光光度计(Hitachi U-3900,Japan)对淀粉扫描液进行扫描得到吸收光谱。试验淀粉含量即直链淀粉和支链淀粉总和。
1.2.6 淀粉酶活性测定
淀粉酶活性采用3,5-二硝基水杨酸测定还原糖的方法[21]。淀粉酶活力的定义为1 min由底物催化生成1 mg还原糖的酶量为一个酶活力单位(U)。各处理3次重复。
1.2.7 种胚内源激素测定
1.2.7.1 样品前处理
样品前处理:随机选取萌发24、48和72 h的大麦种子50粒,剥去种胚、根和芽,迅速用液氮冷冻并研磨成粉末。
1.2.7.2 内源激素测定
激素种类:脱落酸(ABA)和赤霉素(GA3),采用酶联免疫吸附检测法[22]。
1.3 数据统计
利用Excel进行数据处理,SPSS 18.0进行方差分析,SigmaPlot 10.0作图。
2 结果与分析
2.1 人工老化对大麦种子活力的影响
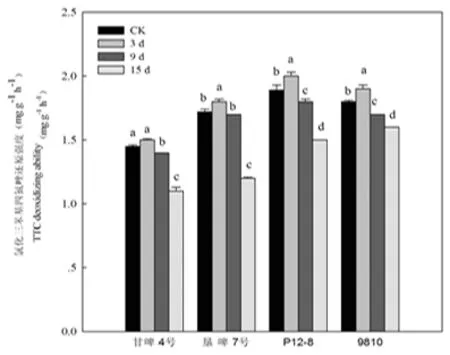
研究表明,老化处理后,各品种大麦种子的TTC还原强度呈先增加后降低的趋势。老化3 d的各品种种子TTC还原强度均高于对照,其中,垦啤7号、P12-8和 9810种子的TTC还原强度与对照相比,差异达到了显著水平,而甘啤4号种子的TTC还原强度与对照差异不显著。随着老化程度的加深,各品种种子的TTC还原强度都显著下降。老化15 d,各品种种子的TTC还原强度显著低于对照。图1
2.2 人工老化对大麦种子胚乳淀粉的影响
2.2.1 人工老化对大麦种子胚乳淀粉粒类型的影响
研究采用Kang等的方法[3],将淀粉粒分为大、小两类,即将B和C型统称为小淀粉粒,A型称为大淀粉粒。由图2可知,随着老化时间的延长,各品种种子胚乳中小淀粉粒逐渐增加,大淀粉粒逐渐减少。老化15 d甘啤4号、垦啤7号、P12-8和9810种子胚乳大淀粉粒显著低于对照;小淀粉粒显著高于对照。图2
注:不同字母表示不同老化天数间在0.05水平差异显著。下同
Note: Different letters indicate significant difference atP<0.05 level among different aging days. The same are as in the other figuers
图1 人工老化下大麦种子TTC还原强度变化
Fig.1 Effects of artificial aging on TTC reduction intensity of barley seed
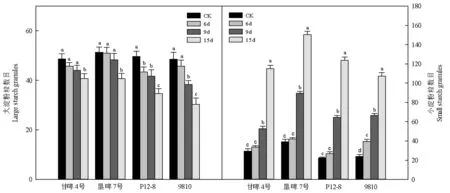
图2 不同活力水平的大麦种子萌发早期胚乳淀粉粒的类型统计(n=30)
Fig.2 Types statistics of endosperm starch grains in barley seeds with different vigor levels(n=30)
2.2.2 人工老化对萌发早期大麦胚乳淀粉含量的影响
研究表明,在萌发过程中,随着老化程度的加深,4个品种胚乳的淀粉质量分数均呈增加趋势。萌发24 h时,甘啤4号和P12-8老化3 d的胚乳淀粉质量分数显著高于对照,而垦啤7号和9810与对照差异不显著。各品种老化9 d的胚乳淀粉质量分数显著高于对照。甘啤4号、垦啤7号、P12-8和9810老化15 d的胚乳淀粉质量分数与对照相比分别增加了9.54%、5.83%、8.92%和7.27%,差异均达到显著水平。而且各品种老化9和15 d的淀粉质量分数,差异均达到显著水平。萌发48 h时,垦啤7号和P12-8老化3 d的胚乳淀粉质量分数显著高于对照,而甘啤4号和9810与对照差异不显著。各品种老化9 d的胚乳淀粉质量分数显著高于对照。甘啤4号、垦啤7号、P12-8和9810老化15 d的胚乳淀粉质量分数与对照相比分别增加了12.94%、19.60%、18.30%和22.70%,差异显著。但是各品种老化9和15 d的淀粉质量分数,无显著差异。萌发72 h时,各品种老化处理的胚乳淀粉质量分数显著高于对照,而且品种老化处理间(除甘啤4号老化9和15 d)淀粉质量分数差异均达到显著水平。表明人工老化使大麦种子萌发早期胚乳淀粉酶含量增加,不同品种间无差异。图3
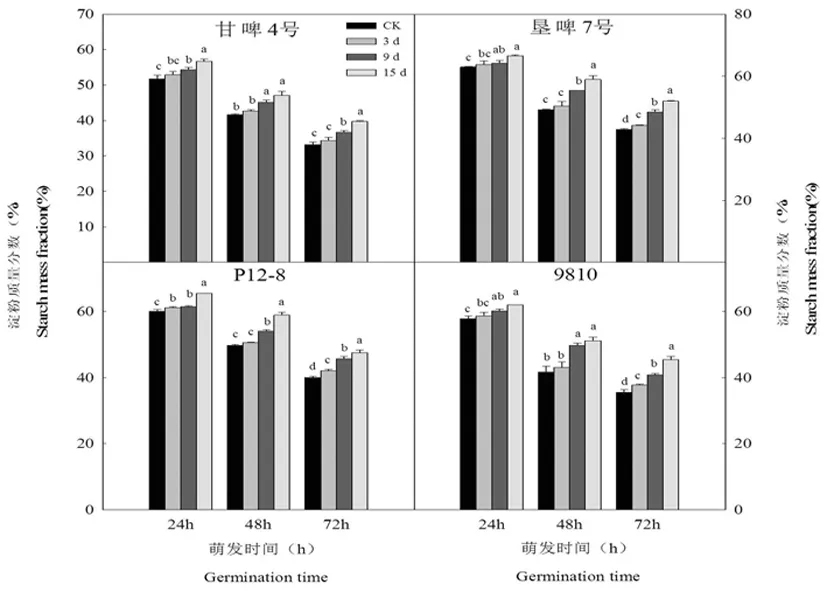
图3 人工老化下萌发早期大麦胚乳淀粉含量变化
Fig.3 Effects of artificial aging on starch mass fraction of barley endosperm in early germination
2.3 老化对萌发早期大麦种子淀粉酶活性的影响
2.3.1 老化对萌发早期大麦种子α-淀粉酶活性的影响
研究表明,在萌发过程中,随着老化程度的加深,4个品种种子在萌发过程中α-淀粉酶活性均呈降低趋势。萌发24 h时,垦啤7号和P12-8老化3 d的种子α-淀粉酶活性显著低于对照,而甘啤4号和9810与对照差异不显著。各品种老化9 d和老化15 d的种子内α-淀粉酶活性显著低于对照。萌发48 h时,甘啤4号和垦啤7号老化3 d的种子α-淀粉酶活性显著低于对照,而P12-8和9810与对照差异不显著。各品种老化9 d和老化15 d的种子内α-淀粉酶活性显著低于对照。萌发72 h时,各品种老化处理的种子内α-淀粉酶活性显著低于对照,而且不同老化处理间差异均达到显著水平。表明人工老化使大麦种子萌发早期α-淀粉酶活性降低,不同品种间无差异。图4
2.3.2 老化对萌发早期大麦种子β-淀粉酶活性的影响
研究表明,在萌发过程中,随着老化程度的加深,4个品种种子在萌发过程中β-淀粉酶活性均呈降低趋势。甘啤4号、垦啤7号、P12-8和9810老化处理的种子内β-淀粉酶活性显著低于对照,而且不同老化处理间差异均达到显著水平。表明人工老化使大麦种子萌发早期β-淀粉酶活性降低,不同品种间无差异。图5

图4 人工老化下萌发早期大麦种子α-淀粉酶活性变化
Fig.4 Effects of artificial aging on α- amylase activity of barley seeds in early germination
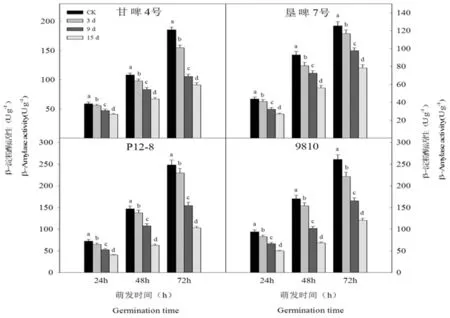
图5 人工老化下萌发早期大麦种子β-淀粉酶活性变化
Fig.5 Effects of artificial aging on β- amylase activity of barley seeds in early germination
2.4 老化对大麦种子萌发早期胚乳内源激素的影响
2.4.1 老化对大麦种子萌发早期胚乳GA3含量的影响
研究表明,在萌发过程中,正常种子胚乳中GA3含量呈先降低后增加的趋势。萌发24 h和48 h时,甘啤4号、垦啤7号和9810老化处理的种子胚乳GA3含量显著低于对照,而P12-8老化处理的种子胚乳GA3含量与对照差异不显著。萌发72 h时,各品种老化9 d显著高于对照,但是老化15 d的种子胚乳GA3含量显著低于老化9 d。图6
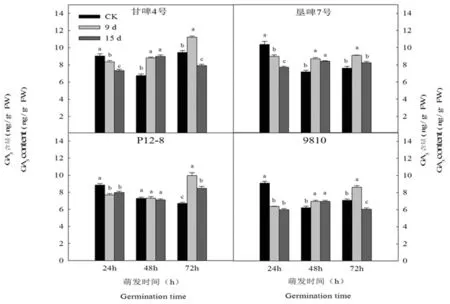
图6 人工老化下大麦种子萌发早期胚乳GA3含量变化
Fig.6 Effects of aging on GA3 content of endosperm of barley seeds in early germination
2.4.2 老化对大麦种子萌发早期胚乳ABA含量的影响
研究表明,在萌发过程中,各品种老化处理与正常的种子胚乳ABA含量变化呈降低的趋势,但是老化处理的种子胚乳ABA含量均高于对照。萌发24 h时,垦啤7号和9810老化处理的种子胚乳ABA含量显著高于对照,而甘啤4号和P12-8老化处理的种子胚乳ABA含量与对照差异不显著。萌发48 h时,其中垦啤7号、P12-8和9810老化处理的种子胚乳ABA含量显著高于对照,而甘啤4号老化处理的种子胚乳ABA含量与对照差异不显著。萌发72 h时,甘啤4号垦、啤7号和P12-8老化9 d的种子胚乳ABA含量显著高于对照,且各品种老化15 d的种子胚乳ABA含量显著高于对照。表明人工老化使大麦种子萌发早期胚乳ABA含量增加,不同品种间无差异。图7
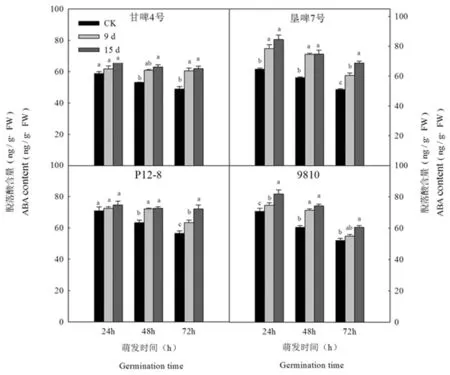
图7 人工老化下大麦种子萌发早期胚乳脱落酸含量变化
Fig.7 Effects of aging on ABA content of endosperm of barley seeds in early germination
3 讨 论
ABA和GA是种子萌发过程中起关键作用的内源信号分子,ABA诱导种胚细胞分裂停止、抑制种子萌发,而GA启动和促进种子萌发,两者存在相互拮抗的关系[23]。大麦种子吸胀18 h,种子内GA的含量显著增加;在吸胀初期ABA的含量均迅速下降,ABA代谢为红花菜豆酸(PA);吸胀18 h,ABA的含量下降量更大[24]。在种子吸水第二阶段的后期,脱落酸的含量恰好是种子能否完成萌发的决定因素[25]。GA3和ABA对未成熟种子萌发的影响与α-淀粉酶的活性有关,GA3促进α-淀粉酶的活性,ABA抑制α-淀粉酶的活性,但是低浓度的ABA能进一步的诱导GA3的活性,从而提高种子的发芽率[26]。研究发现,在种子吸胀时,GA3显著低于对照,随着萌发的进行,GA3逐渐高于对照。ABA在萌发过程中始终高于对照。此外,大麦种子萌发过程中α-淀粉酶、β-淀粉酶活性呈升高趋势[27],而老化处理后的大麦种子中α-淀粉酶和β-淀粉酶活性呈降低的趋势,而且将α-淀粉酶与β-淀粉酶活性变化趋势进行比较,β-淀粉酶活性降低的趋势更明显。这可能是老化处理使大麦种子在萌发初期胚乳中ABA增加,而GA3含量降低,从而使大麦种子糊粉层中GA3诱导的α-淀粉酶的合成过程受到影响,或是糊粉层细胞壁释放α-淀粉酶的过程受到了抑制[28]。然而,种子萌发过程中大麦β-淀粉酶的合成机制与α-淀粉酶不同,并不是所有的β-淀粉酶都从头合成。成熟的大麦种子中有游离态和束缚态的两种形态的β-淀粉酶,其中束缚态的β-淀粉酶占据有总β-淀粉酶的75%。这可能是自由态β-淀粉酶发生了部分降解或失活[29],或是蛋白酶介导的种子萌发束缚态β-淀粉酶的释放过程受阻[30]。因此,老化打破了萌发过程中内源激素GA3和ABA间的平衡,使淀粉酶活性降低,进而导致种子活力彻底丧失。
种子吸水后,其糊粉层和盾片上皮层会合成一系列水解酶,如α-淀粉酶和β-淀粉酶等,这些酶分泌到淀粉胚乳中,分解细胞壁与贮藏的淀粉[31]。萌发过程中,胚乳淀粉粒的直径逐渐变小,总淀粉粒的酶解效率和大淀粉粒含量呈正相关[32]。研究发现,未经老化处理的各品种大麦种子在萌发72 h时,胚乳均有大、小淀粉粒,且以大淀粉粒为主,大淀粉粒较少。但是随着老化程度加深,各品种种子胚乳中小淀粉粒的数目逐渐增加,大淀粉粒的数目逐渐减少,说明是老化降低了淀粉粒的酶解效率。同时,还发现随着老化时间的延长,各品种种子内淀粉质量分数均呈增加的趋势。这可能是随着老化程度的加深,种子糊粉层和盾片上皮层α-淀粉酶和β-淀粉酶的合成或释放过程受到影响,使其的活性受到抑制,从而导致胚乳淀粉粒分解延缓,淀粉质量分数增加。种子活力不是一个单一的测定特性,而是一种能表达有关种子批性能多种特性的综合概念[33]。此外,研究发现,老化3 d的各品种种子TTC还原强度均高于对照,可能是轻度老化引起的种子内部的抗氧化反应[1]。而老化9 d后,各品种种子的TTC还原强度都显著下降。这可能是此时种子内部发生了变化,从而引起种子活力的迅速下降。研究仅仅对老化后大麦种子活力、淀粉分解及内源激素的生理劣变进行了初步探索,其内在原因还需进一步深入研究。
4 结 论
研究采用高温高湿人工老化法,探索人工老化对4个品种大麦种子萌发早期淀粉粒、淀粉酶活性及内源激素ABA和GA3的影响。老化使内源激素GA3和ABA含量发生变化。在老化种子吸胀时,GA3显著低于对照,随着萌发的进行,GA3逐渐高于对照。而ABA在萌发过程中始终高于对照;老化使α-淀粉酶和β-淀粉酶活性均降低,且老化程度越深,酶活性越低;老化使胚乳中不同类型的淀粉粒数目和淀粉质量分数发生改变,随老化程度增加,胚乳中小淀粉粒逐渐增加,大淀粉粒逐渐减少,淀粉质量分数逐渐增加。老化还导致大麦种子发芽势、发芽率、发芽指数及种胚活力下降。
老化打破了大麦种子萌发早期内源激素GA3和ABA间的平衡,使淀粉酶活性降低,淀粉酶粒解减缓,淀粉质量分数增加,进而导致种子活力丧失。
References)
[1] 孔治有, 刘叶菊, 覃鹏. 人工加速老化对小麦种子CAT、POD、SOD活性和可溶性蛋白质含量的影响[J]. 中国粮油学报, 2010,25(10):24-27.
KONG Zhi-you, LIU Ye-ju, QIN Peng. (2010). Effects of Accelerated Aging on CAT, POD, SOD Activities and Soluble Protein Content of Wheat Seeds [J].JournaloftheChineseCerealsandOilsAssociation, 25(10):24-27. (in Chinese)
[2] 李春雷, 马世骏, 彭滨, 等. 人工老化对玉米种子活力指标、内含物质含量及生理指标的影响[J]. 吉林农业大学学报, 2014,36(5):505-509,514.
LI Chun-lei, MA Shi-jun, PENG Bin, et al. (2014). Effects of Artificial Aging on Seed Vigor Indexes, Embedded Sub-stance Content and Physiological Indexes of Maize [J].JournalofJilinAgriculturalUniversity, 36(5):505-509,514. (in Chinese)
[3] Kang, M. Y., Sugimoto, Y., Kato, I., Sakamoto, S., & Fuwa, H. (1985). Some properties of large and small starch granules of barley (l.) endosperm.AgriculturalandBiologicalChemistry, 31(5):423-429.
[4] Takeda, Y., Takeda, C., Mizukami, H., & Hanashiro, I. (1999). Structures of large, medium and small starch granules of barley grain.CarbohydratePolymers, 38(2):109-114.
[5] 韦存虚, 张军, 周卫东, 等. 大麦胚乳小淀粉粒的发育[J]. 作物学报, 2008, 34(10):1 788-1 796.
WEI Cun-xu, ZHANG Jun, ZHOU Wei-dong, et al. (2008). Development of Small Starch Granule in Barley Endosperm [J].ActaAgronomicaSinica, 34(10):1,788-1,796. (in Chinese)
[6] Yong-an, Jun-cang, Wei-hua, Lian-pu, WANG, & Zi-bu. (2012). Formation and developmental characteristics of a- and b-type starch granules in wheat endosperm.JournalofIntegrativeAgriculture, 11(1):73-81.
[7] Kalinga, D. N., Bertoft, E., Tetlow, I., Liu, Q., Yada, R. Y., & Seetharaman, K. (2014). Evolution of amylopectin structure in developing wheat endosperm starch.CarbohydratePolymers, 112(2):316-324.
[8] Yu, X., Yu, H., Zhang, J., Shao, S., Zhou, L., & Xiong, F., et al. (2015). Comparison of endosperm starch granule development and physicochemical properties of starches from waxy and non-waxy wheat.InternationalJournalofFoodProperties, 18(11):2,409-2,421.
[9] 王特, 薛永常. 国内外不同品种啤酒大麦萌发过程中酶的变化[J]. 中国酿造. 2011,30(3):51-54.
WANG Te, XUE Yong-chang. (2011). Change of endogenous enzymes during germination of domestic and imported brewing barley [J].ChinaBrewing, 30(3):51-54. (in Chinese)
[10] Nambara, E., Akazawa, T., & Mccourt, P. (1991). Effects ofthegibberellin biosynthetic inhibitor uniconazol on mutants ofarabidopsis.PlantPhysiology, 97(2):736-738.
[11] Vanková, R. (2011). Analysis of cytokinin mutants and regulation of cytokinin metabolic genes reveals important regulatory roles of cytokinins in drought, salt and aba responses, and aba biosynthesis.PlantCell, 23(6):2,169-2,183.
[12] 马书燕, 李吉跃, 彭祚登. 人工老化过程中柔枝松种子内源激素含量变化的研究[J]. 种子, 2010, 29(2):4-8.
MA Shu-yan, LI Ji-yue, PENG Zuo-deng. (2010). Study on the Variation Changes of Endogenous Hormone in the Seeds of Pinus flexilis James during Artificial Aging Course [J].Seed, 29(2):4-8. (in Chinese)
[13] 蔡春菊, 范少辉, 刘凤, 等. 毛竹种子人工老化过程中生理生化变化[J]. 林业科学, 2013, 49(8):29-34.
CAI Chun-ju, FAN Shao-hui, LIU Feng, et al. (2013). Physiological and Biochemical Changes of Moso Bamboo (Phyllostachys edulis) seeds in Artificial Aging [J].ScientiaSilvaeSinicae, 49(8):29-34. (in Chinese)
[14] 陈丽培, 杨博, 沈永宝. 油松种子萌发初始阶段胚乳内源激素含量变化研究[J]. 北京林业大学学报, 2012,34(6):30-33.
CHEN Li-pei, YANG Bo, SHEN Yong-bao. (2012). Endogenous hormone content of endosperm of Pinus tabuliformis seeds during initial germinating stage [J].JournalofBeijingForestryUniversity, 34(6):30-33. (in Chinese)
[15] 廖乐, 齐军仓, 华淼源, 等. 人工老化对大麦种子萌发过程中发芽特性及部分酶活性的影响[J]. 麦类作物学报, 2015,35(1):71-79.
LIAO Le, QI Jun-cang, HUA Miao-yuan, et al. (2015). Effects of artificial aging on germination characteristics and some enzymes activities during imbibition of barley seeds [J].JournalofTriticeaeCrops, 35(1):71-79. (in Chinese)
[16]国际种子检验协会国际种子检验规程[S]. 北京: 技术标准出版社, 1980,151.
[17] 李合生, 孙群, 赵世杰, 等. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006:207-208.
LI He-sheng, SUN Qun, ZHAO Shi-jie, et al. (2006).PlantPhysiologyandBiochemistryExperimentalprinciplesandtechniques[M]. Beijing: Higher Education Press: 207-208. (in Chinese)
[18] Peng, M., Gao, M., Esm, A. A., Hucl, P., & Chibbar, R. N. (1999). Separation and characterization of a- and b-type starch granules in wheat endosperm.CerealChemistry, 76(3):375-379.
[19] 李芬芬, 张本山. 淀粉颗粒粒径不同测定方法的比较[J]. 食品与发酵工业, 2010,36(4):171-174.
LI Fen-fen, ZHANG Ben-shan. (2010). Comparison of different starch granule diameter measurement methods of starch granule diameter [J].FoodandFermentationIndustries, 36(4):171-174. (in Chinese)
[20] 金玉红, 张开利, 张兴春, 等. 双波长法测定小麦及小麦芽中直链、支链淀粉含量[J]. 中国粮油学报, 2009,24(1):137-140.
JIN Yu-hong, ZHANG Kai-li, ZHANG Xing-chun, et al. (2009). Determination of Amylose and Amylopectin in Wheat and Wheat Malt by Dual- Wavelength Spectrophotometry [J].JournaloftheChineseCerealsandOilsAssociation, 24(1):137-140. (in Chinese)
[21] 刘志国. 生物化学实验[M]. 武汉: 华中科技大学出版社, 2007:123-125.
LIU Zhi-guo. (2007).Biochemicalexperiment[M]. Wuhan: Huazhong University of Science and Technology Press: 123-125. (in Chinese)
[22]Zhao J, Li G, Yi G X, et al. (2006). Comparison between conventional indirect competitive enzyme-linked immunosorbent assay (icELISA) and simplified icELISA for small molecules[J].AnalyticaChimicaActa, 571(1): 79-85.
[23] 江玲, 万建民. 植物激素ABA和GA调控种子休眠和萌发的研究进展[J]. 江苏农业学报, 2007,23(4):360-365.
JIANG Ling, WAN Jian-ming. (2007). Advances in seed dormancy and germination regulated by plant hormones ABA and GA.[J].JiangsuJournalofAgriculturalSciences, 23(4):360-365. (in Chinese)
[24] Jacobsen, J. V., Pearce, D. W., Poole, A. T., Pharis, R. P., & Mander, L. N. (2002). Abscisic acid, phaseic acid and gibberellin contents associated with dormancy and germination in barley.PhysiologiaPlantarum, 115(3):428-441.
[25] Finkelstein, R., Reeves, W., Ariizumi, T., & Steber, C. (2008). Molecular aspects of seed dormancy.PlantBiology, 59(59):387-415.
[26] 蒋素梅, 郭莺华, 陈晓慰, 等. GA3、ABA 对未成熟'博II优15'水稻种子萌发的影响[J]. 亚热带植物学报, 2009,38(3):31-33.
JIANG Su-mei, GUO Ying-hua, CHEN Xiao-wei, et al. (2009). Influence of GA3 and ABA on germination of immature rice Bo ⅡYou 15 seeds [J].SubtropicalPlantScience, 38(3):31-33. (in Chinese)
[27] 管斌, 李珊, 荀娟, 等. 啤酒大麦制麦过程中淀粉酶活性变化动态的研究[J]. 中国酿造, 2009,28(5):69-72.
GUAN Bin, LI Shan, XUN Juan, et al. (2009). Development of three amylase activity during barely malt production [J].ChinaBrewing, 28(5):69-72. (in Chinese)
[28] Taiz, L., & Jones, R. L. (1970). Gibberellic acid, β-1,3-glucanase and the cell walls of barley aleurone layers.Planta, 92(1):73-84.
[29] Nishimura I H, Nishimura M, Daussant J. (1986). Conversion of free β-amylase to bound β-amylase on starch granules in the barley endosperm during desiccation phase of seed development[J].Protoplasma, 134(2/3): 149-153.
[30] Guerin, J. R., Rcm, L., & Wallace, W. (1992). Release and activation of barley beta-amylase by malt endopeptidases.JournalofCerealScience, 15(1):5-14.
[31] Gibbons, G. C. (1981). On the relative role of the scutellum and aleurone in the production of hydrolases during germination of barley.CarlsbergResearchCommunications, 46(4):215-225.
[32] 李春艳, 陆振翔, 李诚, 等. 小黑麦、小麦和黑麦淀粉粒形态特征及酶解特性的差异[J]. 麦类作物学报, 2010,30(3):520-525.
LI Chun-yan, LU Zhen-xiang, LI Cheng, et al. (2010). Comparisons on morphology and susceptibilities to enzymes of starch granules in triticale, wheat and rye [J].JournalofTriticeaeCrops, 30(3):520-525. (in Chinese)
[34] 潘显政. 农作物种子检验员考核学习读本[M]. 北京: 中国工商出版社, 2006:206-207.
PAN Xian-zheng. (2006).CropseedinspectorsassesslearningReading[M]. Beijing: China Industrial and Commercial Press: 206-207. (in Chinese)
Fund project:The earmarked fund for Modern Agro-industry Technology Research System(CARS-05)
Effects of Artificial Aging on Seed Vigor, Starch Decomposition and Endogenous Hormones of Barley in the Early Germination
WANG Feng, QI Jun-cang, ZHENG Xu-guang, GUO Ya-nan, GONG Lei, WANG Shao-yu, CHEN A-long, HUANG Xiang-yi, LI Zhong-hao, SONG Rui-jiao
(CollegeofAgronomy,ShiheziUniversity,ShiheziXinjiang832003,China)
【Objective】 【Method】This study aims to explore the effects of artificial aging on seed vigor, starch granule, starch mass fraction and analyze the activity and endogenous hormones in the endosperm of barley seeds with high temperature and high humidity artificial aging treatment in the early stage of germination. 【Result】The results showed that: The germination indexes and embryo vitality of 4 varieties decreased gradually with increasing aging time. Artificial aging increased the small starch granules and reduced large starch granules of endosperm in the germination 72 h. In addition to that, artificial aging increased starch mass fraction during the germination, reduced the activity of α-amylase and β-amylase of all barley and there were significant differences between the aging 15 d and the control. Content of GA3was lower than that of CK in the germination 24 h but higher than that of the CK in the germination 48 to 72 h. However, contents of ABA were always higher than those of the CK in the all germination process. 【Conclusion】The balance between GA3and ABA was broken by aging, which resulted in the decrease of amylase activity and the slow-down of starch decomposition, so then barley seed vigor was decreased and the germination inhibited.
barley (HordeumvulgareL.); artificial aging; seed vigor' starch granule; amylase; endogenous hormones
2016-09-18
现代农业产业技术体系建设专项(CARS-05)
王凤(1991-),女,甘肃张掖人,硕士研究生,研究方向为大麦种质资源的创新与利用,(E-mail)1374798428@qq.com
齐军仓(1971-),男,新疆石河子人,教授,博士,研究方向为大麦遗传育种与栽培,(E-mail)shzqjc@qq.com
10.6048/j.issn.1001-4330.2017.01.005
S512.1;S311
A
1001-4330(2017)01-0033-10
