羊肚菌固态发酵玉米蛋白粉的研究
2017-04-13佟维娜郑明珠琳张陈方奇刘景圣
佟维娜 蔡 丹 郑明珠 修 琳张 浩 陈方奇 刘景圣
(吉林农业大学食品科学与工程学院1,长春 130118)
(小麦和玉米深加工国家工程实验室2,长春 130118)
羊肚菌固态发酵玉米蛋白粉的研究
佟维娜1,2蔡 丹1,2郑明珠1,2修 琳1,2张 浩1,2陈方奇1,2刘景圣1,2
(吉林农业大学食品科学与工程学院1,长春 130118)
(小麦和玉米深加工国家工程实验室2,长春 130118)
以玉米蛋白粉为主要原料,采用羊肚菌对其进行固态发酵培养,确定羊肚菌固态发酵玉米蛋白粉的培养基配方以及培养条件。结果表明:羊肚菌固态发酵玉米蛋白粉最适培养基配方为玉米蛋白粉30 g、葡萄糖2.5%、MgSO4·7H2O 0.15%、KH2PO40.25%、含水量65%;最佳培养条件为接种量14%、培养温度25℃、初始pH 6、发酵时间20 d。此条件下,得蛋白转化率为22.36%,菌丝体生物量为0.136 9 g/g。对发酵前后玉米蛋白粉进行氨基酸分析,结果表明:发酵后亲水性氨基酸含量比发酵前提高12.75%。对玉米蛋白粉原料和发酵后玉米蛋白粉进行扫描电镜观察,发酵后的玉米蛋白紧密的结构被打开,表面积增加,表面凹凸加剧,孔洞更为明显。
玉米蛋白粉 羊肚菌 固态发酵 菌丝体生物量 蛋白转化率
玉米蛋白粉是玉米淀粉加工过程中的主要副产物。玉米醇溶蛋白是玉米的主要贮藏蛋白,占玉米蛋白总量的50%~60%。基于溶解性和序列同源性,可以分为4类:α-玉米醇溶蛋白、β-玉米醇溶蛋白、γ玉米醇溶蛋白和δ-玉米醇溶蛋白。玉米醇溶蛋白含有丰富的谷氨酸、亮氨酸、脯氨酸和丙氨酸,从而具有良好的抗氧化性、成膜性和保水性,以及可塑性和稳定性。但由于玉米醇溶蛋白中含有高比例的疏水性氨基酸,其独特的氨基酸组成导致玉米蛋白的水溶性差,利用价值低和营养品质较低,不能直接用于人类消费[1-2]。为了提高其利用率,国内外很多学者在寻找玉米醇溶蛋白改性方法方面作了大量工作,包括物理改性[3-5]、化学改性[6-8]、生物改性[9-10]。在化学改性的生产中比较容易造成二次污染,需消耗大量的化学试剂,并且会破坏蛋白质的结构。而物理改性存在生物转化率低等弊端。
本试验应用微生物固态发酵玉米蛋白粉,由于微生物发酵过程中分泌的复合酶对蛋白质发生不同程度的降解,使大分子蛋白部分降解为小分子蛋白或多肽以及氨基酸等。并且固态发酵投资少、能耗较少,不易产生废气,对环境污染少。我国羊肚菌资源丰富,其具有营养、药用价值高等特点[11-12],且羊肚菌具有丰富的纤维素酶和木质素酶,在发酵过程中能够产生丰富的酶系,能够更好的作用于玉米蛋白粉,降解玉米蛋白粉中的多糖、蛋白质等,在进行固态发酵玉米蛋白粉的同时不会产生真菌毒素。目前羊肚菌固态发酵主要用于厨房垃圾制备饲料、豆渣等[13-14]。
本试验以玉米蛋白粉为主要原料,采用羊肚菌对其进行固态发酵培养,筛选最适的培养基配方,并探索最适培养条件,研究了在发酵过程中,菌丝体生物量、蛋白转化率以及发酵前后玉米蛋白粉氨基酸模式以及微观结构的变化。为改善玉米醇溶蛋白功能特性,提高玉米蛋白粉的应用领域提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
羊肚菌菌种Me-01(Morchella esculenta):吉林农业大学小麦和玉米深加工国家工程实验室。
1.1.2 菌种保存斜面培养基
固体麦芽汁培养基:吉林农业大学小麦和玉米深加工国家工程实验室。
1.1.3 试剂
玉米蛋白粉:吉林中粮生化能源销售有限公司;玉米粉、马铃薯:市售;可溶性淀粉:天津市光复精细化工研究所;麦芽糖、酵母浸粉、蛋白胨:北京奥博星生物技术有限责任公司。
1.2 仪器与设备
LD5-2B离心机:北京雷勃尔离心机有限公司;K1100全自动凯氏定氮仪:济南海能仪器股份有限公司;日立L-8900高速氨基酸分析仪:日立高新技术公司;NL-642HT PHENOM台式扫描电镜:复纳科学仪器(上海)有限公司;FLUO Omega多功能微孔板测读仪:德国BMG公司。
1.3 方法
1.3.1 羊肚菌的活化
将4℃保藏的羊肚菌菌种转接至新鲜的PDA斜面培养基,于培养箱27℃培养至第12天时采用。
1.3.2 发酵种子液的制备
葡萄糖2%,酵母浸粉1%,MgSO4·7H2O 0.075%,KH2PO40.12%,FeSO4·7H2O 0.001%,pH
值自然,121℃灭菌20 min,在无菌环境中,从活化好的斜面培养基中取3块菌体接入到装有30 mL液体种子培养基的100 mL三角瓶中,于27℃恒温进行摇床振荡培养,160 r/min培养6 d得制得发酵种子液。
1.3.3 固态发酵培养基配方优化
分别以玉米蛋白粉(15、20、25、30、35、40 g),葡萄糖(1.0%、1.5%、2.0%、2.5%、3.0%、3.5%),KH2PO4(0.05%、0.10%、0.15%、0.20%、0.25%、0.30%),MgSO4·7H2O(0.05%、0.10%、0.15%、0.20%、0.25%、0.30%),含水量(50%、55%、60%、65%、70%、75%)为单因素,固定值分别为玉米蛋白粉20 g、葡萄糖2%、KH2PO40.2%、MgSO4·7H2O 0.2%、含水量65%。考察这5个因素对蛋白转化率、菌丝体生物量的影响,并选用L16(45)正交表(表1)确定最优固态发酵培养基配方。

表1 培养基配方正交试验因素和水平
1.3.4 固态发酵培养条件优化
在固态发酵培养基配方正交试验的基础上,分别以培养温度(19、22、25、28、31℃),接种量(10%、12%、14%、16%、18%),初始pH(5.0、5.5、6.0、6.5、7.0),发酵时间(16、18、20、22、24 d)为单因素,固定值分别为培养温度25℃、接种量12%、pH 6、培养时间20 d,考察这4个因素对蛋白转化率、菌丝体生物量的影响,并选用正交表L9(34)(表2),确定最优固态发酵培养条件。

表2 培养基条件正交试验因素和水平
1.3.5 发酵产物菌丝体生物量的测定
1.3.5.1 纯菌丝体的获得
液体扩大培养结束后,培养液用6层尼龙布过滤,将尼龙布上的滤出物用蒸馏水充分洗涤,收集滤出物,烘箱60℃烘至恒重,将烘干后的菌丝体用研钵研碎,置于干燥器中备用。
1.3.5.2 核酸的提取以及测定方法
纯菌体中核酸的提取和测定:参照魏培莲等[15]在3种固态发酵生物量测定方法的比较中的方法进行测定。称取0.1 g纯菌体,加入25 mL 5%的三氯乙酸溶液,在80℃水浴中提取25 min,并不断搅拌,取出后冰浴,在8 000 r/min 4℃条件下离心15 min,取上清液稀释5倍,以5%三氯乙酸作空白对照,于260 nm处测OD值。
羊肚菌固态发酵产物中核酸的提取和测定:取0.25 g干燥培养物,研磨后按纯菌体中核酸的提取方法进行提取,未经发酵的固态基质采用同样的方法处理作为空白对照,在260 nm处测OD值,所测OD值对照纯菌体与核酸紫外吸收曲线关系(如图1)换算成菌体量。
发酵产物的菌丝体生物量=被利用的发酵产物菌丝体生物量-未经发酵的固态基质中菌丝体生物量
1.3.5.3 纯菌体中核酸含量与菌体量的线性关系
羊肚菌菌体与核酸紫外吸收曲线关系,如图1所示,纯菌体与核酸紫外吸收曲线关系回归方程为:y=3.777 7x+0.013 6,相关系数R2=0.999 2;式中:y为260 nm波长处的吸光值;x为每克干基质中菌丝体的生物量。
1.3.6 蛋白转化率的测定
总蛋白的测定:参照GB 5009.5—2010凯氏定氮法测定。可溶性蛋白的测定:称取样品0.5 g,加8 mL水研磨,4 000 r/min离心10 min,上清液定容至10 mL,再应用GB 5009.5—2010凯氏定氮法测定蛋白含量。
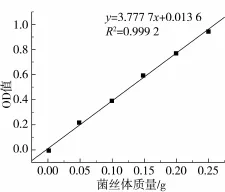
图1 纯菌体中核酸量与菌丝体质量的关系
蛋白转化率按照公式进行计算[16-17]:
蛋白转化率/%=(可溶性蛋白的含量÷原发酵培养基中的总蛋白含量)×100%
1.3.7 发酵前后氨基酸成分以及含量对比
利用L-8900高速氨基酸分析仪对玉米蛋白粉及最优条件下发酵产物的组分进行氨基酸组成以及含量的测定。
1.3.8 扫描电镜样品处理
将发酵前后的玉米蛋白粉进行烘干,分别均匀固定在电镜进样台上,真空条件下进行喷金,然后固定在载物台上,在1 000倍和4 000倍下寻找有代表性的图片进行拍照。
2 结果与分析
2.1培养基配方的单因素试验
2.1.1 最适氮源和碳源添加量的确定
如图2所示,当玉米蛋白粉添加量为20 g时,蛋白转化率、菌丝体生物量最高,分别为17.32%,
0.093 4 g/g;当葡萄糖添加量为2.0%时,蛋白转化率、菌丝体生物量最高,分别为17.32%、0.093 4 g/g。
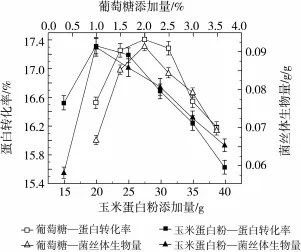
图2 最适氮源和碳源添加量的确定
2.1.2 最适MgSO4·7H2O和KH2PO4添加量的确定
如图3所示,当MgSO4·7H2O为0.2%时,蛋白转化率、菌丝体生物量最高,分别为17.43%、0.093 4 g/g;当KH2PO4为0.15%时,蛋白转化率、菌丝体生物量最高,分别为17.52%、0.102 3 g/g。

图3 MgSO4·7H2O和KH2PO4添加量的确定
2.1.3 最适含水量的确定
如图4所示,当含水量为65%时,蛋白转化率、菌丝体生物量最高,分别为17.43%、0.093 4 g/g。

图4 最适含水量的确定
2.2 培养基配方的正交优化试验
正交试验设计结果见表3。从正交试验结果得出,当以菌丝体生物量为指标时,影响菌丝体生物量的主次顺序为A>B>C>E>D,最优培养基配方A3B2C3D1E4不在这16组中,所以进行验证试验,通过验证试验得蛋白转化率为21.12%,菌丝体生物量为0.131 2 g/g。当以蛋白转化率为指标时,影响蛋白转化率的主次顺序为A>B>C>D>E,最优培养基配方A3B3C3D2E4不在这16组中,所以进行验证试验,通过验证试验得蛋白转化率为21.92%,菌丝体生物量为0.132 3 g/g。
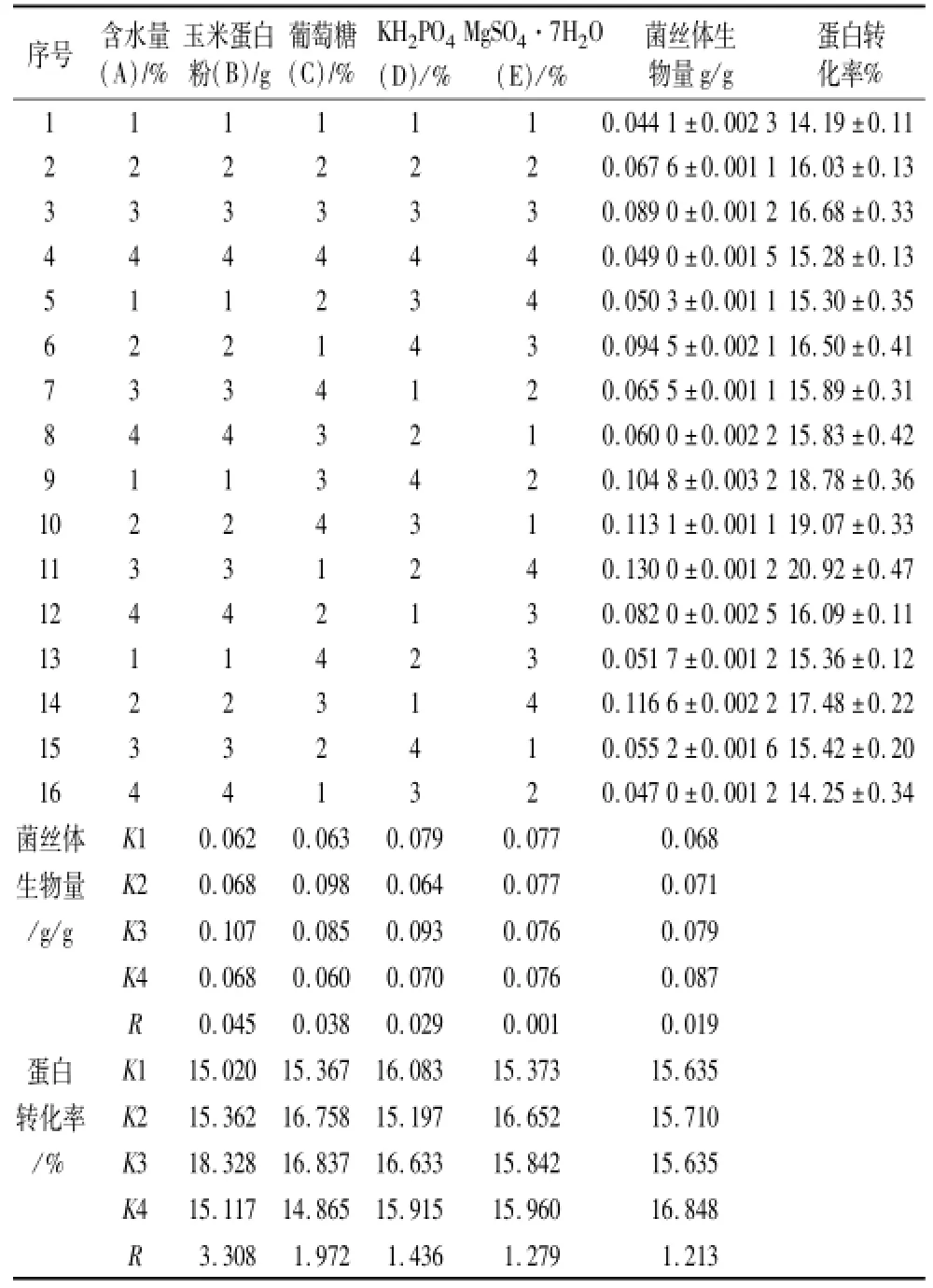
表3 培养基配方正交试验结果
由于以菌丝体生物量为指标和以蛋白转化率为指标得出的最终结果不一致,通过数据分析得知以蛋白转化率为指标得到的蛋白转化率、菌丝体生物量比以菌丝体生物量为指标得出的高0.8%、0.001 1 g/g。故选取以蛋白转化率为指标所确定的培养基配方A3B3C3D2E4,即含水量65%,玉米蛋白粉30 g,葡萄糖2.5%,MgSO4·7H2O 0.15%,KH2PO40.25%。
2.3 固态发酵培养条件单因素试验
2.3.1 培养温度和接种量的确定
如图5所示,当温度为25℃时,蛋白转化率、菌丝体生物量最高,分别为21.92%、0.132 3 g/g;当接种量为14%时,蛋白转化率、菌丝体生物量最高,分别为22.36%、0.136 9 g/g。
2.3.2 培养基初始pH和培养时间的确定
如图6所示,当初始pH为6时,蛋白转化率、菌丝体生物量最高,分别为21.92%、0.132 3 g/g;当发酵时间为20 d时,蛋白转化率、菌丝体生物最高,分别为21.92%、0.132 3 g/g。
2.4 固态发酵培养条件的正交优化试验
正交试验设计结果见表4。由正交试验结果得,以菌丝体生物量为指标,影响菌丝体生物量的主次顺序为A>D>C>B,最佳培养条件A2B2C2D2,蛋白转化率为22.36%,菌丝体生物量为0.136 9 g/g。当以蛋白转化率为指标时,影响菌丝体生物量的主次顺序为A>D>C>B,最佳培养条件A2B3C1D2,蛋白转化率为18.92%,菌丝体生物量为0.125 7 g/g。

图5 培养温度和接种量的确定

图6 最适pH和培养时间的确定
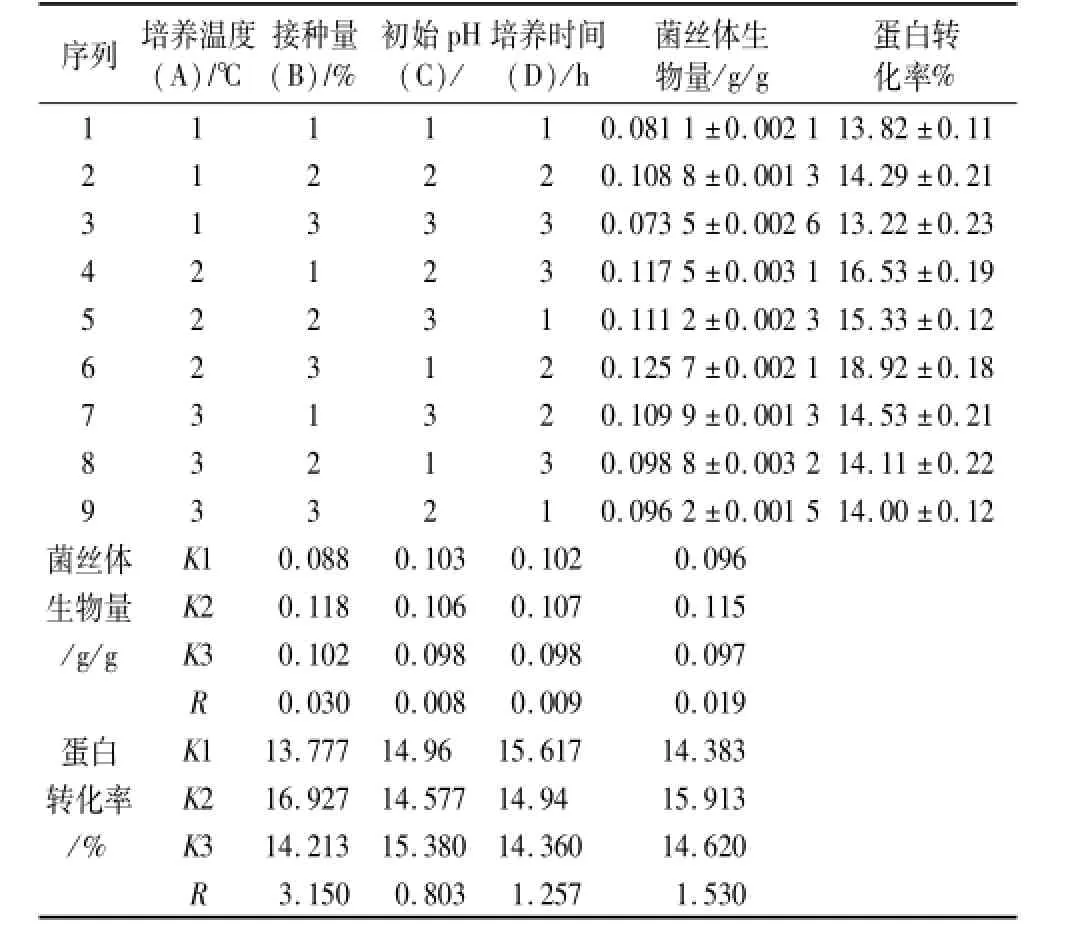
表4 培养条件正交试验结果
由于以菌丝体生物量为指标和以蛋白转化率为指标得出的最终结果不一致,数据分析得知以菌丝体生物量为指标得到的菌丝体生物量、蛋白转化率比以蛋白转化率为指标得出的高0.011 2 g/g、3.34%。故选取以菌丝体生物量为指标所确定的培养条件A2B2C2D2,即接种量14%,培养温度25℃,初始pH 6,发酵时间20 d。
2.5 玉米蛋白粉与发酵产物的氨基酸分析
将玉米蛋白粉与最优培养条件下发酵产物的氨基酸进行对比,如表5所示。

表5 发酵前后玉米蛋白粉的氨基酸分析对比
从图7可以看出,发酵前后玉米蛋白粉氨基酸构成基本上保持一致,但发酵后亲水性氨基酸所占百分比发酵前提高了12.75%,该现象表明,羊肚菌固态发酵玉米蛋白粉不但在一定程度上保留了玉米蛋白的原有氨基酸的模式,而且使得亲水性氨基酸含量增高,更有利于应用。

图7 发酵前后亲水性氨基酸和疏水性氨基酸对比
2.6 扫描电镜结果分析
由图8可见,玉米蛋白粉在发酵前后的微观结构产生了变化。玉米蛋白粉微观结构的大小及形状无规则性,表面凹凸不平,呈现极为紧密的状态。与玉米蛋白粉相比可看出,发酵后的玉米蛋白粉表面积增加且表面凹凸加剧,孔洞的结构更为明显。此现象表明,在发酵过程中,羊肚菌代谢产生蛋白酶,玉米蛋白粉底物与酶的充分接触,在酶解情况下,打开了玉米蛋白粉紧密的结构,促使水溶性增加。

图8 发酵前后玉米蛋白粉扫描电镜图片(×4 000)
3 结论
综合羊肚菌固态发酵玉米蛋白粉培养基配方优化和培养条件优化结果,可以得出,玉米蛋白粉30 g、含水量65%、葡萄糖2.5%、MgSO4·7H2O 0.15%、KH2PO40.25%、接种量14%、培养温度25℃、初始pH 6、发酵时间20 d。在此条件下蛋白转化率为22.36%,菌丝体生物量为0.136 9 g/g。测得发酵后亲水性氨基酸所占百分含量比发酵前提高了12.75%,同时通过扫描电镜观察得出,发酵后的玉米蛋白紧密的结构被打开,表面凹凸加剧,表面积增加,孔洞更为明显。
[1]Lawliet L M.The encyclopedia of chemistry[M].New York:Reinhold Publishing Company,1958:319-320
[2]Tatham A S,Field J M,Morris V J,et al.Solution conformational analysis of the alpha-zein proteins of maize.[J].The Journal of Biological Chemistry,1993,26(8):253-259
[3]陈洁,盛奎川,常蕊,等.辐照处理对玉米醇溶蛋白流变性的影响[J].材料科学与工程学报,2011,2:263-266 Chen Jie,Sheng Kuichuan,Chang Rui,et al.Effect of irradiation treatment on the rheological properties of corn alcohol soluble protein[J].Journal of Materials Science and Engineering,2011,2:263-266
[4]黄国平.玉米醇溶蛋白的超声波提取、改性与释药性能的研究[D].广州:华南理工大学,2004 Huang Guoping.Ultrasonic extraction,modification and drug release properties of corn alcohol soluble protein[D].South China University of Technology,2004
[5]Thomas Gillgren,Mats Stading.Mechanical and Barrier Properties of Avenin,Kafirin,and Zein Films[J].Food Biophysics,2008,3(3):287-294
[6]Gordon Selling,David J.Sessa.Multivalent carboxylic acidsto modify the properties of zein[J].Industrial Crops&Products,2006,25(1):63-69
[7]Qiangxian Wu,Tomoyuki Yoshino,Hiroshi Sakabe,et al. Chemical modification of zein by bifunctional polycaprolactone(PCL)[J].Polymer,2003,44(14):3909-3919
[8]Sessa David J,Mohamed Abdellatif,Byars Jeffrey A.Chemistry and physical properties of melt-processed and solution -cross-linked corn zein[J].Journal of Agricultural and Food Chemistry,2008,56(16):7067-7075
[9]刘萍,陈黎斌,杨严俊.酶解玉米蛋白制备降血压肽的研究[J].食品工业科技,2006,27(5):117-119,122 Liu Ping,Chen Libin,Yang Yanjun.Study on corn protein enzymatic preparation of antihypertensive peptides derived from[J].Science and Technology of Food Industry,2006,27(5):117-119,122
[10]李丽.水解玉米蛋白粉制备玉米肽[D].济南:山东轻工业学院,2011 Li Li.The hydrolysis of corn protein powder preparation of corn peptide[D].Jinan:Shandong Light Industries College,2011
[11]宋淑敏,邹作华,王洪荫,等.EF—11营养液的研制及其保健作用的试验研究[J].食品科学,1996,17(7):52-57 Song Shumin,Zou Zuohua,Wang Hongyin,et al.Research on the development of EF-11 nutrient solution and its experimental study on the function of health care[J].Food Science,1996,17(7):52-57
[12]龙正海.羊肚菌的研究及其应用开发前景[J].中国生化药物杂志,1997,18(3):160-161 Long Zhenghai.The research and application development prospects of Morchella[J].Chinese Morel Pharmaceutical Journal,1997,18(3):160-161
[13]陈园,张增强,沈志红,等.羊肚菌固体发酵转化厨余垃圾制取饲料的研究[J].农业环境保护,2011,30(4):761-767 Chen Yuan,Zhang Zengqiang,Shen Zhihong,et al.Study on Transformation of Morchella solid fermentation of kitchen waste for feed.[J].Agricultural Environmental Protection,2011,30(4):761-767
[14]Li S,Sang Y,Zhu D,et al.Optimization of fermentation conditions for crude polysaccharides by Morchella esculenta using soybean curd residue[J].Industrial Crops and Products,2013,50:666-672
[15]魏培莲,岑沛霖,盛春琦.3种固态发酵生物量测定方法的比较[N].食品与生物技术学报,2006,1:60-69 Wei Peilian,Cen Peilin,Sheng Chunqi.Three solid fermentation biomass determination method comparison[N]. Food Science and Biotechnology Journal,2006,1:60-69
[16]NY/T 685—2003饲料用玉米蛋白粉[S]NY/T 685—2003 Feed with corn protein powder[S]
[17]赵新淮,冯志彪.蛋白质水解物水解度的测定[J].食品科学,1994(11):65-67 Zhao Xinhuai,Feng Zhibiao.Determination of the degree of hydrolysis of protein hydrolysate[J].Food Science,1994(11):65-67.
Solid Fermentation for Zein by Morchella Esculenta
Tong Weina1,2Cai Dan1,2Zheng Mingzhu1,2Xiu Lin1,2Zhang Hao1,2Chen Fangqi1,2Liu Jingsheng1,2
(College of food science and Engineering,Jilin Agricultural University1,Changchun 130118)
(National Engineering Laboratory for Wheat&Corn Further Processing2,Changchun 130118)
This experiment determined the medium formulation and cultural condition of solid-state fermentation of zein using morchella esculenta with corn protein powders as the main materials,in which morchella esculenta was implemented with solid fermental cultivation.The results showed that the optimum medium formulation was:30 g corn protein powders,21%glucose,0.15%MgSO4·7H2O,0.15%KH2PO4,65%H2O;the optimum cultural condition was:14%Morchella inoculum size,cultural temperature 25℃,initial pH 6,fermentation for 20 d.The ratio of protein transformation and mycelium biomass were 22.36%,0.136 9 g/g under the above conditions,respectively.The amino acid analysis of corn protein powders before and after fermentation showed that the content of hydrophilic amino acids was increased by 12.75%compared to corn protein powders before fermentation.The scanning election microscope analysis of corn protein powders before and after fermentation showed that the tight structure of proteins was opened,surface areas were increased,convexo-concave degree was grown on,and holes were more apparent after fermentation.
zein,Morchella esculenta,solid fermentation,mycelium biomass,protein conversion rate
TS210
A
1003-0174(2017)01-0113-06
吉林省科技发展计划(20140204011NY),国家现代农业产业技术体系(CARS02-29)
2015-06-15
佟维娜,女,1987年出生,硕士,发酵微生物的选育与代谢调控
刘景圣,男,1964年出生,教授,粮食深加工与功能性食品
