脾胃虚弱型肥胖小鼠模型的建立与评价❋
2017-04-13司原成苗维纳何嘉悦丁维俊
司原成,苗维纳,何嘉悦,丁维俊
(成都中医药大学基础医学院,成都 610072)
脾胃虚弱型肥胖小鼠模型的建立与评价❋
司原成,苗维纳,何嘉悦,丁维俊△
(成都中医药大学基础医学院,成都 610072)
目的:建立脾胃虚弱型肥胖小鼠模型并进行评价。方法:复制高脂饮食诱导肥胖模型,在肥胖模型的基础上按照神疲乏力、食少纳呆、便溏等主要脾虚指标进行二次筛选符合条件的肥胖鼠。通过ELISA法检测血清总胆固醇、甘油三酯、高密度脂蛋白及低密度脂蛋白含量,测定血清中炎症因子(白介素-6、白介素10及肿瘤坏死因子-α)及脾脏、胸腺和肠道派氏小体中CD4+、CD8+及CD11c+等含量变化。结果:肥胖鼠成模率62.96%,其中脾胃虚弱型肥胖鼠23.53%。脾虚型肥胖鼠IL-10、TNF-α显著高于正常组,白介素-6显著低于正常组,其肠道派氏小体中的CD4+、CD8+及CD11c+明显降低。结论:此方法可以较好地筛选出脾胃虚弱型肥胖鼠,为健脾益气治疗肥胖奠定基础。
脾胃虚弱;肥胖,动物模型;乏力;含水量;免疫;
肥胖已经成为全世界共同面临的公共卫生问题。根据患者不同证候表现,中医将肥胖分为脾胃虚弱、胃肠湿热、脾肾阳虚、肝胆郁热等 5种证型[1-2]。然而,实验性肥胖动物模型却缺乏证候的关联性研究。如何复制出符合中医证型的肥胖动物模型,对进一步开展中医治疗肥胖机理机制至关重要。为此,根据肥胖的中医证候特点,我们在常规高脂饮食诱导肥胖动物模型的基础上,建立并评价适用于中医证型的肥胖动物模型。
脾胃虚弱型肥胖的主症为神疲乏力、食少纳呆、便溏等症状[3-5],本实验从主症着手,在肥胖模型复制成功的基础上,通过自主活动、旷场实验、每日进食量及粪便含水量等,筛选出脾胃虚弱型肥胖鼠。然后,通过血脂4项、相关炎症因子及免疫指标,评价脾胃虚弱肥胖鼠模型。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级C57BL/6小鼠150只,雌雄各半,8周龄,体质量(18±2)g,购于成都达硕生物科技有限公司(合格证号为SCXK(川) 2013-24),饲养于成都中医药大学基础医学院中心实验室动物房内,温度23~25℃,湿度40%~60%,昼夜各半,7∶00~19∶00开灯,19∶00~7∶00关灯。
1.1.2 试剂与仪器 总胆固醇ELISA试剂盒(生产批号20160107)、甘油三酯ELISA试剂盒(生产批号20160107)、高密度脂蛋白ELISA试剂盒(批号20160105)、低密度脂蛋白ELISA试剂盒(批号20160106),南京建成生物工程研究所;白介素-6 ELISA试剂盒(批号21F011)、白介素-10 ELISA试剂盒(批号21F008)、肿瘤坏死因子-α ELISA试剂盒(生产批号21F008),依科赛生物科技有限公司; R&D公司 CD4+ELISA试剂盒(生产批号 ELQ1206b)、CD8+ELISA试剂盒(生产批号 EL-Q1210b)、CD11c+ELISA试剂盒(生产批号 ELQ1213b)。主要仪器为全波长多功能酶标仪(美国ThermoFisher公司Varioskan)。
1.2 方法
1.2.1 造模方法 将小鼠适应性喂养1周后,随机抽取15只作为正常对照组,余下135只饲以高脂饮食,每笼5只。高脂饲料(配方:猪油32%,酪蛋白26%,麦芽糖糊精16%,蔗糖9%,纤维素6%,其他11%)[6]购于北京华阜康生物科技股份有限公司(合格证编号SCXK(京)2014-0008)。每周固定时间测量其体质量、体长及腰围等指标。8周后,筛选出体质量>正常组平均体质量+2SD,且Lee’s指数显著高于正常组者,作为成功造模的肥胖鼠。
旷场实验:将肥胖鼠放入旷场箱中,通过旷场实验检测系统,记录肥胖鼠5 min内在场箱中活动时间、运动时间、站立时间、运动距离,活动度及站立次数小于正常组1倍标准差的定义为乏力鼠。
每日进食量:每日早晨8∶00,称取记录鼠笼食盒上剩余食物重量。每日进食量小于正常鼠或者每日进食量呈现先升高再降低的,定义为食少纳呆鼠。
粪便含水量:每周定期采集肥胖鼠的新鲜粪便,称取粪便湿重和粪便干重,计算出粪便当中的含水量[粪便含水量=(粪便湿重-粪便干重)/粪便湿重]。粪便含水量低于正常组1倍标准差的定义为便溏鼠。综合以上3点,取三者的交集部分得到脾胃虚弱型肥胖鼠21只。
1.2.2 检测方法 每日观察实验鼠的精神状态、毛色改变等变化并作详细记录。每周二固定时间测量实验鼠的体质量、体长、腰围指标。治疗结束后禁食12 h,股动脉取血离心分离血清。严格按照小鼠ELISA试剂盒说明书详细步骤操作,检测血清中CHO、TG、HDL-C、LDL-C、IL-6、IL-10、TNF-α、的含量变化,观察小鼠体内脾脏、胸腺、肠道派氏小体中CD4+、CD8+、CD11c+的含量变化,使用全波长多功能酶标仪检测含量。
1.3 统计学方法
使用SPSS 19.0的统计软件进行分析,计量数据采用均值±标准差(±s),采用单因素方差分析,2组间采用配对SNK检验,P<0.05为差异有统计学意义。
2 结果
2.1 小鼠体质量、Lee’s指数及粪便含水量的变化
C57BL/6小鼠经过8周饲养后,模型组的体质量与Lee’s指数显著高于正常组(P<0.05),表明模型鼠符合肥胖条件。模型组的粪便含水量明显高于正常组(P<0.05),符合中医便溏的中医证型。
表1 2组小鼠体质量及Lee’s指数的差异(±s)
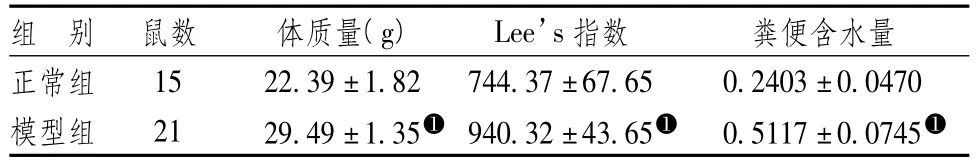
表1 2组小鼠体质量及Lee’s指数的差异(±s)
注:与正常组比较:➊P<0.05
2.2 小鼠旷场实验的检测
表2显示,模型组小鼠在规定的5 min内,其静止时间、运动时间、处在九宫格中心位置的时间及角落时间均明显差异于正常组(P<0.05),尤其是运动距离显著低于正常组(P<0.01),表明神疲乏力的中医证型复制成功。
表2 2组小鼠旷场实验相关数据比较(±s)

表2 2组小鼠旷场实验相关数据比较(±s)
注:与正常组比较:➊P<0.05;➊➊P<0.01
2.3 每日进食量的差异影响
图1显示,2组小鼠饲养8周期间内的每日进食量可以看出,正常组的每日进食量波动不大,模型组的呈现先升高后下降趋势,表明起初小鼠对于高脂饮食比较偏爱,随着时间的延长,高脂饮食阻碍脾胃功能正常运行,导致食欲下降,符合食少纳呆的中医证型。

图1 饲养8周期间每日进食量示意图
2.4 小鼠血脂差异
表3显示,模型组的总胆固醇(CHO)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)与正常组存在明显差异(P<0.05),表明模型组血脂明显高于正常组。模型组血清白介素-10(IL-10)及肿瘤坏死因子-α(TNF-α)显著高于正常组(P<0.01),白介素-6(IL-6)显著低于正常组,表明脾胃虚弱型肥胖存在低水平炎症反应。
表3 2组小鼠血脂4项及相关炎症因子差异(±s)
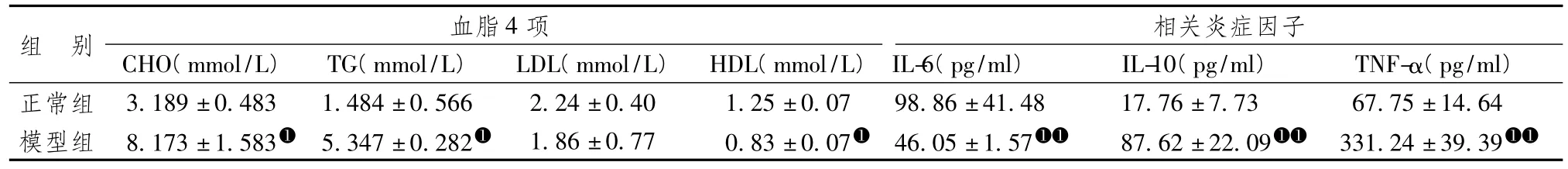
表3 2组小鼠血脂4项及相关炎症因子差异(±s)
注:与正常组比较:➊P<0.05;n=6
2.5 不同脏器中CD4+、CD8+、CD11c+的影响
表4显示,脾脏、胸腺及派氏小体中 CD4+、CD8+及CD11c+的差异,模型组的脾脏CD4+显著低于正常组(P<0.01),CD8+及CD11c+比较差异无统计学意义;胸腺中CD4+、CD8及CD11c+含量比较差异无统计学意义;模型组的肠道派氏小体中CD4+显著低于正常组(P<0.05),CD8+及CD11c+明显高于正常组(P<0.01),表明脾胃虚弱型肥胖鼠存在肠黏膜免疫功能紊乱现象。
表4 2组之间不同免疫器官功能指标的比较(±s)
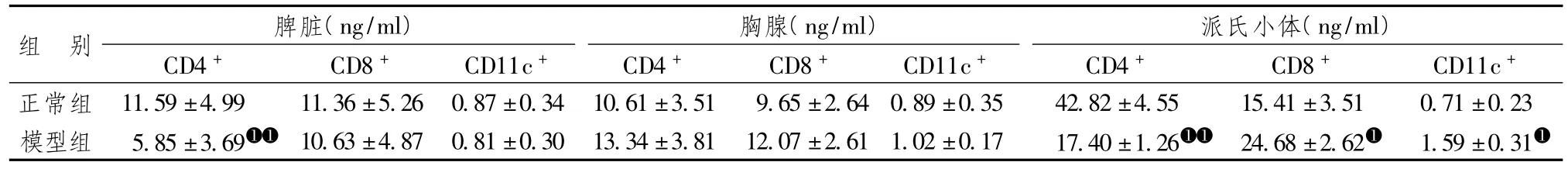
表4 2组之间不同免疫器官功能指标的比较(±s)
注:与正常组比较:➊➊P<0.01,➊P<0.05;n=6。
3 讨论
肥胖有多种中医证型,然而中医治疗肥胖的证型模型仍然面临辨证与体征测试等多方面困难。小鼠属于啮齿目动物,其生长习性决定其进食量增长必然导致体质量增长,但是脾胃虚弱等原因又会使其进食量下降,延长造模时间甚至降低模型成功率。另一方面由于小鼠形体细小,舌象、脉象等难以辨识,给症状体征辨识带来不少困难。
课题组通过参阅文献[7-10],结合中医脾虚证候模型拟建立脾胃虚弱型肥胖模型,为中医治疗肥胖奠定基础。首先,按照常规方法成功复制肥胖动物模型,再结合中医脾胃虚弱主症(神疲乏力、食少纳呆、便溏)筛选出脾胃虚弱肥胖鼠。神疲乏力使用旷场实验检测,观察小鼠在规定的5 min内其在场箱中的活动,记录其静止不动时间、运动时间、运动距离、处在九宫格中心位置时间、角落位置时间及站立时间,综合判断其神疲乏力的状况。其次,按照小鼠每日食物消耗量计算每只小鼠的进食量,再将这些小鼠的进食量求均值,绘制出如图1所示示意图。正常组每日进食量相对稳定,而模型组高脂饮食则呈现出先升高后降低的趋势,这符合小鼠的习性。高脂饲料富含大量油脂、蛋白质、高糖深得小鼠喜爱,所以初次接触进食量增加,随着长时间大量高脂饮食摄入,导致肠胃吸收功能减弱,并开始出现不思饮食、食少纳呆等症状。这与中医的脾虚证候类似。因此将出现此种症状的肥胖鼠我们定义为食少纳呆型肥胖鼠。第三,在饲养过程中时常见到部分小鼠有软便或者稀便的出现,有人称之为“脂肪泻”。大量高脂饮食的摄入使得小鼠的肠道出现功能性紊乱和吸收不完全,直接以脂肪的形式排出。便溏的设立,通过粪便含水量检测来定量观察肥胖鼠的便溏程度,将含水量高于正常鼠1倍标准差的肥胖鼠称之为便溏肥胖鼠。综合以上3点,取三者的交集初步判定脾胃虚弱型肥胖鼠,之后再通过相关指标来反证模型成功。
相关文献表明[11],脂肪组织血管具有联通营养和氧气的网络作用,其为脂肪组织提供营养及氧气,同时将自身合成的瘦素、脂联素等脂肪激素输送到血液中调节周身的脂质代谢。在肥胖患者体内,由于脂肪组织肥厚、血液灌注不足导致局部脂肪组织缺氧,促进IL-6、IL-10、TNF-α等各种炎症因子形成。本实验研究结果表明,肥胖鼠体内在长达8周高脂饮食刺激下出现慢性炎症反应,脂肪组织周围炎症因子合成增多。
胸腺和脾脏分别是体内中枢和外周的主要免疫器官,在维持机体正常免疫功能方面发挥作用。正常胸腺功能是保证人体内成熟T细胞数量的基础。脾脏则是具有免疫活性的T细胞移居和接受抗原刺激后产生免疫应答的重要场所,且增强巨噬细胞的吞噬功能[12]。T淋巴细胞参与机体的特异性免疫,在抗原刺激下前者转化为致敏淋巴细胞,通过释放淋巴因子参与细胞免疫过程[13]。肥胖状态下,小鼠体内胸腺合成的CD4+、CD8+、CD11c+尚未完全分化成熟。至关重要的一点,肥胖免疫能力相对低下,存在一定免疫紊乱趋势。然而在肠黏膜的派氏小体中,富集80%的淋巴细胞对抗肠道病原微生物保持机体内环境的稳态,在肥胖鼠肠黏膜派氏小体的离心组织液中得到CD4+、CD11c+含量较多,这与其肠黏膜时刻警戒肠道微生物密切相关。肥胖鼠体内肠黏膜免疫的紊乱,使得防御病原微生物的能力下降出现抵抗不足现象,肠道微生物乘机侵袭机体,引起机体免疫应答,进而使得白介素、肿瘤坏死因子等致炎因子含量增加,引起一系列生理病理变化并加重肥胖状态。
综上,课题组从中医证型角度出发,结合现代肥胖的临床诊断标准,在肥胖模型复制成功的基础上进行筛选,筛选出符合脾胃虚弱的肥胖鼠,为开展临床研究提供丰富的实验数据,也为课题组探讨健脾益气针法对肥胖鼠慢性炎症反应的调控机制奠定基础。
[1]仝小林,毕桂芝,李敏.肥胖及相关疾病中西医诊疗[M].北京:人民军医出版社,2010:65.
[2]黄碧燕.关于病证结合动物模型研究现状的思考[J].中国中医药信息杂志,2010,17(1):4-6.
[3]赵荣华,谢鸣,李聪,等.肝郁、脾虚和肝郁脾虚证模型大鼠的免疫功能变化[J].北京中医药大学学报,2013,36(12):821-824.
[4]唐洪梅,廖小红,房财富,等.肝郁脾虚型大鼠肠易激综合征模型的建立及评价[J].中国实验方剂学杂志,2012,18(6): 138-140.
[5]刘弱芸,郭晓玲,赵宏波,等.逍遥散提取物对肝郁脾虚证模型大鼠疗效的行为学评价[J].中华中医药杂志,2013,28 (7):2138-2141.
[6]余敏,肖晓秋,唐成林,等.不同强度电针对肥胖大鼠血脂、脂肪组织巨噬细胞趋化蛋白-1及肿瘤坏死因子-α的影响[J].针刺研究,2011,36(2):79-84.
[7]刘芳,高南南,杨润梅,等.不同品系小鼠肥胖模型比较及C57BL/6J小鼠肥胖机制研究[J].中国药理学通报,2013,29 (3):360-5.
[8]田辉,王玉婷,陶莉,等.一种新型小鼠肥胖模型的建立[J].中国药理学通报,2013,29(7):1016-1018.
[9]李斌,侯伟龙,王彩霞,等.脾虚动物水液代谢特征研究[J].辽宁中医杂志,2016,43(1):150-153.
[10]崔明霞,高琲,闵光宁,等.造模持续时间对大鼠高营养性肥胖模型制备的影响[J].中国药理学通报,2008,24(3):412-416.
[11] ZEYDA M,GOLLINGER K,KRIEHUBER E,et al.Newly identified adipose tissue macrophage populations in obesity with distinct chemokine and chemokine receptor expression[J].Int J Obes(Lond),2010,34(12):1684-1694.
[12]ROBBINS CS,SWIRSKI FK.The multiple roles of monocyte subsets in steady state and inflammation[J].Cell Mol Life Sci,2010,67(16):2685-2693.
[13]MORRIS DL,SINGER K,LUMENG CN.Adipose tissue macrophages:phenotypic plasticity and diversity in lean and obese states[J].Curr Opin Clin Nutr Metab Care,14(4):341-346.
Establishment and Evaluation of Spleen Deficiency Syndrome Based on the Obesity Mice Model
SI Yuan-cheng,MIAO Wei-na,HE Jia-yue,DING Wei-jun△
(Fundamental department,Chengdu University of Traditional Chinese Medicine,Chengdu,610072,China)
Objective:To copy and evaluate the spleen deficiency syndrome type in obese mice.Method:Replicating obese mice with high-fat diet,and on this basis,according to the spleen deficient fatigue,less food,stay,loose stools and secondary screening eligible obese mice,and through the ELISA method to detect serum total cholesterol,triglycerides,high-density lipoprotein and low density lipoprotein content,observe serum inflammatory factors(interleukin 6,interleukin 10 and tumor necrosis factor alpha)and CD4+,CD8+,CD11c+content changes of the spleen,thymus and intestinal corpuscle.Results:The model of obesity mice was 62.96%,23.53%of which was spleen deficiency syndrome type.The IL-10,the TNF alpha of these mice is significantly higher than normal group,interleukin-6 was significantly lower than normal group.The CD4+,CD8+and CD11c+of their gut peyer’s patch were also significantly reduced.Conclusion:This method could better screen spleen deficiency syndrome by obesity animal medel.
Spleen deficiency syndrome type;Obesity;Animal models;Lack of power;Water content;Immune
R-332
A
1006-3250(2017)02-0177-03
2016-08-14
国家自然科学基金资助项目(81273899)-健脾益气祛痰法对肥胖鼠肠黏膜TLRs的良性调控机制研究
司原成(1988-),男,安徽阜阳人,医学博士,从事中医防治代谢性疾病的基础与应用研究。
△通讯作者:丁维俊(1967-),男,教授,博士研究生导师,从事中医防治代谢性疾病的基础与应用研究,E-mail: dingwj123@163.com。
