微生物燃料电池型人工湿地去除抗生素的效能研究
2017-04-12杨小丽宋海亮陈桐清张昱悦杨可昀
李 骅 杨小丽 宋海亮 张 帅 陈桐清 张昱悦 杨可昀
(1东南大学能源与环境学院, 南京 210096)(2东南大学土木工程学院, 南京 210096)
微生物燃料电池型人工湿地去除抗生素的效能研究
李 骅1杨小丽2宋海亮1张 帅1陈桐清2张昱悦1杨可昀1
(1东南大学能源与环境学院, 南京 210096)(2东南大学土木工程学院, 南京 210096)
考察了微生物燃料电池型人工湿地 (MFC-CW) 系统对不同浓度抗生素的去除效果和产电特性,以及不同共基质浓度对去除抗生素和产电的影响.结果表明,系统对磺胺甲恶唑 (SMX) 和四环素 (TC) 的去除分别以微生物降解和吸附为主.四环素具有较强的极性,进入系统后能够立即被填料稳定吸附.磺胺甲恶唑易随水流动,更容易被微生物降解.进水抗生素浓度越高,出水浓度越高,系统开路电压越低.同时,进水共基质浓度也影响MFC-CW对抗生素的去除效率和产电能力.随着系统共基质浓度的增加,系统开路电压和系统内阻逐渐增大,而系统库伦效率逐渐下降.由此表明进水抗生素浓度和共基质浓度都应控制在一定范围内,才能使系统在产电、抗生素降解方面达到优化平衡.
微生物燃料电池型人工湿地(MFC-CW); 抗生素;共基质;降解;产电性能
众所周知,抗生素对微生物具有毒害作用,未被降解的抗生素通过污水厂点源排放以及动物粪便排放的形式进入到水环境中,极大地提高了环境中抗性基因的丰度,从而威胁人类健康[1].但是,通过常规生物法去除生态环境中的抗生素效率较低.
人工湿地(constructed wetland, CW) 技术可以通过湿地基质、湿地植物以及微生物间的物理、化学、生物协同作用实现对抗生素的去除[2].Hijosa-Valsero等[3]研究7种不同类型的CW对抗生素去除效果,结果显示所有CW对磺胺甲恶唑去除率可以达到(59±30)%~(87±41)%.微生物燃料电池(microbial fuel cells, MFC)是一种利用产电微生物将有机物的化学能转化为电能的新兴技术.微生物在低电势的阳极催化有机物分解,产生电子和质子,电子通过外电路到达高电势阴极并与最终的电子受体(通常为O2)及来自阳极的质子相结合,实现污染物降解并同时回收电能[4].
研究发现,通过调整CW的流态和湿地的深度可以获得MFC所需要的氧化还原梯度,从而将两者结合构建微生物燃料电池型人工湿地(MFC-CW)[5-6].MFC-CW充分发挥了MFC和CW各自的特点,进一步提高了湿地对污染物的处理能力.湿地植物通过光合作用分泌氧气供给阴极,在改善了MFC产电性能的同时提高了电极处微生物生物量[7].MFC-CW利用填料大的比表面积吸附难降解的有毒污染物,并在电驱动和微生物的作用下将难降解污染物进行还原.目前对MFC-CW系统的研究主要集中于合成染料废水[8-9]、猪粪废水[10-11]、生活污水[12]处理等.但是,MFC-CW对废水中抗生素的去除还鲜有报道.
本文采用黄沙作为填充基质、活性炭颗粒作为阴阳极的填充材料构建MFC-CW.研究MFC-CW对以磺胺甲恶唑(SMX)和四环素(TC)为代表的抗生素废水的处理效能和产电效能,并进一步分析抗生素浓度、易降解有机物投加配比等对系统去除抗生素和产电效能的影响,为MFC-CW技术处理含有抗生素的废水提供依据.
1 试验材料与方法
1.1 试验装置
试验所用MFC-CW装置如图1所示,装置主体下部为湿地基质层(厚度为17.5 cm)和阳极填料层(厚度为5 cm),上部为湿地基质层(厚度为25 cm)和空气阴极层(厚度为5 cm).湿地基质采用细黄沙(粒径为0.2mm),阴阳极电极由活性炭颗粒(granular activated carbon,GAC)和不锈钢丝网(stainless steel mesh,SSM)组成.活性炭颗粒直径为3~5 mm,比表面积为500~900 m2/g.不锈钢丝网型号为304不锈钢,钢丝直径为0.42 mm,孔径为1.70 mm,用于收集电子,增强产电.湿地表层种植湿地植物水芹菜,根系种植于阴极电极层SSM之下.试验共采用5组MFC-CW系统,均为下部进水上部出水.将进水分别为低、中、高浓度抗生素的3组反应器命名为MFC-CW(L),MFC-CW(M)和MFC-CW(H).相同进水抗生素浓度条件下,1/2倍碳源与2倍碳源进水的2组反应器分别命名为MFC-CW(1/2M)和MFC-CW(2M).取样口设置见图1(a).

(a) 示意图

(b) 实物图
1.2 主要试剂及仪器
试验中所用的药物有四环素(TC)、磺胺甲恶唑(SMX),均购自Sigma-Aldrich(美国),药品的纯度大于99%.试验所用葡萄糖为分析纯,甲醇和乙腈均为色谱纯(Fisher,美国),水为超纯水.将抗生素溶解于甲醇中,配置成浓度为1 mg/mL的标准储备液,贮存于-20 ℃冰箱冷冻室中,这样可以最大程度地防止甲醇挥发与抗生素降解.
试验所用仪器主要有数字万用表(Agilent HP 34970,U.S.)、蠕动泵(BT100-2J,兰格恒流泵有限公司)、饱和甘汞参比电极(232 型,雷磁仪器厂)、固相萃取仪(SUPELCO,U.S.)、高效液相色谱仪(Waters e2695,Waters公司)和质谱仪(Micromass Quattro Micro TM,Waters公司).
1.3 MFC-CW接种与运行
接种污泥取自南京城南污水处理厂浓缩池.取回的污泥一部分进行为期2周的曝气饥饿处理,然后接种至各MFC-CW反应器阴极;另一部分进行为期2周的厌氧消化处理,然后接种至各MFC-CW反应器阳极.
各反应器进水抗生素、共基质碳源、微量元素浓度组成见表1,微量元素溶液配方参见文献[13].试验共设置2个阶段,分别采用不同的水力停留时间,第1阶段(3月—5月)设置水力停留时间为5 d,第2阶段(6月—9月)水力停留时间设为2.5 d.每个阶段先通入人工配制的生活污水,连续培养1个月,1个月后再在配水中加入四环素和磺胺甲恶唑,待系统连续运行1个月后,每隔15 d测定5组装置中出水抗生素浓度.系统稳定运行后,比较5组MFC-CW系统的电压、输出功率、库伦效率等产电参数,分析初始抗生素浓度和共基质浓度对MFC-CW系统产电的影响.

表1 各装置进水抗生素浓度及营养物质组成 mg/L
1.4 分析方法
待系统稳定运行1周后,通过改变外电阻的阻值 (10~5×104Ω)获得一系列负载电阻,稳定约1 h后用万用表测量每个阻值下负载电阻两端的电压.采用参比电极为饱和甘汞电极测定电极电势.电流值I可以根据外电阻R及外阻两端电压U通过欧姆定律计算得到.利用I=U/(RS)计算电流密度,其中S为阳极表面积.将电压对电流密度作图即得到极化曲线.根据极化曲线的斜率可以求得表观内阻.按照公式P=UI/S计算功率密度.功率密度曲线采用变电阻的方法在系统稳定条件下进行同步测试.库仑效率ηCE反映有机物转化为电能所占总能量的百分数,其计算方法参见文献[14].抗生素浓度测定步骤为:① 取200 mL水样,用0.22 μm 滤膜过滤后经Oasis HLB固相萃取小柱(6 mL, Waters, USA)富集纯化,并用甲醇对目标抗生素进行洗脱.② 每组水样测定前添加0.5 g Na2EDTA,用以提高四环素回收率.③ 采用液质联用系统测定SMX和TC的浓度,紫外检测波长为270 nm,配制浓度范围在10~1×104μg的系列混合标准溶液,分别以四环素和磺胺甲恶唑的峰面积对浓度作图,绘制标准曲线.质谱离子源为电喷雾离子源(ESI+),前处理方法和液质联用条件参见文献[15].SMX和TC的加标回收率范围分别为87.7%~108.6%和88.8%~102.3%.
2 结果与讨论
2.1 进水抗生素浓度对处理效果的影响
微生物燃料电池型人工湿地对抗生素的去除[16]包括一系列的生物和物理化学过程(填料吸附、微生物降解、植物吸收及水解和电化学作用).
在试验第1阶段(5月),各装置对抗生素的去除作用主要依靠活性炭的吸附.MFC-CW(L),MFC-CW(M)和MFC-CW(H)各装置出水SMX浓度均高于TC(见图2(a)和(b)),检测到的SMX和TC最大浓度分别为2.4 和1.65 μg/L.研究表明,TC类抗生素在土壤、黏粒、沉积物和其他各种基质中有很强的吸附性[17].TC含有极性官能团,容易与固体填料中的有机物官能团及铁铝氧化物等结合,进入系统后能够立即被填料、活性炭等稳定吸附,但较难被微生物降解,而SMX亲水性强,容易发生解吸而随水移动,造成水中SMX浓度增大,但随着系统的运行SMX更容易被微生物降解[18].

(a) 出水SMX浓度

(b) 出水TC浓度
在试验第2阶段(8月—9月),由于水力停留时间减少,系统中各装置出水抗生素浓度先增大后减小(见图2).对比MFC-CW (L),MFC-CW (M),MFC-CW (H) 可以发现,进水抗生素浓度越高,出水中抗生素浓度也越高.系统经过前几个月的连续运行,活性炭吸附已经接近饱和,此时各系统对抗生素的去除主要依靠微生物的降解作用,降解抗生素的微生物逐渐得到富集,各系统中SMX浓度逐渐减小.TC易与微量元素Ca2+,Mg2+等形成结构复杂的复合物,导致部分TC难以被微生物利用,因而后期TC出水浓度逐渐趋于稳定[19].
2.2 进水抗生素浓度对产电性能的影响
在MFC-CW系统稳定运行阶段,不同进水抗生素浓度条件下各系统的产电参数如表2和图3所示.当进水抗生素由200 μg/L增至800 μg/L时,开路阳极电势先下降后上升,开路阴极电势持续下降(电势均相对于饱和甘汞电极).电极电势的减小主要归因于极化所致,当抗生素浓度在一定范围内增大时极化作用不明显,开路阳极电势下降,这可能与适量抗生素改变了产电菌细胞膜通透性有关,使得产电菌活性增强;当抗生素浓度继续增加,一部分电子用于还原抗生素,减少了电子向阳极的传递,产电菌活性受到抑制,极化现象明显.另外由于抗生素浓度提高,产电菌的生理活性和产电能力下降,从而使系统开路电压下降.当进水抗生素浓度为500 μg/L时,MFC-CW(M)系统内阻最低(395.2 Ω),此时功率密度最大 (0.057 2 W/m2), 库伦效率最高(0.99%),电流密度最大 (0.267 5 mA/m2).

表2 不同进水抗生素浓度下MFC-CW的产电效能
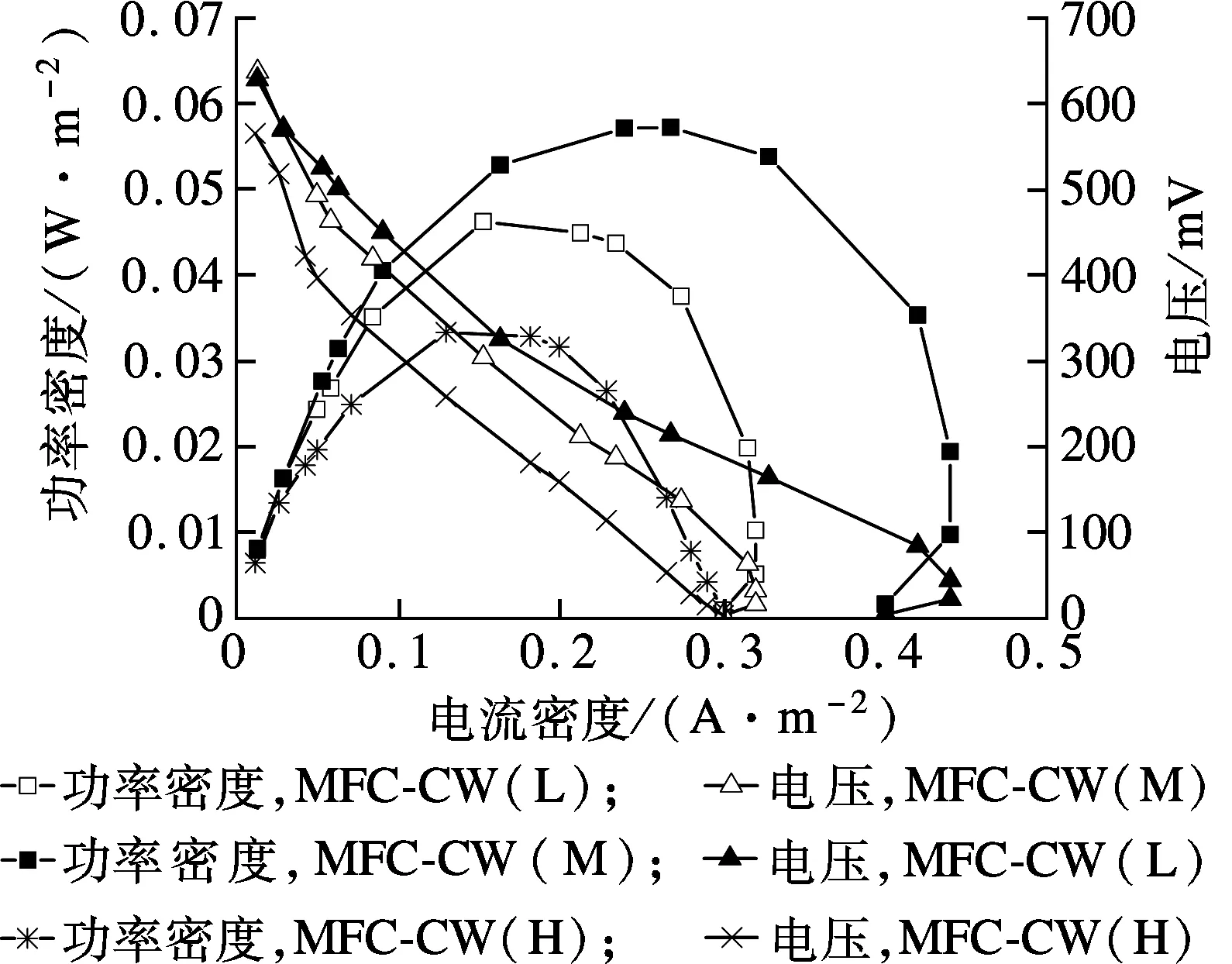
图3 不同进水抗生素浓度条件下MFC-CW 功率密度曲线与极化曲线
2.3 进水共基质浓度对处理效果的影响
试验第1阶段(5月1日—5月31日),MFC-CW(1/2M),MFC-CW(M),MFC-CW(2M)对抗生素的处理效果均较好.MFC-CW(2M)装置在5月1日出水中首先检测出SMX(见图4(a)),直到5月31日出水中才检测到TC(见图4(b)).这可能是因为前期系统对抗生素的去除主要是通过填料的吸附作用,TC比SMX极性更强,会优先吸附于填料的表面,与SMX竞争填料表面的吸附位点,未被填料吸附的SMX首先随水流出被最先检测到.

(a) 出水SMX浓度

(b) 出水TC浓度
试验第2阶段(8月1日—9月15日),8月16日—9月15日期间MFC-CW(2M)出水中的SMX浓度比MFC-CW(M)出水浓度低,可能是因为后期系统对SMX的去除主要依靠微生物降解作用,由于碳源更加充足,通过长时间的驯化,MFC-CW(2M)中SMX降解菌密度更高,微生物降解抗生素作用更强.
另外,MFC-CW(1/2M)与MFC-CW(M)和MFC-CW(2M)相比,9月15日最终出水的抗生素浓度更低,可能是因为MFC-CW(1/2M)进水葡萄糖浓度减半不足以满足系统内不断繁殖的微生物的生长代谢需求,抗生素作为碳源被微生物直接分解以满足基本代谢,导致出水抗生素降低[20].
2.4 进水共基质浓度对产电效能的影响
由表3和图5看出,不同的共基质浓度条件下各装置的库伦效率相差较大,其中MFC-CW (1/2M)最大(1.83%),而MFC-CW (2M) 最低(0.41%).可能的原因在于增加进水有机物使得部分未被降解的有机物到达阴极,在异养菌的作用下消耗氧气,限制氧气在阴极还原,同时丰富的有机物可能会导致形成的异养生物膜影响传质[21].文献[22]研究显示,MFC的库仑效率范围通常在0.04%~97%之间.本试验测得库伦效率偏低的原因之一可能是试验所用反应器体积较大,导致电子传输距离过长,从而增大了系统的内阻[23].同时,O2能否在阴极有效还原也成为限制MFC产电的关键因素,阳极产生电子的速率大于阴极接受电子的速率,也造成MFC产电性能下降[24].因此开发阴极催化剂以及生物阴极具有重要意义.

表3 不同进水共基质浓度对MFC-CW产电的影响
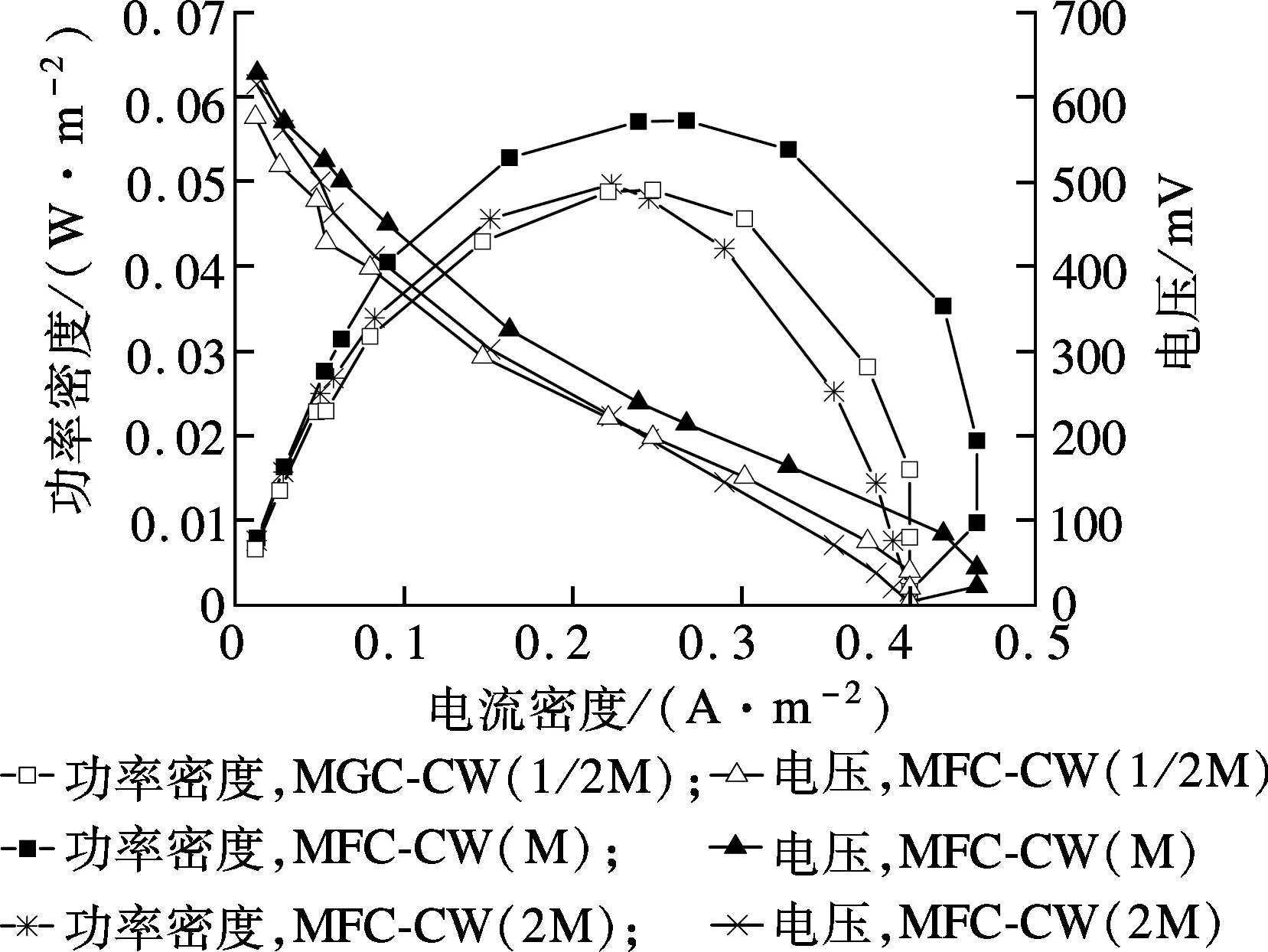
图5 不同进水共基质浓度下MFC-CW 功率密度曲线与极化曲线
厌氧微生物在阳极区的生长能够形成较低的阳极电势.MFC-CW (2M)开路电压与MFC-CW (M) 开路电压相近,且大于 MFC-CW (1/2M) 的开路电压.这表明适当增加进水共基质浓度可以提供更多底物供给产电菌,有利于降低阳极电势,增大输出电压.
MFC-CW (2M)系统内阻大于 MFC-CW (M) 系统内阻,而MFC-CW (M) 系统内阻与MFC-CW (1/2M) 系统内阻接近.这可能是因为有机物浓度增加导致两极微生物过度增值富集,使得电子传输阻力变大,系统内阻变大.最大功率密度主要由内阻与阴阳极化学反应产生的理论电动势决定.Fang等[8]研究表明,随着难降解污染物占总有机物浓度的比例增加,最大功率密度逐渐降低.但过高的有机物浓度会影响阴极的性能,从而影响功率密度,因此选择合适的共基质浓度十分重要.MFC-CW (M) 系统中的开路电压大,内阻小,因而输出功率密度也大.
3 结论
1) 四环素具有较强的极性,进入系统后能够立即被填料等稳定吸附,但较难被微生物降解;磺胺甲恶唑的亲水性较强会随水流动,但随着系统的运行,更容易被微生物降解.
2) 随着进水抗生素浓度增大(由200 μg/L增至800 μg/L),系统电极极化增加,开路电压下降.
3) 不同的共基质浓度会影响系统对抗生素的降解.经过几个月的连续运行,各反应器最终出水中抗生素浓度由高到低分别为MFC-CW(M),MFC-CW (2M),MFC-CW (1/2M).
4) 共基质浓度会影响系统的产电.不同共基质浓度条件下,各反应器开路电压由高到低分别为MFC-CW(2M),MFC-CW(M), MFC-CW(1/2M).库伦效率由高到低为MFC (1/2M),MFC-CW(M),MFC-CW(2M);系统内阻由高到低分别为MFC-CW(2M), MFC-CW(M),MFC-CW(1/2M).
综上所述,微生物燃料电池型人工湿地具有较好的去除抗生素的能力;其工作效率受到抗生素浓度、进水共基质浓度等因素的影响;在适量的共基质条件下,该系统能够显著促进抗生素的降解.
References)
[1]Huang X, Liu C X, Li K, et al. Performance of vertical up-flow constructed wetlands on swine wastewater containing tetracyclines and tet genes[J].WaterResearch, 2015, 70: 109-117. DOI:10.1016/j.watres.2014.11.048.
[2]Chen J, Wei X, Liu Y, et al. Removal of antibiotics and antibiotic resistance genes from domestic sewage by constructed wetlands: Optimization of wetland substrates and hydraulic loading[J].ScienceoftheTotalEnvironment, 2016, 565: 240-248. DOI:10.1016/j.scitotenv.2016.04.176.
[3]Hijosa-Valsero M, Fink G, Schlüsener M P, et al. Removal of antibiotics from urban wastewater by constructed wetland optimization [J].Chemosphere, 2011, 83(5): 713-719. DOI:10.1016/j.chemosphere.2011.02.004.
[4]Pawels S S R. Microbial fuel cell (MFC) technology for household waste reduction and bio-energy production[J].CivilEngineeringandUrbanPlanning:AnInternationalJournal, 2016, 3(2): 119-126. DOI:10.5121/civej.2016.3210.
[5]Yadav A K, Dash P, Mohanty A, et al. Performance assessment of innovative constructed wetland-microbial fuel cell for electricity production and dye removal [J].EcologicalEngineering, 2012, 47: 126-131. DOI:10.1016/j.ecoleng.2012.06.029.
[6]Corbella C, Garfí M, Puigagut J. Vertical redox profiles in treatment wetlands as function of hydraulic regime and macrophytes presence: Surveying the optimal scenario for microbial fuel cell implementation[J].ScienceoftheTotalEnvironment, 2014, 470: 754-758. DOI:10.1016/j.scitotenv.2013.09.068.
[7]Chen Z, Huang Y C, Liang J H, et al. A novel sediment microbial fuel cell with a biocathode in the rice rhizosphere [J].BioresourceTechnology, 2012, 108: 55-59. DOI:10.1016/j.biortech.2011.10.040.
[8]Fang Z, Song H, Yu R, et al. A microbial fuel cell-coupled constructed wetland promotes degradation of azo dye decolorization products[J].EcologicalEngineering, 2016, 94: 455-463. DOI:10.1016/j.ecoleng.2016.06.020.
[9]Li T, Fang Z, Yu R, et al. The performance of the microbial fuel cell-coupled constructed wetland system and the influence of the anode bacterial community [J].EnvironmentalTechnology, 2016, 37(13): 1683-1692. DOI:10.1080/09593330.2015.1127292.
[10]Zhao Y, Collum S, Phelan M, et al. Preliminary investigation of constructed wetland incorporating microbial fuel cell: Batch and continuous flow trials[J].ChemicalEngineeringJournal, 2013, 229: 364-370. DOI:10.1016/j.cej.2013.06.023.
[11]Doherty L, Zhao Y, Zhao X, et al. Nutrient and organics removal from swine slurry with simultaneous electricity generation in an alum sludge-based constructed wetland incorporating microbial fuel cell technology [J].ChemicalEngineeringJournal, 2015, 266: 74-81. DOI:10.1016/j.cej.2014.12.063.
[12]杨广伟,姜珺秋,王琨,等. 生物产电人工湿地系统对处理生活污水的效能[J]. 浙江大学学报(工学版), 2015, 49(6): 1186-1192. DOI:10.3785/j.issn.1008-973X.2015.06.026. Yang Guangwei, Jiang Junqiu, Wang Kun, et al. Performance of sewage treatment by ingegrated system of bioelectrogenesis and constructed wetland[J].JournalofZhejiangUniversity(EngineeringScience), 2015, 49(6): 1186-1192. DOI:10.3785/j.issn.1008-973X.2015.06.026. (in Chinese)
[13]Cao X, Song H L, Yu C Y, et al. Simultaneous degradation of toxic refractory organic pesticide and bioelectricity generation using a soil microbial fuel cell [J].BioresourceTechnology, 2015, 189: 87-93. DOI:10.1016/j.biortech.2015.03.148.
[14]Fang Z, Song H L, Cang N, et al. Electricity production from Azo dye wastewater using a microbial fuel cell coupled constructed wetland operating under different operating conditions[J].BiosensorsandBioelectronics, 2015, 68: 135-141. DOI:10.1016/j.bios.2014.12.047.
[15]Wu D, Huang Z, Yang K, et al. Relationships between antibiotics and antibiotic resistance gene levels in municipal solid waste leachates in shanghai, China[J].EnvironmentalScience&Technology, 2015, 49(7): 4122-4128. DOI:10.1021/es506081z.
[16]Dordio A V, Carvalho A J P. Organic xenobiotics removal in constructed wetlands, with emphasis on the importance of the support matrix[J].JournalofHazardousMaterials, 2013, 252: 272-292. DOI:10.1016/j.jhazmat.2013.03.008.
[17]Gong W, Liu X, He H, et al. Quantitatively modeling soil-water distribution coefficients of three antibiotics using soil physicochemical properties[J].Chemosphere, 2012, 89(7): 825-831. DOI:10.1016/j.chemosphere.2012.04.064.
[18]Carrasquillo A J, Bruland G L, Mackay A A, et al. Sorption of ciprofloxacin and oxytetracycline zwitterions to soils and soil minerals: Influence of compound structure[J].EnvironmentalScience&Technology, 2008, 42(20): 7634-7642. DOI:10.1021/es801277y.
[19]Christian T, Schneider R J, Färber H A, et al. Determination of antibiotic residues in manure, soil, and surface waters[J].ActaHydrochimicaetHydrobiologica, 2003, 31(1): 36-44. DOI:10.1002/aheh.200390014.
[20]Khehra M S, Saini H S, Sharma D K, et al. Biodegradation of azo dye C.I. Acid red 88 by an anoxic-aerobic sequential bioreactor[J].DyesandPigments, 2006, 70(1): 1-7. DOI:10.1016/j.dyepig.2004.12.021.
[21]Freguia S, Rabaey K, Yuan Z, et al. Sequential anode-cathode configuration improves cathodic oxygen reduction and effluent quality of microbial fuel cells[J].WaterResearch, 2008, 42(6/7): 1387-1396. DOI:10.1016/j.watres.2007.10.007.
[22]Feng Y, Lee H, Wang X, et al. Continuous electricity generation by a graphite granule baffled air-cathode microbial fuel cell[J].BioresourceTechnology, 2010, 101(2): 632-638. DOI:10.1016/j.biortech.2009.08.046.
[23]Fan Y, Han S K, Liu H. Improved performance of CEA microbial fuel cells with increased reactor size[J].Energy&EnvironmentalScience, 2012, 5(8): 8273-8280. DOI:10.1039/c2ee21964f.
[24]Heijne A T, Liu F, van Rijnsoever L S, et al. Performance of a scaled-up microbial fuel cell with iron reduction as the cathode reaction[J].JournalofPowerSources, 2011, 196(18): 7572-7577. DOI:10.1016/j.jpowsour.2011.04.034.
Study on antibiotics removal by microbial fuel cell coupled constructed wetland
Li Hua1Yang Xiaoli2Song Hailiang1Zhang Shuai1Chen Tongqing2Zhang Yuyue1Yang Keyun1
(1School of Energy and Environment, Southeast University, Nanjing 210096, China)(2School of Civil Engineering, Southeast University, Nanjing 210096, China)
Varying concentrations of antibiotic and cosubstrates in influent were conducted to test the antibiotic removal efficiency and the microbial fuel cell(MFC) performance. The results show that the mechanisms of microbial fuel cellconstructed wetland (MFC-CW) to remove sulfamethoxazole (SMX) and tetracycline (TC) are mainly adsorption and microbial degradation, respectively. The tetracycline has a strong polarity, thus it can be absorbed immediately and stably after entering the system. Sulfamethoxazole is easier to flow with water and can easily microbial degradation. The higher concentration of antibiotic in influent is observed and detected in the effluent corresponding to the decrease of the system open circuit voltage. Meanwhile, the ability of the system on removing antibiotics is depending on the co-substrate concentration for altering performance of the system. With the increase of the co-substrate concentration, the open circuit voltage and internal resistance increase, while the coulombic efficiency of system gradually declines. Further analysis shows that when concentrations of antibiotic and cosubstrates are controlled within a certain range, the system can achieve the optimum balance in the electricity generation and the degradation of antibiotics.
microbial fuel cellconstructed wetland (MFC-CW); antibiotic; co-substrate; degradation; electricity generation
10.3969/j.issn.1001-0505.2017.02.034
2016-10-08. 作者简介:李骅 (1990—),男,博士生;宋海亮(联系人),男,博士,副教授,博士生导师,songhailiang@seu.edu.cn.
国家自然科学基金资助项目(41571476)、 江苏省自然科学基金资助项目(BK20141117)、江苏省重点研发计划资助项目(BE2015358).
李骅,杨小丽,宋海亮,等.微生物燃料电池型人工湿地去除抗生素的效能研究[J].东南大学学报(自然科学版),2017,47(2):410-415.
10.3969/j.issn.1001-0505.2017.02.034.
X703.5
A
1001-0505(2017)02-0410-06
