加速康复外科对腹腔镜胃癌根治术患者炎症因子与免疫功能的影响*①
2017-04-12程康文王贵和
程康文,王贵和
(铜陵市人民医院,安徽 铜陵,244000)
·论 著·
加速康复外科对腹腔镜胃癌根治术患者炎症因子与免疫功能的影响*①
程康文,王贵和
(铜陵市人民医院,安徽 铜陵,244000)
目的:探讨加速康复外科对腹腔镜胃癌根治术患者炎症因子及免疫功能的影响。方法:将患者分为围手术期加速康复外科模式管理的观察组(n=40)与常规围手术期管理的对照组(n=40),比较两组患者各时段炎性介质(IL-6、IL-8及IL-10)及IgA、IgG、IgM、CD3+、CD4+、CD4+/CD8+免疫指标水平,并进行对比分析。结果:术后第1天、第3天、第7天,两组患者IL-6、IL-8均显著上升(P<0.05),对照组较观察组升高更明显(P<0.05)。术后第1天,两组患者IL-10较术前均明显升高(P<0.05),观察组升高更明显。术后第1天,两组患者IgA、IgG、IgM水平较术前均明显降低(P<0.05)。术后第3天,观察组IgA、IgG水平明显高于对照组(P<0.05);两组患者术后IgM水平无明显差异。术后第1天,两组患者CD3+较术前均明显降低(P<0.05),对照组下降更明显;观察组术后CD4+水平与术前相比差异无统计学意义;对照组CD4+水平明显低于术前(P<0.05)。术后第1天、第3天,两组患者CD8+、CD4+/CD8+水平较术前明显降低(P<0.05),但两组间差异无统计学意义。结论:加速康复外科模式可减轻腹腔镜胃癌根治术后患者机体炎性反应,并保护机体免疫功能,减少过度炎症反应,同时可在一定程度上降低胃癌细胞的转移、复发。
胃肿瘤;胃癌根治术;腹腔镜检查;加速康复外科;炎症因子;免疫功能
加速康复外科(enhanced recovery after surgery,ERAS)是基于一系列有循证医学证据的多学科优化措施在围手术期的管理,包括术前、术中及术后通过减少手术应激、器官功能支持促进术后康复[1-2]。自20世纪90年代ERAS理念提出以来,最先广泛应用于结直肠外科,目前已广泛应用至普通外科各领域[3-6]。近年,胃癌手术中也开始推广ERAS[7],多项研究表明,ERAS可缩短胃癌术后住院时间,促进术后康复[4,8-10]。但大部分研究停留在术后临床相关指标分析上,对于更深层次的应激代谢规律缺乏研究,尤其关于术后康复与炎症介质及免疫功能的关系认知较少。炎性反应体现了术后机体免疫状态,但过度的炎性反应会导致免疫抑制[11]。而手术创伤应激会抑制免疫功能,增加术后并发症,从而影响术后早期康复[12]。因此,本研究通过术后炎性因子及免疫功能的变化,进一步探讨ERAS应用于胃癌术中的科学依据。
1 资料与方法
1.1 临床资料 本研究以2015年1月至2016年3月我院胃肠外科收治的胃癌患者为研究对象,采用前瞻性随机对照研究,电脑产生随机数字表将患者分为两组,即采用ERAS模式围手术期管理的观察组(n=44)与常规围手术期管理的对照组(n=44)。两组病例基本情况差异均无统计学意义,具有可比性。术前患者均签署知情同意书,本研究通过我院伦理委员会审批。按腹腔镜胃癌手术操作指南(2007版)[13]行腹腔镜辅助下D2根治术。入选标准:(1)胃镜病理确诊为胃腺癌患者;(2)年龄≥18岁,≤65岁;(3)术前TNM分期为Ⅰb~Ⅲc期;(4)美国麻醉医师协会评分≤3分。排除标准:(1)有腹腔镜手术禁忌证;(2)术前接受放、化疗或免疫治疗;(3)合并其他恶性肿瘤及既往有其他恶性肿瘤的患者;(4)合并自身免疫性疾病。
1.2 处理方法 观察组围手术期采用ERAS方法[9],对照组采用传统围手术期管理方法。两组患者围手术期处理方法见表1。
表1 两组患者围手术期处理方法

措施观察组对照组术前教育强化沟通交流,减少心理应激反应常规宣教术前肠道准备无需常规行清洁灌肠及口服泻药术前晚应用口服泻剂或机械灌肠术前禁食术前6h禁食,术前3h口服5%葡萄糖盐水术前12h禁食、8h禁水术前放置鼻胃管不常规放置,放置24h后尽早拔除常规放置,3~5d后拔除麻醉方法全麻+胸段硬膜外麻醉全麻+静脉复合麻醉防止术中体温过低保温毯、控制输液温度、温水腹腔冲洗不强调术中保温措施术后放置空肠营养管术后4d左右拔除术后8d左右拔除腹腔引流管不常规放置,术后尽早拔除常规放置,待恢复饮食后拔除术中操作精细操作,避免过度牵拉、钳夹,注意损伤控制,尽量减少术中出血保证手术安全及根治前提下,余未特别注意消化道重建时切口术野足够前提下,尽量缩小切口常规上腹部正中切口(6~10cm)放置尿管术后第1天早晨拔除尿管(24h内)下床活动后拔除(48~72h)液体治疗术中限制补液(6~8ml/kg·h-1);术后尽快停止静脉输液(5d左右)不限制补液,术后液体2500~3000ml/d(8d左右)镇痛方案尽量首选非甾体类止痛药物,减少阿片类药物的使用静脉予以非阿片类止痛药(如氟比洛芬酯),间断予以阿片类药物止痛早期下床活动术后麻醉清醒即开始协助其床上活动,12h后鼓励下床活动,24h内陪护其下床活动24~48h后动员患者下床活动,未陪护其术后活动情况术后饮水、进食术后8h经口少量饮水,术后12~24h管饲或口服肠内营养液,之后逐渐增量过渡至流食、半流食,逐渐加量,第4天开始试行停止肠外营养及输液常规静脉营养4~7d至肛门排气后拔除胃管,给予饮水,逐步过渡至流食、半流食后逐渐停止静脉营养输液
1.3 观察指标 术前及术后第1天、第3天、第7天清晨分别抽取两组患者空腹外周静脉血10 ml,通过免疫散射比浊法测定免疫球蛋白(IgA、IgG、IgM);采用酶联免疫吸附试验法测定IL-6、IL-8及IL-10水平;应用流式细胞仪测定各种T淋巴细胞亚群(CD3+、CD4+、CD8+)的变化及CD4+、CD8+淋巴细胞的比值(CD4+/CD8+)。

2 结 果
2.1 两组患者临床资料的比较 本研究共纳入研究对象88例,研究中剔除8例,最终完成研究者80例,其中男47例,女33例,平均(55.23±7.50)岁,体重指数平均(23.40±1.83) kg/m2。依据TNM分期,Ⅰb期7例、Ⅱa期12例、Ⅱb期17例、Ⅲa期22例、Ⅲb期13例、Ⅲc期9例;依据手术方式分类,腹腔镜辅助远端胃切除术28例,腹腔镜辅助全胃切除术52例;依据吻合方式分类,BillrothⅠ式吻合15例,BillrothⅡ式吻合13例,Roux-en-Y吻合52例。两组患者临床资料差异无统计学意义。见表2。
2.2 两组炎症介质指标的比较 术后第1天、第3天、第7天,两组患者术后IL-6、IL-8、IL-10水平均较术前升高,差异有统计学意义(P<0.05);观察组中IL-6、IL-8水平低于对照组,差异有统计学意义(P<0.05);观察组中IL-10水平高于对照组,差异有统计学意义(P<0.05),见表3。
2.3 两组免疫球蛋白指标的比较 术后第1天。两组患者IgA、IgG、IgM水平均较术前降低,差异有统计学意义(P<0.05);除常规组IgA术后第3天仍低于术前外(P<0.05),其余免疫球蛋白与术前相比差异无统计学意义(P>0.05)。术后第1天,观察组IgA指标下降少于对照组,术后第3天恢复至术前水平,而对照组术后第3天仍低于术前,两组间相比差异均有统计学意义(P<0.05)。术后第3天、第7天,观察组患者IgG水平高于对照组,差异有统计学意义(P<0.05)。两组间IgM水平差异均无统计学意义。见表4。
2.4 两组T淋巴细胞亚群指标的变化 术后第1天,两组CD3+低于术前,观察组高于对照组,差异有统计学意义(P<0.05)。术后第3天,观察组CD3+与术前相比差异无统计学意义(P>0.05),而对照组仍低于术前水平,差异有统计学意义(P<0.05),观察组高于对照组,差异有统计学意义(P<0.05)。术后第7天,两组间CD3+水平及其与术前相比差异均无统计学意义。术后第1天,观察组CD4+水平略下降,与术前水平无差异;而对照组CD4+低于术前水平,差异有统计学意义(P<0.05);术后第3天、第7天,两组CD4+水平与术前相比差异无统计学意义,组间相比差异亦无统计学意义。术后第1天、第3天,两组CD8+、CD4+/CD8+低于术前,差异有统计学意义(P<0.05);术后第7天,差异无统计学意义,两组间差异亦无统计学意义,见表5。
3 讨 论
胃癌患者免疫功能处于抑制状态,而手术创伤应激反应导致内环境紊乱,进一步降低机体免疫能力,常是术后引发感染等并发症的重要原因,并可能为肿瘤扩散提供机会[14]。炎性细胞因子可调节及介导免疫应答与炎性反应,进而引起组织及器官损害。
IL-6作为促炎性细胞因子参与机体的炎症反应与免疫应答,能刺激活化B细胞增殖分泌抗体、T细胞增殖及调节性T细胞活化、肝细胞合成急性期蛋白,主要由活化的单核巨噬细胞、Th2细胞、血管内皮细胞、成纤维细胞分泌产生[15-16]。本研究中两组患者术后IL-6均高于术前,表明手术对机体的创伤应激反应引起机体IL-6升高,但观察组IL-6水平明显低于对照组(P<0.05),表明ERAS可减少促炎性细胞因子IL-6的释放。IL-8是主要由单核巨噬细胞、淋巴样细胞、内皮细胞等产生的一种细胞因子,其生物学活性是吸引并激活中性粒细胞,促进其趋化、脱落,释放溶酶体,促进T细胞趋化,加强免疫反应[17]。本研究中,IL-8在术后明显高于术前,且观察组低于对照组。研究表明,IL-8与胃癌细胞的粘附、迁移、侵袭及对化疗的抵抗作用相关[18]。由此推断,我们认为,ERAS同样可减少胃癌术后的复发转移,具体有待进一步研究。
IL-10主要是由Th2亚型细胞分泌的一种抗炎性细胞因子。研究表明,IL-10在体内起到免疫反应负调节的作用[19]。本研究中,观察组术后IL-10水平高于术前,差异有统计学意义;术后两组间差异亦有统计学意义;至术后第7天,常规组相较术前无明显差异。结果表明,ERAS可增加腹腔镜胃癌根治术患者中IL-10水平,从而降低术后过度炎症反应,减少术后并发症的发生,促进术后康复。
IL-6与IL-8是主要的促炎因子,其浓度的升高随创伤、手术时间成正比。研究表明,手术时间、术中出血量及术后肠道功能恢复时间与IL-6、IL-8浓度也有关联[20]。IL-6、IL-8浓度越低术后并发症越低。IL-10作为抗炎因子,随着IL-6、IL-8水平的升高而升高,同时也可拮抗IL-6与IL-8表达。在胃癌患者中,IL-10增高可抑制癌细胞的增殖与转移。这也表明,ERAS指导下的腹腔镜胃癌根治术患者全身促炎症因子水平相对较低,而抗炎因子相对较高,减轻了术后的炎症反应,同时利于降低胃癌肿瘤细胞术后的转移、复发。
组别性别(n)男女年龄(岁)体重指数(kg/m2)TNM分期(n)Ⅰb期Ⅱa期Ⅱb期Ⅲa期Ⅲb期Ⅲc期手术方式(n)远端胃全胃吻合方式(n)毕Ⅰ式毕Ⅱ式Roux-en-Y观察组251556.22±7.6723.60±1.90368126512287528对照组221854.41±7.2823.20±1.76469107416248824t/χ2值0.4641.6650.9780.3630.9320.820P值0.4960.0960.3310.7160.3510.412
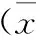

指标组别术前第1天术后第1天t1/P1术后第3天t3/P3术后第7天t7/P7IL-6(ρ/ng·ml-1)观察组常规组t值P值2.53±1.1637.71±13.5516.35929.62±7.6322.20213.28±4.0716.0760.0000.0000.0002.21±1.0951.72±7.8639.46740.52±9.1726.24215.30±4.1019.5030.0000.0000.0001.2905.6575.7812.2160.2010.0000.0000.030IL-8(ρ/ng·ml-1)观察组常规组t值P值1.73±0.6726.78±7.2421.79512.56±5.4512.4833.02±1.624.6590.0000.0000.0051.95±0.9344.23±9.1828.98720.47±6.1118.9548.67±1.8820.3270.0000.0000.0001.2089.4396.11514.4380.2310.0000.0000.000IL-10(ρ/pg·ml-1)观察组常规组t值P值129.08±34.43219.19±48.239.618181.66±20.298.321148.14±13.883.2470.0000.0000.002135.94±29.39196.38±24.939.918160.81±17.844.574140.33±18.220.8030.0000.0000.4240.9582.6574.8822.1570.3410.0100.0000.034
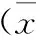
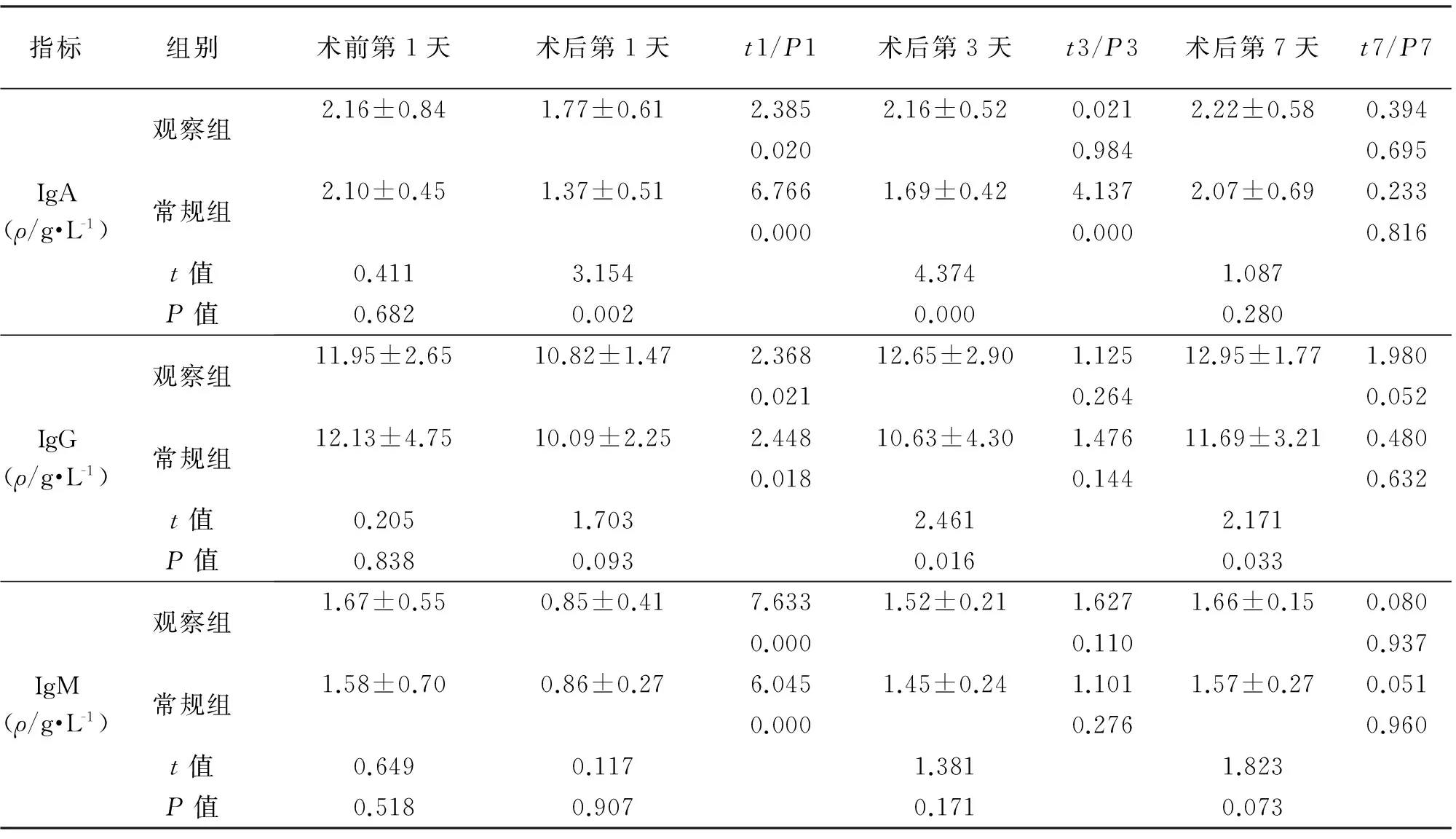
指标组别术前第1天术后第1天t1/P1术后第3天t3/P3术后第7天t7/P7IgA(ρ/g·L-1)观察组常规组t值P值2.16±0.841.77±0.612.3852.16±0.520.0212.22±0.580.3940.0200.9840.6952.10±0.451.37±0.516.7661.69±0.424.1372.07±0.690.2330.0000.0000.8160.4113.1544.3741.0870.6820.0020.0000.280IgG(ρ/g·L-1)观察组常规组t值P值11.95±2.6510.82±1.472.36812.65±2.901.12512.95±1.771.9800.0210.2640.05212.13±4.7510.09±2.252.44810.63±4.301.47611.69±3.210.4800.0180.1440.6320.2051.7032.4612.1710.8380.0930.0160.033IgM(ρ/g·L-1)观察组常规组t值P值1.67±0.550.85±0.417.6331.52±0.211.6271.66±0.150.0800.0000.1100.9371.58±0.700.86±0.276.0451.45±0.241.1011.57±0.270.0510.0000.2760.9600.6490.1171.3811.8230.5180.9070.1710.073
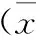

指标组别术前第1天术后第1天t1/P1术后第3天t3/P3术后第7天t7/P7CD3+(%)观察组常规组t值P值56.35±12.0949.22±11.902.65655.32±7.140.46156.89±7.520.2390.0100.6460.81258.77±14.4044.27±8.375.50650.80±8.712.99656.59±6.440.2330.0000.0040.8160.8142.1532.5430.1880.4180.0340.0130.852CD4+(%)观察组常规组t值P值32.76±9.4029.71±7.621.59534.35±10.20.72135.46±8.881.3210.1150.4730.19133.35±9.9228.25±9.632.33631.12±8.761.06636.72±6.351.8070.0220.2900.0750.2740.7521.5110.7280.7850.4540.1350.469CD8+(%)观察组常规组t值P值24.09±3.7820.88±2.924.25122.64±1.982.15223.84±3.140.3240.0000.0350.74723.69±5.2320.57±2.053.52121.46±3.222.30422.84±2.390.9430.0010.0240.3500.3920.5511.9781.6120.6960.5830.0520.111CD4+/CD8+观察组常规组t值P值1.41±0.231.33±0.122.2001.17±0.115.9851.45±0.101.0320.0320.0000.3071.44±0.201.35±0.162.3821.15±0.088.8741.46±0.190.4610.0200.0000.6460.6910.4660.9560.3390.4920.6430.3430.736
机体炎性反应及免疫功能是评估ERAS的客观指标,IgA是机体黏膜分泌的保护性抗体,IgG是血清中的主要保护抗体,IgM是体液免疫应答中最早出现的抗体,可结合抗原、激活补体。两组患者术后第1天IgA、IgG、IgM水平均较术前降低(P<0.05);除常规组IgA术后第3天低于术前外,其余抗体术后第3天已恢复至术前水平。观察组术后第1天、第3天IgA水平高于对照组,差异有统计学意义(P<0.05)。结果表明ERAS对术后IgA、IgG水平影响较小,并可尽早恢复至术前水平。观察组IgM水平与对照组相比差异无统计学意义,考虑到IgM在应激感染的早期就出现改变,因此并不能否认ERAS对IgM水平的保护作用,这与国内研究报道[14,21]相符。
免疫球蛋白是体液免疫的主要作用形式,但以T淋巴细胞亚群为主的细胞免疫也发挥着重要作用,T细胞在胸腺中发育成熟的早期即表达CD3分子,这些T细胞活化后分化成不同功能的效应细胞即辅助T细胞(CD4+T细胞)、细胞毒性T细胞(CD8+T细胞)及调节性T细胞[22]。T淋巴细胞能识别并递呈处理抗原,从而维持免疫功能与生理状态的平衡。目前关于ERAS对胃癌T淋巴细胞的研究较少,而在结直肠癌中有研究表明[23-24],ERAS联合腹腔镜术后T淋巴细胞水平优于常规腹腔镜组。本研究中,除观察组CD4+T淋巴细胞外,两组T淋巴细胞水平在术后第1天均下降(P<0.05);观察组术后第3天CD3+T淋巴细胞恢复至术前水平,对照组为术后第7天;观察组术第1天CD4+T淋巴细胞即恢复至术前水平,对照组为术后第3天。两组CD8+T淋巴细胞、CD4+/CD8+T淋巴细胞比例均于术后第7天恢复至术前水平。术后第1天、第3天,观察组CD3+T淋巴细胞水平高于对照组,其余类型T淋巴细胞在术后不同时间点无明显差异。上述结果表明,ERAS对CD3+T淋巴细胞、CD4+T淋巴细胞具有一定的保护作用。而对其他类型T淋巴细胞无明显影响,不排除因时间点不同及样本量小所致的结果偏倚。
总之,ERAS可影响胃癌术后患者的免疫功能状态,增强机体的免疫功能,减少过度炎症反应,同时可在一定程度上降低胃癌细胞的转移与复发。由于不存在标准ERAS模式,且对于其免疫功能保护的研究仍处于基础阶段,具体机制尚无好的研究验证与解释,这就需要随机照试验及循证医学等研究证实。因此,探索ERAS的循证依据、丰富其内涵是未来促进胃癌外科领域ERAS推广的基础动力。
[1] Kehlet H.Multimodal approach to control postoperative pathophysiology and rehabilitation[J].Br J Anaesth,1997,78(5):606-617.
[2] 江志伟,黎介寿.我国加速康复外科的研究现状[J].中华胃肠外科杂志,2016,19(3):246-249.
[3] Forsmo HM,Pfeffer F,Rasdal A,et al.Compliance with enhanced recovery after surgery criteria and preoperative and postoperative counselling reduces length of hospital stay in colorectal surgery:results of a randomized controlled trial[J].Colorectal Dis,2016,18(6):603-611.
[4] Karran A,Wheat J,Chan D,et al.Propensity Score Analysis of an Enhanced Recovery Programme in Upper Gastrointestinal Cancer Surgery[J].World J Surg,2016,40(7):1645-1654.
[5] Aniskevich S,Pai SL.Fast track anesthesia for liver transplantation:Review of the current practice[J].World J Hepatol,2015,7(20):2303-2308.
[6] Morgan KA,Lancaster WP,Walters ML,et al.Enhanced Recovery After Surgery Protocols Are Valuable in Pancreas Surgery Patients[J].J Am Coll Surg,2016,222(4):658-664.
[7] 江志伟,黎介寿.重视胃癌手术应用加速康复外科的研究与推广[J].外科理论与实践,2016,21(1):25-27.
[8] 赵坤,王刚,江志伟,等.加速康复外科理念指导腹腔镜胃癌根治术临床价值研究[J].中国实用外科杂志,2013,33(7):587-589.
[9] 程康文,王贵和,束宽山,等.腹腔镜胃癌根治术中应用快速康复外科理念的研究[J].腹腔镜外科杂志,2016,21(4):292-296.
[10] Marik PE,Flemmer M.The immune response to surgery and trauma:Implications for treatment[J].J Trauma Acute Care Surg,2012,73(4):801-808.
[11] Page AJ,Ejaz A,Spolverato G,et al.Enhanced recovery after surgery protocols for open hepatectomy--physiology,immunomodulation,and implementation[J].J Gastrointest Surg,2015,19(2):387-399.
[12] Chen ZX,Lui AH,Cen Y.Fast-track program vs traditional care in surgery for gastric cancer[J].World J Gastroenterol,2014,20(2):578-583.
[13] 余佩武,王自强.腹腔镜胃癌手术操作指南(2007版)[S].中华消化外科杂志,2007,6(6):476-480.
[14] 王祥安,虞黎明,范纪昌,等.加速康复外科应用于胃癌根治术对机体免疫功能影响Meta分析[J].中国实用外科杂志,2015,35(10):1108-1112.
[15] 操珍,苏文.胃癌相关细胞因子研究进展[J].中国肿瘤,2016,25(2):125-131.
[16] Nagasaki T,Hara M,Nakanishi H,et al.Interleukin-6 released by colon cancer-associated fibroblasts is critical for tumour angiogenesis:Anti-interleukin-6 receptor antibody suppressed angiogenesis and inhibited tumour-stroma interaction[J].Br J Cancer,2014,110(2):469-478.
[17] 尚颖,赵立元,陆景坤.炎性细胞因子与胃癌的关系[J].中国药科大学学报,2015,46(1):123-128.
[18] Kuai WX,Wang Q,Yang XZ,et al.Interleukin-8 associates with adhesion,migration,invasion and chemosensitivity of human gastric cancer cells[J].World J Gastroenterol,2012,18(9):979-985.
[19] Manzanillo P,Eidenschenk C,Ouyang W.Deciphering the crosstalk among IL-1 and IL-10 family cytokines in intestinal immunity[J].Trends Immunol,2015,36(8):471-478.
[20] 尹作文,喻军,王永,等.腹腔镜辅助下D2根治术对患者血清炎症因子的影响[J].中国普通外科杂志,2014,23(3):383-385.
[21] 孔营,周岩冰,王东升,等.加速康复外科对胃癌手术病人体液免疫和临床指标的影响[J].肠外与肠内营养,2009,16(4):205-208.
[22] 黄旭宏,宋玉国,刘春雷,等.胃癌与T淋巴细胞亚群关系的研究进展[J].世界华人消化杂志,2016,24(15):2331-2335.
[23] 冯金华,李立,汪晓东,等.加速康复外科对结直肠癌患者术后炎性反应及细胞免疫功能影响的随机对照研究[J].四川大学学报(医学版),2016,47(1):131-134.
[24] Wang G,Jiang Z,Zhao K,et al.Immunologic Response After Laparoscopic Colon Cancer Operation Within an Enhanced Recovery Program[J].J Gastrointest Surg,2012,16(7):1379-1388.
(英文编辑:杨庆芸)
Effect of enhanced recovery after surgery on inflammatory factor and immune function after laparoscopic radical operation for patients with gastric cancer
CHENGKang-wen,WANGGui-he.
DepartmentofGastroenterologicalSurgery,TonglingPeople'sHospital,Tongling244000,China
Objective:To investigate the effect of enhanced recovery after surgery (ERAS) on inflammatory factor and immune function of patients with gastric cancer after laparoscopic radical resection.Methods:Patients were divided into ERAS group (observation group,40 cases) and the traditional methods of management group (control group,40 cases).Each period's inflammatory medium (IL-6,IL-8 and IL-10) and IgA,IgG,IgM,CD3+,CD4+,CD4/CD8+immune index concentration were tested and analyzed in two groups.Results:On the postoperative 1st,3rd and 7th day,IL-6 and IL-8 significantly increased as compared to preoperative data in two groups (P<0.05),but the parameters in control group were significantly higher than those in observation group(P<0.05).On the postoperative 1st day,IL-10 significantly increased as compared to preoperative data in two groups (P<0.05),but the parameter in observation group was significantly higher.On the first day after operation,IgA, IgG and IgM were significantly decreased as compared to preoperative data in two groups (P<0.05).On the postoperative 3rd day,IgA and IgG level in observation group were significantly higher than those in control group (P<0.05).There was no significant difference of IgM level between the two groups.On the first day after operation,CD3+were significantly decreased as compared with preoperative data in two groups (P<0.05),but those in the control group decreased more obviously.In observation group,there was no significant difference in CD4+level between postoperative day and before operation.CD4+level was significantly decreased as compared to preoperative level in control group (P<0.05).On the postoperative 1st,3rd day,CD8+,CD4+/CD8+level were significantly lower than those before operation in two groups (P<0.05),but there was no significant difference between the two groups.Conclusions:ERAS can mitigates the immunologic response,protect the immune function of gastric cancer patients after laparoscopic radical resection,decrease excessive inflammatory response,metastasis and recurrence of gastric carcinoma cells.
Stomach neoplasms;Radical operation for gastric cancer;Laparoscopy;Enhanced recovery after surgery;Inflammatory cytokines;Immune function
1009-6612(2017)01-0030-06
10.13499/j.cnki.fqjwkzz.2017.01.030
①*基金项目:安徽省铜陵市卫生科研项目(编号:卫科研〔2015〕12号)
王贵和,E-mail:yiyuanckw@163.com作者简介:程康文(1986—)男,安徽省铜陵市人民医院胃肠外科主治医师,主要从事消化道肿瘤方面的研究。
R735.2
A
2016-09-20)
