基于NaOH刻蚀玻碳电极的电化学传感器在检测膀胱癌DNA中的应用*
2017-04-12张忆一许世超温俊男
张忆一,许世超,2,3*,温俊男,董 凯
(1.天津工业大学环境与化学工程学院,天津 300387;2.天津工业大学中空纤维膜材料与膜过程省部共建国家重点实验室,天津300387;3.天津工业大学水质安全评价与保障技术工程中心,天津300387)
基于NaOH刻蚀玻碳电极的电化学传感器在检测膀胱癌DNA中的应用*
张忆一1,许世超1,2,3*,温俊男1,董 凯1
(1.天津工业大学环境与化学工程学院,天津 300387;2.天津工业大学中空纤维膜材料与膜过程省部共建国家重点实验室,天津300387;3.天津工业大学水质安全评价与保障技术工程中心,天津300387)
制备了一种基于活化的玻碳电极的新型电化学DNA生物传感器,可用于膀胱癌DNA的检测。通过循环伏安法(CV)实现玻碳电极在NaOH溶液中的刻蚀,使电极表面负载大量官能团,为DNA提供连接位点,由Laviron方程计算得到玻碳电极表面的羧基浓度为 1.022×10-6mol/cm2。亚甲基蓝(MB)作为电化学检测的杂交指示剂。采用原子力显微镜(AFM)对刻蚀后的电极进行了形貌表征。在最优杂交条件下,通过差分脉冲法(DPV)计算出最佳检测限为5.677×10-13mol/L(n=5),适用目标 DNA浓度范围1×10-8mol/L~1×10-12mol/L。该传感器有望用于实际样品中膀胱癌DNA的快速检测。
DNA电化学传感器;活化的玻碳电极;差分脉冲法;亚甲基蓝
脱氧核糖核酸(DNA)是形成生物的最基本的分子形式,因此对特定DNA序列的识别和量化在疾病监测和微生物检测领域中是非常重要的[1-4]。目前,常用的DNA 检测技术有荧光检测法、电化学发光检测法、试剂盒法、电化学检测法等[5]。与其他方法相比电化学检测法具有成本低、操作简单、检测速度快、灵敏度高、特异性强等优点[6-8]。如Jin等[9]采用发夹式探针DNA在金电极表面与目标DNA杂交的检测方法;Pandey等[10]构建了一种自组装膜做修饰成分检测大肠杆菌基因的电化学传感器;Pan等[11]制备了一种金纳米粒子与石墨烯复合材料修饰玻碳电极的传感器,并成功检测克雷白氏杆菌;Zhao等[12]将玻碳电极在NaH2PO4溶液中进行电化学刻蚀,使电极的电化学性能明显增强并成功应用于电化学检测中。在生物传感器组装过程中,DNA序列的负载是制备传感器的关键步骤,DNA负载的数量决定了传感器的灵敏度。玻碳电极(GCE)由于其良好的表面导电性在电化学测试中广泛应用,而经过活化的GCE表面负载的大量官能团为DNA的固定提供良好的连接位点。目前,在GCE表面直接固定生物分子的方法也多用于检测多巴胺、抗坏血酸、尿酸[13-15]。膀胱癌是世界第9大癌症,复发率高且潜伏期长[16-17],其前期分析和诊断的已经成为疾病检测的热点。
亚甲基蓝(MB)是一种吩噻嗪族有机染料,常作为电化学杂交指示剂用于生物传感器的检测中[18]。亚甲基蓝的一个重要特征是可以和DNA分子中的鸟嘌呤核苷酸(Guanine)进行特异性结合,具有非常好的生物亲和性[19]。因此,亚甲基蓝可以非常方便的被加入到 DNA 链段中,并发生氧化还原反应,产生电化学信号。
本研究制备了由NaOH刻蚀玻碳电极的新型电化学DNA生物传感器,采用亚甲基蓝作为杂交指示剂,实现了对膀胱癌细胞DNA序列的特异性检测。通过循环伏安法实现对玻碳电极的活化,使其表面负载了大量的官能团[13,18](其中羧基为主要官能团),为DNA的连接提供位点,传感器的灵敏度得到提高。通过这种方法,单链DNA可以直接固定于电极表面,简化了修饰电极繁复的制备过程,使检测更加快速高效。此外,玻碳电极曾被用于0.1 mol/L H2SO4在0~2 V的范围内刻蚀[20],或者在+1.8 V的电势下在PBS缓冲液(pH=5)中活化[21],但很少被用于碱性介质中活化并检测DNA序列,本研究首次使用NaOH活化的电极检测DNA序列。与其他电化学传感器相比,此传感器具有很好的灵敏度,并且具有检测范围宽、检测限低的特点,可以对膀胱癌细胞特异DNA序列进行检测,有望用于实际样品中膀胱癌DNA的快速检测。
1 实验
1.1 仪器与试剂
LK2006A电化学工作站(天津兰力科电子高技术有限公司),Easyscan-2原子力显微镜(瑞典 Nanosurf 科技公司),SB-5200D超声清洗仪(宁波新芝生物科技有限公司);三电极系统:表面修饰的工作电极为玻碳电极(GCE,Φ=3 mm),参比电极为饱和甘汞电极,对电极为铂丝电极。
1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC,纯度为98%)、三羟基烷基甲烷、N-羟基琥珀酰亚胺(NHS,纯度为98%)、EDTA(上海阿拉丁试剂公司);亚甲基蓝(MB,天津博迪化工有限公司);NaCl、NaOH、盐酸(天津市风船化学试剂科技有限公司);无水乙醇、KH2PO4(天津赢达稀贵化学试剂厂);Na2HPO4·12H2O、柠檬酸钠(天津北方天医化学试剂厂);K3Fe(CN)6(天津光复科技发展有限公司)。Tris-HCl缓冲液(pH=7.2,50 mmol/L,含20 mmol/L NaCl):50 mL 0.1 mol/L Tris溶液与44.7 mL 0.1 M盐酸混合均匀,加水稀释至100 mL。PBS缓冲液(pH=7.0,0.1 mol/L):用KH2PO4和Na2HPO4·12H2O配制。2×SSC缓冲液(pH=7.0):NaCl溶液与柠檬酸钠溶液混合配制。TE缓冲液(pH=8.0):用Tris和EDTA配制,再用0.1 mol/L的盐酸调节pH至8.0。所用试剂均为分析纯,所用水均为超纯水。
1.2 DNA序列
下列①~⑦DNA 链段由天津伯益特生物技术有限公司合成:①5′端氨基标记的探针DNA序列:5′-NH2-(CH2)6-CAGTAGACGGGGGTGTCTCGCGAC-3′;②互补目标DNA 序列:5′-NH2-(CH2)6-CAGTAGACGGGGGTGTCTCGCGAC-3′;③单碱基错配目标DNA序列:5′-GTCATCTGGCCCCACAGAGCGCTG-3′;④两碱基错配目标DNA序列:5′-GTCATCTGGCCCCTCAGAGCGCTG-3′;⑤多碱基错配目标DNA序列:5′-TGGTTCTGGCCCCTCAGAGCGCTG-3′;⑥弓形虫特征DNA序列:5′-AGCTATTATAAACTCGTTGGA-TGC-3′;⑦化脓单杆胞菌DNA序列:5′-GGCTTTT-CGTCCGGCGAAAATGCC-3′。
1.3 实验过程
1.3.1 修饰电极的制备
将玻碳电极分别在0.3 μm和0.05 μm的氧化铝抛光粉中进行打磨抛光,然后依次用稀硝酸、乙醇、超纯水超声清洗,最后用氮气吹干电极表面。将预处理好的玻碳电极置于1 mol/L的NaOH溶液中,通过循环伏安法扫描进行电化学蚀刻,循环扫描20圈,电位设定在-0.1 V~1.2 V,扫速为50 mV/s,即得到NaOH/GCE的修饰电极。
1.3.2 传感器的组装
将5 μL单链DNA(ssDNA)探针溶液和10 μL Tris-HCl溶液(内含25 mmol/L EDC和10 mmol/L NHS,pH=7.2)缓慢滴加于处理好的玻碳电极表面,在40 ℃的条件下静置1 h,在此过程中要保证电极表面的湿润程度。将电极用Tris-HCl缓冲液和超纯水轻轻清洗,以除去未组装的DNA,用氮气吹干表面,即得到ssDNA/NaOH/GCE。
1.3.3 目标DNA的杂交
将ssDNA/NaOH/GC置于一定浓度的互补目标DNA的2×SSC溶液中,在37 ℃下杂交1 h。杂交完成后,使杂交溶液自然冷却至室温取出电极,并用Tris-HCl和超纯水依次冲洗电极表面以便将未杂交形成双链结构的DNA(dsDNA)除去,即得到dsDNA/NaOH/GCE。
1.3.4 杂交指示剂的嵌入
将上述制备好的dsDNA/NaOH/GCE浸没在含一定浓度亚甲基蓝的Tris-HCl溶液中,自组装反应一段时间,将电极取出并用Tris-HCl溶液冲洗电极。此传感器制备的流程如图1所示。
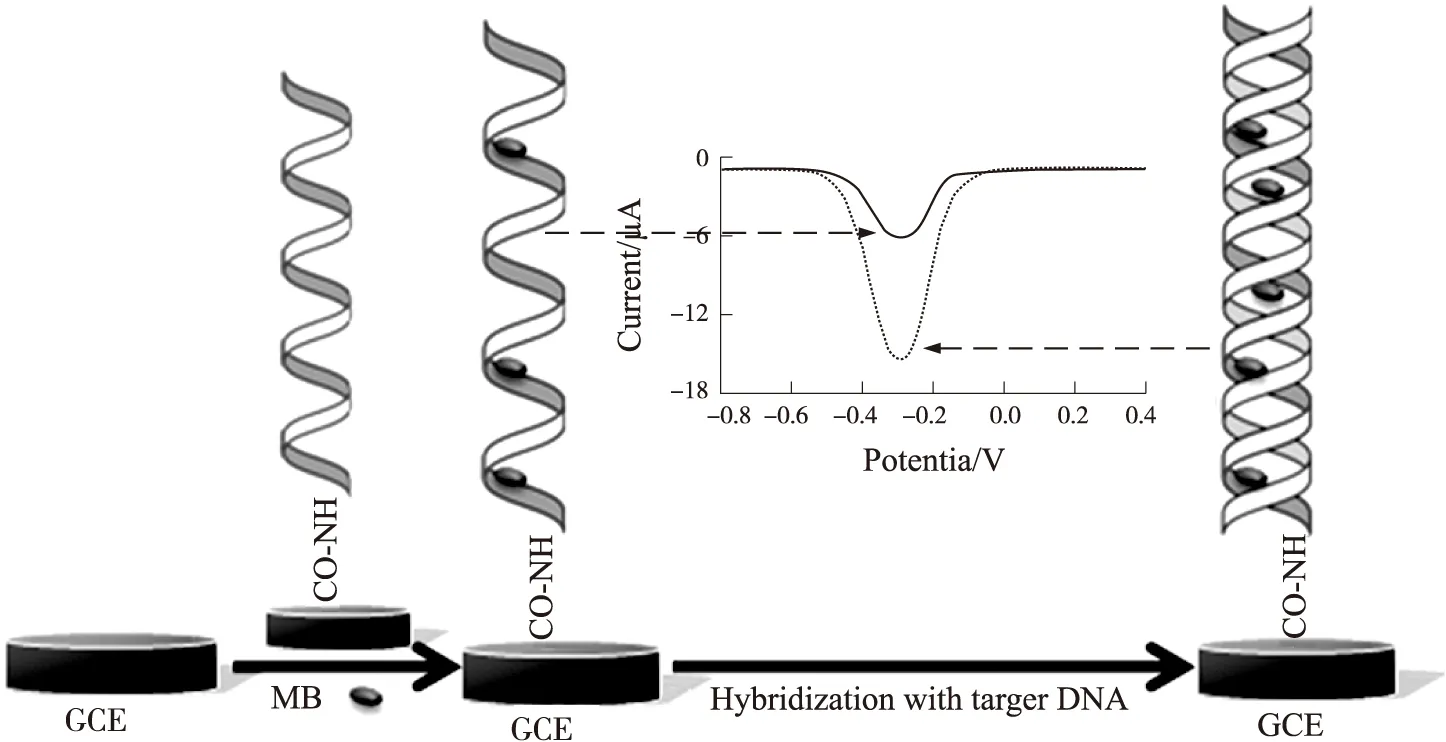
图1 电化学蚀刻法制备电化学 DNA 传感器的流程图
2 结果与讨论
2.1 膀胱癌DNA电化学传感器的制备
2.1.1 玻碳电极的电化学蚀刻表征
NaOH蚀刻过程本质是通过电极在碱性溶液中的活化,使得玻碳电极表面本身形成羧基、 醌型分子、羰基等官能团层[14,22],以便进行进一步的电化学固定。由图2可以看出,相比于裸玻碳电极的循环伏安(图2(a)),经NaOH溶液刻蚀后(图2(b)),出现了很明显的氧化还原峰,证明已经得到了充分活化的电极,形成了稳定的羧基官能团。
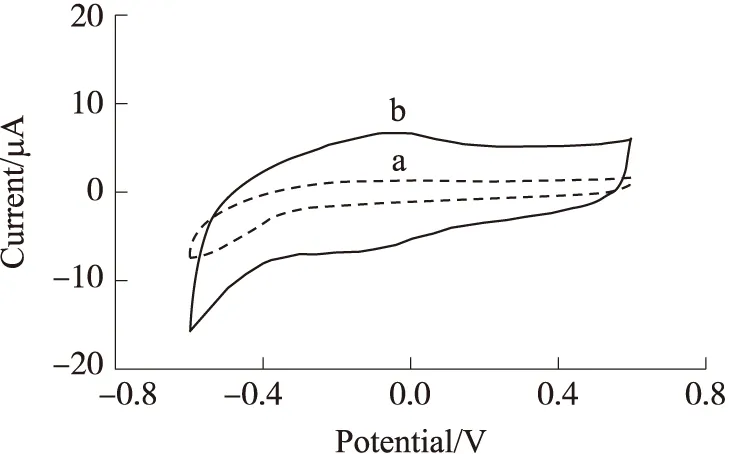
a为裸玻碳电极;b为经NaOH刻蚀的玻碳电极;底液为0.1 mol/L(pH=7.0)PBS缓冲液图2 电化学蚀刻玻碳电极表面的循环伏安图
图3是玻碳电极表面在原子力显微镜(AFM)下的2D和3D形貌图。可以明显看出,相比裸玻碳电极的AFM图(图3(a)),当玻碳电极在NaOH溶液中活化过后(图3(b)),电极表面形成许多不规则的微球状物质,通过测量这些微球的平均直径为151.3 nm,这说明电极表面的粗糙程度明显增加。此外,对比3D形貌图(图3(c)与图3(d)),在电极活化之后表面形成大量凹凸不平的凸起,同样说明了电极粗糙程度的改变,同时电极的有效表面积增大[12],为传感器的组装提供更多的结合位点。综上所述,NaOH已成功在电极表面完成刻蚀过程,得到了活化的玻碳电极。

图3 玻碳电极表面的 AFM 表征图
图4表明,电化学蚀刻后的玻碳电极随着扫描速度的增加,峰电流值也逐渐增加。图5将图4中不同的扫描速度所对应的氧化峰和还原峰电流值进行了拟合。如图5所示,所蚀刻后的玻碳电极其氧化峰和还原峰电流值随着扫速的增加而呈现非常好的线性相关性,拟合后的氧化峰曲线R为0.998 31,拟合方程为IPA=0.018 22·ν+0.892 87;还原峰曲线R为0.997 93,拟合方程为IPC=-0.01853·ν-1.000 89(式中ν为循环伏安法中的扫描速度)。以上结果表明,NaOH蚀刻后的玻碳电极表面为典型的表面控制过程,不是扩散控制过程。
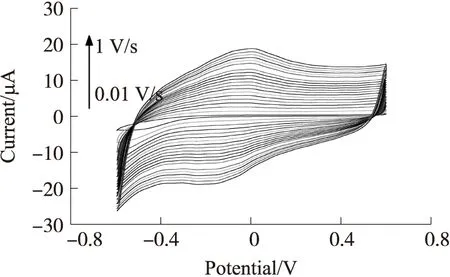
扫描范围-0.6 V~0.6 V,扫描速度0.01 V/s~1 V/s图4 电化学蚀刻后玻碳电极在不同扫描速度下的循环伏安曲线图
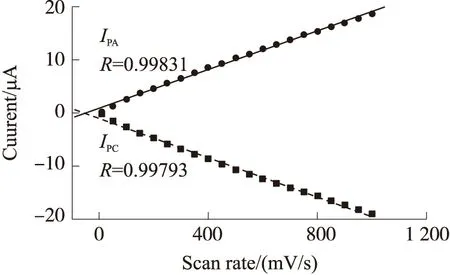
IPA为氧化峰电流;IPC为还原峰电流图5 电化学蚀刻后的玻碳电极在不同扫速时的循环伏安图拟合曲线
此外,根据 Laviron方程[23]可以推算出电极表面的官能团浓度Γ(主要是羧基官能团)。具体计算过程如下:
ip=nFQviip=nFQv/4RTip=nFQvj
(1)
Q=nFAΓ Q=n
(2)
式中:n是电子转移数目,F是法拉第常数,Q是还原峰的积分值,v为扫描速度,R为气体摩尔常数,T是热力学温度。计算结果表明,玻碳电极表面的羧基浓度约为1.022×10-6mol/cm2。
2.1.2 传感器的组装
从图6可以看出,当GCE(曲线c)和ssDNA/GCE(曲线b)分别在PBS缓冲液中进行循环伏安曲线扫描时,没有明显的氧化还原峰出现。这是因为在上述两种电极表面未组装杂交指示剂MB,所以没有出现相应的电化学信号。当在dsDNA组装完成的玻碳电极表面(曲线c)进行MB自组装之后,在-0.235V和-0.312V位置上出现了MB的氧化还原峰(vsSCE),并且两个电化学信号峰对称性良好。以上结果表明,MB分子成功组装到dsDNA修饰的玻碳电极表面,并且表现出良好的电化学氧化还原活性。
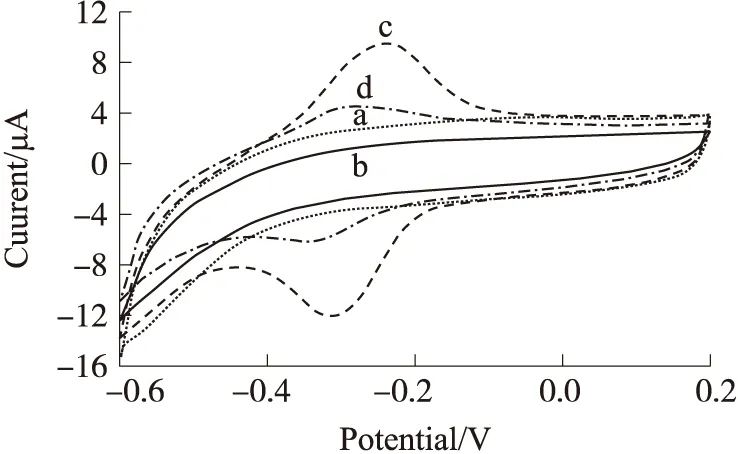
a为裸玻碳电极;b为ssDNA探针修饰的玻碳电极;c为MB/ss DNA修饰的玻碳电极;d为MB/ds DNA修饰的玻碳电极。扫描底液为PBS缓冲液(0.1 mol/L,pH=7.0),扫描速度50 mV/s,扫描范围-0.6 V~0.2 V,目标DNA浓度为10 μmol/L图6 电化学DNA传感器组装的循环伏安图
2.2 目标DNA杂交条件的优化
2.2.1 杂交时间和温度的选择
电化学DNA传感器与目标DNA的杂交时间和温度关系如图7所示。从图7可以看出,随着杂交温度的上升,杂交时间逐渐减小。当杂交温度为25 ℃(图7(a))时,杂交100 min后双螺旋结构才在电极表面形成;随着杂交温度的升高,在35 ℃(图7(b))和45 ℃(图7(c))条件下,分别只需要60 min和40 min即可完成目标DNA在电极表面的杂交,形成双螺旋结构。但是,在45 ℃条件下,起初由于温度较高,DNA杂交过程进行较快,但是随着实验进行,双螺旋结构在高温下逐渐被破坏,因此所测得的电信号值大幅减小。当杂交温度为55 ℃(图7(d))时,由于杂交温度过高,ssDNA探针和目标DNA链段并未发生明显杂交就在高温中被破坏结构,因此并未有明显的杂交信号出现。综上所述,本实验后续的目标DNA杂交实验均选择在35 ℃下杂交1 h。
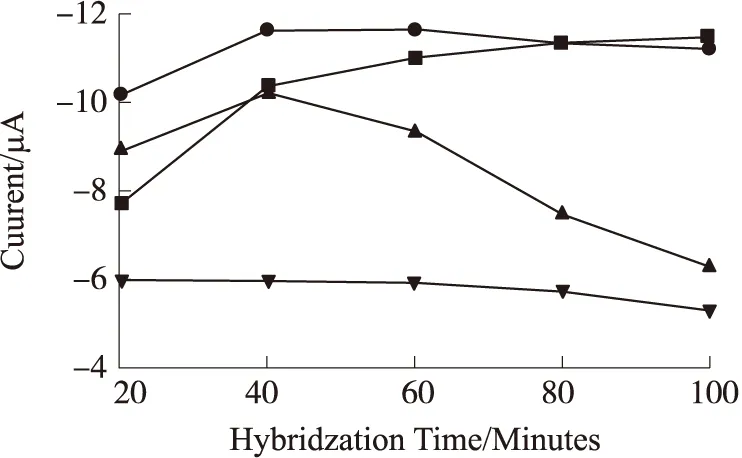
a为25 ℃;b为35 ℃;c为45 ℃;d为55 ℃图7 不同温度条件下MB/dsDNA/GCE的差分脉冲信号响应与不同杂交时间的关系图

DNA杂交溶液为10 μmol/L,MB浓度为10 μmol/L图8 亚甲基蓝自组装时间对杂交信号的影响图
2.2.2 MB分子自组装条件的优化
由图8可知,dsDNA/GCE在组装MB时,随着组装时间的增加,最后所测得的电信号值逐渐增加。当自组装时间达到5 min时,电信号达到最大,随后趋于平稳,没有发生明显波动。因此,在后续MB自组装实验中,MB的组装时间均选为5 min。从图9可知,在相同实验条件下,随着MB浓度的增加,电极最后所测得的电信号也逐渐增加。当MB在底液中的浓度达到2×10-5mol/L时,电信号值达到最大,并且随着MB浓度的继续增加再无明显波动和变化。因此,后续MB自组装实验中,选择MB组装底液的浓度为2×10-5mol/L。
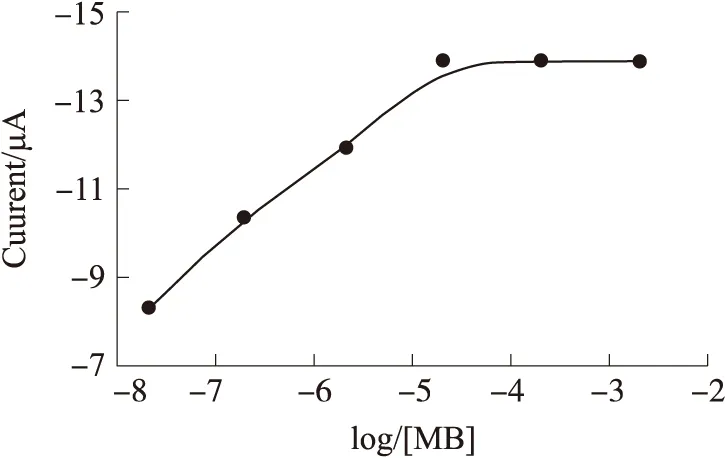
DNA杂交溶液为10 μmol/L,MB组装时间为5 min图9 亚甲基蓝浓度对杂交信号的影响图
2.3 传感器的电化学表征
2.3.1 传感器的选择性
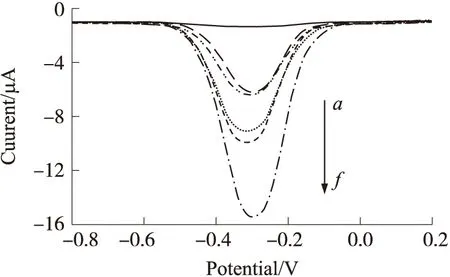
a为裸玻碳电极;b为MB/ssDNA/GCE;c为多碱基错配目标DNA;d为两碱基错配目标DNA;e为单碱基错配目标DNA;f为完全互补目标DNA。检测底液为Tris-HCl缓冲液(50 mmol/L,pH=7.2),以上DNA杂交溶液浓度均为10 μmol/L,DNA杂交温度为35 ℃,杂交时间为60 min。图10 电化学DNA传感器与不同DNA杂交后的差分脉冲伏安图
从图10可以看出,当探针与互补目标DNA(曲线f)杂交时,电化学信号最强。这是因为MB分子充分组装到了dsDNA/GCE 表面,因此其电化学反应充分,电化学信号强。当与单碱基错配(曲线e)和两碱基错配的目标DNA链段(曲线d)杂交之后,在玻碳电极表面并未形成完整的双链DNA螺旋结构,致使MB分子并不能充分嵌入dsDNA结构中因此电化学还原峰信号相比于完全互补的目标DNA明显减小。最后,当探针与多碱基错配目标DNA(曲线c)杂交后,在玻碳电极表面几乎未形成双链DNA螺旋结构,MB几乎未组装在dsDNA结构中,因此其电化学信号仅比MB/ssDNA/GCE微微增大。这种电化学信号微增的现象是因为微量的ssDNA链段物理吸附在了电极表面,在MB分子组装到这些ssDNA结构中之后,产生了微弱的电信号[20]。图10中的曲线a是探针与裸玻碳电极杂交的空白实验,曲线b为ssDNA探针组装MB之后的电化学信号。以上结果表明,所制备的电化学DNA传感器具有很好的选择性,能够对目标DNA链段进行准确检测。
2.3.2 膀胱癌目标DNA检测
从图11可以看出,随着目标DNA杂交液浓度的逐渐增大,DPV信号也相应增加。图12为图11的线性拟合曲线,从图中可以看出,电信号值与目标DNA浓度呈现出良好的线性关系(R=0.998 78),这说明该传感器的有很高的灵敏度。

a~e分别对应1×10-8 mol/L~1×10-12 mol/L图11 电化学DNA传感器与不同浓度的目标DNA杂交的差分脉冲曲线图

图12 电化学传感器与不同浓度的目标DNA杂交后的电信号拟合曲线(n=5)
为了使实验结果准确可靠,我们还对每个数据点进行了5组平行实验,并计算了实验标准差,实验结果如表1所示。

表1 平行实验结果(n=5)
所得到的曲线方程为Ip=-7.661 07-1.016 01·C(C为目标DNA浓度,Ip为电信号值)。根据3δ法,计算出最佳检测限为5.677×10-13mol/L(n=5)。与其他现有传感器相比较,本传感器具有灵敏度高、检测范围宽、检出限低的优点(如表2所示)。

表2 其他传感器的检测范围和检出限的比较
2.4 传感器的特异性
图13为所制备的传感器分别与相同浓度的膀胱癌目标DNA、弓形虫DNA以及化脓单杆胞菌DNA杂交后的电信号变化对比图。从图13可以明显看出,当探针与目标DNA杂交时,其DPV电信号变化值最大,这进一步表明所制备的探针对于膀胱癌DNA的检测具有良好的特异性。
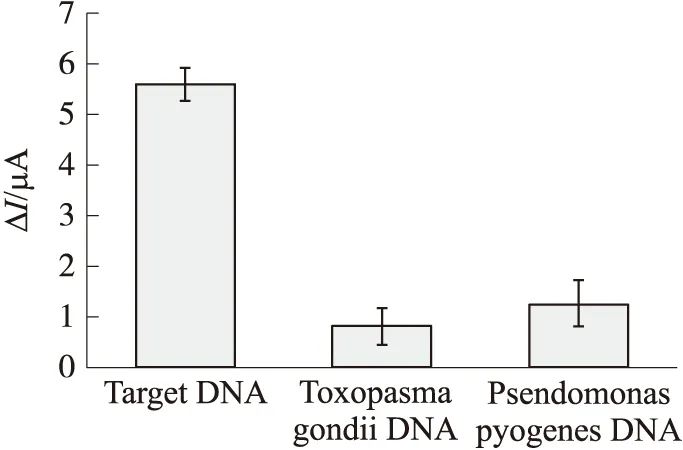
DNA杂交溶液浓度均为10 μmol/L图13 电化学DNA传感器与不同菌种和细胞DNA杂交的DPV信号比较图
2.5 传感器的稳定性与重现性
将所制备的传感器在0.1 mol/L的PBS缓冲液中利用循环伏安法扫描10圈后,氧化峰与还原峰的峰值电流没有发生明显改变。此传感器储藏于4 ℃的冰箱中一个星期后,峰值电流仍未发生明显改变,由此可知,本研究所制备的传感器有很高的稳定性。
在相同的条件下依照上述方法制备了5个传感器,分别检测浓度为0.1 μmol/L的互补目标DNA。检测发现,5个传感器的还原峰电流的平均值为-12.234 3 μA,相对标准偏差为7.22%。由此可知,所制备的探针有良好的重现性。
3 结论
本实验利用NaOH溶液活化玻碳电极表面,使其被大量羧基修饰,在EDC/NHS的作用下将一端用氨基标记的单链DNA探针在表面进行固定,设计了一种新型DNA生物传感器,以MB作为杂交指示剂对DNA的固定与杂交进行研究。结果表明该电化学传感器检测范围宽,检测限低,灵敏度高,具有良好的稳定性和重现性,并且操作简单,有望用于实际样品检测。
[1] Singh R,Mukherjee M D,Sumana G,et al. Biosensors for Pathogen Detection:A Smart Approach Towards Clinical Diagnosis[J]. Sensors and Actuators B:Chemical,2014,197(197):385-404.
[2] Heller A,Feldman B. Electrochemical Glucose Sensors and Their Applications in Diabetes Management[J]. Chemical Reviews,2008,108(42):2482-2505.
[3] Zhang H,Li F,Dever B,et al. DNA-Mediated Homogeneous Binding Assays for Nucleic Acids and Proteins[J]. Chemical Reviews,2012,113(4):2812-2841.
[4] Zhang D,Peng Y,Qi H,et al. Label-Free Electrochemical DNA Biosensor Array for Simultaneous Detection of the HIV-1 and HIV-2 Oligonucleotides Incorporating Different Hairpin-DNA Probes and Redox Indicator[J]. Biosensors and Bioelectronics,2010,25(5):1088-1094.
[5] Sassolas A,Leca-Bouvier B D,Blum L J. DNA Biosensors and Microarrays[J]. Chemical reviews,2008,108(1):109-139.
[6] Fan H,Xu Y,Chang Z,et al. A Non-Immobilizing Electrochemical DNA Sensing Strategy with Homogenous Hybridization Based on the Host-Guest Recognition Technique[J]. Biosensors and Bioelectronics,2011,26(5):2655-2659.
[7] Heller A,Feldman B. Electrochemical Glucose Sensors and Their Applications in Diabetes Management[J]. Chemical Reviews,2008,108(42):2482-2505.
[8] 张乐华,张华阳,李冲,等. 普鲁士蓝/PDDA-石墨烯复合膜修饰电极的制备及应用于过氧化氢无酶传感器[J]. 传感技术学报,2014,27(4):438-445.
[9] Jin Y,Yao X,Liu Q,et al. Hairpin DNA Probe Based Electrochemical Biosensor Using Methylene Blue as Hybridization Indicator[J]. Biosensors and Bioelectronics,2007,22(6):1126-1130.
[10] Pandey C M,Singh R,Sumana G,et al. Electrochemical Genosensor Based on Modified Octadecanethiol Self-Assembled Monolayer for Escherichia Coli Detection[J]. Sensors and Actuators B:Chemical,2011,151(2):333-340.
[11] Pan H Z,Yu H W,Wang N,et al. Electrochemical DNA Biosensor Based on a Glassy Carbon Electrode Modified with Gold Nanoparticles and Graphene for Sensitive Determination of Klebsiella Pneumoniae Carbapenemase[J]. Journal of Biotechnology,2015,214:133-138.
[12] Zhao Q L,Lei B,Luo Q Y,et al. Surface Manipulation for Improving the Sensitivity and Selectivity of Glassy Carbon Electrodes by Electrochemical Treatment[J]. Biosensors and Bioelectronics,2009,24(10):3003-3007.
[13] Thiagarajan S,Tsai T H,Chen S M. Easy Modification of Glassy Carbon Electrode for Simultaneous Determination of Ascorbic Acid,Dopamine and Uric Acid[J]. Biosensors and Bioelectronics,2009,24(8):2712-2715.
[14] Temoçin Z. Modification of Glassy Carbon Electrode in Basic Medium by Electrochemical Treatment for Simultaneous Determina-tion of Dopamine,Ascorbic Acid and Uric Acid[J]. Sensors and Actuators B:Chemical,2013,176(6):796-802.
[15] Zhao Q L,Zhang Z L,Bao L,et al. Surface Structure-Related Electrochemical Behaviors of Glassy Carbon Electrodes[J]. Electrochemistry Communications,2008,10(2):181-185.
[16] 王月生,钟惟德. 现代膀胱癌发病因素的流行病学分析[J]. 现代泌尿生殖肿瘤杂志,2011,(2):363-367.
[17] 韩苏军,张思维,陈万青,等. 中国膀胱癌死亡现状及流行趋势分析[J]. 现代泌尿外科杂志,2013,18(3):228-232.
[18] García-González R,Costa-García A,Fernández-Abedul M T. Methylene Blue Covalently Attached to Single Stranded DNA as Electroactive Label for Potential Bioassays[J]. Sensors and Actuators B:Chemical,2014,191(2):784-790.
[19] Gao H,Qi X,Chen Y,et al. Electrochemical Deoxyribonucleic Acid Biosensor Based on the Self-Assembly Film with Nanogold Decorated on Ionic Liquid Modified Carbon Paste Electrode[J]. Analytica Chimica Acta,2011,704(1-2):133-138.
[20] Thiagarajan S,Tsungsuan T,Chen S m. Easy Modification of Glassy Carbon Electrode for Simultaneous Determination of Ascorbic Acid,Dopamine and Uric Acid[J]. Biosensors and Bioelectronics,2009,24(8):2712-2715.
[21] Li N,Guo L,Jiang J,et al. Interaction of Echinomycin with Guanine:Electrochemistry and Spectroscopy Studies[J]. Biophysical Chemistry,2004,111(111):259-265.
[22] Li Q,Cui C,Higgins D A,et al. Fluorescence Quenching Studies of Potential-Dependent DNA Reorientation Dynamics at Glassy Carbon Electrode Surfaces[J]. Journal of the American Chemical Society,2012,134(35):14467-14475.
[23] Laviron E. General Expression of the Linear Potential Sweep Voltammogram in the Case of Diffusionless Electrochemical Systems[J]. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry,1979,101(1):19-28.
[24] Nordin N,Yusof N A,Abdullah J,et al. Sensitive Detection of Multiple Pathogens Using a Single DNA Probe[J]. Biosensors and Bioelectronics,2016,86:398-405.
[25] Hajihosseini S,Nasirizadeh N,Hejazi S M,et al. A Sensitive DNA Biosensor Fabricated from Gold Nanoparticles and Graphene Oxide on a Glassy Carbon Electrode[J]. Materials Science and Engineering:C,2016,61:506-515.
[26] Ndangili P M,Olowu R A,Mailu S N,et al. Impedimetric Response of a Label-Free Genosensor Prepared on a 3-Mercaptopropionic Acid Capped Gallium Selenide Nanocrystal Modified Gold Electrode[J]. International Journal of Electrochemical Science,2011,6(5):1438-1453.
[27] Miao X,Guo X,Xiao Z,et al. Electrochemical Molecular Beacon Biosensor for Sequence-Specific Recognition of Double-Stranded DNA[J]. Biosensors and Bioelectronics,2014,59(13):54-57.

张忆一(1992-),女,汉族,天津工业大学环境与化学工程学院硕士研究生,主要研究方向为电化学生物传感器的制备,zhangyiyi711@163.com;

许世超(1975-),男,汉族,天津工业大学环境与化学工程学院党委书记,副教授,博士,主要研究方向为电化学传感器,纳米材料的合成,光催化等,xushichao@tjpu.edu.cn。
A Sensitive Electrochemical Biosensor Based on NaOH Etched Glassy Carbon Electrode for Detection of Bladder Cancer DNA*
ZHANGYiyi1,XUShichao1,2,3*,WENJunnan1,DONGKai1
(1.School of Environmental and Chemical Engineering,Tianjin Polytechnic University,Tianjin 300387,China;2.State Key Laboratory of Separation Membranes and Membrane Processes,Tianjin Polytechnic University,Tianjin 300387,China;3.TianJin Engineering Center for Safety Evaluation of Water Quality and Safeguards Technology,Tianjin Polytechnic University,Tianjin 300387,China)
In this paper,a novel and sensitive electrochemical DNA biosensor based on activated glassy carbon electrode(GCE)for detection of bladder cancer DNA. GCE was activated by etching in NaOH solution by cyclic voltammetry(CV)for providing the electrode surface with abundant functional groups for DNA attachment,the average surface concentration of carboxyl groups on electrode surface is about 1.022×10-6mol/cm2(Laviron’s equations). Methylene blue(MB)was used as hybridization indicator for electrochemical detection. Atomic force microscope(AFM)analysis was employed for the morphological performance of activated electrode surface. Under the optimal hybridization conditions,differential pulse voltammetry(DPV)responses of the biosensor were in linear with the target DNA in the concentration range from 1×10-12mol/L to 1×10-8mol/L with the detection limit as 5.677×10-13mol/L(3δ). This sensor will be promising for the fast detection of bladder cancer DNA in real sample.
electrochemical DNA biosensor;activated glassy carbon electrode;differential pulse voltammetry;methylene blue
项目来源:天津市自然科学基金(11JCZDJC22300;13JCQNJC02600);天津市外国专家局引智项目(Y2012061)
2016-08-22 修改日期:2016-11-23
TP212.3
A
1004-1699(2017)03-0353-07
C:7230J
10.3969/j.issn.1004-1699.2017.03.004
