光谱法研究泮托拉唑钠与牛血清白蛋白的相互作用
2017-04-12成飞翔
刘 里, 成飞翔
(曲靖师范学院化学与环境科学学院, 曲靖 655011)
光谱法研究泮托拉唑钠与牛血清白蛋白的相互作用
刘 里*, 成飞翔
(曲靖师范学院化学与环境科学学院, 曲靖 655011)
在优化的实验条件下,运用荧光光谱法和紫外光谱法研究牛血清白蛋白(BSA)与泮托拉唑钠(PS)的结合作用. 研究表明:PS对BSA的荧光有猝灭作用,属于静态猝灭. BSA能运载PS,是一个自发过程,其作用力类型主要为氢键和范德华力. BSA 的亚螺旋域ⅢA是主要结合位置,离酪氨酸残基更近,有正协同作用. PS对BSA构象产生影响,使BSA腔内疏水环境的极性减弱. 该研究对揭示药物动力学问题及后续抗菌类药物的研发提供了理论依据.
泮托拉唑钠; 荧光猝灭; 相互作用
泮托拉唑钠(Pantoprazole Sodium,简称PS)是一种抗酸及抗溃疡病的高效、低毒的治疗肠胃疾病的新药[1]. 因结构上和人血清白蛋白的相似性,牛血清白蛋白(简称BSA)被广泛运用于与药物结合作用的研究[2]. BSA是一种在血浆中具有丰富含量的蛋白质,在人体中传递脂肪酸. 药物及其他代谢产物方面起主要作用[3]. 因此,许多研究人员已经对血清白蛋白的性质和结构开展了研究.它与其它分子和配体的相互作用和结合性能已被深入探讨[2-4]. BSA由582种氨基酸组成,具有与人血清白蛋白(HSA)76%的相似性.
小分子与蛋白质的结合在生物学和化学领域仍然是一个重要的研究课题. 用吸收光谱和荧光光谱法研究药物与BSA的相互作用的研究已有报道[2-4], 但还没有BSA-PS体系的报道. 因此,研究泮托拉唑钠与BSA的结合性质,探讨泮托拉唑钠对蛋白质生物特性的影响,为研究其药物作用机制、药物副作用及药物分子设计提供了一些重要信息,对抗菌类药物的临床医学研究也产生重要意义.
1 实验部分
1.1 仪器与试剂
吸收和荧光光谱分别用F-4600型荧光光谱仪(日本日立公司)和Cary 50型紫外-可见光谱仪(美国瓦里安技术中国有限公司)测定.
牛血清白蛋白(质量分数98%,上海阿拉丁生化科技股份有限公司),泮托拉唑钠(质量分数98%,百灵威科技有限公司),其余试剂均为分析纯,实验用水为超纯水.
1.2 试验方法
室温条件下,扫描220~550 nm BSA-PS的吸收光谱. 对于荧光的测量,在不同温度下(281.15、296.15、311.15K)BSA-PS体系在280 nm激发,从300~585 nm之间扫描荧光光谱.I0和I分别代表无荧光猝灭剂和有猝灭剂时的荧光强度,ΔI=I0-I. 对于同步荧光光谱,进行了2种不同模式的测量,即Δ分别为15、60 nm,扫描BSA-PS体系在295~360 nm的光谱.
2 结果与讨论
2.1 荧光光谱
由于BSA中存在酪氨酸(Tyr)残基、色氨酸(Trp)残基等氨基酸残基,因此具有荧光,最大吸收波长/最大发射波长(ex/em)在280 nm/340 nm处(图1),当PS加入到BSA之后,虽然ex/em几乎未发生变化,但是其荧光强度明显随着PS浓度的增加而逐渐减弱,表明PS能猝灭BSA的荧光,PS与BSA存在着相互作用.

(1~12: (0, 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0, 5.5, 6.0, 6.5)×10-6mol/L)
图1 PS的荧光光谱
Figure 1 Fluorescence spectra of PS
2.2 实验条件对光谱性质的影响
2.2.1 pH对光谱性质的影响 考查了不同缓冲溶液对BSA-PS光谱性质的影响(图2). 发现使用Tris-HCl缓冲溶液效果最佳. 在其缓冲范围内(图3),pH 7.4时,0.015 mol/L Tris-HCl荧光强度最大. 所以在后面的实验中都使用0.015 mol/L Tris-HCl (pH 7.4)作为研究PS与BSA相互作用的反应介质.

图2 不同缓冲溶液对荧光强度的影响
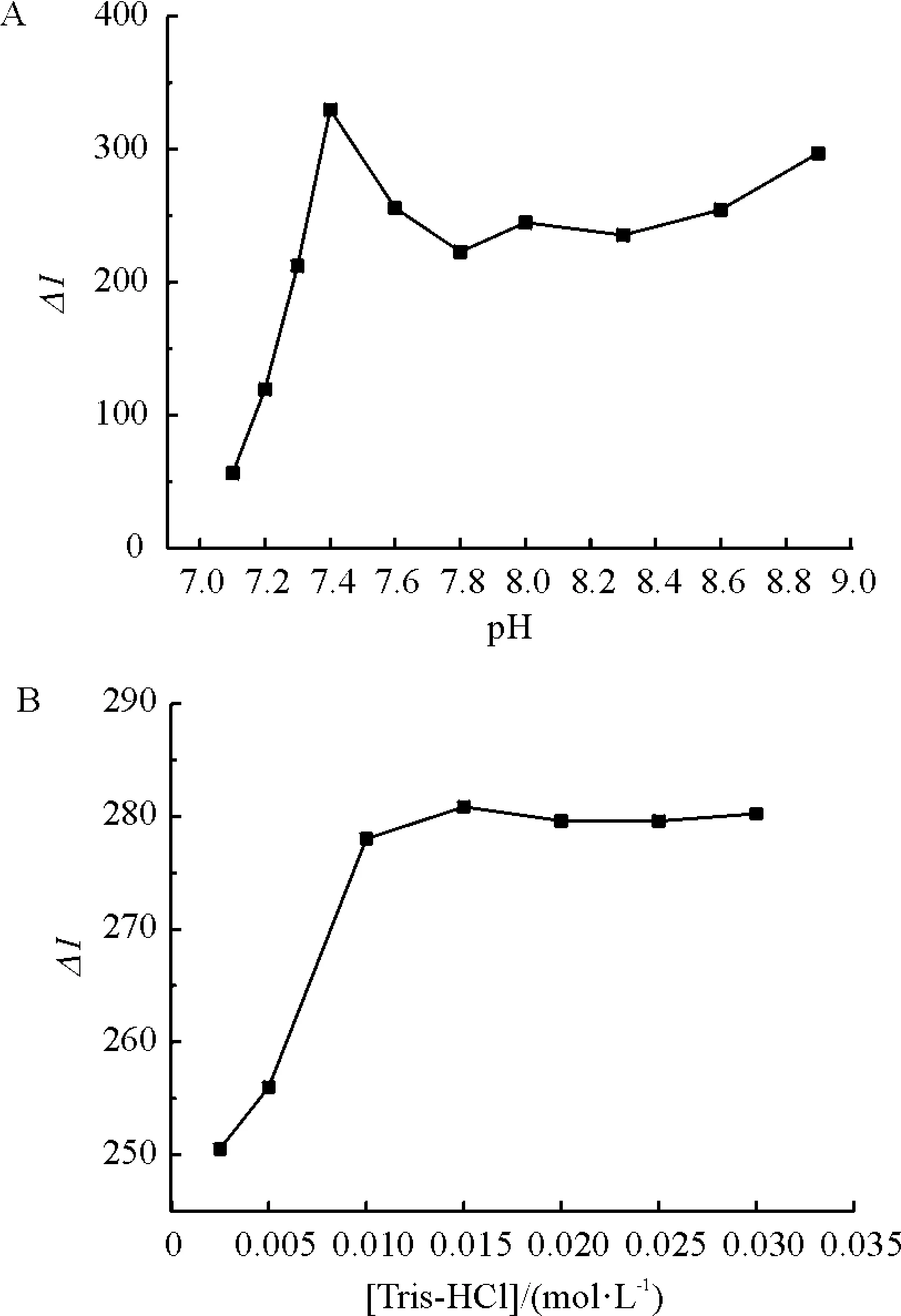
图3 pH(A)及缓冲溶液浓度(B)对荧光强度的影响
Figure 3 Effect of pH value (A) and buffer concentration (B) on fluorescence intensity
2.2.2 BSA浓度对光谱性质的影响 BSA的浓度从2.0×10-7mol/L增加到4.0×10-7mol/L,荧光强度也随着增加(图4). 当BSA浓度高于4.0×10-7mol/L时,荧光强度不再增加,最终选择4.0×10-7mol/L BSA作为反应的最佳浓度.

图4 BSA浓度对荧光强度的影响
Figure 4 Effect of concentrations of BSA on fluorescence intensity
2.2.3 试剂加入顺序和孵育时间对荧光强度的影响 在281.15 K温度下,考察了加入顺序对体系荧光强度的影响(图5A),结果表明最佳的加入顺序为PS→BSA→NaCl→Tris-HCl. 考察孵育时间对体系荧光性能的影响(图5B),结果表明0~40 min荧光强度大幅度增加,40~210 min荧光强度基本不变,选择40 min为最佳孵育时间.

图5 试剂加入顺序(A)和孵育时间(B)对荧光强度的影响
Figure 5 Effect of addition sequence of reagents (A) and incubation time (B)on fluorescence intensity
2.3 PS与BSA的作用机理探讨
2.3.1 猝灭机理 荧光猝灭是指荧光强度的降低,可以用来衡量大分子和配体之间的亲和力. 荧光猝灭是由各种猝灭分子与荧光团发生分子相互作用,引起荧光团的荧光量子产率的降低,如激发态反应、分子重排、形成基态复合物、能量传递和碰撞猝灭. 荧光猝灭如果是动态的,发生荧光团和猝灭剂之间的碰撞猝灭;如果是静态的,荧光团和猝灭剂形成基态复合物[5-7]. 温度或粘度相关的实验可以用来判断猝灭机制. 荧光强度和猝灭剂的浓度之间的关系和猝灭机理常用Stern-Volmer方程来描述[5-7]. 公式表述为I0/I=1+Kqτ0[PS]=1+Ksv[PS],式中[PS]为猝灭剂PS浓度,Ksv为Stern-Volmer常数,Kq为速率常数;τ0为荧光寿命,10-8s数量级左右[5-7];在281.15、296.15、311.15 K条件下的Ksv列在表1中. 结果表明,3个温度下的Kq值比最大动态猝灭速率常数2.0×1010L/(mol·s)大2个数量级[5-7],与动态猝灭机理相违背. 由图6可知,随着温度的升高,直线斜率即Ksv降低,与静态猝灭机理吻合.

图6 BSA与不同PS浓度的Stern-Volmer曲线
Figure 6 Stern-Volmer graph for BSA with varying concentration of PS at different temperatures

紫外吸收光谱也是区分猝灭机制的重要方法[7-9]. 由体系的紫外吸收光谱可知,PS-BSA体系的吸收峰从280 nm红移到286 nm,吸收强度增加,表明推断PS与BSA静态猝灭机理是合理的.

表1 不同温度下由Stern-Volmer 和Lineweaver-Burk方程得到的参数Table 1 The parameters obtained from Stern-Volmer and Lineweaver-Burk equations for BSA-PS system at different temperatures

图7 Lineweaver-Burk曲线
2.3.2 热力学常数和BSA与PS之间作用力类型的确定 小分子和大分子之间的相互作用力分为几种类型,即疏水作用力、静电相互作用、范德瓦尔斯相互作用和氢键等. 热力学常数,如焓变(ΔH)、熵变(ΔS)和自由能变化(ΔG)可根据范特霍夫方程计算求得[10-12]. 不同温度的BSA-PS的热力学参数总结在表2中. ΔG<0,ΔH<0且ΔS<0,表明BSA与PS的结合是自发进行的放热反应,作用力类型为氢键和范德华力.2.3.3 结合常数Kb以及结合位点数n到目前为止,许多研究报道了小分子结合在大分子如白蛋白的结合位点[3-5]. 本研究采用了双对数lg[(I0-I)/I]=lgKb+nlg[PS][7-9]求得药物小分子PS与BSA大分子的结合位点数n. 分别在281.15、296.15、311.15 K温度下,以lg(I0-I)/I对lg[PS]作双对数曲线,由直线的截距和斜率求出的n和Kb值列于表1中.n≈1,形成一个结合位点,随着温度增加,Kb和n值有略微减小,表明温度的增加,对血清白蛋白携带着PS在体内进行运转不利. 温度每升高15 ℃,Kb值减少2个数量级,PS-BSA越不稳定,表明通过温度的改变可以调控载药量.

表2 BSA-PS相互作用的热力学常数和nH值Table 2 The thermodynamic parameters and the value of nH of BSA-PS interactions at different temperatures
2.3.4 PS对BSA构象的影响 同步荧光光谱能提供发色团周围分子微环境变化的信息. 因此,同步荧光法被用来探究PS分子对BSA构象的影响. 激发和发射波长之间的差值Δ是重要的参数. 当Δ为15 nm,光谱显示酪氨酸(Tyr)残基的特征[13-15]. 当Δ为60 nm,光谱显示色氨酸(Trp)残基的特征. 由图8可知,随PS浓度的增大,Tyr和Trp的max均向长波移动,说明PS的加入改变了BSA的构象,使其疏水结构增大,引起肽链的伸展程度增大,导致BSA腔内疏水环境的极性增强,疏水性减弱[13-15]. Tyr的猝灭程度大于Trp,表明PS与BSA相结合的位点偏向于Tyr.2.3.5 可能的结合位置和药物协同作用 BSA 是由二硫键连接起来的3个螺旋状区域(Ⅰ-Ⅲ)所组成的[13-15],每个螺旋域又包含2个亚螺旋域A 和 B[12-15]. 由图9可知,ex=280 nm 和ex=295 nm 的PS-BSA光谱曲线没有重叠,表明色氨酸和酪氨酸残基都参与其中;ex=295 nm的荧光猝灭程度比ex=280 nm 的大,结合位置主要在亚螺旋域ⅢA中.
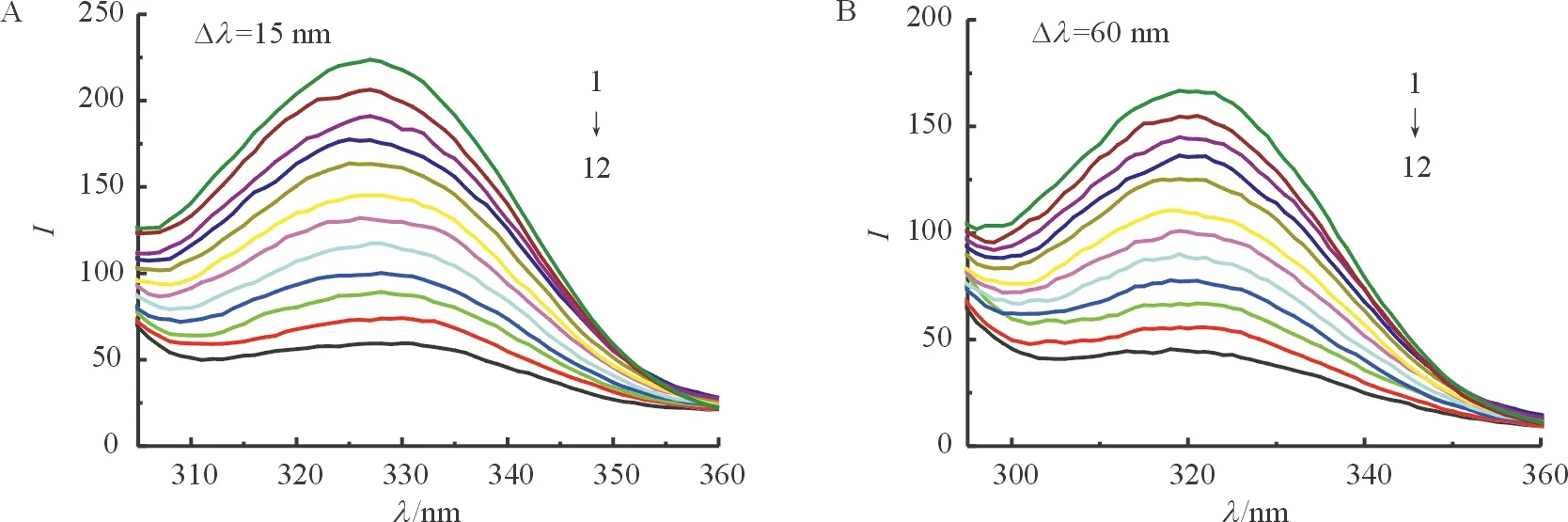
图8 酪氨酸残基(A)和色氨酸(B) 同步荧光光谱图
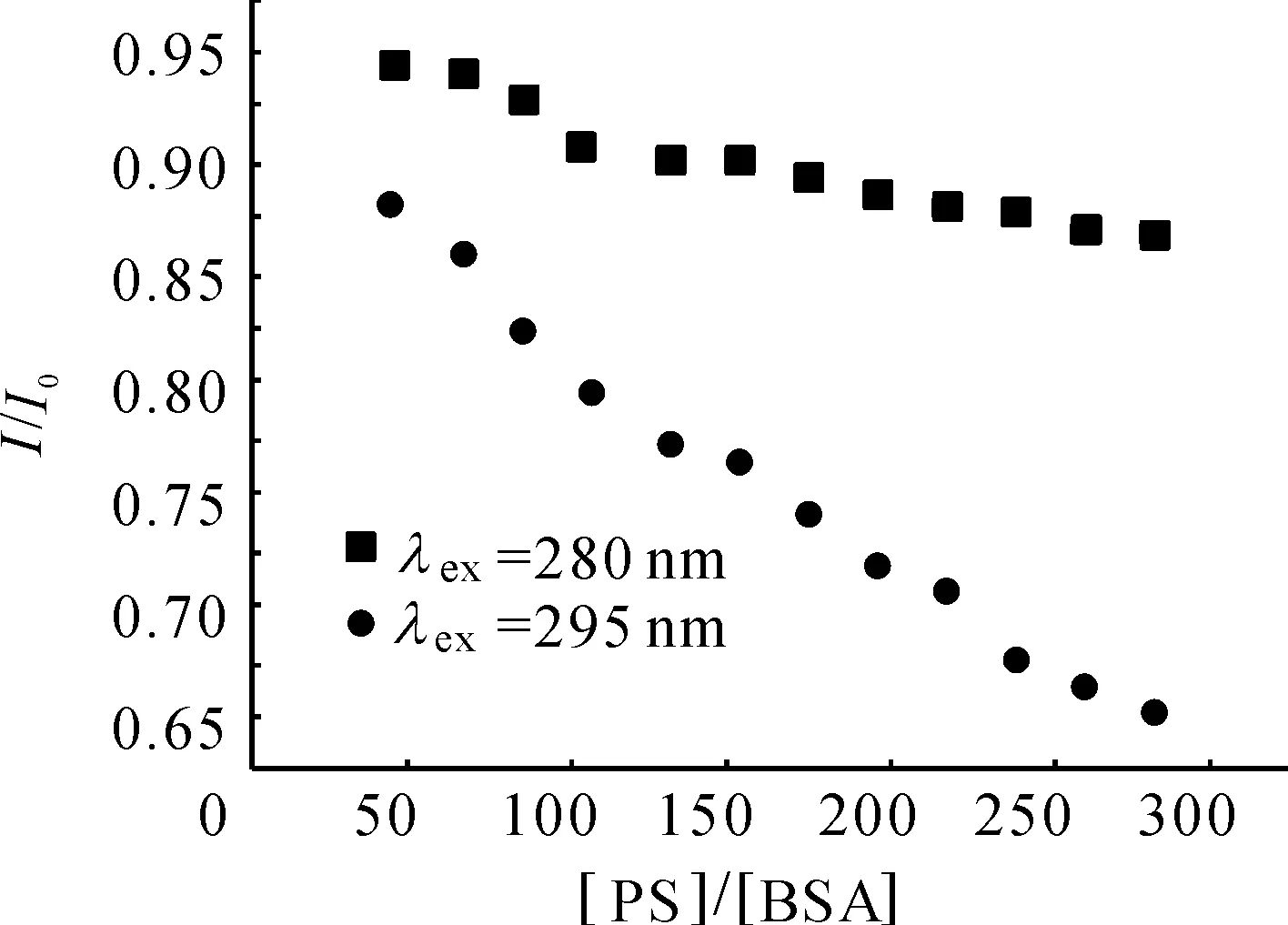
图9 ex为 280 nm 和 295 nm 时PS-BSA的荧光猝灭曲线
Figure 9 Fluorescence quenching curves of PS-BSA atex=280 and 295 nm
药物的协同作用常用Hill方程进行分析[13-15]:E=(I0-I)/I0,1/E对1/[PS]作图,截距为1/Em,lgE(Em-E)=lgK+nHlg[PS],式中,nH为Hill系数,K为结合常数,E为饱和分数. 由表2可知,各温度下的nH值都大于1,并随温度的增加nH值增大,表明PS分子之间呈现出正协同作用,即一个PS结合到BSA结合位点上后,会有利于后继药物分子与蛋白质的结合,温度越高,药物越容易结合到位点上. 当PS浓度的增加时,会引起后续PS与 BSA结合的亲和性增加.
3 结论
利用紫外-可见和荧光光谱法研究了BSA与PS的相互作用. 光谱数据表明PS的加入后BSA的荧光被猝灭,PS与BSA形成基态复合物,猝灭机理为静态猝灭在BSA与PS结合过程中,氢键和范德华力发挥主要作用. 有一个结合位点,结合位置在BSA的亚螺旋域ⅢA中,靠近酪氨酸残基. 有药物正协同作用,PS对BSA构象产生影响. 这些重要信息为抗菌类胃肠药物的临床应用与新药的研发提供了重要依据.
[1] 邱珲,杨庆云,童元峰,等. 泮托拉唑钠单水合物与倍半水合物的晶型与稳定性差异研究[J]. 中国新药杂志,2015,24(8):869-873.
QIU H,YANG Q Y,TONG Y F,et al. Difference of crystal forms and stability between pantoprazole sodium monohydrate and sesquihydrate[J]. Chinese Journal of New Drugs,2015,24(8):869-873.
[2] 刘里,成飞翔. 光谱法研究尼美舒利与牛血清白蛋白的相互作用[J]. 南京师大学报(自然科学版),2016,39(2):50-55.
LIU L,CHENG F X. Study on the interaction between nimesulide and bovine serum albumin by spectrometry[J]. Journal of Nanjing Normal University (Natural Science Edition),2016,39(2):50-55.
[3] 刘里,成飞翔. 光谱法研究安乃近与牛血清白蛋白的相互作用及共存金属离子的影响[J]. 四川农业大学学报,2015,33(4):429-434.
LIU L,CHENG F X. Spectrometric study of the interaction between analgin and bovine serum albumin and the effect of coexistent metal ions[J]. Journanl of Sichuan Agricultural University,2015,33(4):429-434.
[4] 黄发德,俞英,蒋雄. 钙羧酸指示剂与牛血清白蛋白作用的研究[J]. 华南师范大学学报(自然科学版),2001(1):88-92.
HUANG F D,YU Y,JIANG X. Thestudy on the reaction between calconcarboxylic acid and bovine serum albumin[J]. Journal of South China Normal University (Natural Science Edition),2001(1):88-92.
[5] BOGDAM S. Fluorescence study of sinapic acid interaction with bovine serum albumin and egg albumin[J]. Journal of Flurescence,2003,13(4):349-356.
[6] LAKOWICZ J R. Principles of fluorescence spectroscopy[M]. 3rd ed. New York:Springer Press,2006:285.
[7] 许金钩,王尊本. 荧光分析法[M]. 3版. 北京:科学出版社,2006:23-49.
XU J G,WANG Z B. Fluorimetry[M]. 3rd ed. Beijing,China:Science Press,2006:23-49.
[8] 俞英,周秋云. 马兜铃酸 A与牛血清白蛋白相互作用的研究[J]. 华南师范大学学报(自然科学版),2006(4):72-77.
YU Y,ZHOU Q Y. Study on the interaction between aristolochic acid A and serum albumin[J]. Journal of South China Normal University (Natural Science Edition),2006(4):72-77.
[9] 吴霖,俞英,唐敏妮,等. 碱性品红与牛血清白蛋白的相互作用及其应用[J]. 华南师范大学学报(自然科学版),2004(2):95-109.
WU L,YU Y,TANG M N,et al. Interaction of rosaniline with bovine serum ablumin and its analytical applications[J]. Journal of South China Normal University (Natural Science Edition),2004(2):95-109.
[10] 刘保生,杨超,王晶. 硫酸头孢匹罗与牛血清白蛋白结合反应的发光机理[J]. 发光学报,2011,32(3):293-295.
LIU B S,YANG C,WANG J,et al. Luminescence mechanism study of the conjugation reaction between cefpirome sulfate and bovine serum albumin[J]. Chinese Journal of Luminescence,2011,32(3):293-295.
[11]CYRIL L,EARL J K,SPERRY W M. Biochemists handbook[M]. London:Epon Led Press,1961:84.
[12]ROSS D P,SUBRAMANTAN S. Thermodynamics of protein association reactions:forcrs cont ributing to stability[J]. Biochemstry,1981,20(11):3096 -3102.
[13]SULKOWSKA A,MACIAZEK-JURCZYK M,BOJKO B,et al. Competitive binding of phenylbutazone and colchicine to serum albumin in multidrug therapy[J]. Journal of Molecular Structure,2008,881(1):97-106.
[14]MACIAZEK-JURCZYK M,SULKOWSKA A,BOJKO B,et al. Fluorescence analysis of competition of phenylbutazone and methotrexate in binding to serum albumin in combination treatment in rheumatology[J]. Journal of Molecular Structure,2009,924/925/926:378-384.
[15]XU H,GAO S L,LV J B,et al. Spectroscopic investigations on the mechanism of interaction of crystal violet with bovine serum albumin[J]. Journal of Molecular Structure,2009,919(1):334-338.
【中文责编:成文 英文审校:李海航】
Study on the Interaction between Pantoprazole Sodium and Bovine Serum Albumin by Spectrometry
LIU Li*, CHENG Feixiang
(College of Chemistry and Environmental Science,Qujing Normal University, Qujing 655011, China)
Under the optimal conditions,the interaction of Pantoprazole Sodium(PS) with bovine serum albumin(BSA) was investigated by fluorescence spectrometry and ultraviolet-visible light absorption spectrometry. It showed that the fluorescence of BSA was quenched by PS, which was a static quenching process. BSA could transport PS. It was spontaneous and mainly driven by hydrogen bond and Vander Waals force. The primary binding site for PS was located at sub-domain ⅢA of BSA and near by tyrosine residue. There was some positive cooperative effect. The conjugation reaction would affect the conformation of BSA, leading to the polarity around BSA weakened. This test provided a theoretical basis for revealing the pharmacokinetics and further research on development of new antibacterial drugs.
Pantoprazole Sodium; fluorescence quenching; interaction
2015-09-28 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
国家自然科学基金项目(21261019);云南省教育厅科学研究基金项目(2015C090Y)
O657.3
A
1000-5463(2017)01-0074-06
*通讯作者:刘里,讲师, Email:m18908746298@163.com.
