授粉后红球姜雌性生殖器官qRT-PCR的内参基因筛选
2017-04-12林浩川钟春梅孙姝兰
林浩川, 钟春梅, 孙姝兰
(华南师范大学生命科学学院,广东省植物发育与生物工程重点实验室,广州 510631)
授粉后红球姜雌性生殖器官qRT-PCR的内参基因筛选
林浩川, 钟春梅, 孙姝兰*
(华南师范大学生命科学学院,广东省植物发育与生物工程重点实验室,广州 510631)
根据授粉后不同时间点的红球姜转录组数据库以及相关文献报道的传统内参基因,筛选出10个表达相对稳定的基因Actin-2(ACT2)、Actin-7(ACT7)、Betatubulin-1(TUB1)、Betatubulin-5(TUB5)、Alphatubulin-3(TUA3)、Ubiquitin(UBQ)、Glyceraldehyde-3-phosphatedehydrogenase(GAPDH)、Elongationfactor1-alpha(EF-1α)、Cyclophilin(CYP)、Histone(H2A)作为候选内参基因,采用qRT-PCR技术,结合GeNorm、NormFinder和BestKeeper软件对候选内参基因的表达稳定性进行分析. 结果表明,在红球姜雌性生殖器官授粉后的发育过程中,GAPDH和UBQ的表达稳定性最好,均适合作为内参基因,同时使用2种作为内参基因能使实时荧光定量PCR标准化分析结果更精确. 因此,最终选择GAPDH和UBQ作为实时荧光定量PCR标准化分析红球姜雌性生殖器官相关基因表达的内参基因. 该研究将为探究红球姜败育的分子机理奠定基础,也为近源姜属植物内参基因的筛选提供线索.
红球姜; 内参基因; qRT-PCR; GeNorm; NormFinder; BestKeeper
红球姜(Zingiberzerumet(L.) Smith)是一种良好的新型切花和药用材料,具有极高的经济价值[1]. 笔者的前期研究发现,虽然其大、小孢子发育正常,但存在败育现象,极大影响红球姜的发展前景. 目前,姜属植物的研究主要集中在形态解剖、药用价值等方面[1],有关红球姜败育的分子机理尚不清楚. 实时荧光定量PCR(quantitative Real-time PCR, qRT-PCR)技术因其具有灵敏度高、重复性好等优点,常用于基因表达分析[2],但其结果的准确性依赖于标准化分析的内参基因[3]. 应用qRT-PCR技术分析红球姜败育相关基因的表达模式,有助于阐明其败育的分子机制. 然而,目前尚未见任何姜科相关内参基因筛选的报道. 在植物学研究中,一些表达相对稳定的管家基因常被选为内参基因,如肌动蛋白基因(Actin)[4]、微管蛋白基因(Tubulin)[5]等,然而研究表明,管家基因在不同植物或不同实验条件中的表达水平并非持续稳定[6],即使是近源种间,相同的管家基因也存在表达差异[7]. 因此,筛选适用于授粉后不同发育时期的红球姜雌性生殖器官实时荧光定量PCR标准化分析的内参基因是极其必要的.
转录组测序(Transcriptome Sequence)可以从整体上反映基因表达水平,有助于研究基因组信息未知的非模式物种[8]. 基于转录组测序的qRT-PCR内参基因筛选是目前一种新的有效方法,SANG等[9]通过该方法筛选出适用于不同重金属胁迫下东南景天的内参基因;CHANG等[10]也通过该方法筛选出1对可用于侧柏不同组织的内参基因;该方法同样成功应用于动物[11],真菌[12]等非模式物种内参基因的筛选中.
本研究根据授粉后不同时间点的红球姜转录组以及相关文献报道的传统内参基因,筛选出10个表达相对稳定的基因Actin-2(ACT2)、Actin-7(ACT7)、Betatubulin-1(TUB1)、Betatubulin-5(TUB5)、Alphatubulin-3(TUA3)、Ubiquitin(UBQ)、Glyceraldehyde-3-phosphatedehydrogenase(GAPDH)、Elongationfactor1-alpha(EF-1α)、Cyclophilin(CYP)、Histone(H2A)作为候选内参基因,采用qRT-PCR技术,结合GeNorm[13]、NormFinder[14]和BestKeeper[15]3种常用统计学程序分析候选内参基因的表达稳定性,筛选出可用于实时荧光定量PCR标准化分析红球姜雌性生殖器官相关基因表达的内参基因,为探究红球姜败育的分子机理奠定基础.
1 材料与方法
1.1 材料与处理
以红球姜姜花为实验材料,采样地为广东省惠州市博罗县酥醪村罗浮山系. 开花前一天套袋以防止访花动物的干扰,开花后当柱头处于授粉期时进行异花授粉,于授粉后0、2、4、6、8、10、12、18、24 h取下整朵姜花,分离出雌性生殖器官(花柱和子房),液氮速冻后置于-80 ℃冰箱保存. 共9个样品,每个样品设3个生物学重复.
1.2 总RNA提取和cDNA第一链合成
冻存样品经液氮研磨后,使用华越洋超快型植物RNA提取试剂盒(华越洋生物科技有限公司,0416-50)提取总RNA. 利用质量分数1%琼脂糖凝胶电泳检测总RNA的完整性,并用NanoDrop 2000c(Quawell,美国)检测总RNA的纯度和浓度. 使用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(Takara,RR047A)反转录合成cDNA第一链,置于-20℃冰箱保存. 反应体系:模板RNA 800 ng;5×PrimeScript©Buffer (for Real-time) 4 μL;PrimScript©RT Enzyme Mix I 1 μL;RT Primer Mix 1 μL;5×gDNA Eraser Buffer 2 μL;gDNA Eraser 1 μL;用RNase Free dH2O补至20 μL体系. 反应程序:37 ℃ 15 min,85 ℃ 5 s.
1.3 候选内参基因的筛选和引物设计
根据本实验室前期获得的授粉后不同时间点的红球姜转录组数据,计算各基因表达量的平均值(Mean)、标准差(Standard Deviation, SD)和变异系数(Coefficient of Variation, CV),结合常用内参基因[16],筛选出10个表达相对稳定的ACT2、ACT7、TUB1、TUB5、TUA3、UBQ、GAPDH、EF-1α、CYP、H2A基因作为候选内参基因. 使用Primer Premier 5.0软件设计特异性引物(表1). 所有引物均由生工生物工程(上海)股份有限公司合成.
1.4 qRT-PCR反应
qRT-PCR反应在ABI PRISM©7500 PCR仪(Thermo,美国)上进行. 反应体系:cDNA模板2 μL (20×);SYBR©Premix Ex TaqTM(2×) 10 μL;ROX Reference Dye II 0.4 μL;Forward primer 0.4 μL;Reverse primer 0.4 μL;用Nuclease-free water补至20 μL体系. 每个样品设3个重复. 反应程序:预变性95 ℃ 30 s;40个循环,95 ℃ 5 s,60 ℃ 34 s. 反应结束后进行溶解曲线分析扩增产物特异性.
1.5 绘制标准曲线及计算基因扩增效率
取9个样品的cDNA模板等量混合,依次稀释5个梯度,每个梯度稀释5倍,即模板浓度分别为初始浓度的50、5-1、5-2、5-3、5-4倍. 通过qRT-PCR反应,获得候选内参基因在不同模板浓度下的CT值. 以模板的log值为横坐标,以CT值为纵坐标绘制标准曲线,得到斜率k和相关系数R2. 通过公式E=(5-1/slope-1)×100%,计算出扩增效率E.
1.6 数据分析
采用Excel 2007对得到的CT值进行整理,并通过3种常用的统计学程序GeNorm、NormFinder和BestKeeper对候选内参基因进行基因表达稳定性分析,筛选出适用于授粉后不同发育时期的红球姜雌性生殖器官qRT-PCR的内参基因. GeNorm和NormFinder需要先将CT值转换为相对表达量,而BestKeeper可直接使用原始CT值.
2 结果与分析
2.1 样品总RNA的质量检测
选取授粉后不同时间点的红球姜雌性生殖器官提取总RNA,经质量分数1%琼脂糖凝胶电泳检测,结果显示,RNA电泳条带清晰明亮,无可见的DNA污染(图1). NanoDrop 2000c(Quawell,美国)检测结果显示,OD260/OD280为1.8~2.1,OD260/OD230为1.9~2.2,表明RNA样品完整性较好,纯度较高,可进行后续实验.
2.2 引物扩增效率和扩增特异性分析
利用10个候选内参基因引物,分别对5个浓度梯度(5倍稀释)的cDNA模板进行qRT-PCR扩增,根据获得的数据绘制候选内参基因的标准曲线. 结果显示,所有候选内参基因的相关系数R2>0.990,且扩增效率在95.71%~108.63%之间(表1),表明cDNA模板量与相应的CT值具有良好的线性关系,符合qRT-PCR对引物扩增效率的要求,确保实验结果的可靠性. 同时,溶解曲线分析结果表明,10个候选内参基因都有明显的单一信号峰,且同一样品重复性良好(图2),表明所使用的引物特异性好,反应的专一性高,结果准确可靠,可进行后续实验.
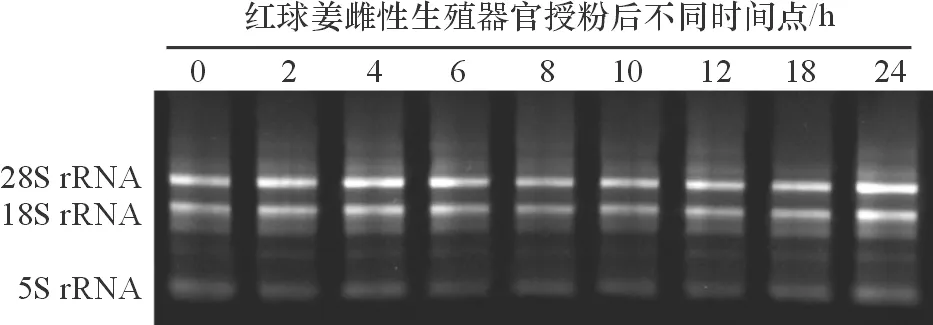
图1 红球姜雌性生殖器官授粉后不同发育时期样品总RNA的琼脂糖凝胶电泳图谱
Figure 1 Agarose gel electrophoresis of total RNA from pollinatedZingiberzerumet(L.) Smith female reproductive organ at different development stages
表1 红球姜候选内参基因qRT-PCR的引物序列和扩增参数
Table 1 Primer sequences and amplification parameter for candidate reference genes ofZingiberzerumet(L.) Smith derived from qRT-CPR
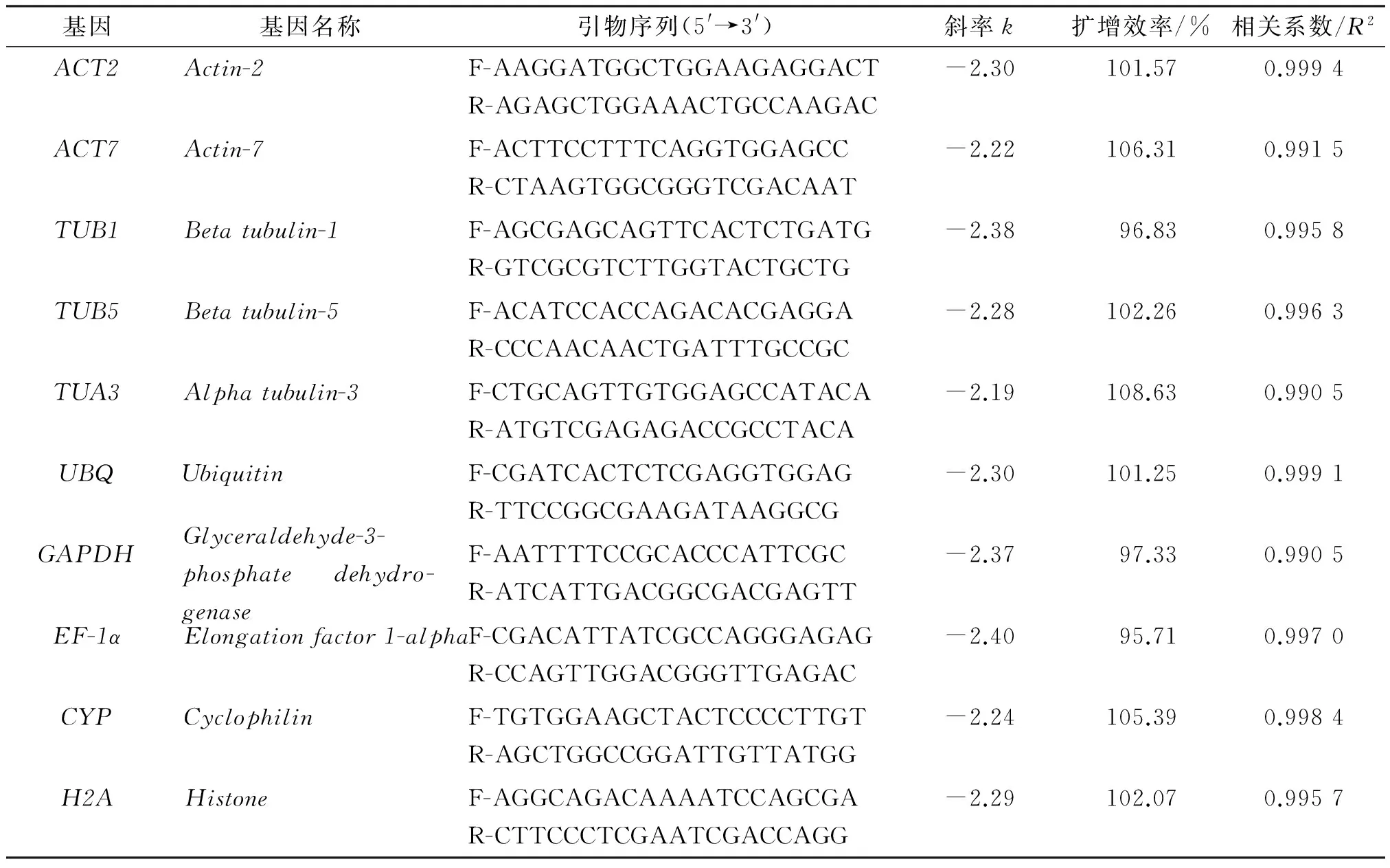
基因基因名称引物序列(5'→3')斜率k扩增效率/%相关系数/R2ACT2Actin-2F-AAGGATGGCTGGAAGAGGACTR-AGAGCTGGAAACTGCCAAGAC-2.30101.570.9994ACT7Actin-7F-ACTTCCTTTCAGGTGGAGCCR-CTAAGTGGCGGGTCGACAAT-2.22106.310.9915TUB1Betatubulin-1F-AGCGAGCAGTTCACTCTGATGR-GTCGCGTCTTGGTACTGCTG-2.3896.830.9958TUB5Betatubulin-5F-ACATCCACCAGACACGAGGAR-CCCAACAACTGATTTGCCGC-2.28102.260.9963TUA3Alphatubulin-3F-CTGCAGTTGTGGAGCCATACAR-ATGTCGAGAGACCGCCTACA-2.19108.630.9905UBQUbiquitinF-CGATCACTCTCGAGGTGGAGR-TTCCGGCGAAGATAAGGCG-2.30101.250.9991GAPDHGlyceraldehyde-3-phosphatedehydro-genaseF-AATTTTCCGCACCCATTCGCR-ATCATTGACGGCGACGAGTT-2.3797.330.9905EF-1αElongationfactor1-alphaF-CGACATTATCGCCAGGGAGAGR-CCAGTTGGACGGGTTGAGAC-2.4095.710.9970CYPCyclophilinF-TGTGGAAGCTACTCCCCTTGTR-AGCTGGCCGGATTGTTATGG-2.24105.390.9984H2AHistoneF-AGGCAGACAAAATCCAGCGAR-CTTCCCTCGAATCGACCAGG-2.29102.070.9957
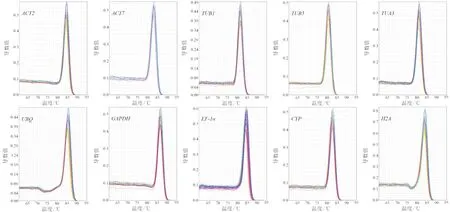
图2 10个候选内参基因的qRT-PCR溶解曲线
2.3 候选内参基因表达丰度分析
对10个候选内参基因在不同样品下的CT值进行汇总,评估这些基因的平均表达丰度(图3). 结果显示,所有候选内参基因CT值处于20~29之间,其中大部分处于20~26之间,表明表达丰度比较适中.GAPDH和UBQ的CT值最低,范围分别为20.18~22.85和20.63~22.58,表明这2个基因的表达丰度最高. 而TUB1的CT值最高,范围为25.26~28.79,表明其表达丰度最低.
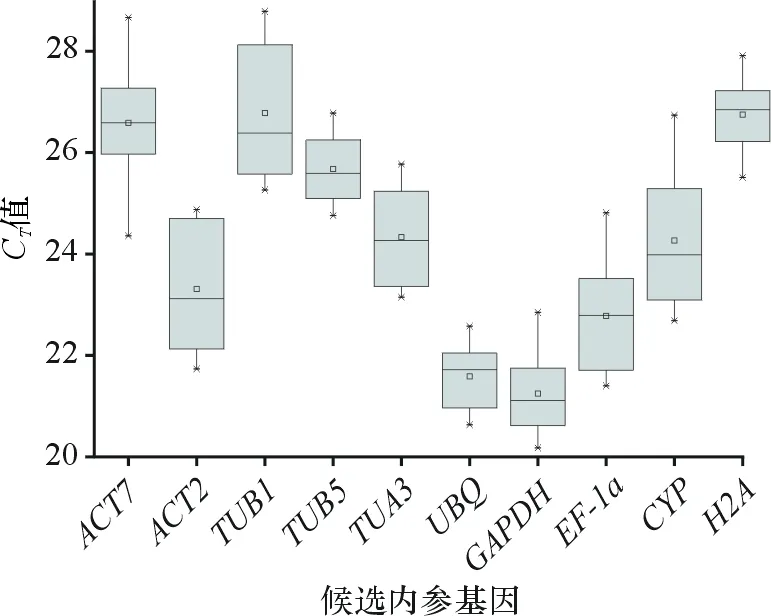
图3 10个候选内参基因的CT值分布
2.4 候选内参基因稳定性分析
采用3种常见但算法不同的统计学程序GeNorm、NormFinder和BestKeeper,分别对10个候选内参基因在授粉后不同发育时期的红球姜雌性生殖器官中的表达稳定性进行分析. 2.4.1 GeNorm分析 GeNorm通过计算候选内参基因在不同样品中的表达稳定值(Expression Stability Value,M)来量化候选基因的稳定性. GeNorm以1.5作为临界值,只有当M值小于1.5时,该候选基因才能作为内参基因使用,而且M值越小其表达稳定性越好. 分析结果显示,10个候选基因的M值均小于1.5,都可以作为内参基因使用. 按照M值由高到低排列依次为:ACT7>TUB5>TUB1>CYP>ACT2>TUA3>EF-1α>H2A>GAPDH=UBQ(图4),表明GAPDH和UBQ的表达最稳定,最适合作为内参基因使用. 其次为H2A和EF-1α.
此外,GeNorm还能通过计算配对变异值(Pairwise Variation Value)来确定理想内参基因的数目. 默认以0.15为临界值,当有n个候选内参基因时,若Vn/(n+1)<0.15,表明此时n个内参基因已满足准确校正目标基因表达量的要求,而无需使用更多的内参基因. 分析结果显示,V2/3<0.15(图4),因此内参基因的最适数目为2个,分别是GAPDH和UBQ.
2.4.2 NormFinder分析 NormFineder基于组内和组间基因表达的差异程度来排序,和GeNorm类似,候选基因的表达稳定性M值越小,表达越稳定. 分析结果显示,10个候选内参基因按照M值由高到低排列依次为:ACT7>TUB5>TUB1>CYP>ACT2>H2A>UBQ>TUA3>EF-1α>GAPDH(图5),表明GAPDH的表达最稳定,其次为EF-1α、TUA3和UBQ.

图4 GeNorm分析10个候选内参基因表达稳定性(A)和最佳内参基因数目(B)
Figure 4 Expression stability of ten candidate reference genes(A) and the optimal numbers of reference genes(B) analyzed by GeNorm
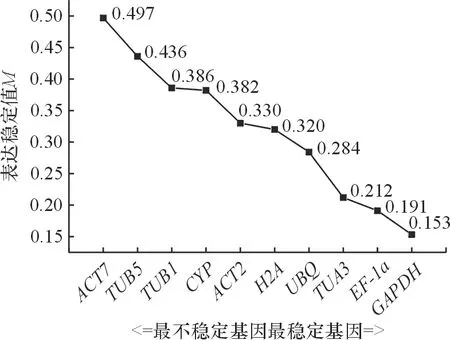
图5 NormFinder分析10个候选内参基因表达稳定性
Figure 5 Expression stability of ten candidate reference genes analyzed by NormFinder
2.4.3 BestKeeper分析 BestKeeper基于候选内参基因在不同样品中的CT值计算标准差(SD)和变异系数(CV),SD值越小,表达越稳定. 程序默认SD的临界值为1,当SD大于1时,表明该基因不适合作为内参基因使用. 分析结果显示,ACT2、CYP和TUB1的SD均大于1,表明这3个基因稳定性差,不适合作为内参基因使用.UQB的SD值最小,表达稳定性最好,其次为TUB5、H2A和GAPDH(表2).
综合上述3种程序的分析结果,GeNorm分析得出表达最稳定的基因组合是GAPDH和UBQ,而NormFinder和BestKeeper则分别为GAPDH和UBQ,可见对最适内参基因的分析结果都集中在GAPDH和UBQ.

表2 BestKeeper分析10个候选内参基因表达稳定性Table 2 Expression stability of ten candidate reference genes analyzed by BestKeeper
注:GM:几何平均数;AM:算数平均数;Min:最小值;Max:最大值;SD:标准差;CP:置信参数.
2.5 内参基因稳定性验证
分别使用GAPDH和UBQ作为内参基因,对与红球姜授粉后雌性生殖器官发育相关的A型细胞周期蛋白基因(A-typeCyclin-dependentKinase1,CDKA1)[17]的表达模式进行分析,验证这2个内参基因对qRT-PCR分析目的基因表达模式的影响. 结果显示,分别以GAPDH和UBQ作为内参基因时所得到的CDKA1的表达模式大致相同,CDKA1在授粉24 h后表达均显著上调(图6). 上述结果表明,GAPDH和UBQ适合作为授粉后不同发育时期的红球姜雌性生殖器官实时荧光定量PCR标准化分析的内参基因.
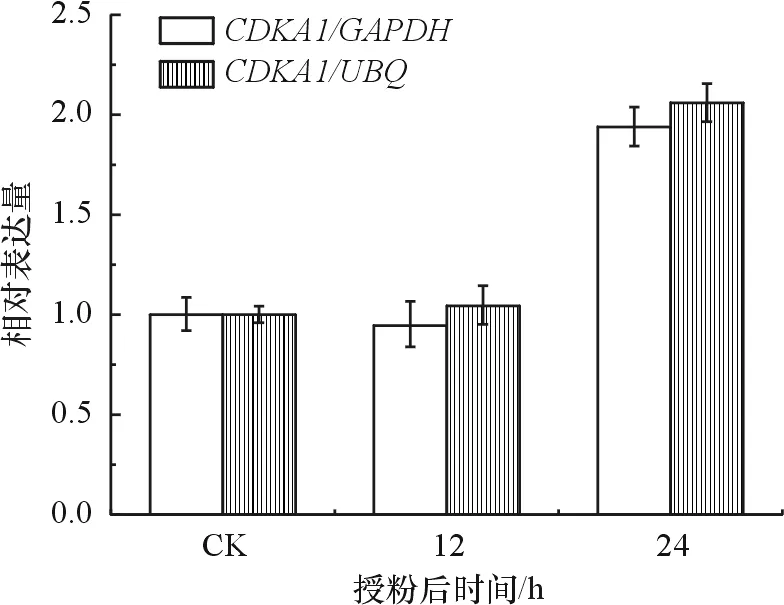
图6 分别以GAPDH和UBQ作为内参基因时CDKA1的表达模式分析
Figure 6 Expression pattern analysis ofCDKA1 usingGAPDHandUBQas internal controls
3 讨论
近年来,qRT-PCR技术已成为研究基因表达量的重要方法,由于常用的内参基因存在不稳定性[18],因此根据具体的实验条件筛选稳定合适的内参基因极为重要. 基于转录组测序的qRT-PCR内参基因筛选是一种新兴的研究方法,能为缺乏基因组信息的非模式物种内参基因的筛选提供线索.
本研究根据授粉后不同时间点的红球姜转录组数据库以及相关文献报道的传统内参基因,筛选出10个候选内参基因ACT2、ACT7、TUB1、TUB5、TUA3、UBQ、GAPDH、EF-1α、CYP、H2A,结合qRT-PCR技术和3种统计学程序GeNorm、NormFinder和BestKeeper对它们在授粉后红球姜雌性生殖器官中的表达稳定性进行了评价. 结果表明,3种程序得出的稳定性排序略有不同,这在黄瓜等植物内参基因的筛选研究中也曾出现,可能是由于程序的统计学算法不同所致[19-20]. 但从总体结果上看,排除差异显著的TUB5,3种程序得出表达稳定性较高的基因都是GAPDH、UBQ、H2A和EF-1α,表达稳定性较低的基因都是ACT7和TUB1. 其中,GeNorm分析得出表达最稳定的基因组合是GAPDH和UBQ,而NormFinder和BestKeeper则分别为GAPDH和UBQ,可见3种程序对最适内参基因的分析结果都集中在GAPDH和UBQ. 分别以GAPDH和UBQ作为内参基因时,CDKA1在授粉后不同发育时期的红球姜雌性生殖器官中的表达模式大致相同,进一步说明这2个候选基因适合作为该条件下的内参基因. 目前已有大量研究表明GAPDH和UBQ在植物发育的不同时期表达稳定,如ZHONG等[21]发现GAPDH在荔枝不同发育时期和不同实验条件下表达均较稳定;孙美莲等[22]也发现GAPDH在不同发育时期的叶片和愈伤组织中表达稳定;刘洪峰等[23]发现UBQ在牡丹不同发育时期的花瓣以及凤丹不同发育时期的种子中表达较稳定;王彦杰等[24]对牡丹内参基因的研究中,同样筛选出GAPDH和UBQ为最稳定的内参基因,上述报道均与本研究结果一致. 此外,GeNorm程序对10个候选基因的配对差异值进行计算,以0.15为临界值界定Vn/(n+1)的大小,最终确定本实验条件下的理想内参基因数目为2个,即GAPDH和UBQ. 许多研究者建议,在进行基因表达分析时,相较于使用单一内参基因校正目的基因的表达量,同时选择2个或以上的内参基因更有利于得到精确可靠的结果,而且对于检测表达差异极为微小的目的基因,这种方法更为有效[25-26]. 因此,本研究最终同时选择GAPDH和UBQ,作为授粉后不同发育时期的红球姜雌性生殖器官实时荧光定量PCR标准化分析的内参基因.
本研究首次报道了可用于实时荧光定量PCR标准化分析红球姜雌性生殖器官相关基因表达的内参基因GAPDH和UBQ,为探究红球姜败育的分子机理奠定基础,也为近源姜属植物内参基因的筛选提供线索.
[1] YOB N J,JOFRRY S M,AFFANDI M M,et al.Zingiberzerumbet(L.) Smith:a review of its ethnomedicinal,chemical,and pharmacological uses[J]. eCAM,2011 (1):543216-543216.
[2] HUGGETT J,DHEDA K,BUSTIN S,et al. Real-time RT-PCR normalization strategies and considerations[J]. Genes and Immunity,2005,6(4):279-284.
[3] DERVEAUX S,VANDESOMPELE J,HELLEMANS J. How to do successful gene expression analysis using Real- time PCR[J]. Methods,2010,50(4):227-230.
[4] WONG C K,WANG C B,LI M L,et al. Identification and characterization of genes associated with the induction of embryogenic competence in leaf-protoplast-derived alfalfa cells[J]. IEEE Transactions on Electron Devices,2014,61(12):4210-4215.
[5] JEONG Y M,MUN J H,LEE I,et al. Distinct roles of the first introns on the expression of Arabidopsis profiling gene family members[J]. Tetrahedron Asymmetry,2006,22(7):722-727.
[6] LONG X Y,WANG J R,OUELLET T,et al. Genome-wide identification and evaluation of novel internal control genes for Q-PCR based transcript normalization in wheat[J]. Plant Molecular Biology,2010,74(3):307-311.
[7] 李钱峰,蒋美艳,于恒秀,等. 水稻胚乳RNA定量RT-PCR分析中参照基因选择[J]. 扬州大学学报(农业与生命科学版),2008,29(2):61-66.
LI Q F,JIANG M Y,YU H X,et al. Selection of internal reference genes for quantitative RT-PCR analysis of total RNA from endosperm of rice (OryzasativaL.)[J]. Journal of Yangzhou University(Agricultural and Life Science Edition),2008,29(2):61-66.
[8] KRISTIANSSON E,ASKER N,FÖRLIN L,et al. Characterization of theZoarcesviviparus,liver transcriptome using massively parallel pyrosequencing[J]. BMC Genomics,2009,10(1):1-11.
[9] SANG J,HAN X,LIU M,et al. Selection and validation of reference genes for real-time quantitative PCR in hyperaccumulating ecotype ofSedumalfrediiunder different heavy metals stresses[J]. Plos One,2013,8(12): Art e82927,10pp.
[10]CHANG E,SHI S,LIU J,et al. Selection of reference genes for quantitative gene expression studies inPlatycladusorientalis(Cupressaceae) using real-time PCR[J]. Plos One,2012,7(3):65-65.
[11]HU Y,XIE S,YAO J. Identification of novel reference genes suitable for qRT-PCR normalization with respect to the zebrafish developmental stage[J]. Plos One,2016,11(2): Art e0149277,13pp.
[12]VIEIRA A,CABRAL A,FINO J,et al. Comparative validation of conventional and RNA-Seq data-derived reference genes for qPCR expression studies ofColletotrichumkahawae[J]. Plos One,2016,11(3): Art e0150651,18pp.
[13]VANDESOMPELE J,DE PRETER K,PATTYN F,et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J]. Genome Biology,2002,3(7):1-11.
[14]ANDERSEN C L,JENSEN J L,ΦRNTOFT T F. Normalization of real-time quantitative reverse transcription-PCR data:a model-based variance estimation approach to identify genes suited for normalization,applied to bladder and colon cancer data sets[J]. Cancer Research,2004,64(15):5245-5250.
[15]PFAFFL M W,TICHOPAD A,PRGOMET C,et al. Determination of stable housekeeping genes,differentially regulated target genes and sample integrity:best Keeper-Excel-based tool using pair-wise correlations[J]. Biotechnology Letters,2004,26(6):509-515.
[16] 张玉芳,赵丽娟,曾幼玲. 基因表达研究中内参基因的选择与应用[J]. 植物生理学报,2014,50(8):1119-1125.
ZHANG Y F,ZHAO L J,ZENG Y L. Selection and application of reference genes for gene expression studies[J]. Plant Physiology Journal,2014,50(8):1119-1125.
[17]IWAKAWA H,SHINMYO A,SEKINE M. Arabidopsis CDKA;1,a cdc2 homologue,controls proliferation of generative cells in male gametogenesis[J]. Plant Journal for Cell & Molecular Biology,2006,45(5):819-831.
[18]GUTIERREZ L,MAURIAT M,GUÉNIN S,et al. The lack of a systematic validation of reference genes:a serious pitfall undervalued in reverse transcription-polymerase chain reaction (RT-PCR) analysis in plants[J]. Plant Biotechnology Journal,2008,6(6):609-618.
[19]WAN H,ZHAO Z,QIAN C,et al. Selection of appropriate reference genes for gene expression studies by quantitative real-time polymerase chain reaction in cucumber[J]. Analytical Biochemistry,2010,399(2):257-261.
[20]MAFRA V,KUBO K S,ALVESFERREIRA M,et al. reference genes for accurate transcript normalization in citrus genotypes under different experimental Conditions[J]. Plos One,2012,7(2): Art e31263,11pp.
[21]ZHONG H Y,CHEN J W,LI C Q,et al. Selection of reliable reference genes for expression studies by reverse transcription quantitative real-time PCR in litchi under different experimental conditions[J]. Plant Cell Reports,2011,30(4):641-653.
[22] 孙美莲,王云生,杨冬青,等. 茶树实时荧光定量PCR分析中内参基因的选择[J]. 植物学报,2010,45(5):579-587.
SUN M L,WANG Y S,YANG D Q,et al. Reference genes for Real-time fluorescence quantitative PCR inCamelliasinensis[J]. Chinese Bulletin of Botany,2010,45(5):579-587.
[23] 刘洪峰,高乐旋,胡永红. 牡丹不同发育阶段种子和花瓣组织实时荧光定量PCR中内参基因的挖掘与筛选[J]. 农业生物技术学报,2015,23(12):1639-1648.
LIU H F,GAO L X,HU Y H. Reference genes discovery and selection for quantitative Real-time PCR in tree peony seed and petal tissue of different development stages[J]. Journal of Agricultural Biotechnology,2015,23(12):1639-1648.
[24] 王彦杰,董丽,张超,等. 牡丹实时定量PCR分析中内参基因的选择[J]. 农业生物技术学报,2012,20(5):521-528.
WANG Y J,DONG L,ZHANG C,et al. Reference gene selection for Real- time quantitative PCR normalization in tree peony(PaeoniasuffruticosaAndr.)[J]. Journal of Agricultural Biotechnology,2012,20(5):521-528.
[25]MAROUFI A,BOCKSTAELE E V,LOOSE M D. Validation of reference genes for gene expression analysis in chicory (Cichoriumintybus) using quantitative real-time PCR[J]. BMC Molecular Biology,2010,11(1):1-12.
[26]LUO H,LUO K,LUO L,et al. Evaluation of candidate reference genes for gene expression studies inCymbidiumkanran[J]. Scientia Horticulturae,2014,167(3):43-48.
【中文责编:成文 英文审校:李海航】
Screening of Reference Genes for qRT-PCR Analysis inZingiberzerumet(L.) Smith Female Reproductive Organ after Pollination
LIN Haochuan,ZHONG Chunmei,SUN Shulan*
(Guangdong Provincial Key Lab of Biotechnology for Plant Development, School of Life Science, South China Normal University, Guangzhou 510631, China)
Screening of reference genes of pollinatedZingiberzerumet(L.) Smith female reproductive organ at development process is crucial for analyzing the expression of key regulatory genes forZingiberzerumet(L.) Smith abortion. According to the transcriptome database ofZ.zerumetSmith and researches on traditional reference genes, we selected 10 relatively stable genes as candidate reference genes, includingActin-2 (ACT2),Actin-7 (ACT7),Betatubulin-1 (TUB1),Betatubulin-5 (TUB5),Alphatubulin-3 (TUA3),Ubiquitin(UBQ),Glyceraldehyde-3-phosphatedehydrogenase(GAPDH),Elongationfactor1-alpha(EF-1α),Cyclophilin(CYP), andHistone(H2A), and analyzed their expression stability by qRT-PCR and three statistic programs: GeNorm, NormFinder and BestKeeper. The results showed thatGAPDHandUBQare the most stable genes during the development process of pollinatedZ.zerumetSmith female reproductive organ. These two genes were suitable to be reference genes, and it was more accurate for qRT-PCR normalization analysis using these two reference genes at the same time. This work indicated thatGAPDHandUBQare effective reference genes for qRT-PCR normalization analysis in pollinatedZ.zerumetSmith female reproductive organ at different development stages, which can be used for the study of molecular mechanism of abortive inZ.zerumetSmith, and for the screening of reference genes in other Zingiber species.
Zingiberzerumet(L.) Smith; reference genes; qRT-PCR; GeNorm; NormFinder; BestKeeper
2016-10-18 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
国家自然科学基金委员会-广东省人民政府联合基金(U1301213)
Q786
A
1000-5463(2017)01-0067-07
*通讯作者:孙姝兰,副研究员,Email:sunsl@scnu.edu.cn.
