PCR检测兔支气管败血波氏杆菌方法的建立及应用
2017-04-12马超锋徐永杰
马超锋,陈 铭,徐永杰
(1.信阳市动物疫病预防控制中心,河南 信阳464000; 2.信阳师范学院 生命科学学院,河南 信阳 464000)
PCR检测兔支气管败血波氏杆菌方法的建立及应用
马超锋1,陈 铭1,徐永杰2*
(1.信阳市动物疫病预防控制中心,河南 信阳464000; 2.信阳师范学院 生命科学学院,河南 信阳 464000)
为建立准确、快速检测兔支气管败血波氏杆菌(Bordetellabronchiseptica)的PCR方法,根据GenBank中波氏杆菌ptxA基因设计1对特异性引物,用建立的PCR方法扩增兔波氏杆菌,可扩增出870 bp的目的片段。该方法特异性好,仅对波氏杆菌有特异性的扩增,而对大肠埃希菌、无乳链球菌、金黄色葡萄球菌、多杀性巴氏杆菌等病原菌的扩增结果呈阴性;敏感性较高,最低检测限可达6.8×10-7μg/mL;用建立的PCR方法检测临床疑似感染支气管败血波氏杆菌病兔的脏器及鼻拭子样品,可扩增出目的条带,且与细菌分离的结果一致。可见,建立的检测方法敏感、特异,可用于临床上兔波氏杆菌病的快速诊断及鉴定。
兔波氏杆菌; PCR;ptxA基因
支气管败血波氏杆菌(Bordetellabronchiseptica,Bb)是一种革兰氏阴性小杆菌,寄生在动物呼吸道黏膜上皮细胞,能引起多种哺乳动物发生呼吸道的急性或慢性炎症。该菌能感染猪、犬、猫、兔、鼠、猴以及刺猬、狐、粟鼠等野生动物。兔波氏杆菌病是由支气管败血波氏杆菌引起的兔的一种呼吸道疾病。研究表明,兔群发生的以鼻腔分泌物增多、打喷嚏、食欲不振和发育不良为特征的卡他性炎症中,大部分是由支气管败血波氏杆菌引起的[1]。本病通过呼吸道传播,带菌兔和病兔鼻腔分泌物中的病菌随咳嗽、喷嚏飞沫污染饲料、饮水、笼舍和空气传染给健康兔。病菌常存在于兔上呼吸道黏膜上,不良因素刺激、家兔抵抗力下降、病菌侵入机体引起发病。该病病程长,反复发生,难治愈,易造成患兔生长障碍,饲料利用率低,给养兔业带来了很大的经济损失[2]。
河南省是养兔大省,其中信阳市有较大的存栏量。现阶段,疾病问题仍然是影响信阳市养兔业发展的重要因素,特别是流行性腹胀、传染性鼻炎以及球虫病的发病率和死亡率仍然较高,给养殖户带来较大经济损失。波氏杆菌病是兔群常发的细菌性疾病,特别是季节交替时,波氏杆菌可引起兔群发生以鼻炎为主要症状的呼吸道疾病,若与巴氏杆菌混合感染,危害更重[3]。Spanoghe[4]调查32个兔场,波氏杆菌的感染率为20%~47%。国内学者检测了不同的鼻炎和胸膜肺炎患兔,波氏杆菌的检出率分别为35.8%[5]、46.0%[6]。由此可见,波氏杆菌仍然是兔呼吸道病的重要病原。目前,国外关于支气管败血波氏杆菌分子生物学方面的研究报道较多[5-12],而有关支气管败血波氏杆菌检测方法的报道却很少[11],国内关于兔波氏杆菌的检测,大都是通过传统的细菌学和血清学方法检测该菌[13-19]。这些方法不但费时、费力,而且检出率不高。因此,临床上常延误该病的及时确诊和有效治疗。此外,有关波氏杆菌分子生物学的检测仅局限于根据鞭毛基因设计的PCR方法,故有必要建立一种快速、准确、经济的实验室诊断方法。鉴于此,针对支气管败血波氏杆菌ptxA基因(百日咳毒素S1亚基启动子基因)[20]设计1对特异性引物,以建立支气管败血波氏杆菌特异性检测方法,旨在为兔波氏杆菌病的诊断治疗提供参考。
1 材料和方法
1.1 材料
1.1.1 菌株、临床样本 家兔支气管败血波氏杆菌、多杀性巴氏杆菌、大肠埃希氏菌、金黄色葡萄球菌和无乳链球菌等试验菌株由信阳市动物疫病预防控制中心实验室分离鉴定并保存;203份待检样品采自信阳市疑似感染支气管败血波氏杆菌的兔群鼻拭子。
1.1.2 主要试剂TaqDNA聚合酶、10×缓冲液、dNTP、DNA Marker、琼脂糖、DNA提取试剂盒等购自大连宝生物工程有限公司;马丁肉汤、麦康凯培养基、三糖铁培养基等购自南京卓越生物公司。
1.1.3 主要仪器设备 PCR仪(德国Biometre公司),电泳仪、凝胶成像系统(以色列DNA公司),5424R高速台式冷冻离心机(德国Eppendorf公司),HH数显恒温水浴锅(江苏金坛晶玻实验仪器厂),SPX-150B智能型生化培养箱(上海琅轩实验设备有限公司)。
1.1.4 引物设计与合成 根据GenBank中波氏杆菌ptxA基因的序列,应用Oligo 6.0软件设计1对引物,预期PCR扩增核酸片段大小870 bp,引物由生工生物工程(上海)有限公司合成。上游引物:5′-GGCACCATCAAAACGCAGAGGGG-3′;下游引物:5′-ATTACCGAGTTGGGCGGGGCTG-3′。
1.2 方法
1.2.1 病原菌的分离培养 无菌条件下,取波氏杆菌等标准菌株画线接种于LB琼脂平板,取多杀性巴氏杆菌接种于鲜血琼脂平板,于37 ℃培养24 h后观察。挑取湿润、光滑小菌落进行革兰氏染色,镜检。
1.2.2 模板DNA的制备 无菌条件下,将波氏杆菌标准菌株接种于LB平板,37 ℃恒温培养24 h,每个平板用6 mL生理盐水洗脱菌落,取2 mL菌液制备模板DNA。分别将大肠杆菌、多杀性巴氏杆菌、无乳链球菌、金黄色葡萄球菌标准菌株接种于LB平板或鲜血琼脂平板,37 ℃培养24 h,每个平板用6 mL生理盐水洗脱菌落,取2 mL菌液制备模板DNA,置于4 ℃备用或-20 ℃长期保存。
1.2.3 PCR方法建立
1.2.3.1 PCR反应 总反应体系25 μL:TaqDNA聚合酶(5 U/μL)0.5 μL,10×缓冲液(Mg2+)2.5 μL,dNTP Mixture(2.5 mmol/L)2 μL,上、下游引物各1 μL,模板DNA 1 μL,ddH2O 17 μL。PCR反应条件: 95 ℃预变性5 min;94 ℃变性40 s,57 ℃退火30 s,72 ℃复性1 min,30个循环;72 ℃延伸10 min,4 ℃保存。
1.2.3.2 PCR反应条件优化 采用25 μL反应体系,以波氏杆菌DNA为模板,设定不同的退火温度(54.0、54.4、55.2、56.4、57.8、59.0、59.7、60.0 ℃)和引物浓度梯度(0.781 25、1.562 5、3.125、6.25、12.5、25、50、100 mmol/L),分别进行梯度PCR扩增,以出现目的条带清晰度高且无明显杂带为标准确定最佳反应条件。
1.2.3.3 PCR扩增产物鉴定 取扩增产物5 μL,PCR产物按5︰1混合6×Loading Buffer进行琼脂糖凝胶电泳检测:1%琼脂糖凝胶、电压100 V,室温电泳30 min。利用凝胶成像系统观察、拍摄。
1.2.3.4 PCR特异性试验 按照1.2.2的步骤分别提取兔支气管败血波氏杆菌、大肠埃希菌、无乳链球菌、金黄色葡萄球菌、多杀性巴氏杆菌的模板DNA,在相同条件下进行PCR扩增,检测引物的特异性,同时设阴性对照(以三蒸水为模板)。
1.2.3.5 PCR 敏感性试验 支气管败血波氏杆菌模板DNA用ddH2O连续10倍梯度稀释,按照上述已优化的最佳反应体系和反应条件进行PCR 扩增,以出现特异性扩增条带的最低DNA模板浓度为最低检出量。
1.2.4 临床样品波氏杆菌的PCR检测 为鉴定建立PCR方法的适用性,对1份人工感染样品及采集的203份鼻拭子进行检测。人工感染样品的制备:复苏冻干保存的支气管败血波氏杆菌于马丁肉汤,37 ℃、190 r/min振荡培养16 h,进行细菌计数。参照范志宇[21]建立的支气管波氏杆菌人工感染模型,调整菌液浓度为2×108cfu/mL,选择2只未免疫健康家兔(体质量为0.5 kg,由信阳市某兔场提供),1只家兔静脉注射2 mL菌液,1只家兔静脉注射2 mL生理盐水作为对照。接种后,2只供试家兔隔离饲养,以确保人工感染组和对照组之间不会相互感染。待人工感染组兔出现波氏杆菌病的疑似临床症状时,分别无菌解剖取出家兔的心、肝、脾、肺、肾等组织,提取DNA,采用建立的家兔波氏杆菌PCR方法进行检测。
2 结果与分析
2.1 PCR反应的条件优化结果
设定不同的退火温度和不同的引物浓度进行PCR扩增,结果显示,各退火温度下目的条带均很亮,引物浓度为3.125 mmol/L(第6组)时,目的条带最亮,且杂带较少(图1、图2)。故选择60.0 ℃为最适退火温度,3.125 mmol/L为最适引物浓度。
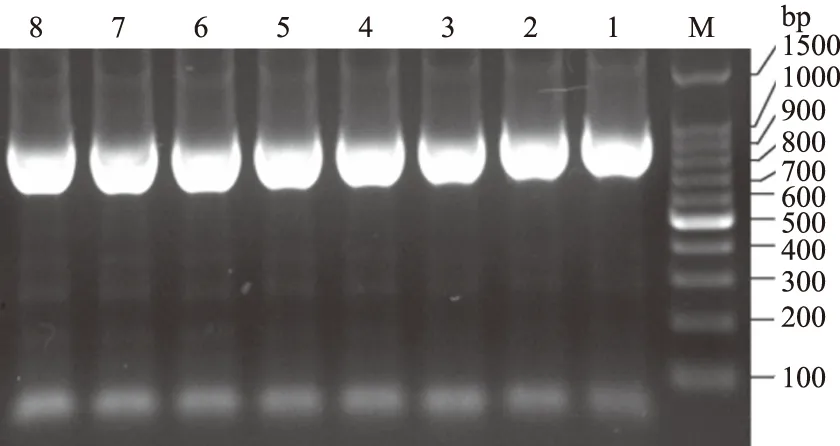
M.DL1500 DNA Marker; 1—8.分别为退火温度60.0、59.7、 59.0、57.8、56.4、55.2、54.4、54.0 ℃图1 PCR反应退火温度优化结果
2.2 特异性试验结果
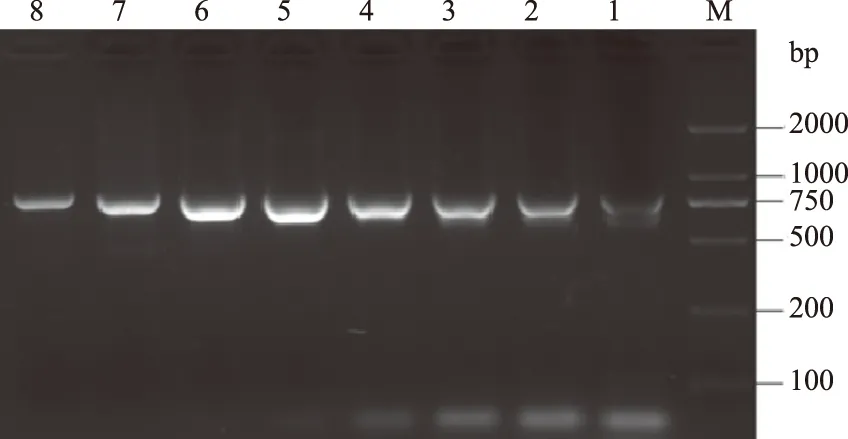
将波氏杆菌、金黄色葡萄球菌、大肠杆菌、无乳链球菌、多杀性巴氏杆菌基因组DNA作为PCR反应模板,按照上述已优化反应体系和条件扩增,结果显示,仅以波氏杆菌菌株为模板的反应体系扩增出约870 bp的条带,以其他菌株为模板的反应体系及空白对照组均未见条带(图3)。表明该PCR反应体系及条件具有很高的特异性。
M.DL2000 DNA Marker; 1—8.分别为引物浓度100、50、25、12.5、 6.25、3.125、1.562 5、0.781 25 mmol/L图2 PCR反应引物浓度优化结果
M.DL2000 DNA Marker; 1—6.分别为阴性对照、支气管败血波氏 杆菌、巴氏杆菌、无乳链球菌、大肠杆菌、金黄色葡萄球菌图3 PCR反应特异性试验结果
2.3 敏感性试验结果
初始模板质量浓度经核酸蛋白仪检测为6.8×10-1μg/mL。将支气管败血波氏杆菌模板DNA依次进行10倍倍比稀释。取不同稀释度的模板DNA 1 μL 进行PCR反应,结果显示,模板质量浓度低至6.8×10-7μg/mL时(第7组),仍可扩增出约870 bp的目的片段(图4)。
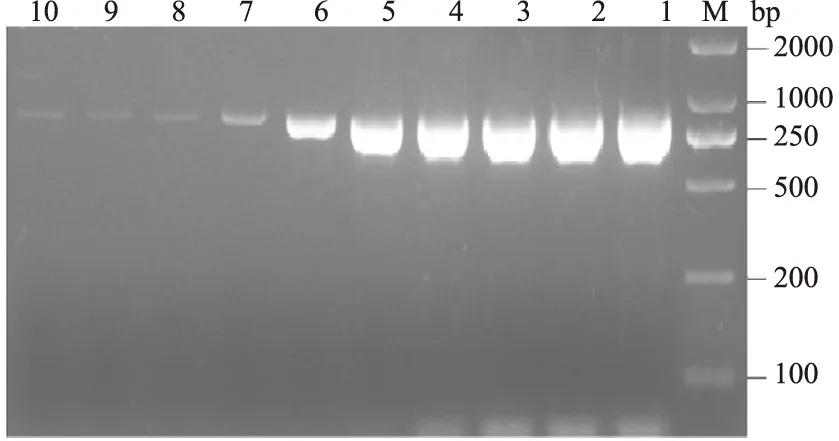
M.DL2000 DNA Marker; 1—10.DNA模板质量浓度分别为 6.8×10-1—6.8×10-10 μg/mL图4 PCR方法灵敏度试验结果
2.4 PCR检测方法的临床检测结果
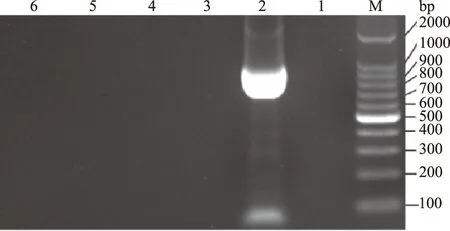
应用建立的PCR检测方法,对实验室人工感染家兔后所收集的临床病料进行检测,可见约870 bp左右条带,对照组未见条带(图5)。用传统的实验室检测方法进行检测鉴定,结果与PCR检测结果一致。对203份鼻拭子进行PCR检测,检出阳性样品18份,阳性率为8.9%。
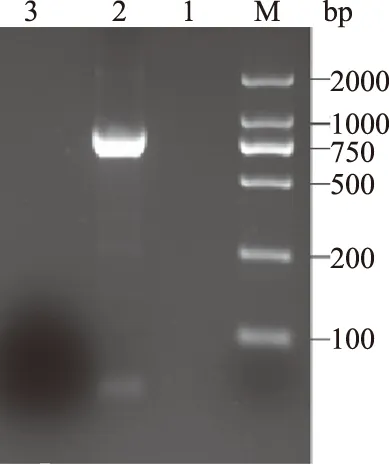
M.DL2000 DNA Marker; 1—3分别为阴性对照、阳性样品、阴性样品图5 临床检测结果
3 结论与讨论
根据GenBank中支气管败血波氏杆菌的ptxA基因的序列,应用Oligo 6.0软件设计1对特异性引物,建立了兔支气管败血波氏杆菌基因片段的检测方法。依照有关退火温度的计算和预测,本研究对退火温度和引物浓度分别进行优化,确定最佳反应体系及反应程序。对兔大肠杆菌、多杀性巴氏杆菌、无乳链球菌和金黄色葡萄球菌以及空白对照的扩增结果表明,本研究所建立的PCR检测方法特异性很高;敏感性试验结果表明,样品的量仅有6.8×10-7μg/mL时,仍能够扩增出特异性条带,说明该PCR方法检测支气管败血波氏杆菌具有很高的敏感性。
本研究所建立和优化的PCR试验方法不需要进行病原菌的分离培养,只需要从病料中提取DNA,利用所设计的特异性引物进行扩增检测,具有检测速度快、灵敏性高、特异性强等优点,在24 h内即可检测出结果,缩短了病原的检测时间(传统检测耗时较长,时间为3~5 d)。用本研究所优化的PCR方法对临床的人工感染病料和所采集样品进行检测,均能够检出目的条带,可用于临床上兔波氏杆菌病的快速诊断及鉴定。
[1] 王欣,恽时峰,王芳,等.兔支气管败血波氏杆菌PCR检测方法的建立及应用[J].中国比较医学杂志,2008,18(7):41-45.
[2] 王英,邢福珊,张彦明.兔支气管败血波氏杆菌PCR检测方法的建立及应用[J].中国动物检疫,2007,24(6):22-23.
[3] 陈直,王炳勋,王志方,等.河南省养兔业生产现状、存在问题及发展思路[J].河南农业科学,2005(10):101-102.
[4] Spanoghe L.Relationship between bacterial flora and lesion in the respiratory tract of rabbits[J].Vlaams Diergeneeskundig Tijdschrift,1978,47(6):462-470.
[5] 董亚芳.家兔鼻炎防治研究初报[J].江苏农业科学,1987,15(6):35-36.
[6] 马健能.家兔鼻炎的病原检查[J].江苏农业学报,1985,1(4):34-38.
[7] 赵战勤,薛云,裴洁,等.支气管败血波氏杆菌dnt基因的克隆、表达及活性鉴定[J].河南农业科学,2010,39(11):112-115.
[8] Parkhill J,Sebaihia M,Preston A,etal.Comparative analysis of the genome sequences ofBordetellapertussis,BordetellaparapertussisandBordetellabronchiseptrca[J].Nature Genetics,2003,35(1):32-40.
[9] Kania S A,Rajeev S,Burns Jr E H,etal.Characterization offimN,a newBordetellabronchisepticamajor fimbrial subunit gene[J].Gene,2000,256(1/2):149-155.
[10] Sacco R E,Regster K B,NordholmG E.Restriction endonuclease analysis discriminatesBordetellabronchisepticaisolates [J].Clinical Microbiology,2000,38(12):4387-4393.
[11] McMillan D J,Mau M,Walker M J.Characterisation of the urease gene cluster inBordetellabronchiseptica[J].Gene,1998,208(2):243-251.
[12] 徐汉祥.家兔支气管败血波氏杆菌的简易鉴定法[J].中国兽医杂志,1987,13(5):21-24.
[13] 胡北侠,任素芳,吴加强,等.兔支气管败血波氏杆菌的分离培养及初步鉴定[J].中国养兔杂志,2002(5):9-11.
[14] 杨留战,苑士祥,赵淑春,等.我国部分地区猪携带支气管败血波氏杆菌情况的调查[J].中国畜禽传染病,1989(1):27-28.
[15] 齐铁英,张亚华,苑士祥,等.我国部分地区猪传染性萎缩性鼻炎病原的调查[J].中国兽医科技,1995,25(4):15-16.
[16] 吴斌,陈焕春,何启盖,等.应用乳胶凝集试验对猪萎缩性鼻炎进行血清学流行病学的调查[J].中国兽医科技,2001,31(6):21-22.
[17] 鲁承,金鑫,杨咏洁.猪传染性萎缩性鼻炎微量凝集反应诊断抗原的制备[J].黑龙江畜牧兽医,2003(11):38-39.
[18] 韦强,佟承刚,鲍国连,等.用Dot ELISA检测兔支气管败血波氏杆菌抗体的研究[J].中国畜禽传染病,1996(4):17-20.
[19] 郭明璋,董亚芳,王启明,等.ELISA检测兔支气管败血波氏杆菌抗体的研究[J].江苏农业学报,1994,10(3):23-28.
[20] 肖海君,崔金生,翁立雪,等.支气管败血波氏杆菌PCR检测方法的建立和应用[J].山东大学学报(自然科学版),2009,40(1):70-74.
[21] 范志宇.兔支气管败血波氏杆菌的分离鉴定及某些生物学特性研究[D].南京:南京农业大学,2007.
Establishment and Application of PCR Assay for the Diagnosis ofBordetellabronchisepticaInfection in Rabbits
MA Chaofeng1,CHEN Ming1,XU Yongjie2*
(1.Xinyang Animal Disease Control and Prevention Center,Xinyang 464000,China;2.College of Life Sciences,Xinyang Normal University,Xinyang 464000,China)
To establish accurate and rapid PCR method for detectingBordetellabronchiseptica(Bb) in rabbits,a pair of specific primers was designed based onptxAgene of Bb in GenBank.This established PCR method can be used to amplify Bb in rabbits,and the target fragment was 870 bp in length.This method was specific in amplification of Bb,while being negative in amplifying such pathogens asEscherichiacoli,Streptococcusagalactiae,Staphylococcusaureus,Pasteurellamultocida,etc.Meanwhile,the method was highly sensitive,with minimum detection limit being 6.8×10-7μg/mL.The PCR method was applied in detecting samples of suspected disease rabbits’ organs and noses.The amplified target fragment was identical with the result of the bacterial isolation method.Therefore,this detection method is both specific and sensitive and can be applied in rapid clinical diagnosis and identification of Bb inrabbits.
Bordetellabronchiseptica; PCR;ptxAgene
2016-11-20
河南省高等学校青年骨干教师资助计划项目(2015GGJS-139)
马超锋(1981-),男,河南禹州人,高级兽医师,硕士,主要从事动物疫病防控。E-mail:machaofeng5@163.com
*通讯作者:徐永杰(1980-),男,河南商城人,副教授,博士,主要从事动物遗传学研究。E-mail:13523899902@126.com
S855.1
A
1004-3268(2017)04-0124-04
