牛瘤胃产纤维二糖磷酸化酶细菌的筛选及产酶条件研究
2017-04-12张青青樊海妍徐新慧张璐璐陈红歌
张青青,樊海妍,徐新慧,张璐璐,陈红歌
(河南农业大学 生命科学学院/农业部农业微生物酶工程重点实验室,河南 郑州 450002)
牛瘤胃产纤维二糖磷酸化酶细菌的筛选及产酶条件研究
张青青,樊海妍,徐新慧,张璐璐,陈红歌*
(河南农业大学 生命科学学院/农业部农业微生物酶工程重点实验室,河南 郑州 450002)
为了获得产新型纤维二糖磷酸化酶(CBP)的菌株,利用选择性培养基从牛瘤胃液中逐步分离纯化,筛选能以纤维二糖为唯一碳源生长的菌株,分别检测所筛选菌株的β-葡萄糖苷酶(βG)和CBP活力,并对其纤维二糖的利用方式(水解途径或磷解途径)进行鉴定,获得产CBP的菌株,命名为BY-a。采用形态学观察、生理生化试验,结合16S rDNA序列分析,鉴定菌株BY-a为克雷伯氏菌属(Klebsiella)。对菌种产CBP的温度、时间、最适装液量和溶氧量进行初步优化,结果显示,BY-a菌株在装液量为30 mL(250 mL)、37 ℃振荡培养24 h时,产CBP活力最高。
牛瘤胃; 纤维二糖; 纤维二糖磷酸化酶; 产酶条件
植物纤维素是含量最丰富的可再生生物质资源。对纤维素的转化利用可以缓解能源匮乏和生态恶化等问题,其关键步骤是纤维素的彻底水解。目前,木质纤维原料的水解普遍采用预处理(酸、碱、蒸汽爆破、湿氧化法等)+酶解的工艺[1]。纤维素的酶解需要内切葡聚糖酶(endoglucanase,EG)、外切葡聚糖酶(exoglucanase,CBH)和β-葡萄糖苷酶(β-glucosidase,βG)3类酶的协同作用[2]。然而,βG水解纤维二糖的过程中会积累大量的葡萄糖,该产物对βG有抑制作用。因此,纤维二糖的降解成为整个纤维原料水解的限速步骤[3]。
除了βG的水解方式外,自然界还存在另一种纤维二糖降解方式,即纤维二糖磷酸化酶(cellobiose phosphorylase,CBP)催化的磷解作用:1分子纤维二糖生成1分子1-磷酸葡萄糖(G-1-P)和1分子葡萄糖[4]。其中,G-1-P在磷酸葡萄糖变位酶(phosphoglucomutase,PGM)的作用下生成6-磷酸葡萄糖(G-6-P),进入糖酵解途径(EMP途径)代谢。因此,1分子纤维二糖经CBP磷解途径发酵时净生成5分子ATP,而经βG水解途径则生成4分子ATP,理论上,CBP的磷解作用比βG的水解作用更具有生物能学优势[5-7]。此外,Shin等[8]研究表明,与转入βG的大肠杆菌相比,转入CBP的大肠杆菌生长延迟期更短,生物量更高,对发酵抑制物如乙酸、丁醇等有更好的耐受性。因此,在降解纤维二糖时,CBP有更高的应用价值。
目前,CBP主要来源于厌氧细菌,如Ruminococcusalbus[9]、Cellvibriogilvus[10]、Clostridiumstercorarium[6]、Ruminococcusflavefaciens[11]、Formsannosus[12]、Thermotoganeapolitana[13]、Clostridiumthermocellum[14]、Thermotogamaritima[15]等菌株,其培养受到严格厌氧条件的限制。因此,不断发现新型产CBP的菌株对纤维素资源化利用具有重要意义[16-17]。牛瘤胃液可以高效降解纤维素,是丰富的纤维素降解菌来源库。鉴于此,从牛瘤胃液中筛选新型CBP产生菌,以进一步丰富CBP的来源,并初步探索其发酵条件,以更加有效地利用纤维素资源。
1 材料和方法
1.1 试剂
α-D-葡萄糖-1-磷酸、D-木糖、二硫苏糖醇(DTT)购自TaKaRa公司;纤维二糖、对硝基酚呋喃葡萄糖苷(pNPG)、羧甲基纤维素钠(CMC-Na)购自Sigma公司;Ezup柱式细菌基因组DNA抽提试剂盒购自生工生物工程(上海)股份有限公司;蛋白胨、酵母浸出物购自Oxiod公司;其他试剂均为国产分析纯。
1.2 牛瘤胃液的采集
供试牛由郑州牧业工程高等专科学校兽医院提供。选取1头停奶期的健康奶牛,在采样前1个月内禁止使用抗生素药物,采集瘤胃液前7 d,加大纤维饲料的饲喂量。采样时,奶牛饮水2 h后,将导胃管自奶牛鼻孔插入,使其顺食道进入奶牛瘤胃,使用虹吸法收集瘤胃液800 mL,装入棕色瓶密封后避光、冰浴保存[18]。
1.3 培养基
1.3.1 痕量营养液 每升培养基含FeSO40.2 g、MnSO40.15 g、ZnCl20.3 g、CoCl20.4 g,定容至1 000 mL,分装后4 ℃保存。
1.3.2 无细胞瘤胃液的制备 取120 mL瘤胃液,经2层纱布过滤除去不溶性植物纤维,4 ℃、4 200 r/min离心15 min,上清即为无细胞瘤胃液,现配现用。
1.3.3 CMC-Na初筛培养基 每升培养基含CMC-Na 20 g、KH2PO42 g 、(NH4)2SO41.4 g、MgSO40.3 g、CaCl20.3 g、痕量营养液1 mL、半胱氨酸1 g、无细胞瘤胃液100 mL、琼脂粉20 g。
1.3.4 加富CMC-Na培养基 每升培养基含CMC-Na 20 g、纤维二糖2 g、 KH2PO42 g、(NH4)2SO41.4 g、MgSO40.3 g、CaCl20.3 g、蛋白胨0.5 g、 酵母浸出物0.5 g、痕量营养液1 mL、半胱氨酸1 g、无细胞瘤胃液100 mL、琼脂粉20 g。
1.3.5 纤维二糖培养基 每升培养基含纤维二糖4 g、(NH4)2SO44 g、Na2HPO44 g、CaCl20.5 g、MgSO40.5 g、琼脂粉15 g。
1.4 纤维二糖利用菌株的筛选
使用CMC-Na初筛培养基对瘤胃菌进行初步筛选,然后在加富CMC-Na培养基上分离纯化。将获得的菌株进行刚果红染色,测量其透明圈大小。将透明圈较大的菌株接种于纤维二糖培养基上进行复筛,获得能以纤维二糖为唯一碳源生长的菌株。
1.5 筛选菌株的鉴定
1.5.1 形态鉴定 参考《伯杰氏细菌分类手册》,对目的菌株进行革兰氏染色、芽孢染色、V-P试验等生理生化试验,进行分类鉴定[19]。
1.5.2 16S rDNA的序列与系统进化树的构建 以通用引物27F/1492R对目的菌株的16S rDNA片段进行扩增。引物序列为27F: 5′-AGAGTTTGATCMTGGCTCAG-3′,1492R:5′-TACGGYTACCTTGTTACGACTT-3′。扩增产物送生工生物工程(上海)股份有限公司测序。将测序结果在GenBank数据库中进行序列同源性比对,初步确定菌种的种属关系。从比对结果中选取与目的菌株相似度较高的16S rDNA序列,用CLUSTALX进行多序列比对,然后用PHYLIP构建系统进化树。
1.6 筛选菌株产CBP活力分析
1.6.1 粗酶液的制备 菌株培养液于4 ℃、6 000 r/min离心10 min,收集菌体,Tris-HCl Buffer重悬菌体,在冰上超声破碎细胞,4 ℃、6 000 r/min离心10 min,收集上清,即获得粗酶液。
1.6.2 βG活力的测定 以pNPG为底物测量βG活力,反应体系:50 μL粗酶液、50 μL底物、100 μL pH值为 4.8的醋酸钠缓冲液,在水浴锅中反应10 min,加入3 mL 0.2 mol/L Na2CO3终止反应,于408 nm波长处测定其吸光值,计算对硝基酚(pNP)的浓度。βG活力单位定义为:50 ℃、pH值为 4.8条件下,每分钟生成1 μmol pNP所需的酶量。
1.6.3 CBP活力测定 采用合成方向的酶活力测定方法:以木糖和G-1-P为底物,在CBP的催化作用下合成纤维二糖,并释放出无机磷,以无机磷的释放量作为酶活力的检测标准。在200 μL的反应体系中,含有终浓度为5 mmol/L的 Mg2+、40 mmol/L的 G-1-P、10 mmol/L 的DTT、400 mmol/L的木糖、50 mmol/L pH 值为7.5的Tris/HCl缓冲液、50 μL粗酶液。反应液于37 ℃温浴15 min后,加入2.0 mL 15 mmol/L钼酸铵溶液,终止反应,再加入0.5 mL 10 %的抗坏血酸,在30 ℃下温浴15 min进行显色,最后在850 nm波长下测定其吸光值。CBP活力单位定义为:在37 ℃、pH值为7.5条件下,每15 min释放出1 mmol无机磷所需要的酶量。
1.7 筛选菌株产CBP条件的优化
1.7.1 温度和时间对产酶的影响 将筛选菌株接种至纤维二糖液体培养基,分别于37、41 ℃条件下,测定培养24、36、48 h时菌株产CBP活力,确定产CBP的最适温度和最佳时间。
1.7.2 装液量和溶氧量对产酶的影响 在静止、振荡、真空3种条件下,分别向250 mL三角瓶中装入30、50、70 mL的纤维二糖液体培养基,接种后37 ℃培养24 h,检测产CBP活力,确定产CBP的最佳装液量和溶氧量。
2 结果与分析
2.1 纤维二糖利用菌株的筛选结果
采用CMC-Na初筛培养基和加富CMC-Na培养基初筛并富集瘤胃液中能够利用纤维素钠的菌株,经刚果红染色发现,有16株菌株透明圈直径大于7 mm。
将上述16株初筛菌株分别在LB培养基和纤维二糖培养基上划线培养,37 ℃培养过夜,结果显示,16株菌株在LB培养基上均生长良好,只有菌株CF51和BY-a可以在纤维二糖培养基上正常生长(图1),表明菌株CF51和BY-a可以利用正常纤维二糖。

图1 菌株在2种培养基上的生长结果
2.2 菌株BY-a和CF51利用纤维二糖方式的鉴定结果
菌株CF51和BY-a的细胞裂解液均没有检测到βG活力,但菌株BY-a有CBP活性。可见,菌株BY-a能产生CBP,并通过磷酸解途径降解纤维二糖。菌株CF51没有显示出CBP活性,推测该菌株是以分泌胞外βG的方式利用纤维二糖。
2.3 BY-a菌株的鉴定结果
2.3.1 形态及生理生化鉴定 BY-a菌株能在纤维二糖培养基上快速生长,圆形菌落呈乳白色,边缘整齐。镜检显示,BY-a菌株为杆状革兰氏阴性菌。生理生化试验结果显示,BY-a菌株过氧化氢酶及V-P试验均为阳性,可产CBP(表1)。

表1 菌株BY-a生理生化特性
2.3.2 16S rDNA的序列与系统进化树 由图2可见,BY-a菌株的16S rDNA序列与Klebsiellavariicolastrain CPB S30的16S rDNA序列相似度为100%。结合系统进化树分析,可以确定菌株BY-a为克雷伯氏菌(Klebsiella)。

图2 菌株BY-a的系统进化分析
2.4 BY-a菌株产CBP的条件优化结果
2.4.1 温度和时间 如图3所示,37 ℃培养时发酵液的CBP活力较41 ℃时高,因此,37 ℃更适合BY-a菌株产CBP。此外,37 ℃培养时,随着发酵时间延长,酶活力降低,24 h时酶活力最高,为0.454 U/mL,48 h时酶活力减半。而温度为41 ℃时,发酵液酶活力不随时间改变。
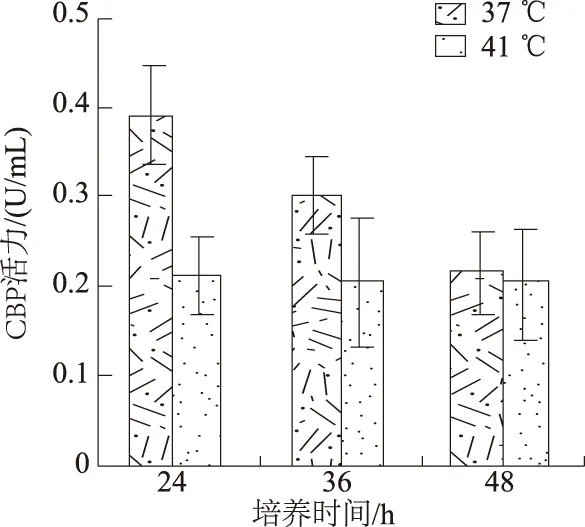
图3 温度和时间对产CBP的影响
2.4.2 装液量和溶氧量 如图4所示,不同程度的溶氧对菌株产CBP有影响,振荡培养时CBP活力最高,真空培养时CBP活力最低。在静止与真空条件下培养时,装液量大小对CBP活力几乎没有影响。而在振荡培养时,CBP活力随装液量增加而减少,在30 mL(250 mL)时最高,为0.490 U/mL。

图4 装液量和溶氧量对产CBP的影响
3 结论与讨论
在纤维素的酶解过程中,中间产物纤维二糖的降解有水解和磷解2种方式。粗糙脉孢菌(Neurosporacrassa)等真菌利用胞内βG将其完全水解[20]。热纤梭菌(Clostridiumthermocellum)等细菌利用CBP将胞内纤维二糖进一步分解。相比之下,CBP的磷解作用更具有生物能学优势。目前,CBP主要存在于厌氧菌中,培养条件严格受限,不易大量获取高纯度酶,因此,发现新型的产CBP的菌株对该酶的利用具有一定的价值。
本研究从牛瘤胃中筛选到1株CBP产生菌BY-a,经鉴定其为克雷伯氏菌(Klebsiella)。王炳晓等[21]从奶牛瘤胃中也筛选到1株克雷伯氏菌,该菌在有氧或无氧时均能产生纤维素酶。但目前尚未有克雷伯氏菌产CBP的报道。因此,这将为纤维二糖的降解利用提供新的候选菌株。此外,BY-a是兼性厌氧菌,具有独特的产酶性质,菌株在好氧条件下培养时,CBP活力比厌氧时高。这不仅将大大降低菌体培养的难度与成本,还丰富了纤维二糖降解酶系资源。而菌株CF51虽然能够利用纤维二糖为唯一碳源生长,但未能检测到胞内βG活力,可能是该菌主要以分泌到胞外的βG来降解纤维二糖,这需要进一步验证。
初步优化后,BY-a菌株在装液量为30 mL、37 ℃振荡培养24 h时产CBP活力最高。虽然牛瘤胃的生理温度为41 ℃,但BY-a菌株在37 ℃时更适合产酶。CBP活力自24 h持续降低,没有出现峰值,可能是因为培养基中0.4 %的纤维二糖含量较少,菌体在24 h前已停止生长。因此,需要进一步优化培养基,确定最佳产酶时间,并进一步提高酶活力。
本研究下一步将纯化兼性厌氧菌BY-a的CBP蛋白,并探究其酶学性质,以更好地阐明纤维素利用机制及获取有益的生物质转化所需酶资源。
[1] Alvira P,Tomás-Pejó E,Ballesteros M,etal.Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis:A review[J].Bioresour Technol,2010,101(13):4851-4861.
[2] 高培基,曲音波,汪天虹,等.微生物降解纤维素机制的分子生物学研究进展[J].纤维素科学与技术,1995,3(2):1-19.
[3] Singhania R,Patel A,Sukumaran R,etal.Role and significance of beta-glucosidases in the hydrolysis of cellulose for bioethanol production[J].Bioresource Technology,2013,127:500-507.
[4] Tanaka K,Kawaguchi T,Imada Y,etal.Purification and properties of cellobiose phosphorylase fromClostridiumthermocellum[J].J Ferment Bioeng,1994,79:212-216.
[5] Fujita Y,Takahashi S,Ueda M,etal.Direct and efficient production of ethanol from cellulosic material with a yeast strain displaying cellulolytic enzymes[J].Applied and Environmental Microbiology,2002,68(10):5136-5141.
[6] Reichenbecher M,Lottspeich F,Bronnenmeier K.Purification and properties of a cellobiose phosphorylase(CepA) and a cellodextrin phosphorylase(CepB) from the cellulolytic thermophileClostridiumstercorarium[J].Eur J Biochem,1997,247(1):262-267.
[7] Skory C,Freer S,Bothast R.Expression and secretion of the Candida wickerhamii extracellular β-Glucosidase gene,bglB,inSaccharomycescerevisiae[J].Curr Genet,1996,30(5):417-422.
[8] Shin H,Wu J,Chen R.Comparative engineering ofEscherichiacolifor cellobiose utilization:Hydrolysis versus phosphorolysis[J].Metabolic Engineering,2014,24:9-17.
[9] Hamura K,Saburi W,Abe S,etal.Enzymatic characteristics of cellobiose phosphorylase fromRuminococcusalbusNE1 and kinetic mechanism of unusual substrate inhibition in reverse phosphorolysis[J].Bioscience Biotechnology and Biochemietry,2012,76(4):812-818.
[10] Sasaki T,Tanaka T,Nakagawa S,etal.Purification and properties ofCellvibriogilvuscellobiose phosphorylase[J].The Biochemical Journal,1983,209(3):803-807.
[11] Ayers W.Phosphorylation of cellobiose and glucose byRuminococcusflavefaciens[J].Journal of Bacteriology,1958,76(5):515-517.
[12] Hüttermann A,Volger C.Cellobiose phosphorylase inFomesannosus[J].Nature:New Biology,1973,245(141):64.
[13] Yernool D,McCarthy J,Eveleigh D,etal.Cloning and characterization of the glucooligosaccharide catabolic pathway beta-Glucan glucohydrolase and cellobiose phosphorylase in the marine hyperthermophileThermotoganeapolitana[J].Journal of Bacteriology,2000,182(18):5172-5179.
[14] Alexander J.Purification and specificity of cellobiose phosphorylase fromClostridiumthermocellum[J].Journal of Biological Chemistry,1968,243(11):2899-2904.
[15] Rajashekhara E,Kitaoka M,Kim Y K,etal.Characterization of a cellobiose phosphorylase from a hyperthermophilic eubacterium,ThermotogamaritimaMSB8[J].Bioscience,Biotechnology,and Biochemistry,2002,66(12):2578-2586.
[16] 王娇,王秋文,尹清强,等.转锰过氧化物酶基因酵母的建立及其降解秸秆木质素能力的研究[J].河南农业大学学报,2015,49(6):817-821.
[17] 冯冲,苏丽娟,张洋,等.白蚁肠道内纤维素酶产生菌的分离与鉴定[J].河南农业大学学报,2013,47(5):587-591.
[18] 张贝贝,赵晓兵,何丽丽,等.牛瘤胃细菌产木聚糖酶菌株的筛选及酶学性质研究[J].河南农业科学,2014,43(2):128-132.
[19] George G M,Julia A B,Timothy G L.Taxonomic outline of the prokaryotes Bergey’s manual of systematic bacteriology[M].Berlin:Springer,2004.
[20] Galazka J,Tian C,Beeson,etal.Cellodextrin transport in yeast for improved biofuel production[J].Science,2010,330(60):84-86.
[21] 王炳晓,柴同杰,苏鹏程,等.奶牛瘤胃兼性厌氧纤维素分解菌的分离鉴定[J].西北农林科技大学学报(自然科学版),2009,37(3):34-42.
Screening and Fermentation Conditions of Cellobiose Phosphory-lase-producing Bacteria from Bovine Rumen
ZHANG Qingqing,FAN Haiyan,XU Xinhui,ZHANG Lulu,CHEN Hongge*
(College of Life Science,Henan Agriculture University/Key Laboratory of Enzyme Engineering of Agricultural Microbiology,Ministry of Agriculture,Zhengzhou 450002,China)
To obtain a novel CBP-producing strain,the bovine rumen fluid was screened using selective culture for the strains which could grow with cellobiose as the sole carbon source.The mode i.e.,hydrolysis or phosphorolysis that the strains degrade cellobiose was further identified.The CBP-producing strain named BY-a was obtained.The targeted strain’s taxonomic status was identified asKlebsiellabased on its physiological,biochemical characteristics,and 16S rDNA phylogenetic analysis.Then the fermentation conditions of the strain for enzyme production were optimized.The highest enzyme activity was obtained under 37 ℃ at 24 h,with 30 mL liquid in 250 mL flask.
bovine rumen fluid; cellobiose; cellobiose phosphorylase; fermentation conditions
2016-11-10
国家自然科学基金项目(31571775)
张青青(1991-),女,河南平顶山人,在读硕士研究生,研究方向:微生物酶工程。E-mail:15903645518@163.com
*通讯作者:陈红歌(1967-),女,河南许昌人,教授,博士,主要从事微生物酶的研究与开发。E-mail:honggeyz@163.com
S816.7
A
1004-3268(2017)04-0113-05
