外源亚精胺对荷花花瓣衰老的影响
2017-04-12李文玲张现丽王佩佩刘艺平孔德政
李文玲,张现丽,王佩佩,刘艺平,孔德政*
(1.郑州市绿文广场管理处,河南 郑州 450002; 2.河南农业大学 林学院,河南 郑州 450002)
外源亚精胺对荷花花瓣衰老的影响
李文玲1,张现丽2,王佩佩2,刘艺平2,孔德政2*
(1.郑州市绿文广场管理处,河南 郑州 450002; 2.河南农业大学 林学院,河南 郑州 450002)
以荷花品种青玉为试验材料,研究了不同浓度亚精胺对荷花花瓣衰老及其衰老过程中超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等活性和丙二醛(MDA)含量的影响,为延缓荷花衰老提供依据。结果表明:0.10 mmol/L亚精胺处理显著增加了荷花的最大花茎及花瓣长度,延长了荷花的单花寿命,其SOD、POD、CAT活性最大值比对照(蒸馏水处理)最大值分别高5.06%、45.63%、17.98%,并且高于其他处理的最大值;0.10 mmol/L亚精胺处理下荷花MDA含量在初花期、盛花期、谢花期均低于其他处理;0.50、1.00 mmol/L亚精胺处理使荷花初花期提前1~2 d,使CAT活性最大值出现时间提前。综上,0.10 mmol/L亚精胺处理能够明显地提高荷花衰老过程中花瓣的生理活性和观花品质。
荷花; 亚精胺; 花衰老; 酶活性; 丙二醛
荷花(Nelumbonucifera)又名莲花、水芙蓉,是睡莲科莲属多年生水生草本花卉,其花大、叶圆、花色纯洁,清香扑鼻,花态令人赏心悦目,出淤泥而不染,深受人们的喜爱。荷花原产于中国,在全国各地分布范围较广。荷花全身是宝,观赏价值及经济价值都很高。随着经济的发展,鲜切花一直都深受人们的喜爱,而荷花是我国十大传统名花中唯一的水生花卉,但是因其花期时间比较短、花瓣易萎蔫脱落及其水生花卉的特性,在很大程度上制约了荷花鲜切花的发展。目前,对荷花花期的研究主要集中在花开放期间花瓣和叶片的生理生化方面[1-2],以及施肥、光照和温度的调控方面[3-4],而关于延长其花期的研究报告鲜见报道。多胺(polyamines,PAs)是一类具有较高活性的低分子脂肪族含氮碱,其在生物代谢过程中产生并广泛存在于生物体内。亚精胺 (spermidine,Spd)是多胺中的三类胺,主要参与种子萌发[5-6]、植物生长发育[7-9]、花芽分化[10-11]、抗逆性[12-17]及延缓衰老[18-20]等重要生理过程。为了探讨延缓荷花花瓣衰老的方法,研究了外源亚精胺对荷花花瓣生理指标和衰老的影响,以期为延长荷花花期、单花寿命以及鲜切花的发展提供理论依据。
1 材料和方法
1.1 试验材料
试验材料为荷花品种青玉(NelumbonuciferaGaertn‘Qing yu’),购于河南郑州田园情水生花卉基地,种植于河南农业大学第三试验区。于荷花立蕾期在莲蓬、叶片主脉注射及在其叶柄、花柄以1 cm2大小创伤+涂抹的方法施用亚精胺,施用浓度分别为0.01、0.05、0.10、0.50、1.00 mmol/L,对照(CK,0 mmol/L亚精胺)注射和涂抹等体积蒸馏水。每天8:00进行采样,采收不同发育时期(立蕾期、现蕾期、初花期、盛花期、谢花期)的花瓣(图1),用去离子水冲洗,然后迅速放入盛有液氮的保温瓶中带回,放入-80 ℃超低温冰箱中保存待用。

1.立蕾期; 2.现蕾期; 3.初花期; 4.盛花期; 5.谢花期图1 荷花采样不同发育时期的形态
1.2 生理指标的测定和方法
超氧化物歧化酶(SOD)活性和过氧化氢酶(CAT)活性的测定采用邹琦[21]的氮蓝四唑(NBT)法和过氧化氢法;过氧化物酶(POD)活性的测定采用李合生[22]的愈创木酚比色法;丙二醛(MDA)含量的测定采用硫代巴比妥酸(TBA)法[23]。生理指标的测量从处理后当天开始取样;在盛花期用米尺和游标卡尺测量荷花花朵的最大花茎、荷花花瓣的长和宽,并观察记录荷花的单花寿命。
1.3 数据处理
数据采用 Excel 2007和SPSS 19.0进行统计分析。
2 结果与分析
2.1 亚精胺对荷花花瓣生长及衰老的影响
由表1可见,与对照相比,0.05、0.10 mmol/L亚精胺处理使荷花的最大花茎增加了21.94%、31.88%,而0.50、1.00 mmol/L亚精胺处理则抑制了荷花的最大花茎的生长;对于荷花花瓣的影响,0.01、0.05、0.10 mmol/L亚精胺处理都在不同程度上增加了荷花花瓣的长和宽,以0.10 mmol/L的作用最为明显,长和宽分别比对照高出39.06%、34.99%,0.50、1.00 mmol/L亚精胺处理与对照相比差异不大;各个处理对荷花花瓣瓣数的影响不太明显;0.10 mmol/L亚精胺处理对于荷花单花寿命的影响最为明显,比对照延长2 d,而1.00 mmol/L处理则缩短了单花寿命。此外,从试验观察中得知,与对照相比,0.5、1.0 mmol/L亚精胺处理使荷花初花期提前1~2 d。

表1 不同浓度亚精胺对荷花盛花期花瓣生长 及单花寿命的影响
2.2 亚精胺对荷花花瓣抗氧化酶活性的影响
2.2.1 SOD活性 从表2可以看出,各个处理荷花花瓣衰老过程中的SOD活性呈先上升后下降的趋势,均在初花期达到最大值,0.50、1.00 mmol/L亚精胺处理在现蕾期SOD活性迅速上升,直到初花期达到最大值,分别为424.97、434.32 U/g,到后期SOD活性又急速下降,谢花期显著低于其他处理;0.05、0.10 mmol/L 亚精胺处理的SOD活性最大值分别为446.43、462.33 U/g,比对照高1.45%、5.06%,并且高于其他处理,到谢花期显著高于其他处理。以上结果表明,0.05、0.10 mmol/L亚精胺处理在荷花花瓣衰老过程中有利于提高其SOD活性,防止花瓣衰老。

表2 不同浓度亚精胺处理对荷花花瓣SOD活性的影响 U/g
注:同列不同小写字母表示在0.05水平上差异显著,下同。
2.2.2 POD活性 从表3可以看出,对照的POD活性在初花期迅速达到最大值,为273.96 U/(g·min),0.01、0.05、0.10 mmol/L亚精胺处理的POD 活性最大值均出现在盛花期,分别为315.19、360.83、398.98 U/(g·min),而且均高于对照,其他处理的 POD 活性最大值均低于对照,0.10 mmol/L亚精胺处理的POD活性最大值比对照和0.01、0.05 mmol/L亚精胺处理的POD活性最大值分别高45.63%和26.58%、10.57%。谢花期各处理间POD活性差异显著。由此说明,0.05、0.10 mmol/L亚精胺处理表现出较高的POD活性,有利于延缓荷花花瓣的衰老。
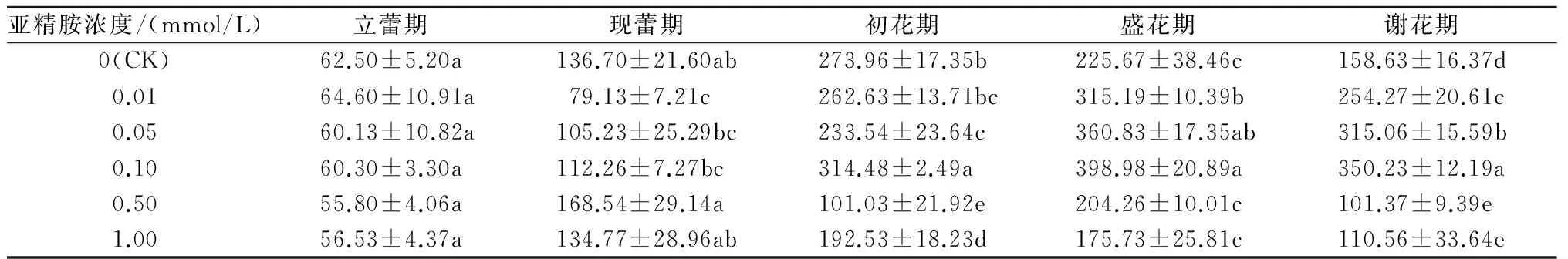
表3 不同浓度亚精胺处理对荷花花瓣POD活性的影响 U/(g·min)
2.2.3 CAT活性 CAT是生物体内防御系统的最关键酶之一,能够有效清除植物细胞体内过量的活性氧和自由基。从表4可以看出,各个处理荷花花瓣衰老过程中的CAT活性呈先上升后下降的趋势。对照的CAT活性在盛花期达到最大值,为356.00 U/(g·min),0.01、0.05、0.10 mmol/L亚精胺处理的CAT活性最大值均出现在盛花期,分别为370.00、396.00、420.00 U/(g·min),比对照高出3.93%、11.24%、17.98%。0.50、1.00 mmol/L亚精胺处理的荷花花瓣CAT活性在初花期达到最大值,分别为342.00、318.00 U/(g·min),低于对照。以上结果表明,0.10、0.05 mmol/L亚精胺处理的荷花花瓣表现出较高的CAT活性。
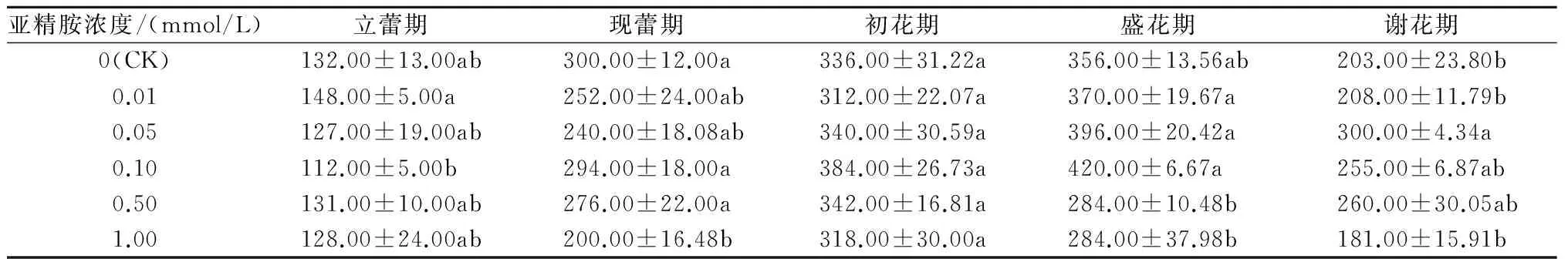
表4 不同浓度亚精胺处理对荷花花瓣CAT活性的影响 U/(g·min)
2.3 亚精胺对荷花花瓣MDA含量的影响
衰老固有的特征就是膜质过氧化,而MDA作为细胞膜质过氧化的指标[24],不仅是过氧化的产物,又能与细胞内各种成分发生强烈的反应,严重损害膜系统和多种保护酶,其含量的高低反映出膜质过氧化的程度,对荷花花瓣衰老有重要的影响。从表5可以看出,各处理间荷花花瓣MDA含量初期上升趋势差异不大,到初花期差异逐渐增加,1.00 mmol/L亚精胺处理在初花期突然升高,而其他处理的MDA含量上升趋势差别不大,0.05 mmol/L亚精胺处理的MDA含量在立蕾期、现蕾期低于其他处理,0.10 mmol/L亚精胺处理的MDA含量在初花期、盛花期、谢花期低于其他处理,说明0.10、0.05 mmol/L亚精胺处理具有降低荷花花瓣衰老后期细胞膜脂过氧化程度的作用,可以延缓荷花花瓣的衰老。

表5 不同浓度亚精胺处理对荷花花瓣MDA含量的影响 μmol/g
3 结论与讨论
前人就植物对亚精胺的生理反应做过很多的研究,杨丽等[25]以切花菊神马为材料研究发现,0.10 mmol/L 亚精胺促进菊花开花,延长花期,提高菊花切花品质,1.00 mmol/L 亚精胺则抑制开花,缩短了菊花花期。柏素花[26]用外源亚精胺处理离体大豆叶发现,亚精胺处理可以减缓大豆叶片叶绿素、蛋白质的降解,明显抑制SOD 活性的下降、POD活性的上升和MDA含量的增加,外源亚精胺处理能延缓大豆离体叶片的衰老。阳成伟等[27]用0.10 mmol/L 亚精胺和精胺处理切花月季发现,0.10 mmol/L 外源亚精胺和精胺处理均能延缓MDA含量和膜相对透性的上升,延缓切花月季的衰老,改善其品质。前人的研究结果表明,亚精胺对植物衰老具有一定的延缓作用,但是这些试验均是研究离体材料在不同亚精胺浓度下衰老的生理反应。而本试验研究了不同亚精胺浓度下连体荷花花瓣材料衰老的生理反应,所得到的数据更接近于实际状况,对荷花花瓣衰老的研究更具有指导意义。
本试验结果表明,随着亚精胺浓度的增加,对荷花花瓣衰老过程中酶活性的促进作用也越来越明显,到达一定浓度则抑制了酶活性的上升。0.05、0.10 mmol/L 亚精胺处理明显增大了荷花的最大花茎及荷花花瓣的长和宽,延长了荷花的单花寿命,但对荷花花瓣数影响不大。0.05、0.10 mmol/L亚精胺处理对荷花花瓣SOD和CAT活性的提高效果最为明显,以0.10 mmol/L亚精胺处理效果最佳。0.05、0.10 mmol/L亚精胺处理对荷花花瓣POD活性的提高和MDA积累量的降低效果最为明显,以0.10 mmol/L亚精胺处理效果最佳。低浓度亚精胺能维持荷花花瓣衰老过程中具有较高的 SOD 活性,降低了MDA的积累,其中以0.10 mmol/L亚精胺处理作用效果最佳。此外,0.50、1.00 mmol/L亚精胺处理虽然降低了酶活性,提高了MDA含量,但是会使荷花初花期提前1~2 d。
[1] 孔德政,刘晶晶,杨秋生.荷花花瓣衰老过程中的生理生化分析[J].河南农业科学,2007,36(6):114-117.
[2] 孔德政,申雪莹,孟伟芳,等.外源激素对碗莲开花及酶活性的影响[J].东北林业大学学报,2015,43(3):79-82.
[3] 姜红卫,李欣,江君,等.苏南观赏荷花设施栽培周年开花技术研究[J].江苏农业科学,2013(12):191-193.
[4] 杨镇明,程萍,罗丽霞.珠海冬季荷花反季节栽培技术[J].广东农业科学,2006(7):83-84.
[5] 王颖,何生根,伍春莲.多胺代谢和种子萌发[J].种子,2003(2):53-56.
[6] 付玉营,马文广,曹栋栋,等.多胺对种子萌发生长及成熟的影响[J].种子,2016,35(5):52-56.
[7] 刘春艳,吴强盛.多胺在植物生长发育中的作用[J].生物学教学,2010,35(10):4-6.
[8] Yu H,Zhao W,Wang M,etal.The exogenous application of spermidine alleviates photosynthetic inhibition and membrane lipid peroxidation under low-light stress in tomato(LycopersiconesculentumMill.) seedlings[J].Plant Growth Regulation,2016,78(3):1-8.
[9] 丁义峰,刘萍,常云霞,等.精胺对菊花蕾期叶片生理及花期形态的影响[J].湖北农业科学,2006,45(6):789-791.
[10] 陈以俊,沈惠娟.石竹花芽发生与内源多胺含量的关系[J].园艺学报,1999,26(5):341-342.
[11] 郭俊娥,李田,孙宪芝,等.亚精胺参与菊花花芽分化的调控研究[J].北京林业大学学报,2014,36(4):88-93.
[12] 李州,彭燕.亚精胺对水分胁迫下白三叶脯氨酸代谢、抗氧化酶活性及其基因表达的影响[J].草业学报,2015,24(4):148-156.
[13] 孙鑫博,韩烈保.亚精胺、精胺对低温下内源激素含量及内源多胺代谢的影响[J].草地学报,2015,23(4):804-810.
[14] 陆芳勤,王欣,沈潼,等.多胺代谢与植物环境胁迫[J].天津农业科学,2014,20(3):15-17.
[15] 杜红阳,侯小歌,刘怀攀.亚精胺浸种对渗透胁迫下玉米种子萌发和淀粉酶活性的影响[J].河南农业科学,2010,39(5):8-10.
[16] 王强,尹相博.不同种类外源多胺缓解大豆盐胁迫伤害的研究[J].河南农业科学,2014,43(4):48-50.
[17] Agami R A.Pre-soaking in indole-3-acetic acid or spermidine enhances copper tolerance in wheat seedlings[J].South African Journal of Botany,2016,104:167-174.
[18] 刘萍,常云霞,丁义峰.亚精胺对牡丹膜质过氧化的影响[J].湖北农业科学,2007,46(5):774-776.
[19] 黄漫青,韩涛,李丽萍,等.多胺对果蔬采后衰老的抑制作用[J].北京农学院学报,2003,18(4):302-306.
[20] Altman A.Inhibition of senescence of leaves and other plant organs by polyamines[J].Israel Journal of Botany,1979,28(1):55-63.
[21] 邹琦.植物生理生化实验指导[M].北京:中国农业出版社,1995.
[22] 李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,2000.
[23] 赵世杰,许长成,邹琦,等.植物组织中丙二醛测定方法的改进[J].植物生理学通讯,1994(3):207-210.
[24] 石鹏.干旱预处理诱导白三叶抗旱性的生理机制与抗氧化酶基因差异表达[D].雅安:四川农业大学,2012.
[25] 杨丽,杨际双.亚精胺对秋菊‘神马’成花诱导期间内源多胺和开花的影响[J].河北农业大学学报,2009,32(6):41-46.
[26] 柏素花.外源亚精胺对大豆离体叶片衰老的影响[J].中国农学通报,2008,24(6):243-246.
[27] 阳成伟,蒋跃明,何生根.月季切花衰老过程中多胺与膜脂过氧化的关系[J].西北植物学报,2001,21(6):1157-1161.
Effects of Exogenous Spermidine on Flower Senescence of Lotus
LI Wenling1,ZHANG Xianli2,WANG Peipei2,LIU Yiping2,KONG Dezheng2*
(1.Zhengzhou Lüwen Square Management Department,Zhengzhou 450002,China;2.College of Forestry,Henan Agricultural University,Zhengzhou 450002,China)
To investigate effect of spermidine(Spd) on lotus senescence,lotus ‘Qing yu’ was used as the materials to study the effects of different concentrations of Spd during the senescence process of lotus petal.And we also measured the activity of superoxide dismutase(SOD),peroxidase(POD),catalase(CAT) and the content of MDA,to provide the basis for delaying senescence of lotus.The results showed that the treatmeat of 0.10 mmol/L of Spd preferably increased the largest stem and petal length oflotus,and delayed seneacence of the lotus flower natural life.The highest activities of SOD,POD,CAT were 5.06%,45.63%,17.98% higher than those of CK under the treatment of 0.10 mmol/L of Spd,and also higher than other treatments.The content of MDA was lower than other treatments at initial-flowering,full-flowering and flower-wilting stages under the treatment of 0.10 mmol/L of Spd.Initial-flowering stage was advanced by one or two days under the treatments of 0.50,1.00 mmol/L of Spd,and the maximum of CAT activity was also ahead of time.Under this experimental condition,the treatmeat of 0.10 mmol/L of Spd could significantly improve the physiological functions and flower quality of the petal during the lotus senescence process.
lotus; spermidine; flower senescence; enzyme activity; MDA
2016-12-22
河南省重大科技项目(30601044)
李文玲(1969-),女,河南襄城人,工程师,主要从事城市园林绿化工作。E-mail:1510511070@qq.com
*通讯作者:孔德政(1964-),男,江苏南京人,教授,博士,主要从事园林植物栽培、组织培养的研究。 E-mail:wugongzhu123@163.com
S682.32
A
1004-3268(2017)04-0095-05
