雷公藤甲素在正常大鼠和佐剂性关节炎模型大鼠体内的药动学研究
2017-04-12陈凯丽易剑峰翟文静宜春学院化学与生物工程学院江西宜春336000
陈凯丽,易剑峰,翟文静,孙 兰,孙 文(宜春学院化学与生物工程学院,江西 宜春 336000)
雷公藤甲素在正常大鼠和佐剂性关节炎模型大鼠体内的药动学研究
陈凯丽*,易剑峰#,翟文静,孙 兰,孙 文(宜春学院化学与生物工程学院,江西 宜春 336000)
目的:研究雷公藤多苷片中活性成分雷公藤甲素在正常大鼠和佐剂性关节炎模型大鼠体内的药动学特征,为其临床合理用药提供参考。方法:将12只SD大鼠随机分为正常组和模型组,每组6只。模型组大鼠sc完全弗氏佐剂0.1 mL复制佐剂性关节炎模型,正常组大鼠sc等体积生理盐水。造模14 d后,两组大鼠均ig雷公藤多苷片混悬液96 mg/kg,分别于给药前及给药后10、30、45、60、90、120、150、180、240、300、420 min眼眶取血0.4 mL,采用高效液相色谱法测定雷公藤甲素的血药浓度;采用DAS 2.0药动学软件计算药动学参数,并进行比较。结果:雷公藤甲素在正常组、模型组大鼠体内的cmax分别为(1.139±0.114)、(0.916± 0.103)μg/mL,tmax分别为(2.167±0.606)、(3.083±0.801)h,t1/2α分别为(5.500±3.610)、(5.593±1.795)h,AUC0-7h分别为(5.052± 0.371)、(4.707±0.347)μg·h/mL,MRT0-7h分别为(3.224±0.119)、(3.429±0.139)h,CL分别为(11.616±2.986)、(11.246±2.638)mL/h。与正常组比较,模型组大鼠cmax显著减小,tmax和MRT0-7h显著延长(P<0.05)。结论:佐剂性关节炎会影响大鼠体内雷公藤甲素的药动学特征,其可促进大鼠体内雷公藤甲素的吸收与消除。
雷公藤多苷片;佐剂性关节炎;雷公藤甲素;药动学;大鼠
类风湿关节炎(Rheumatoid arthritis,RA)属于慢性全身性自身免疫性疾病,主要临床表现为关节周围组织和滑膜非感染性炎症病变,临床治疗多采用口服给药。雷公藤多苷片(Tripterygium glycosides tablets,TGPT)为传统中成药,是从卫矛科植物雷公藤的根芯部分提取并精制而成的混合物,雷公藤甲素(Triptolide)为其最主要的活性成分,其抗炎作用显著,治疗RA和其他自身免疫性疾病疗效较好,是常用的免疫抑制剂。临床研究表明,雷公藤甲素能明显缓解关节疼痛,但同时具有多器官毒性、安全范围较小的特点,使其临床使用受到一定限制[1-2]。因此,在本研究中笔者拟探讨雷公藤甲素在正常大鼠和佐剂性关节炎大鼠体内的药动学特征,以为其治疗RA提供实验依据。
1 材料
1.1 仪器
1200高效液相色谱(HPLC)仪,包括G1315D二极管阵列检测器(美国Angilent公司);5415R高速低温离心机(德国EPPENDORF公司);FC204电子天平(上海精科天平仪器厂)。
1.2 药材、药品与试剂
雷公藤多苷片(湖南千金协力药业有限公司,批号:20150301,规格:0.1 mg/片);雷公藤甲素对照品(上海源叶生物科技有限公司,批号:38748-32-2,纯度:98%);完全弗氏佐剂(美国Sigma公司);乙腈、甲醇为色谱纯,乙酸乙酯为分析纯。
1.3 动物
SPF级SD大鼠,12只、♂,体质量(280±15)g,由湖南斯莱克景达实验动物有限公司提供,合格证号:43004700021623,许可证号:SCXK(湘)2013-0004。实验遵循动物实验伦理委员会指导原则,实验前12 h禁食不禁水。
2 方法
2.1 色谱条件
[3-5]改进色谱条件。色谱柱:Agilent Eclipse XDB-C18(150 mm×4.6 mm,5 μm);柱温:30℃;流动相:乙腈-水(30∶70,V/V);流速:0.8 mL/min;检测波长:218 nm;进样量:20 μL。
2.2 标准溶液的制备
精密称取雷公藤甲素对照品5 mg,置于5 mL量瓶中,甲醇溶解并定容,即得质量浓度为1 mg/mL的雷公藤甲素对照品溶液。依次稀释为质量浓度为800、100、50、10、1 μg/mL的系列标准溶液,4℃冰箱保存,备用。
2.3 分组、造模、给药与取血
12只SD大鼠随机分为正常组和模型组,每组6只。模型组大鼠于右后足趾部sc完全弗氏佐剂0.1 mL以复制佐剂性关节炎模型;正常组大鼠sc等体积生理盐水。14 d后,两组大鼠分别ig雷公藤多苷片混悬液96 mg/kg(溶剂为0.5%羧甲基纤维素钠,给药剂量根据前期预实验确定)。分别于给药前及给药后10、30、45、60、90、120、150、180、240、300、420 min从眼眶取血0.4 mL,置于含肝素钠的EP管中,离心(离心半径为8 cm、3 500 r/min)15 min,-80℃冰箱冷冻保存,备用。
2.4 血浆样品处理
吸取“2.3”项下血浆100 μL,置于EP管1中,加入乙酸乙酯300 μL,涡旋2 min,静止1 min分层后离心(离心半径为8 cm、8 000 r/min)10 min,取上清液于EP管2中;向EP管1中再加入乙酸乙酯300 μL,同上法取上清液,与EP管2中的上清液混匀;以55~60℃水浴蒸干,加入100 μL甲醇复溶,旋涡混匀,离心(离心半径为8 cm、12 000 r/min)10 min后,吸取20 μL进样测定[6-7]。
2.5 雷公藤甲素血药浓度测定的方法学考察
按照相关规定考察雷公藤甲素血药浓度测定方法的专属性、回归方程与线性范围、日内和日间精密度、准确度、提取回收率和稳定性。
2.6 药动学研究
取“2.4”项下处理血浆后,按“2.1”项下色谱条件进样分析,绘制药-时曲线,并采用DAS 2.0药动学软件计算药动学参数。
2.7 数据处理
采用DAS 2.0药动学软件对大鼠体内的药-时曲线进行非房室模型拟合,采用SPSS 17.0统计软件对两组药动学参数进行计算。数据以±s表示,采用独立样本t检验。P<0.05表示差异有统计学意义。
3 结果
3.1 方法学考察结果
3.1.1 专属性考察 按相关要求进行操作,结果雷公藤甲素在该色谱条件下分离度好、峰形良好、样品峰附近无内源杂峰干扰,表明本方法专属性良好。
3.1.2 回归方程、精密度、准确度、提取回收率与稳定性考察 按相关要求进行操作,以雷公藤甲素质量浓度(x,μg/mL)为横坐标,峰面积(y)为纵坐标进行线性回归,结果雷公藤甲素的回归方程为y=77.723x-33.224(r=0.998 2),检测质量浓度线性范围为0.29~36.48 μg/mL;日内、日间精密度试验的RSD均不大于4.53%(n=5),准确度在81.23%~93.46%之间(RSD均不大于5.0%,n=5);提取回收率在77.20%~88.16%之间(RSD均不大于2.04%,n=3);室温放置4 h、-80℃冻存20 d、反复冻融3次后稳定性的RSD≤4.95%(n=5)。考察结果表明,精密度、准确度、提取回收率与稳定性符合相关要求。
3.2 药动学研究结果
两组大鼠ig雷公藤多苷片混悬液后药-时曲线见图1。采用DAS 2.0软件,按照非房室模型进行处理,计算药动学参数,结果见表1。
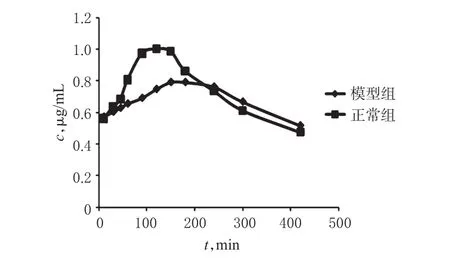
图1 雷公藤甲素在正常大鼠和佐剂性关节炎模型大鼠体内的药-时曲线Fig 1 Plasma concentration-time curves of triptolide in normal rats and adjuvant arthritis rats
由表1可知,与正常组比较,模型组大鼠体内雷公藤甲素的cmax显著减小,tmax、MRT0-7h显著延长(P<0.05)。
4 讨论
参考预实验和文献报道[8],TGPT主要成分雷公藤甲素在甲醇、乙腈等溶剂中较稳定,前期预实验对样品提取方法进行了考察,经比较后发现采用乙酸乙酯萃取结果较好。本研究建立的HPLC法专属性较好、灵敏度较高,且方法简单可靠,可满足雷公藤甲素血浆药物浓度分析的需要。
大鼠右后足趾部sc完全弗氏佐剂0.1 mL可成功复制佐剂性关节炎模型,与RA的临床表现、病理生理以及免疫学变化等方面有相似特征[9-10]。此外,由于TGPT成分复杂,雷公藤甲素含量较低,在预实验时发现TGPT中所含雷公藤甲素吸收入血后含量较低,按照临床常用剂量折算后给药,其血药浓度不在线性范围内,无法估计正常和病理状态下的药动学参数。参考相关毒性研究文献对给药剂量进行优化后发现,选用稍高于临床剂量连续给药1个月后可进行正常状态和病理状态下的药动学研究[11-12],因此本实验选用稍高于临床剂量(约9倍)换算后进行研究。
采用DAS 2.0软件拟合药动学参数的结果显示,模型组大鼠体内雷公藤甲素cmax显著低于正常组,tmax、MRT0-7h显著高于正常组,这表明雷公藤甲素在佐剂性关节炎大鼠体内的吸收速度减慢、血药浓度显著降低,与正常组大鼠药动学行为相比存在显著差异。这可能是受到模型大鼠体内的炎症介质、滑膜成纤维细胞的表达及T细胞和细胞因子分泌等的影响[13-15],从而使药物的药动学行为发生改变,但具体的作用机制还有待进一步研究。
综上所述,佐剂性关节炎会影响大鼠体内雷公藤甲素的药动学特征,其可促进大鼠体内雷公藤甲素的吸收与消除。但不同病理状态对雷公藤甲素药动学的影响程度尚需进一步研究确定。本研究结果可为TGPT在临床上对不同机体状态的患者制订合理给药方案提供参考,以进一步提高其临床用药的疗效和安全性。
表1 雷公藤甲素在正常和佐剂性关节炎大鼠体内的主要药动学参数(±s,n=6)Tab 1 Main pharmacokinetic parameters of triptolide in normal and adjuvant arthritis rats in vivo(±s,n=6)

表1 雷公藤甲素在正常和佐剂性关节炎大鼠体内的主要药动学参数(±s,n=6)Tab 1 Main pharmacokinetic parameters of triptolide in normal and adjuvant arthritis rats in vivo(±s,n=6)
注:与正常组比较,*P<0.05Note:vs.normal group,*P<0.05
药动学参数tmax,h cmax,μg/mL AUC0-7h,μg·h/mL AUC0-∞,μg·h/mL AUMC0-7hAUMC0-∞MRT0-7h,h MRT0-∞,h t1/2α,h CL,mL/h V,mL模型组3.083±0.801*0.916±0.103*4.707±0.347 8.954±2.174 16.169±1.733 84.059±42.437 3.429±0.139*8.927±2.402 5.593±1.795 11.246±2.638 85.719±13.111正常组2.167±0.606 1.139±0.114 5.052±0.371 8.934±3.209 16.294±1.455 87.971±91.381 3.224±0.119 8.446±4.774 5.500±3.610 11.616±2.986 80.137±21.690
参考文献
[1] Bao J,Dai SM.AChinese herb Tripterygium wilfordii hook F in the treatment of rheumatoid arthritis:mechanism,efficacy,and safety[J].Rheumatol Int,2011,31(9):1123-1129.
[2] 贾歌刘畅,庞晶瑶,马致洁,等.雷公藤肝毒性化学成分、毒性机制及减毒方法研究进展[J].中国药房,2016,27(13):1857-1861.
[3]Su MX,Song M,Yang DS,et al.Simultaneous LC-MS/ MS determination of five tripterygium pyridine alkaloids in dog plasma and its application to their pharmacokinetic study after oral administration of tripterygium glycosides tablets[J].J Chro B,2015,990(23):31-38.
[4] 李颖,汪永忠,罗欢,等.类风湿关节炎患者雷公藤甲素血清浓度测定及其药动学研究[J].中国中医药信息杂志,2014,21(1):85-87.
[5]张军,陈玟,刘史佳,等.LC/APCI/MS/MS测定Beagle犬口服雷公藤片后血浆中雷公藤甲素[J].中国药理学通报,2013,29(12):1765-1768.
[6] Shao F,Wang GJ,Xie HT,et al.Pharmacokinetic study of triptolide,a constituent of immunosuppressive Chinese herb medicine in rats[J].Biol Pharm Bull,2007,30(4):702-707.
[7] Zhuang XM,Liu PX,Zhang YJ,et al.Simultaneous determination of triptolide and its prodrug MC002 in dog blood by LC-MS/MS and its application in pharmacokinetic studies[J].Journal of Ethnopharmacology,2013,150(1):131-137.
[8] 余炜,黄秀旺,许建华,等.HPLC法测定大鼠血浆中雷公藤内酯醇及其药代动力学研究[J].中药药理与临床,2007,23(2):15-17.
[9] 宋珊珊,张玲玲,魏伟.实验性关节炎动物模型建立及病理机制研究进展[J].中国药理学通报,2011,27(12):1648-1653.
[10] Wan L,Liu J,Huang CB,et al.Effect of tripterygium glycosides on pulmonary function in adjuvant arthritis rats[J]. Journal of the Chinese Medical Association,2013,76(12):715-723.
[11] 薛璟,贾晓斌,谭晓斌,等.雷公藤化学成分及其毒性研究进展[J].中华中医药杂志,2010,25(5):726-733.
[12] 邵凤,孙建国,王广基,等.雷公藤甲素在Beagle犬体内毒代动力学研究[J].中国临床药理学与治疗学,2014,19(12):1326-1331.
[13] 王爽,张如松.雷公藤多苷治疗自身免疫疾病作用机制的研究进展[J].中成药,2011,33(3):498-501.
[14] 王伟东,肖鲁伟,童培建,等.雷公藤内酯醇对RA滑膜新生血管翳TNF-α抑制机理的研究[J].中华中医药学刊,2013,31(5):1034-1035.
[15] 周铭,马丽华,崔颖,等.雷公藤甲素对类风湿性关节炎患者外周血T细胞的免疫抑制作用[J].中国药房,2014,25(47):4441-4443.
(编辑:刘明伟)
Pharmacokinetic Study on the Triptolide in Normal Rats and Adjuvant Arthritis Model Rats in vivo
CHEN Kaili,YI Jianfeng,ZHAI Wenjing,SUN Lan,SUN Wen(School of Chemistry and Bioengineering,the College of Yichun,Jiangxi Yichun,336000 China)
OBJECTIVE:To study the pharmacokinetics of triptolide in Tripterygium glycosides tablet in normal rats and adjuvant arthritis model rats in vivo,and provide reference for clinical rational drug use.METHODS:12 SD rats were randomly divided into normal group and model group,6 in each group.Model group was subcutaneously injected complete Freund’s adjuvant 0.1 mL to induce adjuvant arthritis model,normal group was subcutaneously injected the same volume of saline.After 14 d modeling,2 groups were given Tripterygium glycosides tablet suspension 96 mg/kg intragastrically,the blood sample of eyes 0.4 mL were respectively taken before and 10,30,45,60,90,120,150,180,240,300,420 min after administration.The plasma concentration of triptolide was determined by HPLC,the pharmacokinetic parameters were calculated by DAS 2.0 software,and the parameters were compared.RESULTS:The pharmacokinetic parameters of triptolide in normal group were cmaxof(1.139±0.114)μg/mL,tmaxof(2.167±0.606)h,t1/2αof(5.500±3.610)h,AUC0-7hof(5.052±0.371)μg·h/mL,MRT0-7hof(3.224±0.119)h,and CL of(11.616±2.986)mL/h;and those in model group were cmaxof(0.916±0.103)μg/mL,tmaxof(3.083±0.801)h,t1/2αof(5.593±1.795)h,AUC0-7hof(4.707±0.347)μg·h/mL,MRT0-7hof(3.429±0.139)h,and CL of(11.246±2.638) mL/h. Compared with normal group,cmaxin model group was significantly decreased,tmaxand MRT0-7hwere significantly prolonged(P<0.05).CONCLUSIONS:Adjuvant arthritis can affect the pharmacokinetics of triptolide in rats in vivo,and promote its absorption and removal.
Tripterygium glycosides tablet;Adjuvant arthritis;Triptolide;Pharmacokinetics;Rats
R969.1;R284.1
A
1001-0408(2017)07-0923-03
2016-08-07
2016-12-31)
*硕士研究生。研究方向:临床药学。E-mail:1043160721@qq. com
#通信作者:教授,博士。研究方向:临床药学。电话:0795-3200633。E-mail:rainbowyjf@126.com
DOI10.6039/j.issn.1001-0408.2017.07.17
