汉防己多糖对急性酒精性肝损伤小鼠氧化应激及肝细胞凋亡的影响Δ
2017-04-12赵南晰吴畏难吉林医药学院基础医学院吉林吉林0吉林医药学院检验学院吉林吉林北华大学药学院吉林吉林吉林市中心医院普外科吉林吉林
徐 博,沈 楠,安 英,李 妍,李 贺,赵南晰,吴畏难(.吉林医药学院基础医学院,吉林吉林0;.吉林医药学院检验学院,吉林吉林 0;.北华大学药学院,吉林吉林 0;.吉林市中心医院普外科,吉林吉林 0)
汉防己多糖对急性酒精性肝损伤小鼠氧化应激及肝细胞凋亡的影响Δ
徐 博1*,沈 楠1,安 英1,李 妍2,李 贺3,赵南晰3,吴畏难4(1.吉林医药学院基础医学院,吉林吉林132013;2.吉林医药学院检验学院,吉林吉林 132013;3.北华大学药学院,吉林吉林 132013;4.吉林市中心医院普外科,吉林吉林 132011)
目的:探讨汉防己多糖对急性酒精性肝损伤小鼠的保护作用及其机制。方法:将60只小鼠随机分为空白对照组(生理盐水)、模型组(生理盐水)、联苯双酯组(阳性对照,150 mg/kg)和汉防己多糖低、中、高剂量组(100、200、400 mg/kg),每组10只,ig给药,每天1次,连续7 d。末次给药1 h后,除空白对照组外其余各组小鼠均ig 50%乙醇(0.1 mL/10 g)溶液复制急性酒精性肝损伤模型。12 h后,测定小鼠血清中丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)水平以及肝组织中丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-Px)水平;苏木精-伊红染色观察小鼠肝组织病理改变;流式细胞术检测肝细胞凋亡率。结果:与空白对照组比较,模型组小鼠肝组织发生水肿、细胞排列紊乱及局部坏死等病变,血清中ALT、AST水平和肝组织中MDA水平以及肝细胞凋亡率显著升高,肝组织中SOD、GSH、GSH-Px水平显著降低,差异均有统计学意义(P<0.01)。与模型组比较,汉防己多糖中、高剂量组小鼠肝组织细胞变性和坏死程度均减轻;除汉防己多糖低剂量组小鼠肝细胞凋亡率降低不明显外,其余各给药组小鼠上述指标均显著改善(P<0.05或P<0.01)。结论:汉防己多糖对急性酒精性肝损伤小鼠具有明显的保护作用,其机制可能与抗氧化应激及减少肝细胞凋亡有关。
汉防己多糖;急性酒精性肝损伤;抗氧化;细胞凋亡;小鼠
汉防己为传统中药材,应用历史悠久,为防己科多年生藤本植物,其块根入药。研究表明,汉防己具有利水消肿、行气止痛、祛风除湿等功效,其中生物碱、挥发油及多糖为汉防己的主要活性成分[1]。汉防己对肝损伤的保护作用多见报道,尤其是汉防己甲素对实验性肝损伤具有明显的保护作用[2]。汉防己多糖为汉防己的活性成分之一,其体内、外抗氧化作用均已被证实[3]。鉴于已有大量关于植物多糖具有减轻肝损伤作用的报道,且氧化应激损伤在急性酒精性肝损伤进展中起着重要作用[4-5],故本研究旨在通过探讨汉防己多糖对急性酒精性肝损伤小鼠是否具有保护作用,并初步阐明其与氧化应激及肝细胞凋亡的相关性,以期为后续的深入研究及临床应用奠定实验基础。
1 材料
1.1 仪器
722型可见光分光光度计(上海欣茂仪器有限公司);TDL-40B型台式离心机(上海安亭科学仪器有限公司);Smarte-500型数码生物显微镜(上海蔡康光学仪器有限公司);EPICS-XL型流式细胞仪(美国贝克曼公司)。
1.2 药品与试剂
汉防己多糖(由长春中医药大学提供,批号:201502,规格:多糖含量为86.7%);联苯双酯滴丸(浙江万邦药业股份有限公司,批号:02140107,规格:1.5 mg/丸);丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒(南京建成生物工程研究所,批号:150126、150222、150328、141211、150408、150114)。
1.3 动物
健康清洁级KM小鼠60只,♀♂各半,由吉林大学实验动物中心提供,许可证号为SCXK(吉)2010-0005。所有大鼠于常规条件下适应性饲养1周后用于实验。
2 方法
2.1 分组、给药与造模
将60只小鼠随机分为6组,分别为空白对照组(生理盐水)、模型组(生理盐水)、联苯双酯组(阳性对照,150 mg/kg)[6]和汉防己多糖低、中、高剂量组(100、200、400 mg/kg,剂量参考预实验结果设置),每组10只。ig给药(0.1 mL/10 g),每天1次,连续7 d。末次给药1 h后,除空白对照组外,其余各组小鼠均ig 50%乙醇(0.1 mL/10 g)复制急性酒精性肝损伤模型,空白对照组小鼠ig等体积蒸馏水。
2.2 血清和肝组织生化指标的测定
于造模12 h后,各组小鼠均摘眼球取血,离心,取血清,采用终点比色法按照试剂盒说明书测定血清中ALT、AST水平。然后小鼠经断髓处死,迅速取肝组织,将肝左叶剪下后于10%中性福尔马林中固定;另取肝组织100 mg,在冰水浴下加0.9 mL生理盐水,制成10%组织匀浆,离心取上清,按试剂盒说明书进行MDA、SOD、GSH及GSH-Px水平的检测。
2.3 肝组织病理学变化观察
取出于10%福尔马林溶液中固定24 h的肝组织,在0.01 mol/L磷酸盐缓冲液(PBS)中放置12 h,然后进行梯度乙醇脱水;经石蜡包埋后进行切片(4 μm),行苏木精-伊红(HE)染色;再次梯度乙醇脱水,中性树胶封片,观察并拍照。
2.4 细胞凋亡率的测定
将肝组织研碎,用PBS洗涤2次,用结合缓冲液调整细胞密度为3×108mL-1的细胞悬液,取200 μL结合缓冲液重悬细胞,加入5 μL膜联蛋白-Ⅴ-绿色荧光蛋白(Annexin-Ⅴ-GFP)工作液,室温下避光反应30 min;用结合缓冲液洗涤细胞2次,300µL结合缓冲液重悬细胞,加入碘化丙啶(PI)溶液5 μL,充分混匀后,室温避光孵育15 min;1 h内用流式细胞仪检测细胞凋亡率。
2.5 统计学方法
3 结果
3.1 汉防己多糖对急性酒精性肝损伤小鼠血清中ALT、AST水平的影响
与空白对照组比较,模型组小鼠血清中ALT、AST水平均显著升高(P<0.01);与模型组比较,各给药组小鼠血清中上述指标均显著改善(P<0.05或P<0.01),且汉防己多糖的作用呈现一定的剂量依赖性,结果见表1。
表1 各组小鼠血清中ALT、AST水平测定结果(±s,n=10)Tab 1 Determination results of ALT,AST levels in serum of mice in each group(±s,n=10)

表1 各组小鼠血清中ALT、AST水平测定结果(±s,n=10)Tab 1 Determination results of ALT,AST levels in serum of mice in each group(±s,n=10)
注:与空白对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.blank control group,**P<0.01;vs.model group,#P<0.05,##P<0.01
AST,U/L 14.18±5.15 42.25±4.36**25.54±14.63##31.34±2.74#28.68±2.04##25.78±2.01##组别空白对照组模型组联苯双酯组汉防己多糖低剂量组汉防己多糖中剂量组汉防己多糖高剂量组剂量,mg/kg 150 100 200 400 ALT,U/L 10.74±2.14 23.00±2.77**12.25±1.66##15.54±4.17##14.42±3.50##12.68±1.66##
3.2 汉防己多糖对急性酒精性肝损伤小鼠肝组织中MDA、SOD、GSH和GSH-Px水平的影响
与空白对照组比较,模型组小鼠肝组织中MDA水平升高,SOD、GSH和GSH-Px水平降低,差异均有统计学意义(P<0.01);与模型组比较,各给药组小鼠上述指标均显著改善(P<0.05或P<0.01),且汉防己多糖的作用呈现一定的剂量依赖性,结果见表2。
表2 各组小鼠肝组织中MDA、SOD、GSH和GSH-Px水平测定结果(±s,n=10)Tab 2 Determination results of MDA,SOD,GSH and GSH-Px levels in liver tissue of mice in each group(±s,n=10)

表2 各组小鼠肝组织中MDA、SOD、GSH和GSH-Px水平测定结果(±s,n=10)Tab 2 Determination results of MDA,SOD,GSH and GSH-Px levels in liver tissue of mice in each group(±s,n=10)
注:与空白对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.blank control group,**P<0.01;vs.model group,#P<0.05,##P<0.01
GSH-Px,U/mg prot644.15±19.17 401.89±49.91**576.66±21.28##424.23±46.13#497.42±12.10##515.75±16.37##组别空白对照组模型组联苯双酯组汉防己多糖低剂量组汉防己多糖中剂量组汉防己多糖高剂量组剂量,mg/kg 150 100 200 400 MDA,nmol/mg prot2.01±0.417.27±1.21**3.09±0.30##5.69±1.17##4.32±0.33##3.39±0.56##SOD,U/mg prot 233.06±13.72 126.73±27.79**201.09±10.86##180.12±21.25##181.94±15.37##195.71±17.01##GSH,μmol/g prot 4.29±0.82 1.45±0.15**3.07±0.45##1.91±0.60##2.74±0.25##2.94±0.45##
3.3 汉防己多糖对急性酒精性肝损伤小鼠肝组织病理学的影响
空白对照组小鼠肝细胞均以中央静脉为中心呈放射状排列,未见炎性细胞浸润、变性、坏死等改变。模型组小鼠肝细胞排列紊乱,出现水肿现象,同时可见局部坏死。联苯双酯组小鼠肝细胞形态与空白对照组小鼠接近,未见变性、坏死等情况。汉防己多糖低剂量组小鼠肝组织形态基本与模型组接近,而汉防己多糖中、高剂量组小鼠肝细胞变性和坏死程度与模型组比较显著减轻,结果见图1。
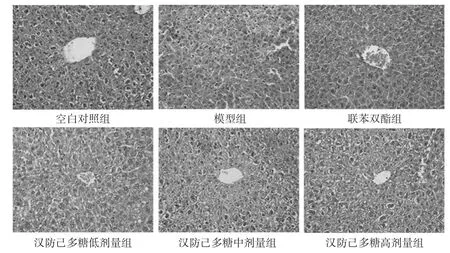
图1 各组小鼠肝组织形态观察结果(HE染色,×200)Fig 1 Observation results of liver tissue morphologyof mice in each group(HE staining,×200)
3.4 汉防己多糖对急性酒精性肝损伤小鼠肝细胞凋亡的影响
与空白对照组比较,模型组小鼠肝细胞凋亡率显著升高,存活率显著降低(P<0.01)。与模型组比较,联苯双酯组和汉防己多糖中、高剂量组小鼠肝细胞凋亡率显著降低,存活率显著升高(P<0.05或P<0.01);汉防己多糖低剂量组小鼠肝细胞存活率显著升高(P<0.05)。流式细胞图见图2、凋亡率测定结果见表3。
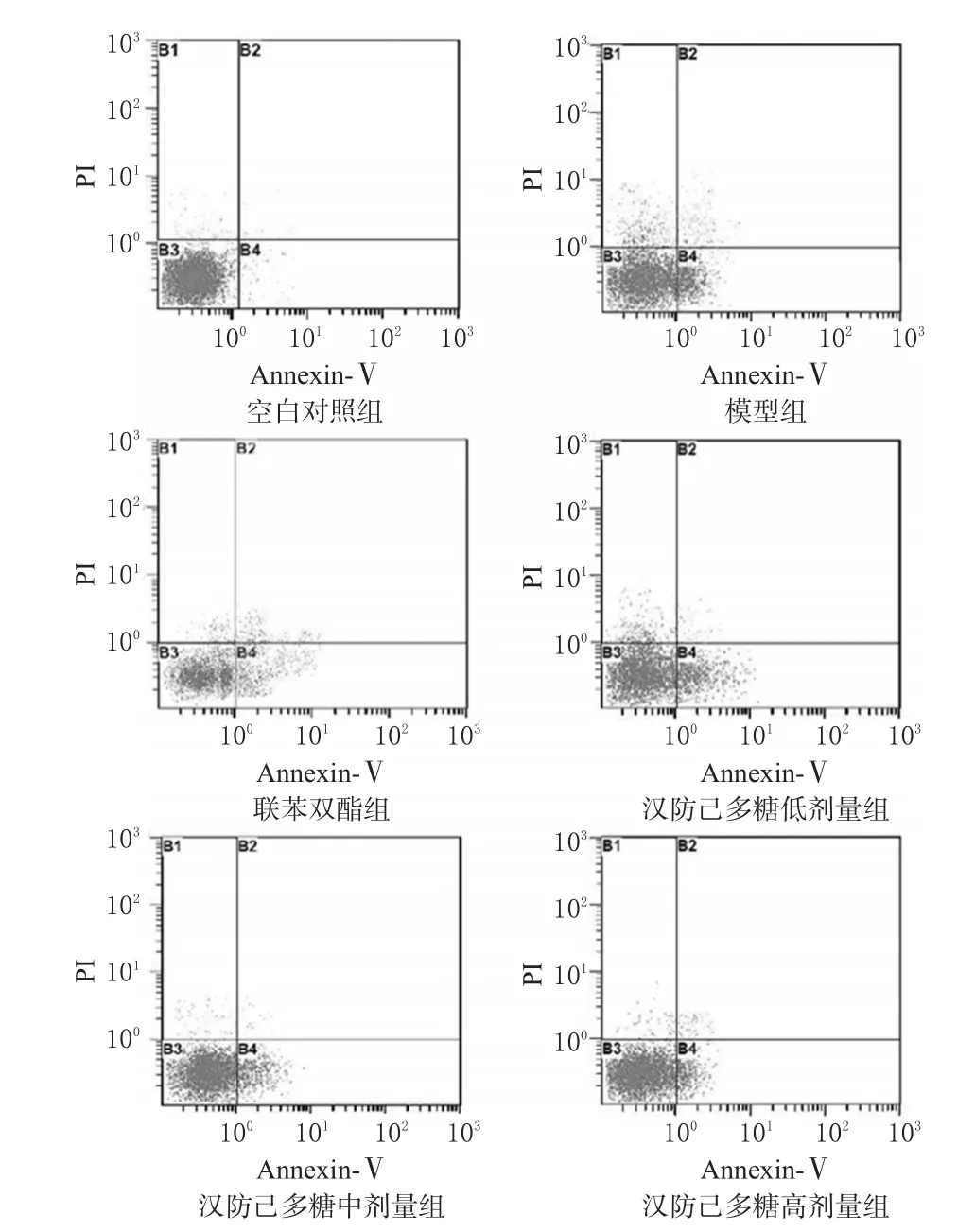
图2 各组小鼠肝细胞凋亡率测定的流式细胞图Fig 2 Cell apoptotic rate in liver of mice in each group determined by flow cytometry
表3 各组小鼠肝细胞凋亡率测定结果(±s,n=10)Tab 3 Determination results of cell apoptotic rate in liver of mice in each group(±s,n=10)
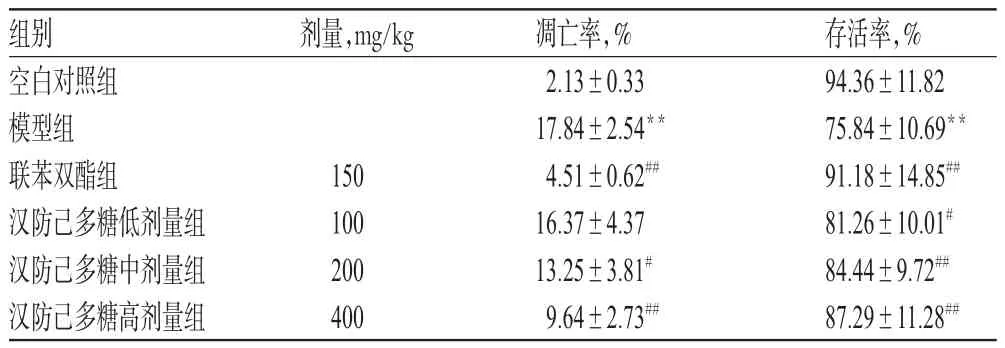
表3 各组小鼠肝细胞凋亡率测定结果(±s,n=10)Tab 3 Determination results of cell apoptotic rate in liver of mice in each group(±s,n=10)
注:与空白对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.blank control group,**P<0.01;vs.model group,#P<0.05,##P<0.01
存活率,% 94.36±11.82 75.84±10.69**91.18±14.85##81.26±10.01#84.44±9.72##87.29±11.28##组别空白对照组模型组联苯双酯组汉防己多糖低剂量组汉防己多糖中剂量组汉防己多糖高剂量组剂量,mg/kg 150 100 200 400凋亡率,% 2.13±0.33 17.84±2.54**4.51±0.62##16.37±4.37 13.25±3.81#9.64±2.73##
4 讨论
近年来,随着我国人们饮食结构和生活水平的改变,酒精性肝损伤的发病率呈明显升高趋势,严重危害了人们身体健康。开发和筛选治疗酒精性肝损伤的药物是解决急性酒精性肝病的重要课题之一[7]。酒精的过量摄入可引起肝细胞受损,引起脂肪变性、炎性细胞浸润或坏死,如果早期阶段没有得到适当的治疗可能有转化为肝硬化的风险。临床生化指标检测中,血清转氨酶活性被认为是肝细胞损伤的一项敏感指标。ALT和AST主要分布于肝脏,当肝细胞损害严重时ALT和AST释放入血[8]。联苯双酯对酒精性肝损伤具有确切的防治作用,可有效降低血清中ALT、AST水平。因此,在多数同类研究中均将其作为阳性对照药物使用[9]。本研究结果发现,联苯双酯及汉防己多糖均可以有效降低急性酒精性肝损伤小鼠血清中ALT、AST水平,这表明两者对急性酒精性肝损伤均具有一定的保护作用。
急性酒精性肝损伤发病机制中的一个重要环节是酒精导致的氧化应激。已知酒精可明显降低细胞抗氧化能力,使氧化应激产物增多,提升许多组织尤其是肝组织的氧化应激水平。用各种方法抑制肝细胞氧化应激水平的提高均有利于肝损伤的治疗[10]。MDA是脂质过氧化反应的终产物,可以沉积于细胞内,使细胞膜结构发生损坏,从而导致细胞肿胀、坏死,其水平高低可以反映过氧化损伤及细胞受损程度[11]。SOD为最重要的抗氧化酶之一,其水平高低可间接反映机体抗氧化和清除自由基的能力,具有防止细胞氧化损伤的作用。GSH为非酶类抗氧化物质,不仅可间接或直接清除自由基,还可参与另一抗氧化物酶GSH-Px的催化反应[12]。本研究结果发现,汉防己多糖可以明显改善急性酒精性肝损伤小鼠肝组织的病理改变,同时降低肝组织中MDA水平,升高肝组织中SOD、GSH、GSH-Px水平,提示其对急性酒精性肝损伤的保护作用可能是通过抗氧化应激而实现的。
肝细胞凋亡是指基因控制下的肝细胞自主而有序地死亡,此过程是为了更好地适应生存环境[13]。研究结果显示,细胞凋亡是急性酒精性肝病的重要发病机制之一,而酒精作为一种肝细胞凋亡诱导剂,可通过促进脂质过氧化反应,引起肝细胞结构及功能的异常,从而引发肝细胞凋亡[14-15]。本实验结果显示,中、高剂量汉防己多糖均可显著降低急性酒精性肝损伤小鼠肝细胞凋亡率,且低、中、高3个剂量汉防己多糖均能显著提高肝细胞存活率。以上结果提示,汉防己多糖可通过抑制酒精性肝损伤小鼠肝细胞凋亡而起到治疗肝损伤的作用。
综上所述,汉防己多糖对急性酒精性肝损伤小鼠具有明显的保护作用,其机制可能涉及抗氧化应激及减少肝细胞凋亡等,但仍需进一步研究证实。
[1] 冯劲立,沈海蓉,李想,等.防己黄芪汤对复合造模肝纤维化小鼠肝线粒体过氧化损伤的影响[J].中药新药与临床药理,2010,21(5):506-508.
[2] 何玉先,徐克沂,张启,等.汉防己甲素对大鼠实验性肝纤维化胶原蛋白合成的抑制作用[J].中国中药杂志,1996,21(3):177-179.
[3] 王蒙,魏晴,李静,等.粉防己多糖与汉中防己多糖间结构特征及抗氧化活性的比较研究[J].中华中医药杂志,2016,31(5):1674-1678.
[4] Wang XY,Luo JP,Chen R,et al.The effects of daily supplementation of Dendrobium huoshanense polysaccharide on ethanol-induced subacute liver injury in mice by proteomic analysis[J].Food Funct,2014,5(9):2020-2035.
[5] Dong Y,Huang J,Lin X,et al.Hepatoprotective effects of Yulangsan polysaccharide against isoniazid and rifampicin-induced liver injury in mice[J].J Ethnopharmacol,2014,152(1):201-206.
[6] 陈冬雪,陈亮.甘草多糖对CCl4诱导急性肝损伤模型小鼠的保护作用及其机制研究[J].中国药房,2016,27(10):1322-1325.
[7] Yin HQ,Choi YJ,Kim YC,et al.Salvia miltiorrhiza bunge and its active component cryptotanshinone protects primary cultured rat hepatocytes from acute ethanol-induced cytotoxicity and fatty infiltration[J].Food Chem Toxicol,2009,47(1):98-103.
[8] Eminler AT,Ayyildiz T,Irak K,et al.AST/ALT ratio is not useful in predicting the degree of fibrosis in chronic viral hepatitis patients[J].Eur J Gastroenterol Hepatol,2015,27(12):1361-1366.
[9] 王春梅,李贺,李生,等.北五味子木脂素对小鼠酒精性肝损伤的保护作用[J].食品科学,2014,35(13):262-265.
[10] Wu D,Cederbaum AI.Oxidative stress and alcoholic liver disease[J].Seminars in Liver Disease,2009,29(2):141-154.
[11] Purohit V,Abdelmalek MF,Barve S,et al.Role of sade-nosylmethionine,folate,and betaine in the treatmentof alcoholic liverdisease:summary of a symposium[J]. Am J Clin Nutr,2007,86(1):14-24.
[12] Gomez E,Powell ML,Bevington A,et al.A decrease in cellular energy status stimulates perk-dependent eIF2 alpha phosphorylation and regulates protein synthesis in pancreatic beta-cells[J].Biochem J,2008,410(3):485-493.
[13] Khanal T,Choi JH,Hwang YP,et al.Saponins isolated from the root of platycodon grandiflorum protect against acute ethanol-induced hepatotoxicity in mice[J].Food Chem Toxicol,2009,47(3):530-535.
[14] Zhao J,Chen H,Li Y.Protective effect of bicyclol on acute alcohol-induced liver injury in mice[J].Eur J Pharmacol,2008,586(1/2/3):322-331.
[15] Harrison-Findik DD.Is the iron regulatory hormone hepcidin a risk factor for alcoholic liver disease[J].World J Gastroenterol,2009,15(10):1186-1193.
Effects of Sinomenium acutum Polysaccharide on Oxidative Stress and Hepatocyte Apoptosis in Mice with Acute Alcoholic Liver Injury
XU Bo1,SHEN Nan1,AN Ying1,LI Yan2,LI He3,ZHAO Nanxi3,WU Weinan4(1.School of Basic Medicine,Jilin Medical College,Jilin Jilin 132013,China;2.School of Laboratory Medicine,Jilin Medical College,Jilin Jilin 132013,China;3.School of Pharmacy,Beihua University,Jilin Jilin 132013,China;4.Dept.of General Surgery,Jilin Central Hospital,Jilin Jilin 132011,China)
OBJECTIVE:To explore the protective effect and its mechanisms of Sinomenium acutum polysaccharide on mice with acute alcoholic liver injury.METHODS:60 mice were randomly divided into blank control group(normal saline),model group(normal saline),bifendate group(positive control,150 mg/kg)and S.acutum polysaccharide low-dose,medium-dose,highdose groups(100,200,400 mg/kg),10 in each group,intragastrically administrated,once a day,for continual 7 d.1 h after last administration,mice received 50%ethanol(0.1 mL/10 g)intragastrically to induce acute alcoholic liver injury model except for those in blank control group.After 12 h,alanine aminotransferase(ALT),aspartate aminotransferase(AST)levels in serum,malondialdehyde(MDA),superoxide dismutase(SOD),glutathione(GSH),glutathione peroxidase(GSH-Px)levels in liver tissue of mice were determined;hematoxylin-eosin staining was conducted to observe the pathological changes in liver tissue;flow cytometry was used to detect the cell apoptosis rate.RESULTS:Compared with blank control group,mice in model group showed pathological changes in edema,disordered cell arrangement and local necrosis;ALT and AST levels in serum,MDA level in liver tissue and hepatocyte apoptotic rate were significantly increased,while the SOD,GSH and GSH-Px levels in liver tissue were significantly decreased,with statistical significances(P<0.01).Compared with model group,cell degeneration and necrosis degree of mice were improved in S.acutum polysaccharide medium-dose and high-dose groups;except for cell apoptosis rate of liver in S.acutum polysaccharide low-dose group was not decreased significantly,the above-mentioned indicators in other treatment groups were significantly improved(P<0.05 or P<0.01).CONCLUSIONS:S.acutum polysaccharide shows obvious protective effect on mice with acute alcoholic liver injury,its mechanism might relate to antioxidation stress and inhibiting hepatocyte apoptosis.
Sinomenium acutum polysaccharide;Acute alcoholic liver injury;Anti-oxidation;Cell apoptosis;Mice
R285.5
A
1001-0408(2017)07-0885-04
2016-06-28
2016-11-06)
(编辑:林 静)
吉林省教育厅“十二五”科学技术研究项目(No.吉教科合字〔2013〕第359号);吉林省科技发展计划项目(No.20140203012YY)
*实验师,硕士。研究方向:中药药理学。E-mail:xubojl_1985@ 126.com
DOI10.6039/j.issn.1001-0408.2017.07.06
