重组人p53腺病毒注射液对肾母细胞瘤细胞增殖、凋亡及自噬的影响Δ
2017-04-12仲智勇时保军王文博河北医科大学第二医院小儿外科石家庄050017
仲智勇,时保军,周 辉,王文博(河北医科大学第二医院小儿外科,石家庄 050017)
重组人p53腺病毒注射液对肾母细胞瘤细胞增殖、凋亡及自噬的影响Δ
仲智勇*,时保军,周 辉,王文博(河北医科大学第二医院小儿外科,石家庄 050017)
目的:研究重组人p53腺病毒注射液对肾母细胞瘤细胞增殖、凋亡及自噬的影响。方法:将肾母细胞瘤细胞分别与高、中、低浓度(1×109、1×108、1×107VP/mL)的重组人p53腺病毒注射液共同孵育20 h,以不加注射液的细胞为空白对照。检测细胞增殖、周期、凋亡及相关基因p21、Bax蛋白表达,检测细胞中自噬相关基因LC-3、Atg7、Atg12表达和自噬体数量。结果:高、中、低浓度重组人p53腺病毒注射液对肾母细胞瘤细胞的增殖抑制率分别为(42.86±3.18)%、(33.64±7.25)%、(16.26±9.07)%,细胞凋亡率分别为(53.85±9.36)%、(37.35±9.64)%、(23.64±10.65)%。与空白对照比较,高、中、低浓度药物作用下G0/G1期细胞均增加,其中高、中浓度药物效果较明显(P<0.05或P<0.01);高浓度下细胞中p21、Bax蛋白和LC-3、Atg7、Atg12基因表达增强,自噬体数量增加(P<0.01);中浓度下细胞中Bax蛋白表达增强(P<0.05),其余指标无明显变化(P>0.05)。结论:重组人p53腺病毒注射液可抑制肾母细胞瘤细胞增殖,诱导细胞凋亡和自噬。
肾母细胞瘤;重组人p53腺病毒注射液;细胞周期;增殖;凋亡;自噬
肾母细胞瘤是儿童常见的恶性肿瘤性疾病之一,发病率在小儿肿瘤中高居第5位,手术切除并予以辅助化疗是其主要治疗手段[1]。但对于病理分型为间变型等的肾母细胞瘤预后不良型的治疗,受到目前临床治疗手段的限制,疗效一直不稳定[2]。
重组人p53腺病毒(rAd-p53)注射液是以现代生物医学工程技术为基础,通过生物重组而制备的一类具有代表性的病毒颗粒注射液。有研究表明,rAd-p53注射液可以通过调节细胞凋亡过程对多种肿瘤起到治疗作用[3-4]。近年研究发现,自噬与细胞的凋亡有着密切的联系,二者可以相互调控。本文主要研究rAd-p53注射液对肾母细胞瘤细胞增殖、凋亡及自噬的影响。
1 材料
1.1 仪器
CKX41倒置显微镜(日本Olympus公司);DM0412低速离心机(美国赛洛捷公司,离心半径:4 cm);LSM 880激光共聚焦显微镜(德国Zeiss公司);JEM-1400透射电镜(日本JEM公司);Tanon 5500化学发光仪(上海天能科技有限公司);Multiskan MK3酶标仪、ABI7500荧光定量聚合酶链式反应(Q-PCR)仪(美国Thermo公司);FACSCantoⅡ流式细胞仪(美国BD公司)。
1.2 药品与试剂
rAd-p53注射液(深圳市赛百诺基因技术有限公司,批号:20151003,规格:1×1012VP/支);RPMI 1640培养液及胎牛血清(FBS)(美国Gibco公司);胰蛋白酶(美国Sigma公司);CCK-8试剂盒(日本同仁公司);细胞周期、细胞凋亡试剂盒(四正柏生物技术有限公司);兔p21(细胞周期相关基因)、Bax(凋亡相关基因)、LC-3(自噬相关基因)抗体及山羊抗兔二抗(美国Abcam公司);增强化学发光(ECL)液(德国Milipore公司);LC-3荧光标记试剂盒(美国Ebioscience公司);所有化学试剂均为国产分析纯。
1.3 细胞
肾母细胞瘤细胞由中国科学院细胞所提供。
2 方法
2.1 给药浓度的选择
以预试验结果为依据,本试验的Ad-p53高、中、低浓度分别设定为1×109、1×108、1×107VP/mL,rAd-p53注射液用含有10%FBS的RPMI 1640培养液进行稀释;以含有10%FBS的RPMI 1640培养液为空白对照。
2.2 肾母细胞瘤的培养
肾母细胞瘤细胞从液氮中取出后,迅速置于37℃水浴中,摇晃解冻,1 000 r/min离心3 min,去上清,转移细胞至培养瓶中,于37℃、5%CO2条件下培养。待细胞生长至密布瓶底约80%以上,加入500 μL胰酶消化细胞,加入新培养液终止消化,1 000 r/min离心3 min,重悬细胞至合适浓度后进行下一步试验操作。
2.3 rAd-p53注射液对肾母细胞瘤细胞增殖的影响
取传一代后的肾母细胞瘤细胞,取1×104个细胞接种于96孔板中,培养至对数生长期,加入适量rAd-p53注射液使其终浓度分别为1×109、1×108、1×107VP/mL(高、中、低浓度组),每个浓度设6个复孔。于37℃、5% CO2条件下培养20 h后,按照CCK-8试剂盒检测并计算细胞增殖抑制率,同时以含有10%FBS的RPMI 1640培养液培养为空白对照组。
2.4 rAd-p53注射液对肾母细胞瘤细胞周期和凋亡的影响
取传一代后的肾母细胞瘤细胞,取1×105个细胞接种于96孔板中,加入适量rAd-p53注射液使其终浓度分别为1×109、1×108、1×107VP/mL(rAd-p53高、中、低浓度组),每个浓度设6个复孔。培养20 h后,制备成细胞悬液,按照试剂盒要求加入碘化丙啶(PI)及异硫氰酸荧光素(FITC),采用流式细胞仪检测细胞周期和凋亡情况,计算凋亡率,同时以含有10%FBS的RPMI 1640培养液培养为空白对照组。
2.5 rAd-p53注射液对肾母细胞瘤细胞中p21、Bax蛋白表达的影响
同“2.4”项下方法分组、培养细胞20 h后,胰蛋白酶消化细胞,冰浴超声(200 W,10 s/次,共3次)破解细胞,提取总蛋白。总蛋白上样量为30 μg,使用7.5%聚丙烯酰胺凝胶电泳,80 V电泳30 min至平行后,使用120 V电泳90 min,200 mA恒流转膜90 min,5%脱脂奶粉封闭1 h,加入兔p21、Bax抗体(稀释比例为1∶500),4℃孵育过夜;第2天洗膜后,加入山羊抗兔二抗(稀释比例为1∶1 000),室温孵育2 h,洗膜,ECL曝光,记录数据。采用Image J软件分析条带光密度,以目标蛋白与内参β-肌动蛋白(β-actin)比值评价目标蛋白的相对表达量。
2.6 rAd-p53注射液对肾母细胞瘤细胞自噬的影响
2.6.1 自噬相关基因LC-3表达 取传一代后的肾母细胞瘤细胞,取1×104个细胞接种于激光共聚焦专用皿中,加入适量的rAd-p53注射液使其终浓度分别为1×109、1× 108、1×107VP/mL(高、中、低浓度组),每个浓度设3个复孔。培养20 h后,磷酸盐缓冲液(PBS)清洗细胞后使用4%多聚甲醛固定细胞,3%牛血清白蛋白(BSA)封闭非特异性抗原,加入10 μg/mL兔LC-3抗体孵育细胞24 h。清洗后使用FITC荧光标记二抗孵育2 h,激光共聚焦显微镜拍照记录数据,每孔拍摄3个视野,同时以含有10%FBS的RPMI 1640培养液培养为空白对照组。
2.6.2 自噬相关基因Atg7、Atg12表达 同“2.4”项下方法分组、培养细胞20 h后,吸去培养液,加入Trizol裂解细胞提取总RNA,按照Takara试剂盒说明书反转录为mRNA,并采用Q-PCR法检测Atg7、Atg12基因的表达情况,每个浓度设6个复孔。扩增条件:95℃、15 min;94℃、15 s,40个循环;62℃、60 s。引物序列:Atg7上游引物为5′-GAGGAGACCGTCTGAGCAAC-3′,下游引物为5′-TGACACAGGAAGGTGCAA-3′,扩增长度为131 bp;Atg12上游引物为 5′-AAACGTGAGCCAAGGGATT-3′,下游引物为5′-AAACGTGAGCCAAGGGATT-3′,扩增长度为132 bp;内参甘油醛-3-磷酸脱氢酶(GAPDH)上游引物为5′-TGAAGGTCGGAGTCAACGGATTTGGT-3′,下游引物为5′-AAATGAGCCCCAGCCTTCTCCATG-3′,扩增长度为325 bp。数据使用2-ΔΔct法分析,ΔΔct=Δct给药组-Δct空白对照组,Δct=ct目标产物-Δct内参。
2.6.3 自噬体数量 同“2.4”项下方法分组、培养细胞20 h后,胰蛋白酶消化细胞,2.5%中性戊二醛固定4 h,用PBS漂洗6次,加1%锇酸固定2 h,乙醇梯度脱水并使用树脂渗透,包埋,切片(厚度为50~70 nm),铀铅双染色后,透射电镜观察自噬体数量的变化。
2.7 统计学方法
3 结果
3.1 细胞增殖抑制率
高、中、低浓度rAd-p53注射液对肾母细胞瘤细胞的增殖抑制率分别为(42.86±3.18)%、(33.64±7.25)%、(16.26±9.07)%。与空白对照组比较,rAd-p53中、高浓度组细胞的增殖抑制率明显升高(P<0.01);rAd-p53高、中、低浓度组间差异无统计学意义(P>0.05)。
3.2 细胞周期和凋亡率
与空白对照组比较,rAd-p53高、中浓度组G0/G1期细胞明显增加(P<0.05或P<0.01),rAd-p53高、中、低浓度组细胞凋亡率明显升高(P<0.05或P<0.01)。各组细胞周期变化和凋亡率测定结果见表1。
表1 各组细胞周期变化和凋亡率测定结果(±s,n=6)Tab 1 Changes of cell cycle and determination results of apoptosis rate in each group(±s,n=6)

表1 各组细胞周期变化和凋亡率测定结果(±s,n=6)Tab 1 Changes of cell cycle and determination results of apoptosis rate in each group(±s,n=6)
注:与空白对照组比较,*P<0.05,**P<0.01Note:vs.blank control group,*P<0.05,**P<0.01
凋亡率,% 5.27±1.64 53.85±9.36**37.35±9.64**23.64±10.65*组别空白对照组rAd-p53高浓度组rAd-p53中浓度组rAd-p53低浓度组G0/G1,% 61.66±3.84 81.74±4.76**73.46±5.73*66.32±6.86 S,% 23.75±1.85 9.54±0.97**14.75±2.87*22.85±4.86 G2/M,% 14.09±1.01 8.12±1.89*11.39±5.25 10.13±3.15
3.3 p21、Bax蛋白表达
与空白对照组比较,rAd-p53高浓度组细胞中p21和Bax蛋白表达增强(P<0.01),rAd-p53中浓度组细胞中Bax蛋白表达增强(P<0.05),其余差异无统计学意义(P>0.05)。各组细胞中p21、Bax蛋白表达的电泳图见图1,测定结果见表2。

图1 各组细胞中p21、Bax蛋白表达的电泳图Fig 1 Electrophoresis graphs of p21,Bax protein expressions of cells in each group
表2 各组细胞中p21、Bax蛋白表达测定结果(±s,n=6)Tab 2 Determination results of p21,Bax protein expressions of cells in each group(±s,n=6)

表2 各组细胞中p21、Bax蛋白表达测定结果(±s,n=6)Tab 2 Determination results of p21,Bax protein expressions of cells in each group(±s,n=6)
注:与空白对照组比较,*P<0.05,**P<0.01Note:vs.blank control group,*P<0.05,**P<0.01
Bax/β-actin 0.998±0.001 1.455±0.107**1.267±0.054*1.065±0.647组别空白对照组rAd-p53高浓度组rAd-p53中浓度组rAd-p53低浓度组p21/β-actin 1.021±0.009 1.365±0.042**1.127±0.153 0.995±0.264
3.4 自噬情况
3.4.1 LC-3基因表达 与空白对照组比较,rAd-p53高浓度组细胞中LC-3荧光增多,rAd-p53中、低浓度组细胞中LC-3荧光无明显变化。各组细胞中LC-3基因表达荧光图见图2。

图2 各组细胞中LC-3基因表达荧光图(FITC,×400)Fig 2 Fluorescence graphs of LC-3 gene expression of cells in each group(FITC,×400)
3.4.2 Atg7、Atg12基因表达 与空白对照组比较,rAdp53高浓度组细胞中Atg7、Atg12基因表达增强(P<0.01),表明细胞自噬的基因启动,细胞自噬显著性增加;其余组差异无统计学意义(P>0.05)。各组细胞中Atg7、Atg12基因表达的测定结果见表3。
表3 各组细胞中Atg7、Atg12基因表达的测定结果(±s,n=6)Tab 3 Determination results of Atg7,Atg12 gene expressions of cells in each group(±s,n=6)

表3 各组细胞中Atg7、Atg12基因表达的测定结果(±s,n=6)Tab 3 Determination results of Atg7,Atg12 gene expressions of cells in each group(±s,n=6)
注:与空白对照组比较,**P<0.01Note:vs.blank control group,**P<0.01
Atg12/GAPDH 1.015±0.008 2.287±0.211**1.333±0.624 1.098±0.274组别空白对照组rAd-p53高浓度组rAd-p53中浓度组rAd-p53低浓度组Atg7/GAPDH 1.001±0.012 1.928±0.173**1.264±0.521 1.173±0.324
3.4.3 自噬体数量 与空白对照组比较,rAd-p53高浓度组细胞内自噬体数量明显增加,rAd-p53中、低浓度组细胞内自噬体数量无明显变化,表明高浓度rAd-p53注射液可以促进细胞自噬的发生。各组细胞自噬体的透射电镜图见图3。
4 讨论
自1995年9月美国FDA批准第一个p53基因治疗的临床试验方案,现临床研究已证实rAd-p53制品采用多种给药方式均可以治疗多种恶性肿瘤,并且安全[5]。从调查研究中发现,多数恶性肿瘤有p53基因突变,同时,rAd-p53注射液对多种不同类型的肿瘤均表现出很强的抑制作用,临床应用结果都说明其能提高患者的生活质量,未发现严重不良反应,安全性较好。流行病学研究发现,多种肿瘤情况的发生与p53基因的改变有着密切联系[6-7],有将近60%的人类肿瘤的发生都与其改变有关,通过增强p53基因表达从而起到治疗肿瘤作用是目前药物作用的重要靶点之一[8]。据目前的研究发现,肾母细胞瘤也存在着p53基因缺失等基因突变的状况[9]。
p21是由p53调控的下游蛋白,p53-p21-去磷酸化细胞瘤通路也是调控肿瘤基因表达的重要通路之一,该通路的异常表达会导致机体细胞的癌变[10]。对于正常的细胞而言,该通路的激活会引起细胞的衰老和生长的抑制;而对于癌细胞而言,该通路的激活会诱导癌细胞的凋亡,从而起到治疗肿瘤的作用[11-12]。Bax是位于线粒体膜上的一类具有调控凋亡功能的蛋白,研究表明,只有当p53基因被激活时,Bax才会发挥促进细胞凋亡的作用[13]。rAd-p53注射液通过调控p21及Bax两个基因和蛋白的表达,从而起到促进癌细胞凋亡的作用。另外,研究还发现rAd-p53注射液诱导肾母细胞瘤细胞的凋亡,还与诱导细胞自噬的发生有关。研究表明,细胞自噬增加与细胞凋亡发生有着密切的关系[14]。本研究证实了rAd-p53注射液具有通过增加细胞自噬从而治疗肿瘤的作用,表明通过调节细胞自噬来抗肿瘤可能是p53治疗的新靶标。
本试验证实了rAd-p53注射液具有抑制肾母细胞瘤细胞增殖、抑制癌细胞周期、增强癌细胞凋亡、同时诱导p21和Bax基因表达而增强肿瘤细胞自噬的作用,具有治疗肾母细胞瘤的潜力,这对扩宽rAd-p53注射液的应用范围有着重要的意义。
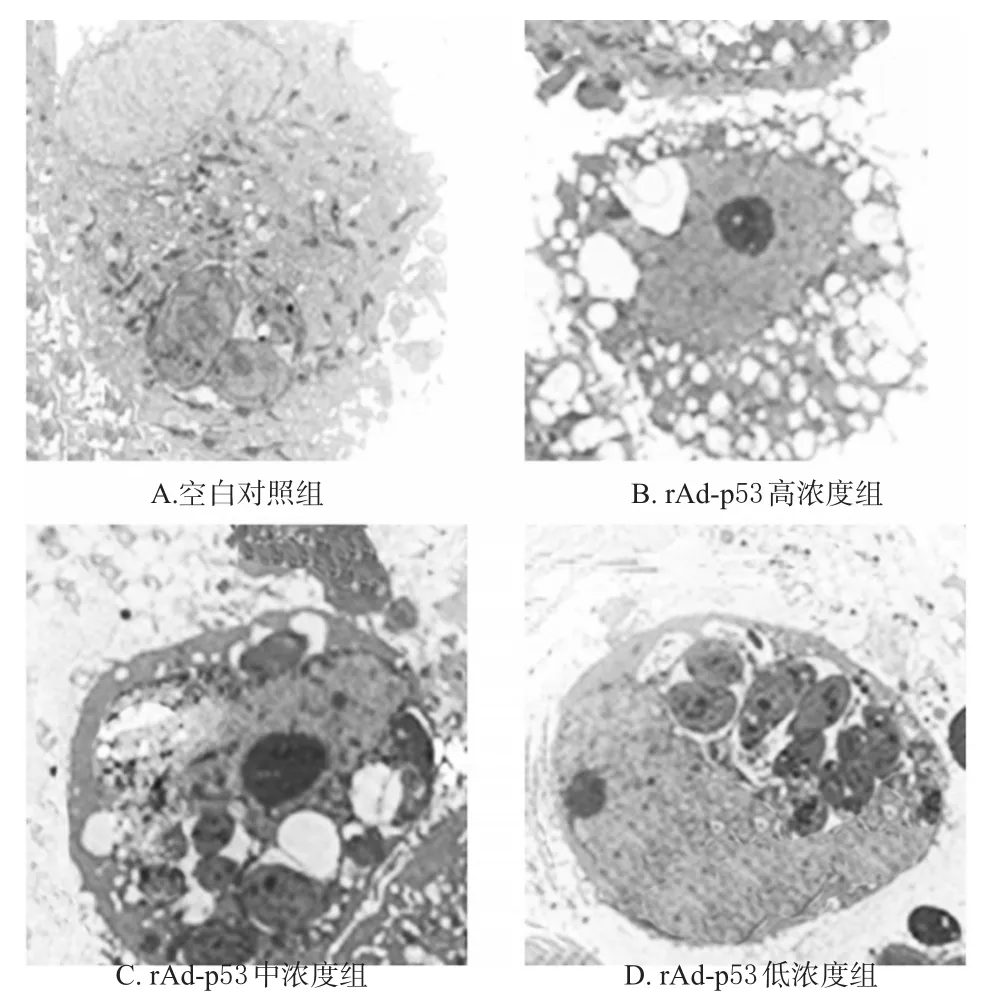
图3 各组细胞中自噬体的透射电镜图(×10 000)Fig 3 Transmission electron microscopys of cell autophagosomes in each group(×10 000)
[1] 张崔建,李学松,虞巍,等.成人肾母细胞瘤的治疗及其长期随访结果[J].北京大学学报(医学版),2012,44(4):535-538.
[2] 蒋也平,孙宁,沈颖,等.肾母细胞瘤的化疗和放疗[J].中国实用儿科杂志,2008,23(3):234-236.
[3] 曹信杰,张颖,李会兰,等.重组人p53腺病毒注射液联合化疗治疗恶性体腔积液的疗效观察[J].中国药房,2005,16(23):1809-1810.
[4] 张林,王季堃,王莉.重组人p53腺病毒注射液逆转人耐药胃癌MGC-803细胞耐药性的体外试验研究[J].中国药房,2012,23(13):1182-1184.
[5] Ding HF,Lin YL,McGill G,et al.Essential role for caspase-8 in transcription-independent apoptosis triggered by p53[J].J Biol Chem,2000,275(49):38905-38911.
[6] Sykes SM,Stanek TJ,Frank A,et al.Acetylation of the DNA binding domain regulates transcription-independent apoptosis by p53[J].J Biol Chem,2009,284(30):20197-20205.
[7] Dashzeveg N,Yoshida K.Crosstalk between tumor suppressors p53 and PKCdelta:execution of the intrinsic apoptotic pathways[J].Cancer Lett,2016,377(2):158-163.
[8] Melincovici CS,Mihu CM,Marginean M,et al.The prognostic significance of p53,Bax,Bcl-2 and cyclin E protein overexpression in colon cancer:an immunohistochemical study using the tissue microarray technique[J].Rom J Morphol Embryol,2016,57(1):81-89.
[9] 岳恺,张成辉,李明.p53和鼠双微粒体2在肾母细胞瘤中的表达[J].中华实用诊断与治疗杂志,2016,30(2):172-174.
[10] Vaseva AV,Marchenko ND,Moll UM.The transcriptionindependent mitochondrial p53 program is a major contributor to nutlin-induced apoptosis in tumor cells[J].Cell Cycle,2009,8(11):1711-1719.
[11] 司晓宇.p21功能缺失在端粒DNA损伤所致细胞衰老与肿瘤发生中的作用研究[D].昆明:昆明理工大学,2013.
[12] 张凤艳,张金子,邹树彪,等.胃癌组织中p21、p27、p53和Rb的表达及临床意义[J].临床与实验病理学杂志,2011,27(6):586-589.
[13] Speidel D.Transcription-independent p53 apoptosis:an alternative route to death[J].Trends Cell Biol,2010,20(1):14-24.
[14] 封晓昆,王贲士,王安娜,等.p53及其凋亡刺激蛋白对结肠癌细胞自噬和凋亡影响机制探讨[J].中华肿瘤防治杂志,2015,22(10):752-757.
Effects of rAd-p53 Injection on the Proliferation,Apoptosis and Autophagy of Nephroblastoma Cells
ZHONG Zhiyong,SHI Baojun,ZHOU Hui,WANG Wenbo(Dept.of Pediatric Surgery,the Second Hospital of Hebei Medical University,Shijiazhuang 050017,China)
OBJECTIVE:To study the effects of rAd-p53 injection on the proliferation,apoptosis and autophagy of nephroblastoma cells.METHODS:Nephroblastoma cells were respectively cultured 20 h with high,medium,low concentration(1×109,1× 108,1×107VP/mL)of Recombinant human rAd-p53 injection,cells with no injection were the blank control.Cell proliferation,cycle,apoptosis and related gene p21,Bax protein expressions were detected,and autophagy gene LC-3,Atg7,Atg12 expressions and number of autophagosomes were also detected.RESULTS:The proliferation inhibition rates of high,medium,low concentration of Recombinant human rAd-p53 injection to nephroblastoma cells were(42.86±3.18)%,(33.64±7.25)%,(16.26±9.07)%;apoptotic rates were(53.85±9.36)%,(37.35±9.64)%,(23.64±10.65)%,respectively.Compared with blank control,cells at period G0/G1were increased under high,medium,low concentration Recombinant human rAd-p53 injection,effects were relatively obvious under high,medium concentration(P<0.05 or P<0.01);p21,Bax protein and LC-3,Atg7,Atg12 gene expressions were enhanced under high concentration,the number of autophagosomes was increased(P<0.01);Bax protein expression was enhanced under medium concentration(P<0.05),the other indicators had no obvious changed(P>0.05).CONCLUSIONS:Recombinant human rAd-p53 injection can inhibit the cell proliferation of nephroblastoma,and induce its apoptosis and autophagy.
Nephroblastoma;rAd-p53 injection;Cell cycle;Proliferation;Apoptosis;Autophagy
R361+.3
A
1001-0408(2017)07-0889-04
2016-07-21
2017-01-04)
(编辑:邹丽娟)
河北省2013年医学科学研究计划基金项目(No.20130151)
*副教授,硕士。研究方向:儿童肿瘤。电话:0311-66002267。E-mail:zhongzy2005@163.com
DOI10.6039/j.issn.1001-0408.2017.07.07
