围产期酮病奶牛与健康奶牛相关氧化状态分析比较
2017-04-12李心慰杜希良
杨 丹 王 哲 李心慰 杜希良
(1.吉林大学动物医学学院,吉林长春 130062;2.天津市动物疫病预防控制中心,天津 300402)
围产期酮病奶牛与健康奶牛相关氧化状态分析比较
杨 丹1,2王 哲1*李心慰1杜希良1
(1.吉林大学动物医学学院,吉林长春 130062;2.天津市动物疫病预防控制中心,天津 300402)
奶牛酮病是处于围产期奶牛机体内碳水化合物以及脂肪无法正常代谢并使能量达到负平衡状态逐渐演变而成的营养代谢失调性常见多发病,本文通过相关实验对酮病奶牛与健康奶牛氧化状态进行分析比较,为深入研究氧化应激的相关性奠定基础。
围产期 酮病奶牛 健康奶牛 氧化状态
随着我国畜牧业的不断发展,奶牛存栏量逐年提高,随之出现的营养代谢性疾病也越来越多,奶牛酮病即为其中一种。奶牛酮病是处于围产期奶牛机体内碳水化合物以及脂肪无法正常代谢并使能量达到负平衡状态逐渐演变而成的营养代谢失调性常见多发病,患牛表现出“三酮”(酮血、酮尿、酮乳)、“三低”(低血糖、消化能力降低、产乳量降低)症状[1],而且神经功能水平可能会有所降低。本病主要发生在产后刚开始泌乳或每天乳汁分泌量在30kg以上的母牛群体中[2],多发生于泌乳性能良好的高产奶牛[3],乳汁分泌消耗体内能量,母牛需要补充的更多,而补充能量有两种途径,一种是加大食物摄入量,另一种是将体内的脂肪转换为能量。由于生产初期奶牛摄食量不能马上恢复,过分依赖于第二种途径,会使得肝脏无法进行正常的糖类以及脂肪代谢,引起血液里面酮体(β-羟丁酸、乙酰乙酸、丙酮)含量上升,进入到能量负平衡状态,如果机体无法通过自身的功能纠正这种状态,其体内就会合成并释放更多的酮体,最终患上酮病[4]。在健康机体体内,活性氧的含量能够保持在一定的平衡状态,其合成和消耗基本相当,从而避免含量过高给机体造成毒害作用。不过患病后,这种平衡状态会被打破,活性氧含量迅速提高,严重影响机体的健康。进入到围产期的奶牛,代谢水平较高,存在生理性氧化应激的症状。而且,部分患上酮病的奶牛面临病理性氧化应激的问题,导致器官受到氧化作用功能水平降低。为进一步弄清奶牛酮病与氧化应激的存在的相关性。本实验随机选取某牛场健康奶牛,临床型酮病奶牛及亚临床型酮病奶牛各10头,给予相同饲料喂养,再对其血液进行一系列实验,根据实验结果进行酮病基本特征,生化特性,氧化状态的相关分析。
1 材料和方法
1.1 实验动物
国内某奶牛养殖场抽取围产期奶牛样本30头,其中在泌乳初期呈健康状态以及确诊亚临床型、临床型酮病的奶牛分别10头。
1.2 材料与方法
抽取血液进行分析。早晨饲喂前颈静脉采血,肝素钠抗凝,3000rpm离心5min,将血浆转移到1.5ml离心管,-20℃保存。血浆样品中葡萄糖(GLU)、非酯化脂肪酸(NEFA)、β-羟丁酸(BHBA)、甘油三酯(TG)、总胆固醇(TC)、极低密度脂蛋白(VLDL)、高密度脂蛋白(HDL)、碱性磷酸酶(ALP)、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、胆碱酯酶(CHE)、乳酸脱氢酶(LDH)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLO)、Ca、Mg、P 生化试剂盒采用 Roche公司产品,由吉林大学第四附属医院 7170 型全自动生化分析仪(HITACHI)测定。在测量血液含有的丙二醛(MDA)、总抗氧化能力(TAC)、黄嘌呤氧化酶(XOD)、过氧化氢(H2O2)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)等物质含量以及抑制羟自由基能力时,用到上海江莱生物有限公司生产的试剂盒。
2 结果
表1三组奶牛胎次无显著差异,和健康组对比来看,其他两组样本产奶量、体况得分明显更低,组间对比具有显著性差异。

Table 1 The basic description of the ketotic,subclinical ketotic and healthy dairy cows
表2血糖水平在临床型和亚临床型牛群血液中含量都显著的下降,临床型2.95±0.42mM比亚临床型3.23±0.22mM更为明显,NEFA及BHBA的值相对于健康奶牛,临床型和亚临床型则升高明显。

Table2 Serum biochemical indices of ketotic,subclinical ketotic and non-ketotic cows
表3两种转氨酶(丙氨酸转氨酶、谷草转氨酶)的量在临床型酮病奶牛中含量明显高于亚临床型酮病牛及健康牛,亚临床酮病奶牛转氨酶虽变化不显著,但仍高于健康组。同时TC、HDL、VLDL、LDH在酮病奶牛出现显著降低或升高。

Table 3 Serum biochemical indices of ketotic,subclinical ketotic and non-ketotic cows
表4与健康组相比,其他两组血浆样本里面MDA含量更高(P<0.05),而SOD、CAT的活性更低。以健康组为标准来看,临床组血浆里面维生素C含量更低(P<0.05),血浆所含有的尿酸以及阻碍羟自由基能力更是显著低于健康组(P<0.01),H2O2浓度比健康组、亚临床组更高(P<0.01)。
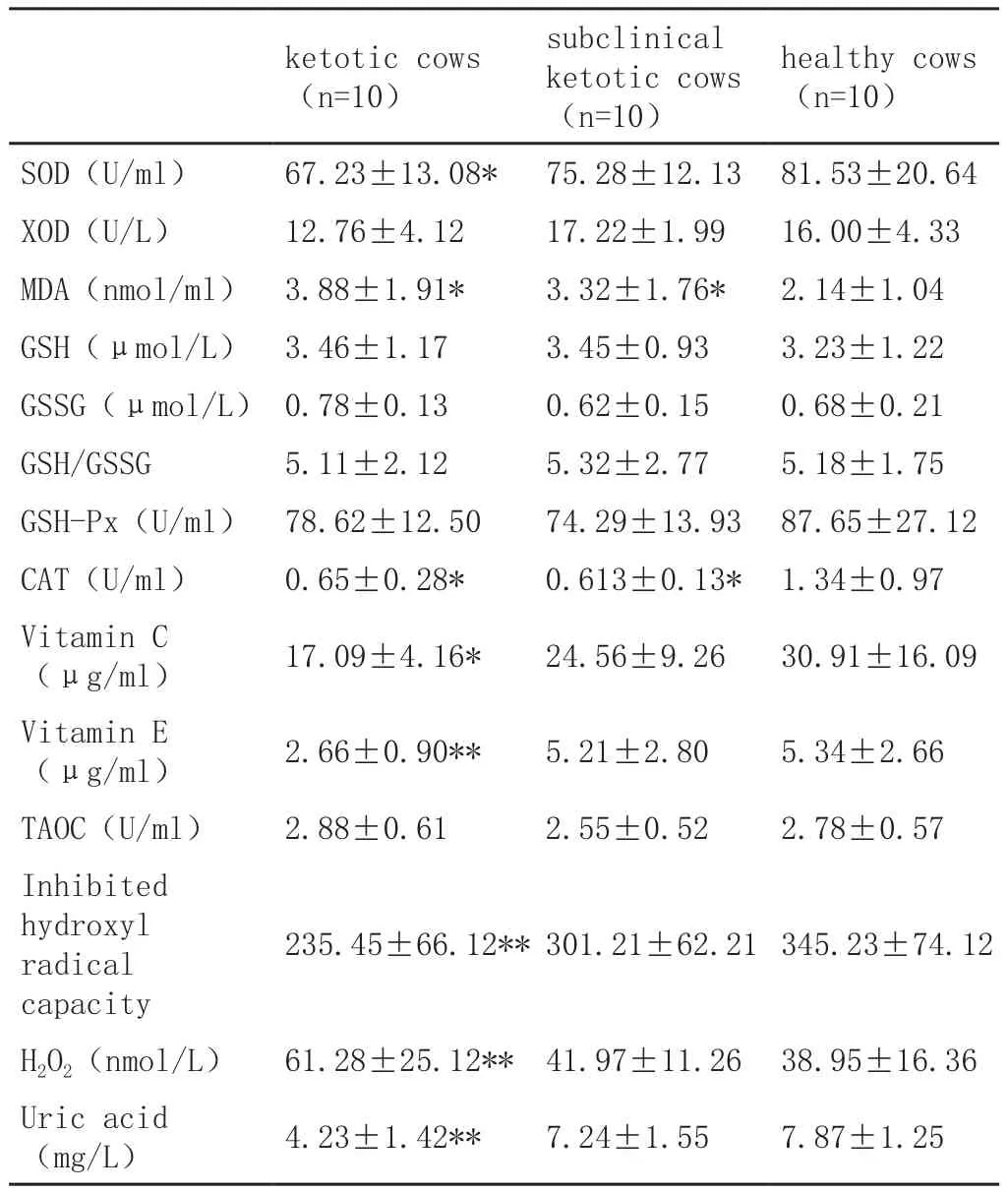
Table 4 Biomarkers of oxidative status of ketotic,subclinical ketotic and non-ketotic cows
3 讨论
对三组奶牛给予相同配方的饲料,产奶量出现明显差异,以健康奶牛产奶量为最高,亚临床型奶牛次之,临床型酮病奶牛最少,产量减少非常明显,与相关研究指出奶牛酮病直接或间接引起泌乳量下降相符合。同时临床酮病奶牛体况评分也出现了明显的差异。符合临床型酮病所表现出的体况变化,而亚临床型酮病相对症状不明显,需要根据血液中酮体水平相关数据进行辨别。酮病奶牛表现为血液中高NEFA及BHBA,低血糖。转氨酶的显著差异表明奶牛酮病造成肝脏不同程度损伤,同时TC、HDL、VLDL、LDH显著变化提示肝脏出现脂质蓄积。根据血浆中氧化剂和抗氧化剂含量情况显示患有亚临床型、临床型酮病的奶牛,抗氧化能力显著降低,呈氧化还原失衡状态。
奶牛酮病是一种高发的营养代谢紊乱性疾病,这种疾病是在能量负平衡(Negative Energy Balance,NEB)基础上发展而来的,在NEB状态下,奶牛因生产和繁殖就有可能患上这种疾病。处于围产期的奶牛,食欲降低,干物质摄入量不足,而胎儿成长、乳汁分泌会消耗更多的葡萄糖,分娩后短期内丙酸盐合成量太少,从而引发NEB[5]。研究结果显示,奶牛在尚未发生酮病时血糖水平较低,脂肪动员供能,血液里面NEFA含量因此而上升。本实验表明,和健康组相比,亚临床组、临床组血液样本里面的葡萄糖含量更低,而NEFA、BHBA两种物质含量则更高,这和现有的研究结论是相符的,这些症状可以作为确诊NEB的依据。处于围产期的奶牛,体内氧化剂增加,处于病理性氧化应激状态。机体里面最主要的抗氧化酶物质是SOD和GSH-Px。前者是机体防御氧化应激的第一道屏障,它可以和超氧阴离子发生反应从而形成过氧化氢,GSH-Px也是一种重要的抗氧化物质,它能够有效地阻碍自由基伤害细胞。现有的研究结论表明,血浆里面GSH-Px的活性,和脂质过氧化物的浓度存在关联,因此可以以后者作为评价氧化应激状态的指标。健康细胞进行新陈代谢后会释放自由基,比如超氧阴离子(O2-)、H2O2、羟自由基(OH-)和一氧化氮(NO)等。在健康机体中,自由基的形成和消耗能够保持平衡,任何原因导致这种平衡状态被打破,就会出现氧化应激的症状。和健康组相比,其他两组血液样本中总胆固醇含量更低,不过三组样本TG含量基本一致,导致胆固醇含量降低的原因是肝脏未能释放出足够的胆固醇。对于反刍动物而言,肝脏提供脂蛋白,而脂蛋白能够分解成为胆固醇。患有脂肪肝疾病后,奶牛血液里面VLDL含量有所下降,这或许代表着机体可能患上酮病。本实验结果显示,和健康组相比,其他两组血液样本里面VLDL浓度明显更低,这或许是因为肝脏无法正常地输出TG。本实验结果表明,和健康组相比,亚临床组、临床组血浆样本含有的SOD、GSH-Px活性水平更低,充分证明酮病使奶牛抗氧化功能受到影响。另外,CAT在机体抗氧化方面也发挥着重要的作用,它的功能是和过氧化氢发生反应,得到的产物为H2O和O2。生物体内的抗氧化剂包括了维生素C、维生素E以及尿酸,这三种物质对维持机体健康来说非常重要。目前有足够的证据证明,可以使用血液里面维生素C、维生素E和尿酸的含量,评价分娩后母体氧化状态的改变。本研究结果显示,患有酮病后,机体血液所含有的维生素C、维生素E和尿酸量会大幅下降,充分证明这种疾病会给奶牛抗氧化能力带来负面的影响。而且,和健康组相比,其他两组血浆样本里面H2O2含量更高,证明患有这种疾病后机体氧化水平有所上升。脂质过氧化会释放出一系列的产物,MDA即为其中之一,其在血液中含量的提高,是机体存在脂质过氧化的有力证据。所以,以MDA为指标揭示氧化应激状态程度高低在实践中得到了广泛的应用。本实验结果显示,和健康组相比,其他两组血液样本中MDA浓度明显更高符合相关结论。
[1] 王爱红,杨玉平,胡喜斌.奶牛酮病的防治措施[J].中国畜牧兽医文摘,2011,27(4):133.
[2] Shaw J C. Studies on ketosis in dairy cattle. VII. The efficacy of B vitamins and methionine in the treatment of ketosis[J]. Journal of Dairy Science,1946,29(3):131-139.
[3] 张振国.奶牛酮病病因及综合防治措施[J].中国畜禽种业,2015,(12):74-75.
[4] HERDT T H.Ruminant adaptation to negative energy balance. Influences on the etiology of ketosis and fatty liver[J].Vet Clin North Am Food Anim Pract,2000,16(2):215-230.
[5] 李玉.奶牛酮病氧化应激致肝细胞凋亡的信号转导机制研究[D].吉林大学,2014.
王哲
