LC3在早期糖尿病大鼠视网膜的表达和意义
2017-04-12刘青韦芳许迅
刘青 韦芳 许迅
·基础研究·
LC3在早期糖尿病大鼠视网膜的表达和意义
刘青*韦芳 许迅
目的 探讨微管相关蛋白1轻链3(MAP1-LC3)在糖尿病大鼠视网膜中的表达及其意义。方法 将24只雄性SD大鼠随机分为3组:正常对照组(C组,n=8),糖尿病组(D组,n=8),非诺贝特干预组(F组,n=8)。利用10 g/L链脲佐星(STZ)建立糖尿病大鼠模型。成模后给予药物干预,并在第4周末时取出大鼠眼球。将眼球置于中性甲醛固定后作免疫组织化学检测,分离视网膜抽提蛋白,采用免疫印迹技术检测视网膜组织中LC3蛋白的表达。采用TUNEL法测定4周时大鼠视网膜各层细胞凋亡情况。 结果 成功构建糖尿病大鼠模型。苏木素-伊红(HE)染色显示3组大鼠视网膜各层细胞无明显改变。3组大鼠视网膜LC3蛋白均有表达,免疫组织化学和Western印迹法检测结果一致。糖尿病大鼠视网膜中有LC3蛋白的表达,且明显高于正常对照组。LC3Ⅱ/LC3Ⅰ比值,C组明显低于D组和F组(P<0.05),F组高于D组(P<0.05),说明非诺贝特干预后,F组LC3Ⅰ向LC3Ⅱ的转化表达增加。免疫组织化学与Western印迹法结果一致。建模4周,仅D组见极少量细胞质呈绿色的凋亡阳性细胞。结论 糖尿病大鼠视网膜自噬增加,非诺贝特能增强自噬,且未见明显细胞凋亡。在糖尿病性视网膜病变中,自噬作为保护机制,早于细胞凋亡的发生。(中国眼耳鼻喉科杂志,2017,17:10-15)
糖尿病性视网膜病变 ;微管相关蛋白1轻链3;自噬;大鼠, Sprague-Dawley
糖尿病已成为一种全球性疾病。我国糖尿病患病率正在逐年增长。国际糖尿病联盟(IDF)预测,到2035年全球罹患糖尿病患者将增至5.92亿人[1]。糖尿病性视网膜病变(diabetic retinopathy, DR)是糖尿病最常见且严重的致盲性眼病。DR对视觉的威胁日益受到重视。通过复杂的分子机制,血-视网膜屏障的破坏,神经细胞的退行性改变,糖尿病可引起微血管病变,其中包括DR、糖尿病肾脏病变(diabetic nephropathy,DN)及糖尿病神经病变。在微血管系统出现病变前,已存在神经组织的损伤。其病理特征包括神经元凋亡、神经胶质细胞活跃及内层视网膜变薄[2-4]。临床实践也发现,糖尿病患者在眼底出现微血管改变之前已有视功能的异常。目前认为,糖尿病引起视网膜神经细胞的改变早于糖尿病视网膜微血管病变。因此,早期发现神经细胞的病理改变并及早干预对于延缓DR的发展将有重要的临床意义。
自噬是发生在真核细胞中由细胞初级溶酶体处理内容性底物的重要生理过程,在维持细胞生存更新、物质再利用和内环境稳定中起到重要作用。自噬功能紊乱与糖尿病密切相关,其在机体维持正常血糖水平过程中发挥重要作用。饥饿情况下,血糖、游离脂肪酸等营养物质水平下降均可诱导自噬激活,从而降解细胞内大分子物质,为机体提供所需营养素,调节血糖于正常范围内。在近年来的糖尿病及DN的相关研究中,自噬已成为热点。多项研究结果提示,自噬在糖尿病微血管病变的发病过程中起重要作用。此外,自噬与肿瘤、DN和年龄相关性黄斑变性(age-related macular degeneration, AMD)等密切相关,而这些疾病的发病机制与DR有相似之处[5-8]。
微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,MAP1-LC3)蛋白是哺乳动物细胞中酵母ATG8基因的同源物,定位于自噬体和自噬体膜表面,参与自噬体形成,现作为自噬体的特异性标记蛋白之一[9]。LC3的表达强度与自噬活性密切相关。但自噬是否存在DR中,目前报道较少。本研究观察自噬相关蛋白LC3在正常大鼠、糖尿病大鼠视网膜中的表达情况,为临床早期防治DR提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组 雄性SD大鼠(上海市中科院实验动物中心)24只,体重140~160 g。所有动物购买后适应喂养1周后用于实验。代谢笼、标准饲料喂养,自由进食和饮水,室温18~22 ℃,相对湿度40%~70%,12 h光照,昼夜循环。
1.1.2 试剂 链脲佐菌素(streptozotocin,STZ,Sigma公司);LC3抗体(CST公司);非诺贝特胶囊(Abbott公司);DeadEndTM荧光测定TUNEL系统(Promege公司)。
1.1.3 动物模型的建立 所有动物禁食12 h,实验前自尾静脉取血,行血糖测定(罗氏活力型血糖仪,ACCU-CHEK Active)和体重检测。采用随机数字表法将大鼠随机分为对照组(C组,n=8),糖尿病组(D组,n=8)和糖尿病非诺贝特灌胃组(F组,n=8)。依据Hammes等[10]介绍的方法,用STZ诱发糖尿病。D组、F组大鼠腹腔注射新鲜配制的1%STZ溶液(Sigma公司,美国),剂量为65 mg/kg,C组大鼠腹腔注射等体积的柠檬酸-枸橼酸钠缓冲液(pH=4.5,浓度为0.1 mol/L)。糖尿病大鼠模型确立的标准:72 h后大鼠尾静脉测得的血糖>16.7 mmol/L。成模次日开始至实验结束,F组大鼠给予非诺贝特(35 mg/kg)灌胃,C、D组仅给予自来水灌胃。实验期间,所有动物自由进食,不给予胰岛素等降糖治疗。不限水喂养。
1.2 方法
1.2.1 样品收集 灌胃后4周,称各组大鼠体重和测血糖。腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉,处死大鼠,取出眼球。摘取每只鼠的双眼,将左眼球固定于10%甲醛溶液,制作石蜡组织病理学切片。视网膜组织用苏木素-伊红(hematoxylin-eosin,HE)染色和末端标记法(TUNEL)检测;去除右眼球前节,在显微镜下钝性分离其视网膜组织,置于液氮下冷冻,-80 ℃储存,以备进行Western印迹法实验。
1.2.2 大鼠视网膜病理学检测 普通HE染色观察3组大鼠灌胃后4周时视网膜各层变化。
1.2.3 大鼠视网膜LC3免疫组织化学染色 石蜡切片常规脱蜡、水化、微波修复抗原,滴加稀释的一抗(兔抗大鼠LC3抗体,CST公司)、羊抗兔二抗 ABC复合物及二氨基联苯胺(DAB)显色剂,苏木素复染,脱水透明,甘油明胶封片。以磷酸盐缓冲液(PBS)代替一抗作为对照。先低倍镜下观察着染情况,再在高倍镜下随机选取10个视野,采用全自动图像分析系统(Image-pro plus 6.0)分别计数其积分光密度(integral optical density,IOD)值,取其平均值进行分析。
1.2.4 大鼠视网膜Western免疫印迹法检测LC3 用含1%蛋白酶抑制剂的RIPA细胞裂解液提取视网膜组织蛋白,NanoDrop测定;蛋白加样后行聚丙烯酰胺凝胶电泳(SDS-PAGE),将蛋白转至聚偏二氟乙烯(PVDF)膜上;加5%脱脂牛奶在室温下封闭1 h后,加LC3抗体(1∶1 000)和β-actin 抗体(1∶4 000)孵育,40 ℃过夜;加辣根过氧化物酶标记的Ⅱ抗(1∶500),室温下孵育2 h,ECL发光液显色。
1.2.5 TUNEL 检测凋亡 石蜡切片二甲苯脱蜡,梯度乙醇水化后,按照TUNEL试剂盒说明书进行操作。用Triton○RX-100通透细胞;蛋白酶K通透组织切片,荧光素-12-dUTP标记DNA断裂链,SSC终止反应后洗涤,在封片介质中加入4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)核染料进行分析。荧光显微镜在蓝色背景下DAPI染色,检测定位凋亡细胞的绿色荧光(荧光素-12-dUTP)。
1.3 统计学处理 数据处理运用统计分析软件SPSS 20.0统计软件包,数据以均数±标准差表示;多组比较采用单因素方差分析,组间比较采用SNK-q检验;2组均数比较采用独立样本t检验;P<0.05为差异有统计学意义。
2 结果
2.1 血糖 各组血糖情况详见表1。建模3 d时,D、F组较C组血糖升高(t值分别为-13.11及-20.51,P<0.05),说明建模成功。4周时,D组、F组较C组血糖高(t值分别为-29.41及-35.15,P<0.05)。
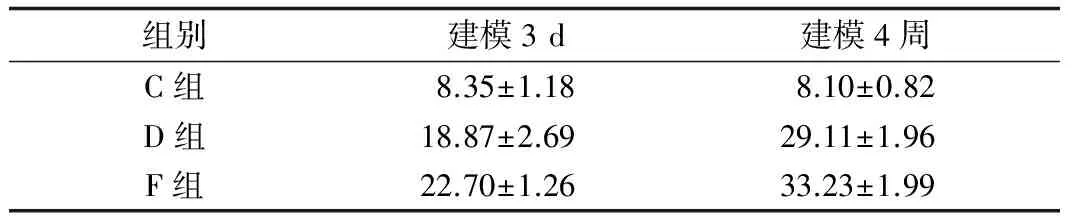
表1 实验起点及终点各组大鼠血糖对比(mmol/L)
2.2 体重 4周时D组大鼠体重比C组明显减轻,差异有统计学意义(t=5.61,P<0.05)。F组大鼠体重较C组减轻,差异有统计学意义(t=5.113,P<0.05)。D组和F组大鼠体重相比,差异无统计学意义(t=1.331,P>0.05)(表2)。
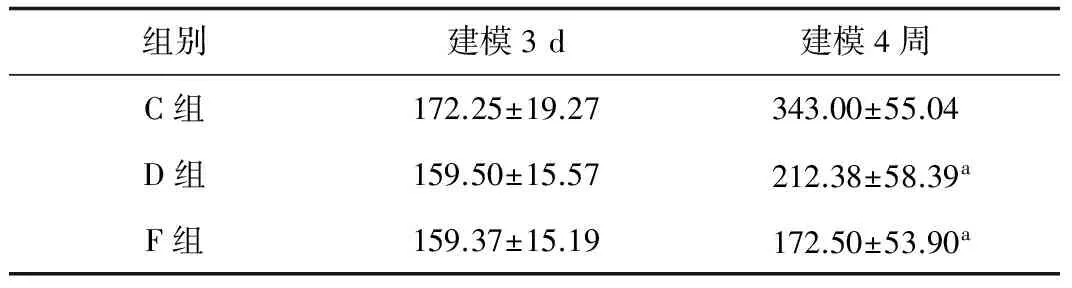
表2 实验起点及终点各组大鼠体重对比(g)
注:a示D、F组建模4周大鼠体重与建模3 d时相比,差异有统计学意义(P<0.05)
2.3 糖尿病大鼠视网膜HE染色 4周时,各组视网膜细胞排列基本整齐,形态学上未见明显异常。各层视网膜厚度无明显变化(图1)。

图1. 糖尿病大鼠视网膜HE染色(×400) 视网膜各层排列规则,细胞密集,形态正常。A. C组;B. D组;C. F组
2.4 各组大鼠LC3免疫组织化学结果 显微镜下观察,LC3蛋白以细胞质染为黄色至棕黄色为阳性细胞。3组大鼠视网膜节细胞层、内核层、外核层均有表达(图2)。3组 LC3阳性产物IOD值比较,差异有统计学意义(F=12.782,P=0.000)(图3)。

图2. 免疫组织化学检测(×400) 各组大鼠视网膜LC3Ⅱ的表达情况。 A. C组;B. D组;C. F组

图3. 免疫组织化学结果显示各组大鼠视网膜LC3的表达情况*示与C组、D组比较,P<0.05
2.5 Western印迹法结果 LC3Ⅰ总量,C组、D组高于F组,差异有统计学意义(F=23.767,P=0.003);C组和D组LC3Ⅰ总量相当(图4)。

图4. Western印迹法,各组大鼠LC3Ⅰ/actin的表达情况*示与C组、D组比较,P<0.05;#示与C组比较,P>0.05
LC3Ⅱ/LC3Ⅰ比值,C组明显低于D组和F组(F=18.614,P=0.005);F组表达略高于D组,说明非诺贝特干预后,F组LC3Ⅰ向LC3Ⅱ的转化较C组增加(图5)。
2.6 DeadEndTM荧光测定TUNEL系统检测结果 建模4周,C、F组大鼠视网膜各层细胞荧光染色未见明显凋亡。核呈蓝色,D组能见极少量细胞质绿色的凋亡阳性细胞(图6)。

图5. Western印迹法,各组大鼠LC3Ⅱ/LC3Ⅰ的表达情况*示与C组、D组比较,P<0.05

图6. 3组大鼠视网膜细胞凋亡情况 A、D、G为DAPI,B、E、H为TUNEL,C、F、I为MERGE; TUNEL荧光染色(×200),箭头示凋亡细胞核
3 讨论
DR的发病机制十分复杂,至今尚未完全阐明,可能包括各种细胞的病变、代谢途径的病变及各种细胞因子的影响。近期自噬研究成为生物科学领域中的热点。
过去一直认为,DR的基本病理改变是微血管病变;而最新研究表明,在DR早期,视网膜细胞已经发生病理改变。有学者[11]认为,糖尿病引起的视网膜神经元和(或)神经胶质细胞的改变早于糖尿病视网膜微血管病变。Ning等[12]发现,在糖尿病早期,视网膜神经元凋亡数目呈时间渐进性,提示糖尿病视网膜中的神经病变可能发生在糖尿病微血管病变之前或在其早期阶段。因此神经细胞的退行性变化在早期DR的病理中起重要作用。
1963年,Christian de Duve在溶酶体国际会议上第1次提出了“自噬”概念,是指一些需降解的蛋白质和细胞器等细胞质成分被包裹,并最终运送至溶酶体降解的过程。近年研究显示,自噬在糖尿病中扮演重要角色,推测细胞自噬可能与DR的发生、发展有关。
LC3是一种自噬相关蛋白(Atg),是酵母Atg8在哺乳动物的同源体,定位于自噬体的膜表面,参与自噬体的形成[13]。LC3有2个亚型:Ⅰ型和Ⅱ型。前LC3的羧基末端侧翼区被Atg4蛋白酶切割后成为LC3Ⅰ,接着暴露其羧基末端甘氨酸残基,然后磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)将其修饰变为LC3Ⅱ[14]。LC3被广泛用于自噬的研究,与LC3Ⅰ相比,LC3Ⅱ定位于自噬体的膜上,因此对于评价自噬活性更为敏感。
活化的LC3与PE结合发生脂化,LC3由其胞质可溶形式LC3Ⅰ成为膜结合的自噬小体相关形式LC3Ⅱ,引起自噬标记物LC3Ⅰ向LC3Ⅱ转化,通过检测细胞内LC3Ⅱ的变化可以判断细胞内的自噬状态。LC3Ⅱ结合并始终位于胞内自噬体的膜上,其含量与自噬体的数量成正比[13,15]。
Yao等[16]在高糖诱导的氧化应激环境下发现了视网膜色素上皮(retina pigment epithelium,RPE)细胞中的自噬现象。说明高糖可以诱导视网膜细胞的自噬。
本研究通过建立糖尿病大鼠模型,4周后取大鼠视网膜,LC3免疫组织化学染色和Western印迹法检测,发现3组大鼠视网膜均有LC3表达;建模4周,3组大鼠LC3在视网膜节细胞层、内核层、外核层均有阳性表达;在F组大鼠中有强阳性表达。提示自噬存在于大鼠视网膜细胞中。LC3Ⅱ向LC3Ⅰ的转化,D组和F组明显高于C组(P<0.05),提示自噬在早期糖尿病大鼠视网膜中的提高,LC3Ⅱ的积累可以解释为自噬被激活[17]。自噬的提高是为了在细胞和组织稳态中发挥作用。推测糖尿病早期细胞自噬水平的提高,对糖尿病大鼠视网膜神经细胞的损伤修复和生命功能的维持有帮助。
糖尿病建模4周后,HE染色,3组大鼠视网膜各层结构未见明显变化;TUNEL法检测早期视网膜细胞凋亡, 仅D组能见极少量凋亡阳性细胞核。说明早期糖尿病大鼠视网膜细胞已发生自噬改变,D组刚开始出现细胞凋亡;F组未见明显细胞凋亡,推测非诺贝特对早期糖尿病大鼠视网膜有提高自噬的作用,使细胞凋亡延缓出现。
非诺贝特作为调脂药物已被广泛应用在临床上,它是第3代苯氧酸类衍生物,氯贝丁酯类降血脂药,非诺贝酸是其血浆活性代谢产物,是一种过氧化物酶体增殖物激活受体-α(peroxisome proliferator-activated receptor-α,PPARα),能显著降低血液中的甘油三酯和总胆固醇,升高高密度脂蛋白胆固醇水平。非诺贝通过转化成具有药理活性的非诺贝酸,进而活化核转录因子发挥调脂作用[18]。
多项研究证实,PPAR在内皮细胞中广泛存在,非诺贝特可以激活内皮中PPAR产生,抑制血管内皮生长因子受体2以及新生血管形成;且PPAR与抗炎、抗氧化和神经保护作用有关[19-21]。近年来对其非调脂作用的研究已成为热点。
Miranda等[22]根据体外实验推测,高糖、缺氧环境下,RPE细胞的自噬水平明显下降;而加入非诺贝酸后,其自噬水平提高。本实验通过建立早期糖尿病大鼠模型,非诺贝特灌胃干预,首次在动物实验中观察到糖尿病大鼠早期视网膜有LC3表达且上升,非诺贝特干预后LC3表达更高,LC3Ⅱ/LC3Ⅰ转化增加,提示糖尿病早期,视网膜自噬活性增强;加入非诺贝特后自噬活性更强,推测非诺贝特通过诱导自噬而对DR病理过程发挥延缓、抑制作用。
细胞死亡包括3种类型:坏死、凋亡和自噬性细胞死亡。凋亡即Ⅰ型程序性细胞死亡,具有依赖caspase参与,染色体浓聚,细胞皱缩,出现凋亡小体等特征[23]。目前普遍认为自噬是一种防御和应激调控机制。细胞可以通过自噬,消除、降解,并消化受损、变性、衰老和失去功能的细胞、细胞器和变性蛋白质及核酸等生物大分子,为细胞重建、再生和修复提供必需原料,实现细胞再循环、再利用。细胞自噬可以单独通过细胞保护作用或自身破坏吞噬作用决定细胞生存和死亡,也能通过比较复杂的机制与细胞凋亡联系起来,从而对细胞产生影响,清除细胞凋亡残余物,防止组织损伤[24]。一般说来,凋亡是程序化细胞死亡,自噬是程序化细胞存活。但是自噬是把“双刃剑”,过多或过少的自噬都将危害细胞生存。然而细胞自噬在DR中的作用及其与细胞凋亡相互作用的具体机制,以及提高细胞自噬和减少细胞凋亡是否有助DR微血管病变的改善值得进一步研究证实。
本实验中,各组大鼠视网膜早期均未见明显凋亡。但仍需延长病程时间,观察凋亡和自噬是否存在紧密联系。此外非诺贝特是通过何种机制调节自噬,从而改善视网膜细胞的稳态?糖尿病视网膜自噬和凋亡的内在关联如何?将是未来研究重点。
[1] IDF. International Diabetes Federation-Diabetes Atlas[M].6th ed.2013:1-160.
[2] Simó R. Neurodegeneration as an early event in diabetic retinopathy[J].Endocrinol Nutr,2011,58(5):211-213.
[3] Villarroel M, Ciudin A, Hernández C, et al. Neurodegeneration:an early event of diabetic retinopathy[J].World J Diabetes,2010,1(2):57-64.
[4] Antonetti DA,Klein R,Gardner TW. Diabetic retinopathy[J].N Engl J Med ,2012,366(13):1227-1239.
[5] Tanaka Y,Kume S,Kitada M,et al.Autophagy as a therapeutic target in diabetic nephropathy[J].Exp Diabetes Res,2012,2012:628978.
[6] Brech A,Ahlquist T,Lothe RA.et al.Autophagy in tumour suppression and promotion[J].Mol Oncol,2009,3(4):366-375.
[7] Hoare M,Young AR,Narita M,et al.Autophagy in cancer:having your cake and eating it[J].Semin Cancer Biol,2011,21(6):397-404.
[8] Kaamiranta K.Autophagy—hot topic in AMD[J].Acta Ophthalmol,2010,88(4):387-388.
[9] Tanida I,Ueno T,Kominami E.LC3 conjugation system in mammalian autophagy[J].Int J Biochem Cell Biol,2004,36(12):2503-2518.
[10] Hammes HP,Ali SS,Uhlmann M,et al. Aminoguanidine does not inhibit the initial phase of experimental diabetic retinopathy in rats[J].Diabetologia,1995,38(3):269-273.
[11] Parisi V,Uccioli L.Visual electrophysiological responses in persons with type 1 diabetes[J].Diabetes Metab Res Rev, 2001,17(1):12-18.
[12] Ning X,Baoyu Q,Yuzhen L, et al.Neuro--optic cell apoptosis and microangiopathy in KKAY mouse retina[J].Int J Mol Med,2004,13(1):87-92.
[13] Kabeya Y,Mizushima N,Ueno T,et al.LC3,a mammalian homologue of yeast Apg8p,is localized in autophagosome membranes after processing[J].EMBO J,2000,19(21):5720-5728.
[14] Kimura S,Fujita N,Noda T,et al.Monitoring autophagy in mammalian cultured cells through the dynamics of LC3[J].Methods Enzymol,2009,452:1-12.
[15] Mizushima N.Methods for monitoring autophagy[J].Int J Biochem Cell Biol,2004,36(12):2491-2502.
[16] Yao J,Tao ZF,Li CP,et al.Regulation of autophagy by high glucose in human retinal pigment epithelium[J].Cell Physiol Biochem,2014,33(1):107-116.
[17] K1ionsky DJ,Abdalla FC,Abeliovich H, et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J].Autophagy,2012,8(4):445-544.
[18] Treacy MP,Hurst TP.The case for intraocular delivery of PPAR agonists in the treatment of diabetic retinopathy[J].BMC Ophthalmol,2012,12:46-50.
[19] Inoue l,Shino K,Noji S,et al.Expression of peroxisome proliferator—activated receptor alpha(PPAR alpha)in primary cultures of human vascular endothelial cells [J].Biochem Biophys Res Commun,1998,246(2):370-374.
[20] Chen XR, Besson VC, Palmier B, et al.Neurological recovery-promoting, anti-inflammatory, and anti-oxidative effects afforded by fenofibrate,a PPAR alpha agonist,in traumatic brain injury[J].J Neurotrauma,2007,24(7):1119-1131.
[21] Deplanque D, Gelé P, Pétrault O, et al.Peroxisome proliferator-actived receptor-alpha activation as a mechanism of preventive neuroprotection induced by chronic fenofibrate treatment[J]. J Neurosci,2003,23(15):6264-6271.
[22] Miranda S, González-Rodrítquez, García-Ramírez M, et al.Beneficial effects of fenofibrate in retinal pigment epithelium by the modulation of stress and survival signaling under diabetic conditions[J].J Cell Physiol,2012,227(6):2352-2362.
[23] Lockshin RA,Zakeri Z. Apoptosis,autophagy,and more[J].Int J Biochem Cell Biol,2004,36(12):2405-2419.
[24] Grossmayer GE, Munoz LE ,Gaipl US, et al. Removal of dying cells and systemic lupus erythematosus[J].Mod Rheumatol,2005,15(6): 383-390.
(本文编辑 诸静英)
Expression and significance of LC3 in the retina of early stage diabetic rats
LIUQing*,WEIFang,XUXun.
DepartmentofOphthalmology,ShanghaiGeneralHospital,ShanghaiJiaotongUniversity,Shanghai200080,China
XU Xun, Email:drxuxun@sjtu.edu.cn
Objective To explore the expression and significance of microtubule-associated protein 1 light chain 3 (MAP1-LC3) in the retina of early stage diabetic rats. Methods Twenty-four SD rats were randomly divided into the control group(Group C,n=8), streptozotocin(STZ) group (Group D,n=8) and STZ+fenofibrate group (Group F,n=8). At the end of the 4th week, all rats were sacrificed, and their eyeballs were harvested. The retinas were tested by hemotoxylin-eosin (HE) staining, the protein expression of LC3 were tested by Western blot and immunohistochemistry. Terminal-deoxynucleoitidyl transferase mediated nick end labeling (TUNEL) was performed to observe the apoptosis of retina cells in all rats. Results Diabetic rat model was successfully established. HE staining showed no obvious pathologic changes in retina among the three groups.Western blot test showed that the ratio of LC3Ⅱ/LC3Ⅰ in retina was significantly increased in Group D and Group F compared with Group C at the end of the 4th week(P<0.05). The immunohistochemical test of LC3 showed the consistent results as Western blot. Retina cells had no obvious apoptosis in all three groups.Conclusions Autophagy was increased in early stage diabetic rats. Fenofibrate increased autophagy in diabetic rats. A protective mechanism, autophagy, occurred before cell apoptosis in diabetic retinopathy. (Chin J Ophthalmol and Otorhinolaryngol,2017,17:10-15)
Diabetic retinopathy; Microtubule-associated Protein 1 light chain 3; Autophagy; Rats, Sprague-Dawley
上海交通大学附属第一人民医院眼科 上海 200080;*上海交通大学医学院附属同仁医院眼科 上海 200336
许迅(Email:drxuxun@sjtu.edu.cn)
为上海交通大学附属第一人民医院在职研究生 上海 200080
10.14166/j.issn.1671-2420.2017.01.004
2016-01-29)
