平菇多糖中蛋白质脱除方法的比较
2017-04-11王新嘉雷国风翟志军吴晓玉
王新嘉,雷国风,翟志军,吴晓玉
(南昌市发酵应用技术重点实验室/江西农业大学生物科学与工程学院,江西南昌330045)
平菇多糖中蛋白质脱除方法的比较
王新嘉,雷国风,翟志军,吴晓玉*
(南昌市发酵应用技术重点实验室/江西农业大学生物科学与工程学院,江西南昌330045)
本试验以蛋白质脱除率、多糖保留率以及两因素的综合指标为评价指标,采用Sevage法、盐酸-乙醇等电点法和TCA法,分析比较其对平菇多糖脱蛋白效果的影响。试验结果表明,平菇多糖中蛋白质脱除率最高的为Sevage法,其次为TCA法;而多糖保留率最高的为盐酸-乙醇等电点法,其次为TCA。综合考虑两因素的影响,以TCA法效果最好。利用Box-Behnken试验设计,获得TCA法脱蛋白工艺的回归方程,再经响应面分析,得出脱蛋白最佳方案,即:TCA浓度5.6%,处理时间33min,处理温度48℃,此时其综合评价平均值为83.96%,蛋白质脱除率为89.5%,多糖保留率为78.4%。
平菇;多糖;脱蛋白;响应面分析
平菇(Pleurotusostreatus)又名侧耳、糙皮侧耳,是担子菌门伞菌目侧耳科的一个种类,是我国目前栽培最多的4种主要食用菌之一。平菇营养物质种类与含量都很丰富,如糖类、蛋白质、维生素等,且其氨基酸种类齐全,矿物质含量繁多。每100克干品中含蛋白质19.43 g,脂肪1.71 g,糖类22.25 g,粗纤维8.21 g[1],是获得多糖物质的极佳原材料。平菇多糖一般是指平菇水溶性多糖,是目前研究最多的平菇主要成分之一。大量研究结果表明,平菇多糖具有抗肿瘤、抗氧化、降血糖、调节人体免疫等功能[2-6],因此,开发平菇多糖产品将具有较好的经济和社会效益。
平菇多糖提取过程中往往含有无机盐、色素、蛋白质以及醇不溶性小分子物质等杂质,比如热水浸提法获得的多糖中蛋白质含量约为6%~14%。含有蛋白质的多糖溶液在柱层析分离时将堵塞凝胶而影响分离效果,并且对后续多糖结构分析造成影响。蛋白质脱除方法一般有Sevage法、三氯乙酸(TCA)法、CTAB法[7]、大孔吸附树脂法、等电点沉淀法、酶法及综合法[8]等。这些方法各有优劣。Sevage、大孔吸附树脂、TCA、和CTAB法均有较好的脱蛋白效果,但前两者操作复杂,多糖损失较严重,后两种方法TCA和CTAB的用量与多糖损失量成正比[9]。酶解法和盐酸等电点法尽管作用条件温和,但因酶具有专一性、等电点法体系的极性不够等,两种方法除蛋白效果不太理想[10-11]。有关脱除平菇多糖中蛋白质的报道不多,本试验以平菇鲜品为原料,通过比较Sevage法、盐酸-乙醇等电点法(加入乙醇以增大体系的极性)和TCA法去除平菇多糖的蛋白质效果,优化脱除工艺条件,筛选适宜的脱蛋白方法,为后续的研究提供理论和技术参考。
1材料与方法
1.1材料与试剂
平菇:购于农贸市场。
盐酸、氢氧化钠:西陇化工股份有限公司生产;正丁醇:天津市永大化学试剂有限公司;无水乙醇、三氯甲烷、葡萄糖、三氯乙酸、苯酚:天津市大茂化学试剂厂;浓硫酸、考马斯亮蓝G-250:国药集团化学试剂有限公司;牛血清白蛋白:盐城赛宝生物科技有限公司。
纤维素酶(5万U/g)、果胶酶(10万U/g)、木瓜蛋白酶(80万U/g):上海源叶生物科技有限公司。
1.2方法
1.2.1平菇多糖的提取
将市场上购买的平菇洗净65℃烘干后粉碎过40目筛得到粉末,常温下干燥保存。称量一定量的平菇干粉,按照质量比1∶40加入蒸馏水,将pH调到5.0,再按0.5%的量加入3种酶的混合液,其中3种酶的质量比为1∶1∶1,50℃水浴中浸提1.5 h,将水升温至90℃,灭酶并水浴浸提3 h,3 000 r/min离心10min,弃去沉淀,将滤液浓缩到其体积的1/5至1/4,浓缩液加入4倍体积的无水乙醇过夜沉淀,3 000 r/min离心10min,抽滤,沉淀即为粗多糖。
1.2.2多糖含量的测定
采用硫酸-苯酚法[12]测定多糖含量。准确称取标准葡萄糖20mg于500mL容量瓶中,加水至刻度,分别吸取0.4、0.6、0.8、1.0、1.2、1.4、1.6mL及1.8mL葡萄糖标液于8支试管中,各以蒸馏水补至2.0mL,然后加入5%苯酚(新制)1.0mL及浓硫酸5.0mL,摇匀冷却,室温放置30min后于490 nm测光密度,以2.0mL水按同样显色操作为空白,横坐标为葡萄糖浓度(μg/ mL),纵坐标为光密度值,得标准曲线,见图1。

图1 葡萄糖标准曲线Fig.1 The standard curveofglucose
取稀释到一定倍数的样品溶液1mL,按照上述同样的方法测定其在490 nm处的吸光度值,并根据标准曲线计算多糖含量。
1.2.3多糖保留率的计算

式中:A0表示脱蛋白前样品中多糖的质量,μg;AI表示脱蛋白后样品中多糖的质量,μg。
1.2.4蛋白质含量的测定
蛋白质含量的测定采用考马斯亮蓝法[13-14]。
考马斯亮蓝G-250溶液:称取50mg考马斯亮蓝G-250,溶于25mL 95%的乙醇中,加入50mL 85%的磷酸,用蒸馏水定容至500mL。
标准蛋白溶液:称取10mg牛血清蛋白,溶于蒸馏水并定容至100mL,制得100μg/mL的标准蛋白溶液。蛋白质标准曲线中标准浓度的配制见表1。

表1 蛋白质标准曲线中标准浓度的配制Table1 Preparation of standard solution concentrationsat the protein standard curve
标准曲线的制作:按表1进行反应溶液的配制,加样完成后,轻轻摇匀,避免产生气泡,室温放置反应2min~5min后于1 h内在595 nm波长下完成比色测定。以蛋白质浓度(μg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线,见图2。

图2 蛋白质标准曲线Fig.2 Thestandard curveof protein
1.2.5蛋白质脱除率的计算

式中:B0表示脱蛋白前样品中蛋白质的质量,μg;BI表示脱蛋白后样品中蛋白质的质量,μg。
1.2.6综合指标的计算
比较蛋白质的脱除效果要综合考虑蛋白质脱除率和多糖保留率两方面的结果,本试验采取加权计算法,以综合指标作为蛋白质脱除效果的评价指标。
综合指标=多糖保留率×50%+蛋白质脱除率×50%
1.3除蛋白方法
1.3.1 Sevage试剂法除蛋白
蛋白质在氯仿等有机溶剂中容易变性沉淀,釆用正丁醇∶三氯甲烷=1∶5(体积比)配制成Sevage试剂,取平菇粗多糖溶液25mL以体积比(多糖液:Sevage试剂)1∶4加入Sevage试剂,混合后放入摇床振摇20到30min,静置分层,放出下层有机溶剂及交界处变性蛋白质,反复进行至无蛋白层,得到脱蛋白上层液。脱蛋白过程中每进行1次吸取1mL上清液分别测多糖和蛋白含量,计算多糖保留率和蛋白质脱除率。
1.3.2盐酸-乙醇等电点法[11]除蛋白
1.3.2.1溶液pH对蛋白质脱除的影响
取15支10mL离心管,分别加入平菇多糖5mL,用0.1mol/LHCl将pH分别调成3.0、3.2、3.4、3.6、3.8、4.0,然后缓慢加入无水乙醇至乙醇终浓度为7%,边加边搅拌,混匀后置于4℃冰箱中静置过夜,24 h后取出于离心机中3 000 r/min离心20min,取上清液测多糖及蛋白质的含量,计算多糖保留率和蛋白质脱除率。
1.3.2.2乙醇浓度对蛋白质脱除的影响
取24支10mL离心管,分别加入平菇粗多糖5mL,用0.1mol/LHCl将pH调成3.8,然后缓慢加入无水乙醇至乙醇终浓度分别为1%、3%、5%、7%、9%、11%、13%、15%,边加边搅拌,混匀后置于4℃冰箱中静置过夜,24 h后取出于离心机中3 000 r/min离心20min,取上清液测多糖及蛋白质的含量,计算多糖保留率和蛋白质脱除率。
1.3.3三氯乙酸(TCA)法[15]除蛋白
1.3.3.1三氯乙酸(TCA)浓度的影响
取15支10mL离心管,分别加入平菇粗多糖溶液5mL,然后加入质量分数为20%的三氯乙酸(TCA)至终浓度分别为5%、5.5%、6%、6.5%、7%,振荡均匀后于50℃水浴40min,3 000 r/min离心10min除去沉淀,取上清液测多糖和蛋白含量,计算多糖保留率和蛋白质脱除率。
1.3.3.2三氯乙酸(TCA)处理时间的影响
取15支10mL离心管,分别加入平菇粗多糖溶液5mL,然后加入质量分数为20%的三氯乙酸(TCA)至终浓度为6%,振荡均匀后于50℃分别水浴20、30、40、50、60min,3 000 r/min离心10min除去沉淀,取上清液测多糖和蛋白含量,计算多糖保留率和蛋白质脱除率。
1.3.3.3三氯乙酸(TCA)处理温度的影响
取15支10mL离心管,分别加入平菇粗多糖溶液5mL,然后加入质量分数为20%的三氯乙酸(TCA)至终浓度为6%,振荡均匀后分别于30、40、50、60、70℃水浴40min,3000 r/min离心10min除去沉淀,取上清液测多糖和蛋白含量,计算多糖保留率和蛋白质脱除率。
1.3.4 3种方法的比较
按照蛋白质脱除率、多糖保留率和综合评价的综合考虑,根据试验结果将3种方法进行比较得出最合适的方法。
1.3.5应用Box-Behnken试验设计分析TCA法除蛋白
在单因素试验的基础上,采用中心组合试验Box-Behnken进行方案设计优化脱蛋白工艺。选取TCA浓度、处理时间、处理温度3个因素为自变量,分别以A、B、C表示,并以1、0、-1分别代表自变量的高、中、低水平进行编码,以综合指标为响应值Y,因素编码及水平见表2。

表2 Box-Behnken试验设计因素及水平表Table2 Factorsand levers in the Box-Behnken experim ental design
2结果与分析
2.1 Sevage试剂法对蛋白质脱除及多糖保留的影响
采用Sevage法除蛋白,研究其对蛋白质脱除率、多糖保留率以及综合指标的影响,见图3。

图3 清除次数对蛋白质脱除率和多糖保留率的影响Fig.3 Effectof elim inating tim eson theprotein rem oval rateand polysaccharide retention rate
蛋白质脱除率随着脱蛋白次数的增加而增加,用Sevage试剂处理1次,蛋白质脱除率为88.73%,处理9次后,蛋白质脱除率可达96.8%。而多糖保留率随着清除次数的增加而呈现下降的趋势,Sevage试剂处理1次时,多糖保留率仅为26.22%,处理9次后,多糖保留率为13.05%。综合指标变化幅度不大,在57%上下浮动。表明用Sevage试剂处理多次后,对蛋白质的脱除效果明显,但多糖损失严重,推测平菇多糖液中含有多糖与蛋白结合的复合物,Sevage试剂将复合物沉淀,造成多糖也被去除。因此,虽然蛋白质脱除率很高,但多糖保留率偏低,故不选用此方法除蛋白。
2.2盐酸-乙醇等电点法对蛋白质脱除及多糖保留的影响
2.2.1溶液pH的影响
pH对蛋白质脱除率和多糖保留率的影响见图4。
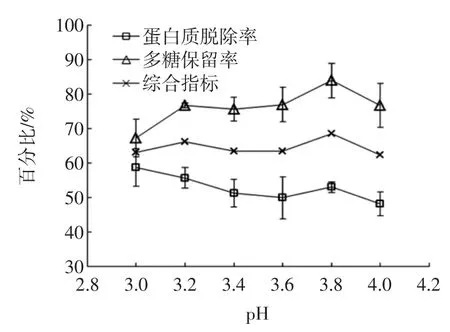
图4 pH对蛋白质脱除率和多糖保留率的影响Fig.4 Effectof pH on theprotein rem oval rateand polysaccharide retention rate
图4 结果表明,乙醇浓度为7%条件下,在pH 3~4之间,多糖保留率呈现上升的趋势,蛋白质脱除率呈现的是下降的趋势,在pH 3.8时多糖保留率达到最大,说明pH 3.8是一个临界点,增大pH使多糖溶解;蛋白质脱除率一直下降的原因可能是蛋白质的等电点不在这个范围内。随后研究显示:pH 1~6范围内蛋白质脱除率仍然呈现下降趋势。从图4看,综合指标在pH 3.8时达最大值68.45%,此时蛋白质脱除率为52.98%,多糖保留率为83.92%。
2.2.2溶液乙醇浓度的影响
在溶液pH 3.8条件下,设置乙醇浓度分别为1%、3%、5%、7%、9%、11%、13%、15%,测定蛋白质脱除率与多糖保留率。乙醇浓度对蛋白质脱除率和多糖保留率的影响见图5。

图5 乙醇浓度对蛋白质脱除率和多糖保留率的影响Fig.5 Effectof ethanolconcentration on the protein removal rate and polysaccharide retention rate
由图5看出,蛋白质脱除率随着溶液中乙醇浓度的增加呈现下降的趋势,多糖保留率在7%时达到最大值。继续加大乙醇浓度,多糖保留率反而减小。估计由于乙醇浓度过大,可造成多糖沉淀。其综合指标在7%时达最大值,为63.19%,此时蛋白质脱除率为47.81%,多糖保留率为78.57%。
2.3三氯乙酸(TCA)法对蛋白质脱除及多糖保留的影响
2.3.1溶液三氯乙酸(TCA)浓度的影响
在三氯乙酸(TCA)处理时间40min、三氯乙酸(TCA)处理温度50℃条件下,设置溶液TCA浓度分别为5%、5.5%、6%、6.5%、7%,测定蛋白质脱除率与多糖保留率。TCA浓度对蛋白质脱除率和多糖保留率的影响见图6。
如图6所示,随着TCA浓度的增加,蛋白质脱除率逐渐增加;但多糖保留率随着TCA浓度的增加,呈现下降趋势。估计TCA溶液与蛋白质结合沉淀时会吸附一定量的多糖,导致多糖含量下降[8]。从综合指标来看,当TCA浓度为6%时达到最大值85.63%,此时蛋白质脱除率为93.8%,多糖保留率为77.88%。
2.3.2三氯乙酸(TCA)处理时间的影响

图6 TCA浓度对蛋白质脱除率和多糖保留率的影响Fig.6 Effectof TCA concentration on theprotein removal rateand polysaccharide retention rate
在溶液TCA浓度6%、三氯乙酸(TCA)处理温度50℃条件下,设置三氯乙酸(TCA)处理时间分别为20、30、40、50、60min,测定蛋白质脱除率与多糖保留率。TCA处理时间对蛋白质脱除率和多糖保留率的影响见图7。
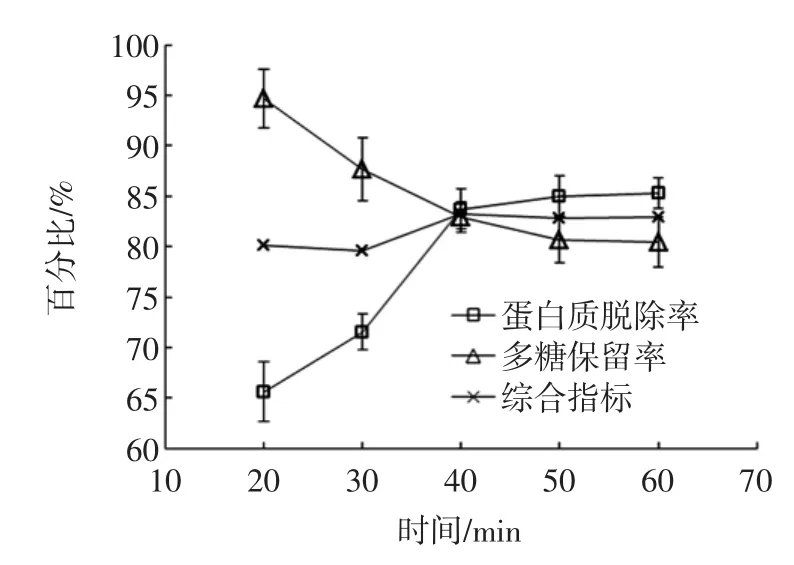
图7 TCA处理时间对蛋白质脱除率和多糖保留率的影响Fig.7 Effectof TCA p rocessing timeon theprotein rem oval rate and polysaccharide retention rate
如图7所示,随着处理时间的增加,蛋白质脱除率逐渐增加,40min~50min后趋于平稳。对于多糖保留率,则随着时间的增加呈现下降趋势,40min~50min后趋于平稳。从综合指标来看,当时间为40min时达到最大值83.31%,此时蛋白质脱除率为83.7%,多糖保留率为82.92%。
2.3.3三氯乙酸(TCA)处理温度的影响
在溶液TCA浓度6%、三氯乙酸(TCA)处理时间40min条件下,设置三氯乙酸(TCA)处理温度分别为30、40、50、60、70℃,测定蛋白质脱除率与多糖保留率。TCA处理温度对蛋白质脱除率和多糖保留率的影响见图8。

图8 TCA处理温度对蛋白质脱除率和多糖保留率的影响Fig.8 Effectof TCA processing tem peratureon the protein rem oval rateand polysaccharide retention rate
如图8所示,30℃~50℃时,温度升高,蛋白质脱除率呈现上升的趋势,50℃时达到最大值;50℃以后,温度升高,蛋白质脱除率下降明显。而多糖保留率在30℃~60℃时,温度升高,总体呈现下降趋势,60℃后反而上升。推测温度升高至50℃以后,造成蛋白质逐渐变性,一方面不利于其沉淀去除,另一方面使与蛋白质结合的多糖分离析出,多糖保留率上升。从综合指标来看,当温度为50℃时达到最大值,为87.12%,此时蛋白质脱除率为90.94%,多糖保留率为83.3%。
2.4 3种脱蛋白方法的比较
Sevage法是将平菇多糖溶液以体积比(多糖液:S evage试剂)1∶4加入Sevage试剂混合后震荡摇匀,静置分层后放出蛋白质层及有机试剂,反复操作,得到脱蛋白液;盐酸-乙醇等电点法是利用盐酸将平菇多糖液调成一定pH,再加入乙醇至一定浓度,最后静置离心得脱蛋白液;TCA法是在平菇多糖液中加入浓度为20%的TCA至一定浓度,混匀后水浴一段时间再离心得脱蛋白液。3种脱蛋白方法的综合比较见图9。
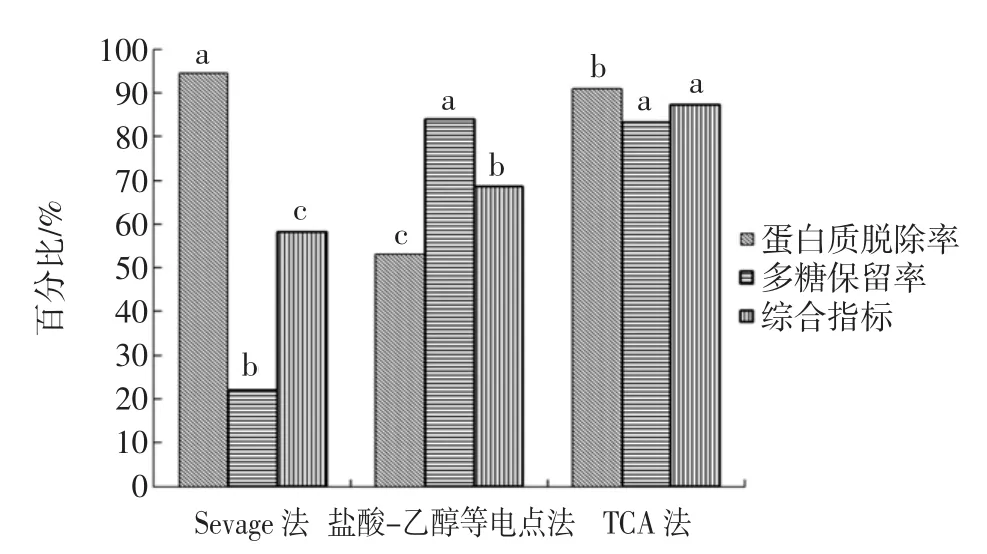
图9 3种脱蛋白方法的综合比较Fig.9 Com prehensive comparison of 3methodsof protein removal
由图9可以看出,Sevage法和TCA法脱蛋白效果优于盐酸-乙醇等电点法,盐酸-乙醇等电点法和TCA法的多糖保留率高于Sevage法。但3种方法综合比较:Sevage法多糖保留率太低,而盐酸-乙醇等电点法的蛋白质脱除率偏低。故综合考虑两因素,TCA法比较合适。后期试验采用TCA法优化脱蛋白工艺。
2.5 Box-Behnken试验优化TCA法脱蛋白工艺
在2.3TCA法单因素试验的基础上,按照表2的Box-Behnken试验设计方案(见1.4.4)进行三因素三水平试验,结果如表3所示。

表3 Box-Behnken试验设计及结果Table3 Box-Behnken experim entaldesignm atrix and experimental results
利用Design Expert8.05软件对表3的试验数据进行多元回归拟合,得到综合指标(Y)对自变量TCA浓度(A)、处理时间(B)、处理温度(C)的二次多项回归方程为:Y=-173.542 75+66.201 50A+1.254 78B+2.293 25C-0.091 500AB-0.014 000AC-0.001 650 0BC-5.617 00A2-0.010 043B2-0.022 417C2。此模型的方差分析见表4。
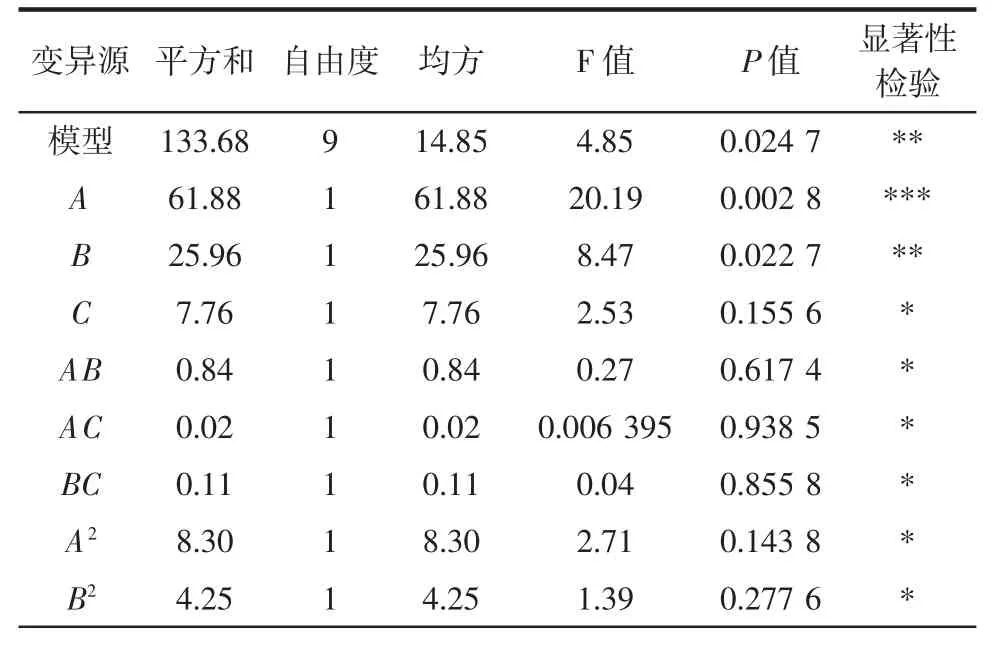
表4 综合指标回归方程模型方差分析及显著性检验Table4 Varianceanalysisof the fitted regression equationmodel and significance testof comp rehensive index

续表4综合指标回归方程模型方差分析及显著性检验Continue table4 Varianceanalysisof the fitted regression equationm odeland significance testof comprehensive index
由表4可知,模型P值为0.024 7,小于0.05,说明二次回归模型是显著的;拟合不足P值为0.069 0,差异不显著,说明二次回归模型能够较好的反应响应值的变化,模型与实际试验拟合程度较好。
TCA浓度(A)对综合指标的影响达到极显著水平(P<0.01),处理时间(B)以及处理温度的二次项(C2)对综合指标的影响达到显著水平(P<0.05),各因素对综合指标的影响顺序是:A>B>C2>A2>C>B2>AB>BC>AC。即:TCA浓度对综合指标影响最大,其次是处理时间。
根据回归方程对以上3个因素绘制响应面图及等高线图,见图10~图12。

图10 TCA浓度和处理时间对综合指标影响的响应面图和等高线图Fig.10 Diagram sof responsesurfaceand contour lines for effecting of com prehensive index on TCA concentration and processing tim e

图11 TCA浓度和处理温度对综合指标影响的响应面图和等高线图Fig.11 Diagramsof response surfaceand contour lines for effecting of com prehensive index on TCA concentration and processing tem perature

图12 处理时间和处理温度对综合指标影响的响应面图和等高线图Fig.12 Diagramsof response surfaceand contour lines for effecting of comprehensive index on processing timeand p rocessing temperature
3个图分别表示TCA浓度、处理时间、处理温度3个因素中1个因素取零点时其余2个因素对综合指标的影响。响应面坡度越陡峭,表明响应值对于操作条件的改变越敏感,该因素对综合指标的影响越大;反之则表明因素对综合指标的影响越小。在其他试验因素固定不变的情况下,考察交互项对综合指标的影响,响应面分析图可用于评价试验因素对综合指标影响的两两交互作用。由图10~图12可知,3个响应面均为开口向下的凸形曲面,说明响应值(综合指标)存在极高值且TCA浓度、处理时间和处理温度3个因素之间两两交互作用均不显著,这与方差分析的结果一致。3个响应曲面的等高线中心均位于-1~1之间,说明最优条件存在于所设计的因素水平范围之内。对回归方程求解得到对综合指标的最优条件为:TCA浓度5.6%,处理时间33min,处理温度48℃,综合指标86.66%。
为验证响应面法所得模型的准确性,取TCA浓度5.6%,处理时间33min,处理温度48℃,对模型进行检验,共进行3次平行验证试验,3次平行试验的综合指标分别为84.64%、84.49%、82.76%,平均值为83.96%(蛋白质脱除率为89.5%,多糖保留率为78.4%),与理论预测值相比相对误差为3.11%,可见该模型能较好地模拟和预测蛋白质脱除率和多糖保留率的综合指标。
3讨论
本文对Sevage法、TCA法和盐酸-乙醇等电点法去除平菇多糖中蛋白质进行了分析比较。Sevage法是利用蛋白质易在有机溶剂中变性沉淀原理去除蛋白。试验结果显示:用Sevage试剂处理1次,蛋白质脱除率为88.73%,多糖保留率仅为26.22%;处理9次后,蛋白质脱除率可达96.8%,而多糖保留率为13.05%。Sevage法在除蛋白过程中,随着大部分蛋白质去除,多糖损失量也在加大。王金玺[16]在分离平菇多糖中的蛋白质时,运用Sevage法除蛋白发现在脱蛋白次数达到7次时,蛋白质脱除率已达95%,但平菇多糖已损失一半以上,与本研究的结果一致。
盐酸-乙醇等电点法中盐酸和乙醇都是极性分子,能破坏蛋白质亲水胶体颗粒使之聚沉;其中乙醇溶剂可增大体系极性,有助于蛋白质分子之间的相互结合而形成沉淀。本试验结果表明:脱除蛋白的最佳条件为乙醇浓度7%,pH 3.8,此时蛋白质脱除率为52.98%,多糖保留率为83.92%。尹丽敏等[17]利用盐酸-乙醇等电点法除去油茶籽多糖中的蛋白质时,获得最佳工艺条件为pH 3.4,乙醇添加量13%,静置时间3天,此时蛋白质脱除率为92.68%,多糖保留率为61.78%。运用盐酸-乙醇等电点法去除平菇多糖蛋白鲜见报道。从本试验的结果看,虽然多糖损失较少,但脱蛋白效果不太理想。与尹丽敏等人的研究有较大差异,推测试验材料不同,多糖和蛋白质特性存在差异,导致脱蛋白效率不一致。
三氯乙酸(TCA)法利用酸性条件下三氯乙酸与蛋白质形成不溶性盐,且TCA作为蛋白质变性剂能使蛋白质构象发生改变,暴露出较多的疏水性基团,使之聚集沉淀。从本试验的结果看,TCA法蛋白脱除率与三氯乙酸含量呈正相关,但多糖保留率随着TCA量的加大逐渐减小。邓启[18]利用TCA法去除黑木耳多糖中的蛋白质时发现随着三氯乙酸含量的增加,蛋白质脱除率在增加,但是多糖的保留率却在下降。TCA浓度为5%时,蛋白质脱除率为76.9%,多糖保留率为56.4%;TCA为9%时,蛋白质脱除率为82.2%,多糖保留率为41.9%。估计黑木耳中蛋白质与多糖连接紧密,多糖随蛋白质一起聚集沉淀,因此与本研究结果存在差异。本试验从三氯乙酸浓度、三氯乙酸处理时间和处理温度着手,运用Box-Behnken试验优化TCA法脱蛋白工艺,经响应面分析得到最佳工艺条件为三氯乙酸终浓度5.6%,处理时间33min,处理温度48℃,其综合评价均值为83.96%,蛋白质脱除率为89.5%,多糖保留率为78.4%,蛋白质脱除与多糖保留的效果优于Sevage法和盐酸-乙醇等电点法。
4结论
本试验分别采用Sevage法、盐酸-乙醇等电点法和TCA法脱除平菇多糖中的蛋白质。结果表明,3种脱蛋白方法对平菇多糖中的蛋白质均有不同程度的脱除作用,Sevage法和TCA法最为显著,Sevage法处理9次后,蛋白质脱除率可达96.8%,但多糖保留率仅为13.05%。盐酸-乙醇等电点法虽多糖保留率较高,为83.92%,但蛋白质脱除率偏低,为52.98%。因此,综合考虑蛋白质脱除率和多糖保留率两因素,得出最理想的脱蛋白方法为TCA法,运用响应面分析获得最佳脱蛋白方案为TCA浓度5.6%,处理时间33min,处理温度48℃,此时的综合指标均值为83.96%,蛋白质脱除率为89.5%,多糖保留率为78.4%。
[1]史琦云,邵威平.八种食用菌营养成分的测定与分析[J].甘肃农业大学学报,2003,38(3):336-339
[2]Ullah M I,AkhtarM,Iqbal Z,etal.Immunotherapeutic activities of mushroom derived polysaccharides in chicken[J].International JournalofAgricultureand Biology,2014,16(2):269-276
[3]JM F,EP A,C A,et al.Antitumor activity of Pleurotus ostreatus polysaccharide fractions on Ehrlich tumor and Sarcoma 180[J].International Journal of Biological Macromolecules,2014,68(7):72-77
[4]Jian-zhongW,Yan-ru L,Hua-ruiG.Studieson theantioxidantactivitiesof crude polysaccharides from Pleurotusostreatus[J].Journal ofBiology,2014,31(1):15-19
[5]BR,RER,MLP,etal.Evaluation ofantidiabetic potentialofoyster mushroom(Pleurotusostreatus)in alloxan-induced diabeticmice[J]. Immunopharmacol Immunotoxicol,2013,35(1):101-109
[6]YangQi,Huang.Gastroprotectiveactivitiesofa polysaccharide from the fruiting bodies of Pleurotus ostreatus in rats[J].International JournalofBiologicalMacromolecules,2012,50(5):1224-1228
[7]苗慧琴,霍秀文,王阳,等.山药多糖脱蛋白方法的研究[J].食品科技,2014,39(1):210-214
[8]张善玉.天然产物多糖脱蛋白方法的研究[J].中国药房,2009,20 (33):2633-2635
[9]陈凯立,王爽,赵书光,等.大孔树脂层析法分离纯化地榆多糖工艺[J].北华大学学报(自然科学版),2016,17(1):35-39
[10]杨国力,王文侠,张慧君,等.玉米麸皮水溶性多糖除蛋白条件研究[J].食品工业科技,2012,33(21):239-241,245
[11]中华人民共和国农业部.NY/T 1676-2008食用菌中粗多糖含量的测定[S].北京:中国标准出版社,2008
[12]Zhuo ZHAO,Wenbin SUN,Yaru JI,etal.Effectsof temperature on determination ofprotein concentration with coomassie brilliantblue method[J].Agricultural Science&Technology,2015,16(2):209-213
[13]赵卓,籍浩天,刘东波,等.光照对考马斯亮蓝法测定蛋白质浓度影响的研究[J].吉林师范大学学报(自然科学版),2015,5(2):112-116
[14]尹丽敏,周建平,姚开波.油茶籽多糖中蛋白质的脱除工艺研究[J].现代食品科技,2012,28(11):1519-1522
[15]Xie L Y,Peng W H.Optimization of protein removalmethod and condition of polysaccharide from Phellinus Linteus[J].Agricultural Science&Technology-Hunan,2011,12(9):1249-1251
[16]王金玺.平菇多糖分离纯化、结构表征与修饰及抗氧化性的研究[D].扬州:扬州大学,2013:36-38
[17]尹丽敏.油茶籽工艺水中多糖及油茶皂素的分离纯化研究[D].长沙:湖南农业大学,2013:19-21
[18]邓启.黑木耳多糖分离纯化及其对大豆分离蛋白糖基化的研究[D].哈尔滨:东北林业大学,2015:19-20
Com parison of M ethods for Rem oving Protein from Polysaccharide of Pleurotus ostreatus
WANGXin-jia,LEIGuo-feng,ZHAIZhi-jun,WUXiao-yu*
(Collegeof Bioscienceand Bioengineering,JiangxiAgriculturalUniversity/Nanchang Key Laboratory for Fermentation Application Technology,Nanchang330045,Jiangxi,China)
The effectsofprotein removal from polysaccharide of Pleurotusostreatus were analyzed by comparing the threemethods of Sevage,hydrochloric acid-ethanol isoelectric point and TCA with protein removal rate,polysaccharide retention rate and comprehensive index as evaluation index.The result showed that protein removal rate ofpolysaccharide by themethod of Sevagewas the highest,and followed by themethod of TCA.The bestway for polysaccharide retention rate was themethod of hydrochloric acid-ethanol isoelectric point,and secondwas TCA.And in consequence the TCAmethod was themosteffective one among the threewaysby considering the two factors of protein removal rate and polysaccharide retention rate.A regression equation of the protein removal from polysaccharide of Pleurotus ostreatus by the way of TCA was obtained using the Box-Behnken test design,and then the optimal conditions of the process for protein removalwas established by response surface analysis,whichwas TCA concentration 5.6%,processing time 33min,and temperature 48℃. Under these conditions,the average of comprehensive evaluation was 83.96%,the protein removal rate and polysaccharides retention ratewas89.5%and 78.4%,respectively.
Pleurotusostreatus;polysaccharide;removalofprotein;responsesurfaceanalysis
10.3969/j.issn.1005-6521.2017.05.024
2016-06-23
农产品加工省部共建国家重点实验室培育基地开放基金项目(粤农科蚕[2012]9号)
王新嘉(1991—),男(汉),硕士研究生,主要从事微生物资源开发利用研究。
*通信作者:吴晓玉,教授,博士。
