芒果核酚类物质提取工艺优化及其抗氧化活性研究
2017-04-11康超李燕段振华覃盛帅良伍淑婕罗杨合
康超,李燕,2,段振华,覃盛,帅良,伍淑婕,罗杨合,*
(1.贺州学院食品科学与工程技术研究院,广西贺州542899;2.大连工业大学,辽宁大连116034)
芒果核酚类物质提取工艺优化及其抗氧化活性研究
康超1,李燕1,2,段振华1,覃盛1,帅良1,伍淑婕1,罗杨合1,*
(1.贺州学院食品科学与工程技术研究院,广西贺州542899;2.大连工业大学,辽宁大连116034)
在单因素试验基础上应用正交试验方法对芒果核多酚提取条件进行优化并初步评价其体外抗氧化活性。试验确定乙醇为最佳提取溶剂;各因素对多酚物质提取量的影响依次为料液比>乙醇提取浓度=提取时间>提取温度;用乙醇溶液提取芒果果核中多酚物质的最佳工艺条件为乙醇浓度70%,料液比1∶25(g/mL),提取时间120min,提取温度60℃,芒果核多酚物质提取含量可达4.36mg/g。抗氧化活性试验结果表明芒果核多酚物质对羟基自由基、超氧阴离子自由基及DPPH自由基的清除率分别为90.9%、83.3%、90%。优化的芒果核多酚提取工艺合理、可行,芒果核多酚物质具有较强的抗氧化性。
芒果核;多酚物质;抗氧化活性
芒果中化学成分种类繁多[1-2],主要以多酚物质为主,没食子酸、香豆素、芒果苷、香草醛、单宁等,并且90%的多酚存在于占芒果总重20%~60%的芒果核中,国外针对果核活性成分做了较多研究,发现芒果核中的酚类物质具有很高的研究价值[3-9]。但长期以来,我国芒果深加工过程中常将芒果核作为废渣抛弃,造成了环境的极大污染和资源严重浪费[10]。广西是中国第二大的芒果生产省份,目前省内最大的芒果加工企业是广西合浦果香园食品有限公司,每年加工芒果约1万t,约产生3 000 t果核废弃物无法得到利用。有研究表明芒果核中多酚类物质的含量和抗氧化作用能力均高于芒果果实,且抑菌光谱范围较宽,可有效抑制脂质过氧化和诱导红细胞氧化损伤抑制作用等[11-15]。笔者通过了解我国芒果及芒果加工产业的发展现状,分析了芒果核多酚的多重功效,采用溶剂法对芒果核多酚物质的提取工艺进行了研究,以期为芒果核中多酚物质的开发利用提供基础资料。
1材料与方法
1.1材料
芒果果核:由广西合浦果香园食品有限公司提供,于60℃恒温烘干并粉碎后,贮于干燥避光处备用。
1.2试剂和仪器
无水碳酸钠、甲醇、乙醇、丙酮、乙酸乙酯、福林酚试剂、没食子酸标准品等:均由柳州苏利有限责任公司提供。万能粉碎机、电热恒温干燥箱、恒温水浴锅、电子天平、分光光度计等:均由贺州学院食品科学与工程技术研究院提供。
1.3方法
1.3.1没食子酸标准曲线的建立
准确称取50mg没食子酸,用70%乙醇溶液定容至50mL,即得浓度为1.0mg/mL没食子酸标准溶液。取9支50mL容量瓶,分别移取0、1、2、3、4、5、7.5、10、12.5mL上述没食子酸标准溶液,将其稀释后配成0、0.02、0.04、0.06、0.08、0.10、0.15、0.20、0.25 mg/mL的标准液。用福林法测定吸光度值。以没食子酸浓度为横坐标,765 nm处的吸光度值为纵坐标,绘制标准曲线,并进行回归分析。
1.3.2总酚含量的测定
准确移取待测液2.0mL于50mL容量瓶中,加入福林试剂1.0mL,充分混合后静置2min,加入10mL 7%的碳酸钠溶液,充分混合后用蒸馏水定容,置30℃恒温水浴中反应1 h,不断振荡。取出,在波长765 nm处测定吸光度值(以蒸馏水为空白对照)。根据标准曲线及其回归方程求出待测液中的多酚含量,然后计算出1 g芒果核样品中多酚类物质的含量(以没食子酸计,mg/g)。
1.3.3试验设计
通过单因素试验,确定影响提取效果的最佳溶剂、主要因素及水平,然后利用正交试验对芒果核多酚类物质提取条件进行优化。
1.3.4抗氧化活性的测定
1.3.4.1清除羟基自由基能力测定
分别取不同质量浓度的待测样液于5只试管中,各加入硫酸亚铁、双氧水,静置,10min后加入水杨酸,静置后在510 nm处测定吸光度A1,用蒸馏水替代水杨酸按照上述方法测定吸光度值A2,用蒸馏水代替待测液按上述方法测定吸光度值A0,VC做对照,按照下列公式计算多酚物质对羟自由基的清除率:
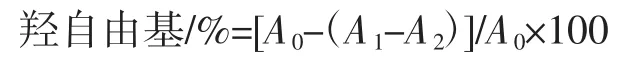
1.3.4.2清除超氧阴离子自由基能力测定
取4.5mLTris-HCl缓冲溶液,于20℃水浴中预热20min,分别加入1mL不同浓度的样品液和0.4mL 25mmol/L的邻苯三酚溶液,混匀后,于25℃水浴中反应5min,然后加入8mol/L的HCl溶液1mL终止反应,然后在325 nm处测定吸光度A1,空白以蒸馏水代替样品液,测定吸光度A0。按照下列公式计算样品对超氧阴离子自由基的清除率:

1.3.4.3清除DPPH自由基能力测定
分别取2.0mL不同质量浓度芒果核活性成分样液于试管中,各加入2mL DPPH(0.04mg/mL),静置20min在517 nm检测吸光度A1;以无水乙醇代替DPPH,按照上述方法测定吸光度A2;做空白组按上述方法测定吸光度A0,以VC做对照,按照下列公式计算样品对DPPH自由基的清除率:
DPPH清除率/%=[1-(A1-A2)/A0]×100
2结果与分析
2.1没食子酸的标准曲线
根据1.3.1的方法回执出福林酚法测定总酚的标准曲线(图1)。
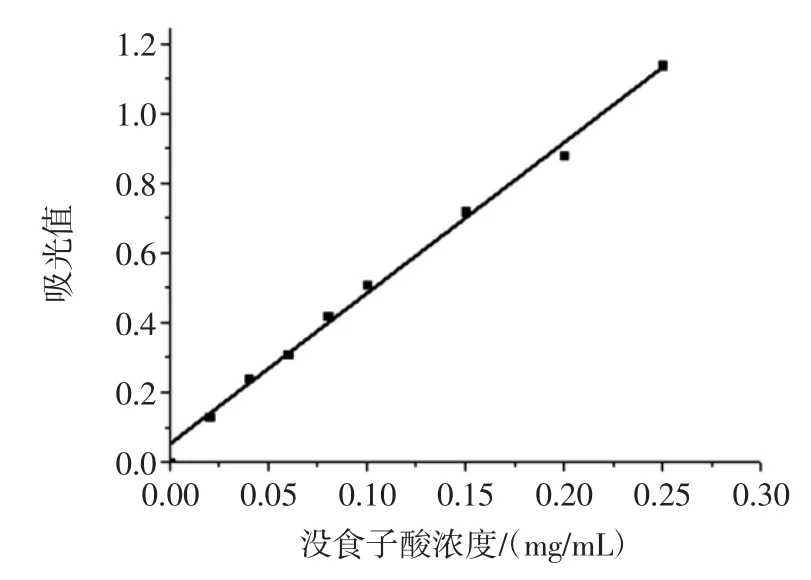
图1 标准曲线Fig.1 Thestandard curveof gallic acid
结果表明,没食子酸在浓度0~0.25mg/mL内与其吸光值呈良好的线性关系,在此范围内的线性回归方程为:y=4.297 4x+0.056,R2=0.999 4。
2.2不同溶剂提取对芒果核多酚提取效果的影响
不同有机溶剂对多酚提取量的影响见图2。
由图2可知,浓度为60%的有机溶剂中,丙酮提取效果最佳,乙醇次之,甲醇、乙酸乙酯再次之,蒸馏水提取效果最差。

图2 不同有机溶剂对多酚提取量的影响Fig.2 Effectof reagentson extraction yield of polyphenol
2.3不同浓度有机溶剂对芒果核多酚提取效果的影响
考虑到丙酮和乙醇提取芒果核多酚效果相差不是很大,且丙酮毒性较大,成本较高,因此我们以不同浓度的丙酮和甲醇进行优化试验(见图3)。

图3 不同浓度丙酮和乙醇对多酚提取量的影响Fig.3 Effectof acetoneand ethanolon extraction yield of polyphenol
结果显示尽管整体上丙酮提取效果较佳,但是60%乙醇对芒果核多酚效果(4.03mg/g)跟60%丙酮提取效果(4.08mg/g)相差不大。另外,多酚是易溶于乙醇的,并且有机溶剂与水的混合液可以打断多酚类物质-蛋白质(多糖)复合物的结合键,从而释放多酚物质。经综合分析,乙醇作为提取剂时多酚提取量和安全性都较高,因此,后续试验考虑乙醇为最佳提取溶剂。
2.4乙醇溶剂提取芒果核多酚物质工艺的研究
2.4.1单因素试验
2.4.1.1温度对多酚物质含量的影响
以乙醇作为最佳溶剂,分别考察在不同提取温度(30、40、50、60、70、80℃)条件下对多酚提取量的影响(见图4)。
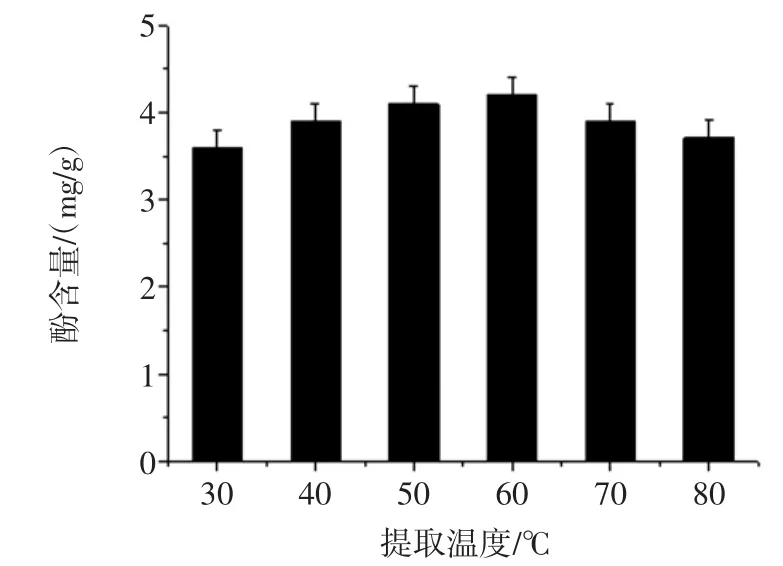
图4 不同温度对多酚提取量的影响Fig.4 Effectof temperatureon extraction yield of polyphenol
结果表明,在温度达到60℃之前,芒果核多酚提取量随着温度的增加而逐步提高,可能由于高温增强分子运动能力,使得多酚类物质易于溶出,但当温度到60℃以后,多酚提取量开始出现下降趋势,应该是多酚物质在高温下结构不稳定的缘故,但总体提取效果也较低温提取效果好。鉴于以上原因,最终确定以乙醇为提取溶剂从芒果核中提取多酚类物质的正交试验的水浴温度范围为50℃~70℃。
2.4.1.2时间对多酚物质含量的影响
不同提取时间对多酚提取量的影响见图5。

图5 不同时间对多酚提取量的影响Fig.5 Effectof timeon extraction yield of polyphenol
由图5可以看出,在60min时芒果核多酚提取量达到最高,60min以后芒果核提取物中的多酚含量逐渐略微减少,当提取时间达到120min后,提取量又略微上升,但之后基本又持平。从理论上来说,提取时间的加长更容易使多酚充分溶解于溶剂中,但过长的时间也会破坏多酚的分子结构。所以,最终确定以乙醇为提取溶剂从芒果核中提取多酚类物质的正交试验的提取时间范围为60min~120min。
2.4.1.3料液比对多酚物质含量的影响
不同料液比对多酚提取量的影响见图6。
由图6可以看出,料液比的提高并非有利于多酚物质的提取,当料液比为1∶20(g/mL),多酚提取效果最佳。因此,考虑到提取溶剂的用量过多造成试剂的浪费以及尽量减少提取过程中的能耗等,确定以乙醇作为提取溶剂时,芒果核多酚物质的正交试验中,料液比范围确定为1∶15(g/mL)~1∶25(g/mL)。

图6 不同料液比对多酚提取量的影响Fig.6 Effectof ration ofmaterial towater on extraction yield of polyphenol
2.4.2正交试验
由上述试验结果,在单因素试验的基础上,进一步考察乙醇浓度、提取温度、提取时间、料液比对芒果核多酚提取效果的影响,设计四因素三水平L9(34)的正交试验(表1)优化工艺参数,采用极差分析法确定最佳方案,表2为正交试验及分析结果。

表1 正交试验因素水平Tab le1 Orthogonalexperimental factor level

表2 正交试验及多酚的得率Table2 Orthogonalexperim entaland polyphenolyield
由表2可知,乙醇浓度及液料比对芒果核多酚物质的提取有较大影响,各因素对芒果核多酚提取影响大小顺序为:B>A=D>C,即料液比>乙醇浓度=提取时间>提取温度,提取温度影响不大。由正交试验结果可以得出最佳试验组合为A3B3C3D3,即乙醇浓度70%,料液比1∶25(g/mL),提取时间120min,提取温度60℃。由于最佳组合没有在参加正交表的组合中,所以需要做验证试验,结果表明当组合为A3B3C3D3时,芒果核多酚提取量为4.36mg/g。
2.5芒果核多酚物质抗氧化活性研究
羟基是活性最强的活性氧化自由基,会诱发机体产生氧化损伤,其清除率常常是反应药物抗氧化作用的重要指标。同样的,超氧阴离子也是生物体主要的活性氧自由基,由其引起的体内脂质过氧化是机体衰老、心血管疾病及肿瘤发生的重要原因。因此,本论文选择羟基自由基及超氧阴离子自由基清除率作为考察芒果核多酚抗氧化活性的指标。芒果核多酚羟基自由基清除能力如图7所示,芒果核多酚超氧阴离子自由基清除能力如图8所示,芒果核多酚提取物DPPH自由基清除能力结果如图9所示。
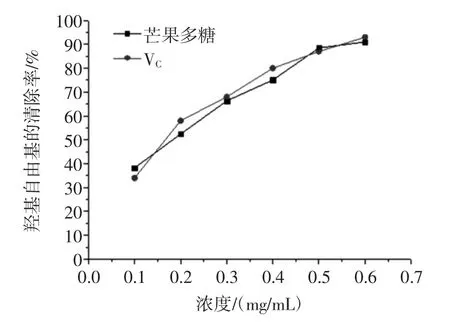
图7 芒果核多酚对羟基自由基的清除作用Fig.7 The scavenging activity of polyphenolon hydroxyl radicals
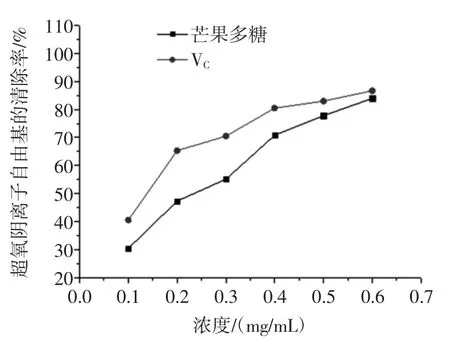
图8 芒果核多酚对超氧阴离子自由基的清除作用Fig.8 The scavenging activity of polyphenolon superoxideanion radicals
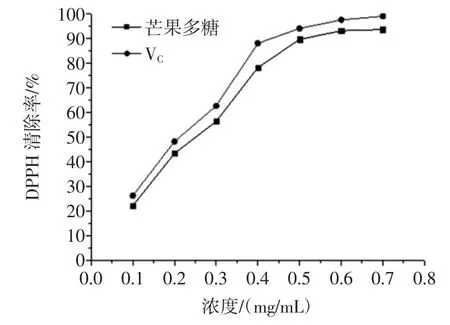
图9 芒果核多酚对DPPH自由基的清除作用Fig.9 Thescavenging activity ofpolyphenolon DPPH radicals
由图7可知,清除能力随着多酚浓度增加而增加,当浓度达到0.6mg/mL时清除率能达到约90%,说明芒果核多酚具有较强的清除羟基自由基作用。由图8可知,多酚浓度越高,清除超氧阴离子自由基的能力越强,当浓度达到0.5mg/mL~0.6mg/mL,清除能力趋于平稳,清除率达到83%,但是清除能力较VC弱些。由图9可知,清除DPPH自由基能力随着多酚浓度增加而增加,当浓度达到0.6mg/mL以上时,其对DPPH自由基的清除率能达到90%,说明芒果核多酚具有较强的清除DPPH自由基作用。以上数据说明芒果果核多酚对羟基自由基、超氧阴离子自由基及DPPH自由基均具有较好的清除能力,研究结果将为芒果核资源的综合利用及其相应的功能性食品开发提供参考借鉴。
3结论
采用单因素和正交试验对芒果核多酚物质的提取条件进行优化,确定乙醇为最佳提取溶剂,各因素对多酚物质提取量的影响依次为料液比>乙醇提取浓度=提取时间>提取温度,最佳工艺条件为乙醇浓度70%,料液比1∶25(g/mL),提取时间120min,提取温度60℃。此条件下,芒果核多酚物质提取含量可达4.36mg/g。抗氧化活性试验表明,芒果核多酚对羟基自由基、超氧阴离子自由基及DPPH清除作用明显,说明芒果核多酚具有很好的抗氧化活性。
[1]周新远,刘帅.“希望之果”——芒果[J].中老年保健,2010(2):36-37
[2]鞠志杰.芒果[J].当代人,2006(8):17-18
[3]Yean-Yean Soong,Philip JBarlow.Quantification ofgallic acid and ellagic acid from longan(Dimocarpus longan Lour.)seed andmango (Mangifera indica L.)kernel and their effectson antioxidantactivity [J].Food Chemistry,2006,97(3):524-530
[4]SNithitanakool,P Pithayanukul,R Bavovada.Antioxidant and hepatoprotective activities of thaimango seed kernel extract[J].Planta Med,2009,75(10):1118-1123
[5]JCBarreto,M TTrevisan,W EHull.Characterization and quantitation of polyphenolic compounds in bark,kernel,leaves,and peel of mango(Mangifera indica L.)[J].JAgric Food Chem,2008,56(14): 5599-5610
[6]A S Abdullah,A SMohammed,A Rasedee.Induction of apoptosis and oxidative stress in estrogen receptor-negative breast cancer, MDA-MB231 cells,by ethanolicmango seed extract[J].BMCComplementAltern Med,2015,15:45
[7]P Maisuthisakul,M H Gordon.Influence of polysaccharides and storage during processingon the propertiesofmango seed kernelextract(microencapsulation)[J].Food Chem,2012,134(3):1453-1460
[8]PMaisuthisakul.Characterization and storage stability of the extract of Thaimango(Mangifera indica Linn.Cultivar Chok-Anan)seed kernels[J].JFood SciTechnol,2014,51(8):1453-1462
[9]Yean-Yean Soong,Philip JBarlow.Antioxidantactivity and phenolic contentof selected fruit seeds[J].Food Chemistry,2004,88(3): 411-417
[10]赖必辉,毕金峰,庞杰,等.芒果加工技术研究进展[J].食品与机械,2011(3):152-155
[11]龙燕,图雅.芒果核生药鉴定[J].时珍国医国药,1999(12):918
[12]W Van Pee,LBoni,M Foma,etal.Positionaldistribution of the fatty acids in the triglyceridesofmango(Mangifera indica)kernel fat [J].Journal of the American Oil Chemists’Society,1980,57(8): 243-245
[13]TChandrasekhara Rao,G Lakshminarayana,PA Ramalingaswamy. Varietal variations in content,characteristics and composition of mango seedsand fat[J].Journal of the American Oil Chemists’Society,1983,60(1):88-89
[14]Darwish SM,Asballa A E.Antioxidantand antimicrobiaactivitiesof extract and oil from mango seed kernel[J].Food Chemistry,2007, 103:1134-1140
[15]刘晓芳,刘满红,张荣来.双水相-匀浆萃取法提取芒果核多酚工艺研究[J].云南民族大学学报(自然科学版),2015(2):144-146
Optim ization of Extraction Process of Polyphenol from M ango Kernel Seeds and Evaluation of Antioxidative Activity
KANGChao1,LIYan1,2,DUAN Zhen-hua1,QINSheng1,SHUAILiang1,WUShu-jie1,LUOYang-he1,*
(1.Research Instituteof Food Science&Engineering Technology,Hezhou University,Hezhou 542899,Guangxi,China;2.Dalian Polytechnic University,Dalian 116034,Liaoning,China)
Based on the single factorexperiments,orthogonalexperimentaldesignwasemployed tooptimize the extraction conditionsofpolyphenol frommango kernelseedsand itsantioxidativeactivitywasevaluated.The results revealed the ethanol to be the best extraction solvent extraction and determined the factors affect the amountof time for the extraction as followed:ratio of rawmaterial towater>concentration ofethanol=time>temperature.Theoptimum extraction conditionwere:concentration ofethanol70%,ratio ofwater to rawmaterial1∶25(g/mL),extraction time 120min,extraction temperature 60℃.Under these conditions,the extraction yield of polyphenolwas 4.36mg/g.The results of antioxidation experiments showed that the highest scavenging capacity of polyphenolagainst·OH,O2-·and DPPH free radicalwas 90.9%,83.3%and 90%,respectively.The optimization of polyphenolextraction process technologywas reasonable and feasible,polyphenol frommango kernelseedshad strongerantioxidantactivity.
mangokernelseeds;polyphenol;antioxidativeactivity
10.3969/j.issn.1005-6521.2017.05.011
2016-06-13
国家自然科学基金(21365011);广西自然科学基金(2013 GXNSFAA019046);贺州学院博士启动基金(HZUBS201515)
康超(1985—),女(汉),讲师,博士,研究方向:食品工程和天然产物研究与开发。
*通信作者:罗杨合(1969—),男,教授,博士。
