铬耐性菌对土壤中六价铬的还原作用
2017-04-11肖文丹叶雪珠孙彩霞浙江省农业科学院农产品质量标准研究所浙江杭州310021
肖文丹,叶雪珠,孙彩霞,张 棋,徐 萍 (浙江省农业科学院农产品质量标准研究所,浙江 杭州 310021)
铬耐性菌对土壤中六价铬的还原作用
肖文丹,叶雪珠*,孙彩霞,张 棋,徐 萍 (浙江省农业科学院农产品质量标准研究所,浙江 杭州 310021)
选择7种全国性典型土壤(黄壤、红壤、石灰性紫色土、青紫泥、黑土、砖红壤和潮土),研究微生物群落对铬胁迫的响应以及土著铬耐性菌对土壤中六价铬的还原作用.结果表明,在重金属铬的胁迫作用下,铬耐性菌成为土壤中的优势菌群,在黄壤、红壤、石灰性紫色土、青紫泥、黑土、砖红壤和潮土中丰度依次为 75.2%、89.9%、77.3%、65.3%、72.8%、65.4%、92.8%,并在六价铬还原过程中发挥了重要的作用,7种土壤中微生物对六价铬还原的贡献率分别为 14.4%、44.0%、20.6%、34.9%、21.9%、21.7%、22.0%.微生物对六价铬还原的贡献率主要受土壤中亚铁含量和颗粒组成影响.采用 PCR-DGGE-克隆测序技术鉴定了这 7种土壤中铬耐性菌的种类,主要为芽孢杆菌(Bacillus sp.)、埃希氏菌(Escherichia sp.)、异常球菌(Deinococcus sp.)、小单胞菌(Micromonospora sp.)、甲基杆菌(Methylobacterium sp.)、马赛菌(Massilia sp.)、酸杆菌(Acidobacterium sp.)、丛毛单胞菌(Comamonas sp.)、慢生根瘤菌(Bradyrhizobium sp.)和节杆菌(Arthrobacter sp.).关键词:六价铬;铬耐性菌;优势菌群;克隆测序;相关分析
随着工业的发展,铬及其化合物应用越来越多,如电镀、皮革、印染、化工等行业[1].大量含铬的废水、废渣随意排放,导致土壤、水体和生物遭到不同程度的污染[2].土壤中的铬通常以三价和六价2种稳定价态存在,三价铬在土壤中具有移动性弱和生物有效性低的特点,而六价铬具有移动性强和生物有效性高的特点,并且六价铬对人体的毒性比三价铬高约100倍[3-4].根据胁迫机制,长期生活在铬污染土壤中的微生物,会对恶劣环境产生抗逆性,生成一些对抗不利因素的自我保护措施.因此,铬污染土壤中生存着一些耐受高浓度六价铬的微生物,即铬耐性菌,
其中有些耐性菌还能将高毒的六价铬还原成低毒的三价铬,间接地提高对铬的抗逆性[5-6].
目前已经报道的铬还原菌主要为Pseudomonas[7-8]、Microbacterium[9]、Desulfovibrio[10]、Enterobacter[1]、Escherichia coli[11]、Bacillus[12].
对六价铬具有抗逆性并且能将六价铬还原为三价铬的微生物能够被用来修复铬污染土壤
[6].相比于传统方法,微生物修复具有环境友好、可原地处理、操作简单等优势,为铬污染土壤的治理开辟了一个极具潜力的新领域.目前,采用铬还原菌处理铬污染土壤已有报道,如常文越等[13]将铬污染土壤中筛选出的铬还原菌修复污染土壤,1个月内土壤中六价铬的修复效果可达到 90%以上.Achal等[14]将真菌 Gloeophyllum sepiarium用于修复六价铬污染土壤,6个月后,六价铬还原率达到 90%.但是目前对微生物修复铬污染土壤的研究往往都是通过人为投加外源铬还原菌,缺乏对土壤中土著微生物的探索,并且对主要农田土壤中土著铬耐性菌的组成,以及它们对六价铬还原的作用还缺乏研究.应用土著微生物进行铬污染土壤的修复在环境安全性、环境适应性、种群协调性以及应用成本方面具有其他外源菌种不可比拟的优越性.因此,探究典型农田土壤中土著铬耐性菌的组成以及它们对土壤中六价铬的还原作用,可为铬污染土壤的原位微生物修复提供科学依据和菌种资源.本研究选择7种全国性的典型土壤(黄壤、红壤、石灰性紫色土、青紫泥、黑土、砖红壤和潮土),研究微生物群落对铬胁迫的响应以及土著铬耐性菌在六价铬还原过程中的作用,并通过 PCR-DGGE-克隆测序鉴定土壤中铬耐性菌的种类.
1 材料与方法
1.1 土壤样品采集
本试验选用7种典型土壤类型:红壤(黏化湿润富铁土,中国系统分类)、砖红壤(简育湿润铁铝土,中国系统分类)、黄壤(铝质常湿淋溶土,中国系统分类)、石灰性紫色土(石灰紫色正常新成土,中国系统分类)、青紫泥(潜育水耕人为土,中国系统分类)、黑土(黏化湿润均腐土,中国系统分类)和潮土(底锈干润雏形土,中国系统分类),分别采集(0~20cm)于广西桂林、广东湛江、浙江湖州、四川雅安、浙江嘉兴、黑龙江哈尔滨和山东曲阜.土壤理化性质和污染物背景值见表1.

表1 供试土壤基本理化性质和污染物背景浓度(干重计)Table 1 Selected physicochemical properties of the soil (dry weight basis)
1.2 实验设计
每种土壤类型设2个处理:灭菌和非灭菌.灭菌处理采用剂量10kGy的60Co γ射线对土壤进行辐照来达到灭菌目的[15].称取相当于 100g 干土重的新鲜土样于塑料盆,以 K2Cr2O7水溶液的形式在土壤中加入六价铬,并充分搅拌使铬均匀地分布在土壤中,六价铬的目标浓度为100mg/kg,每个处理设3个重复.所有装载土壤的塑料盆均已灭菌,并用灭菌锡箔纸覆盖,于人工气候箱25oC黑暗培养,培养期间每天通过添加无菌水使土壤含水量保持在田间持水量的 60%.六价铬添加后1,3,7,14,21,28d取样测定土壤中残留六价铬含量.同时取第 28d非灭菌处理土样采用PCR-DGGE方法测定土壤中微生物群落结构.所有取样操作均在厌氧手套箱中进行(Coy Scientific Products)[16].
1.3 铬耐性菌计数
六价铬加入28d后,取非灭菌处理的土样测定土壤中铬耐性菌的数量和丰度,具体方法如下:称取相当于1g烘干土重的新鲜土样,迅速倒入盛有10ml 0.9% NaCl溶液的试管中,涡旋1min.将制好的土壤溶液进行 10倍梯度稀释,然后选择10-3到10-74个稀释梯度,取100μL土壤溶液均匀涂布于添加5mmol/L K2Cr2O7的NA固体培养基中,同时取 100μL土壤溶液均匀涂布于未添加K2Cr2O7的NA固体培养基中.每个稀释梯度设3个平行,30℃培养 4d后,统计平板上长出的菌落数,选取菌落数在30~300之间的稀释度计数,取3个平行的平均数乘以稀释倍数来表示菌的数目
[17].铬耐性菌的丰度用添加 5mmol/L K2Cr2O7的NA固体培养基中的菌落数与未添加K2Cr2O7的NA固体培养基中菌落数的比值表示.
1.4 微生物群落结构分析
使用美国MoBio公司的土壤DNA试剂盒(Ultra High Purity DNA Isolation Kit for Soil)提取土壤总DNA.土壤16S rRNA的V3区段采用通用引物357F-GC和518R进行PCR扩增[18-19]. 357F-GC和 518R序列分别为:357F-GC (5’-CGCCCGCCGCGCGCGGCGGGCGGGGCGGG GGCACGGGGGGCCTACGGGAGGCAGCAG-3’)和 518R(5’-ATTACCGCGGCT GCTGG-3’). PCR扩增采用50μL反应体系:10×PCR反应缓冲液 5μL;MgCl2(20mmol/L) 5μL;357F-GC (10μmol/L) 1μL;518R (10μmol/L) 1μL;dNTPs (2.5mmol/L) 4μL;Taq酶 (5U, Takara) 0.5μL; DNA模板 1μL;灭菌超纯水 32.5μL.反应后的PCR产物经琼脂糖凝胶电泳后,割胶,并用胶回收试剂盒进行回收纯化.
取大约400ng纯化后的PCR产物进行8%的聚丙烯酰胺凝胶电泳(DCodeTM,Bio-rad),变性梯度为20%~50% (100%变性梯度包括7mol L−1尿素和40%甲酰胺).在电压200V和60ºC条件下,电泳5h.电泳完毕后将凝胶进行SYBR GREEN I染色,并利用 ChemiDoc™ XRS+凝胶成像系统(Bio-rad)进行凝胶成像.之后采用 Quantity One分析软件对DGGE凝胶图像进行数字化分析.根据DGGE图谱中各泳道的条带位置、亮度以及数目,采用邻接法做聚类分析.利用Shannon指数表示微生物群落多样性.
在紫外灯下挑取DGGE图谱中的目标条带,割胶后,用TaKaRa DNA purification kit胶回收试剂盒(宝生物,大连)回收条带中DNA,并将其作为模板,采用引物对 357F和 518R进行 PCR扩增.PCR产物经胶回收试剂盒纯化后,使用试剂盒pEASY-T1cloning Kit进行克隆.将经检测含有目的插入片断的克隆送交华大基因科技股份有限公司,用ABI PRISM 3100Genetic Analyzer进行测序.
1.5 数据分析
六价铬在土壤中的还原动态趋势采用指数模型拟合:

式中:C是t时的铬(VI)浓度;C0是铬(VI)初始浓度; k是速率常数.土壤中铬耐性菌的数量与铬(VI)还原速率(k)之间的相关关系通过Pearson相关分析(P<0.05)探讨.试验数据采用SPSS 18.0进行处理和分析.
2 结果
2.1 灭菌和非灭菌土壤中六价铬还原动态
如图1所示,在培养1~7d的时间内土壤中六价铬还原速率最快,随后还原速率减慢.培养 7d,非灭菌土壤中六价铬的还原率分别为82.51%(红壤)、49.14%(青紫泥)、41.41%(石灰性紫色土)、27.93%(黑土)、21.11%(砖红壤)、17.38%(黄壤)、12.37%(潮土);灭菌土壤中六价铬还原率分别为76.89%(红壤)、36.37%(青紫泥)、30.58%(石灰性紫色土)、20.27%(黑土)、14.58%(砖红壤)、13.86%(黄壤)、8.58%(潮土)(表2).
六价铬在土壤中还原动态趋势通过一级动力学模型拟合:

式中:[Cr(VI)]是时间 t时的 Cr(VI)浓度,[Cr(VI)]0是Cr(VI)初始浓度,k是速率常数.
一级动力学常数如表3所示,六价铬在土壤中的还原动态趋势能用此一级动力学模型很好的拟合,相关系数高达 0.80~0.98(P<0.01).六价铬还原速率依次为红壤>青紫泥>石灰性紫色土>黑土>砖红壤>黄壤>潮土. 非灭菌土壤六价铬还原速率是灭菌土壤的1.17~2.75倍.微生物在六价铬还原过程中的贡献率通过灭菌和非灭菌处理的六价铬还原速率之差与非灭菌处理的六价铬还原速率的比值计算,分别为 14.4%(黄壤)、44.0%(红壤)、20.6%(石灰性紫色土)、34.9%(青紫泥)、21.9%(黑土)、21.7%(砖红壤)和22.0%(潮土).
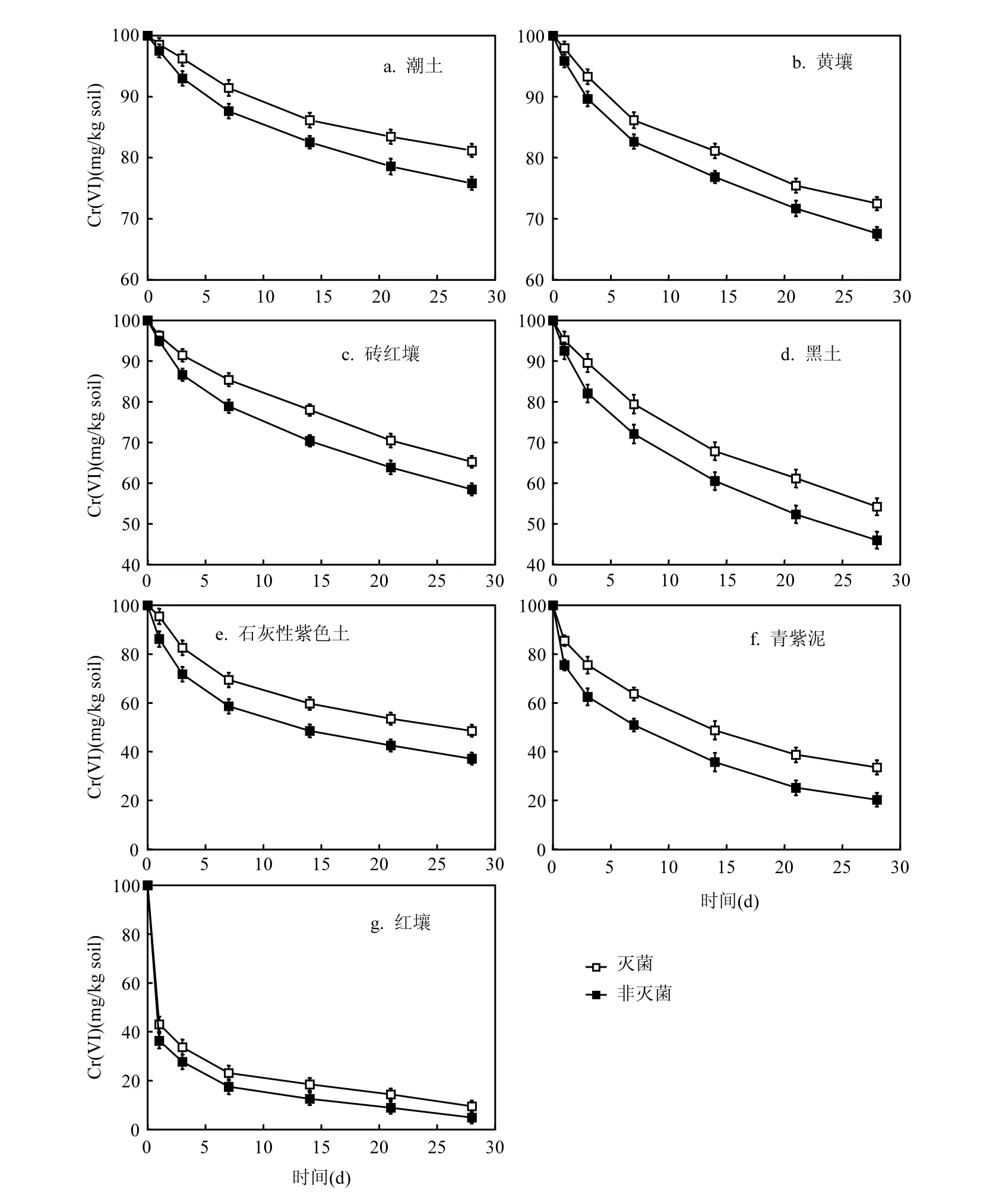
图1 土壤中铬(VI)的还原动态趋势Fig.1 Dynamic changes of Cr(VI)
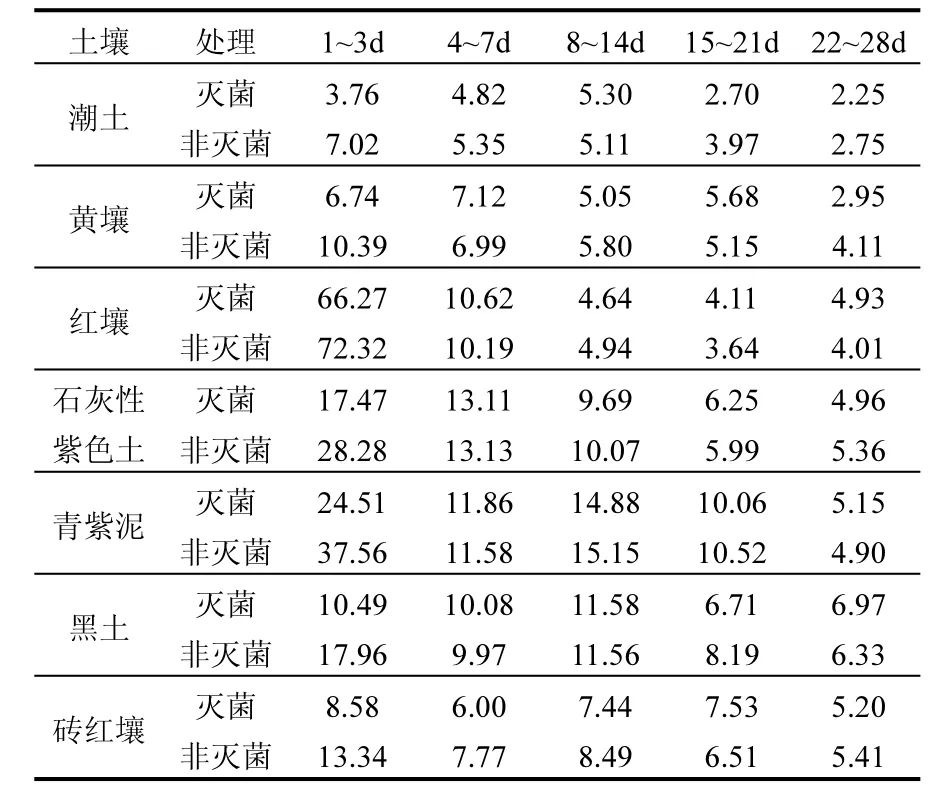
表2 不同时间段六价铬的还原率(%)Table 2 Cr (VI) reduction at different time periods (%)
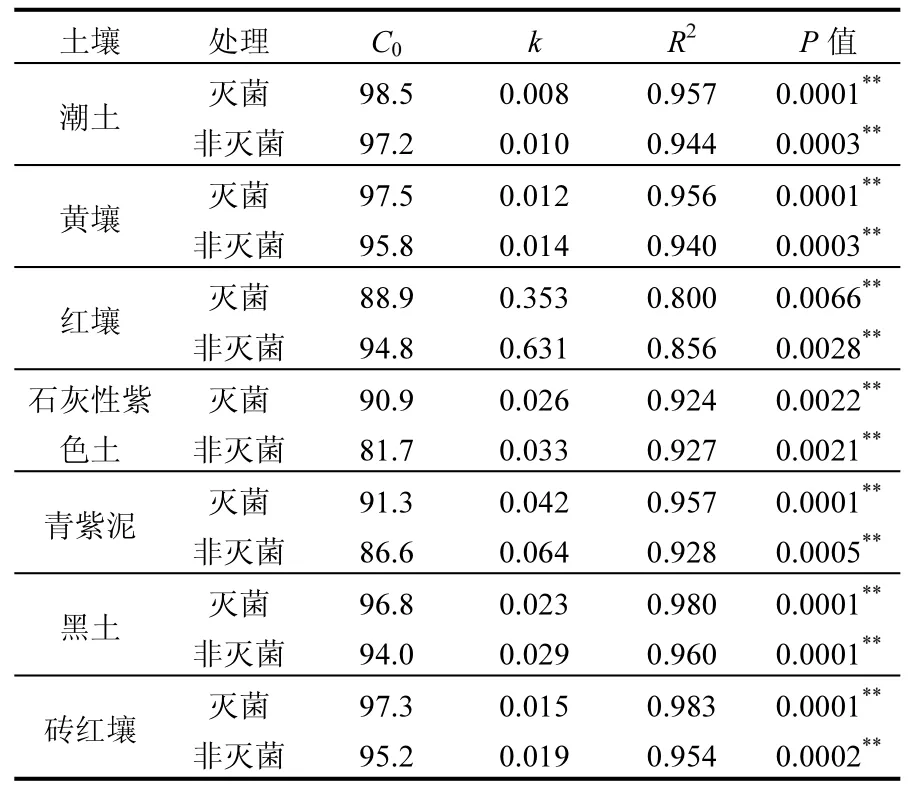
表3 铬(VI)还原一级动力学模型拟合结果Table 3 Fitted regressions of dynamic changes of Cr(VI)
2.2 微生物群落对铬处理的响应
采用PCR-DGGE方法分析不同土壤中微生物群落对铬处理的响应,土壤微生物群落 DGGE图谱如图2所示.亮度高的条带所代表的微生物为逆境环境选择出来的最具有竞争优势的种群.通过与对照土壤DGGE图谱相比,六价铬的加入改变了微生物群落结构,出现了一批在六价铬污染土壤中的优势菌群,即为铬耐性菌.
六价铬加入28d后,土壤中铬耐性菌的数量如表4所示,分别为2.5×105个(黄壤),8.5×106个(红壤),3.0×106个(石灰性紫色土),3.9×106个(青紫泥),2.2×106个(黑土),9.0×104个(砖红壤)和1.5×104个(潮土).通过 Pearson相关分析,土壤中铬耐性菌的数量与六价铬还原速率之间的相关系数高达0.896,达到了P<0.01显著水平,说明铬耐性菌在六价铬还原过程中发挥了重要的作用.并且在六价铬加入28d后,铬耐性菌已经成为土壤中优势菌群,丰度高达65.3%~92.8%.
根据16S rRNA的序列,基于邻接法,建立土壤微生物群落系统发育树,如图3所示.根据系统发育树的结果,青紫泥中铬耐性菌主要为异常球菌Deinococcus sp.和节杆菌Arthrobacter sp.;石灰性紫色土中铬耐性菌主要为马赛菌 Massilia sp.和芽孢杆菌Bacillus sp.;黑土中铬耐性菌主要为芽孢杆菌Bacillus sp.和异常球菌Deinococcus sp.;潮土中铬耐性菌主要为小单胞菌Micromonospora sp.、甲基杆菌Methylobacterium sp.和节杆菌Arthrobacter sp.;红壤中铬耐性菌主要为酸杆菌 Acidobacterium sp.、芽孢杆菌Bacillus sp.、埃希氏菌Escherichia sp.和丛毛单胞菌 Comamonas sp.;砖红壤中铬耐性菌主要为慢生根瘤菌Bradyrhizobium sp.;黄壤中铬耐性菌主要为酸杆菌 Acidobacterium sp.、埃希氏菌Escherichia sp.、丛毛单胞菌Comamonas sp.和慢生根瘤菌Bradyrhizobium sp..

表4 铬(VI)处理土壤铬耐性菌数量及丰度Table 4 The number of Cr resistant bacteria at day 28

图2 土壤微生物群落DGGE图谱Fig.2 DGGE profiles of the soil bacterial 16S rRNA fragments图中CK代表对照土壤、100代表添加100mg kg−1Cr(VI)土壤
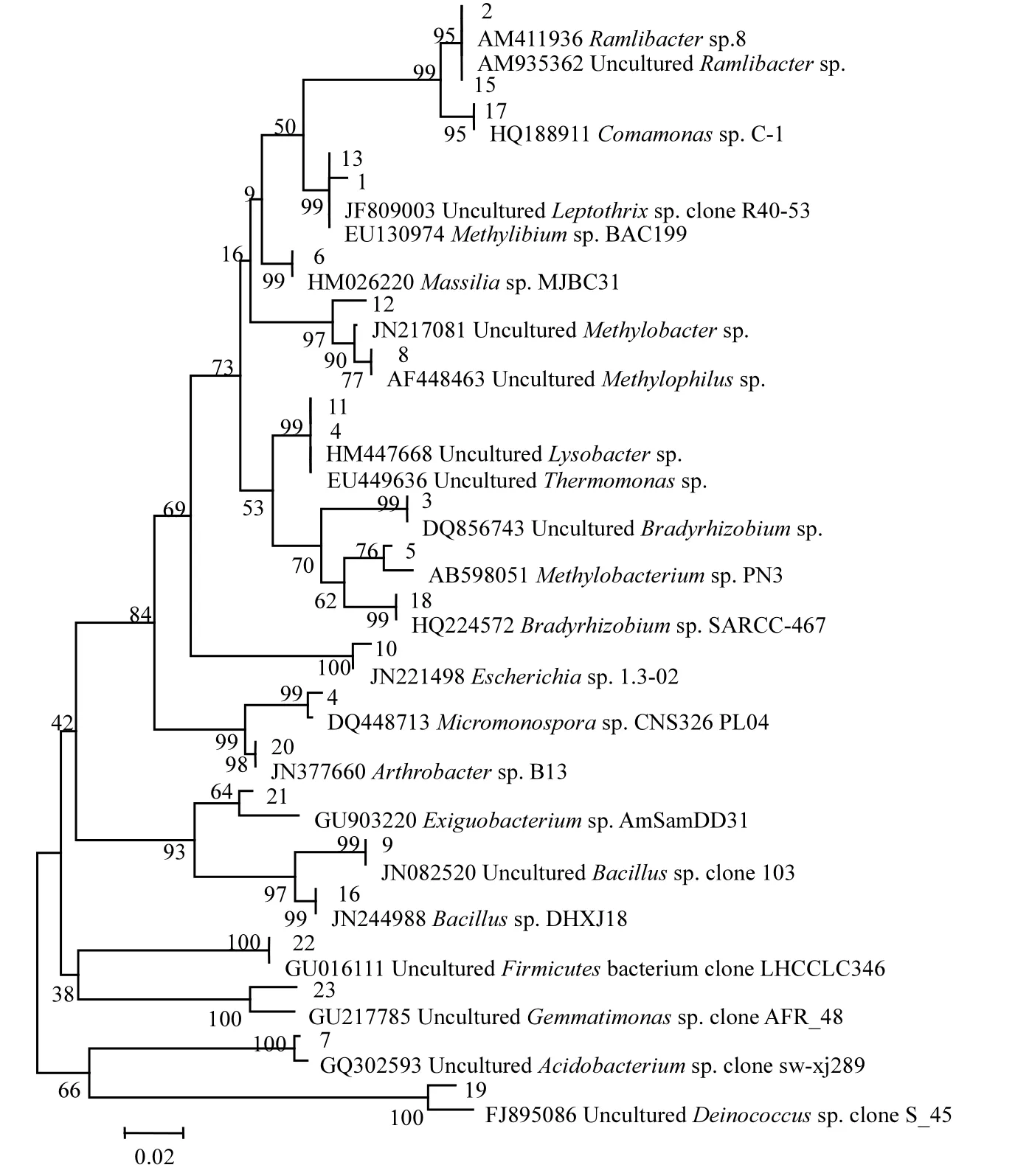
图3 土壤微生物群落系统发育树Fig.3 Phylogenetic analysis showing the relationships of clones
土壤微生物优势菌群可以分为8大类:α-变形菌(慢生根瘤菌 Bradyrhizobium和甲基杆菌Methylobacterium);β-变形菌(纤发菌Leptothrix、沙壤土杆菌Ramlibacter、马赛菌Massilia、嗜甲基 菌 Methylophilus 和 丛 毛 单 胞 菌Comamonas);γ-变形菌(埃希氏菌Escherichia、溶杆菌Lysobacter、甲基球菌Methylobacter和热单胞 菌 Thermomonas);放 线 菌 (小 单 胞 菌Micromonospora和节杆菌 Arthrobacter);厚壁菌(芽胞杆菌Bacillus和微小杆菌Exiguobacterium);酸杆菌Acidobacterium;芽单胞菌Gemmatimonas;异常球菌Deinococcus.
使用STLINK 作为仿真器,当LDC1000 检测到存在金属或硬币时,它会比较检测到的数据。然后,在软件中设置改变阈值以区分和识别导线和硬币的阈值,并且设置硬币阈值是700。
Shannon指数用来表征土壤微生物群落多样性[16],结果如表5所示.黄壤、石灰性紫色土、青紫泥、黑土、砖红壤和潮土中Shannon指数在铬处理条件下比对照高,而红壤的Shannon指数在铬处理条件下比对照低.结合表4铬耐性菌百分率的数据推断,微生物群落多样性并没有因为六价铬加入而减少,而是在重金属铬胁迫作用下,铬耐性菌成为土壤中优势菌群.
2.3 微生物还原铬(VI)贡献率与土壤性质关系
微生物在六价铬还原过程中贡献率与土壤性质之间的相关关系通过Pearson相关系数表示,如表 6所示.相关系数表明微生物对铬(VI)还原的贡献率与亚铁含量存在极显著正相关(P <0.01),与黏粒含量存在显著正相关(P < 0.05),而与砂粒含量存在显著负相关(P < 0.05).其他土壤理化参数如土壤pH值、有机质、阳离子交换量和易还原态锰含量与微生物在铬(VI)还原中贡献率无显著相关关系.
在添加六价铬后,黄壤、红壤、石灰性紫色土、青紫泥、黑土、砖红壤和潮土中六价铬与三价铬的含量比例分别为3.31、1.46、1.72、1.76、1.53、1.58和2.79.通过Pearson相关分析,土壤中六价铬与三价铬的含量比例与微生物在六价铬还原过程中贡献率之间的相关系数仅为-0.564,P>0.05(表 6).因此六价铬与三价铬的含量比例对微生物在六价铬还原中贡献率无显著影响.

表5 微生物群落多样性Shannon指数Table 5 Shannon index of the bacterial community diversity in the tested soils

表6 土壤各性质与微生物在铬(VI)还原中贡献率之间的Pearson相关系数Table 6 Coefficients of linear correlation between soil properties and contribution of microorganisms to Cr(VI) reduction
3 讨论
3.1 土壤微生物群落对铬处理的响应
本研究证明了重金属铬的添加是影响土壤微生物群落组成的一个重要因素,此外,土壤类型也一定程度影响了微生物群落的组成.在本研究中,外源添加铬比土壤性质对微生物群落的影响更大.在铬处理土壤中,铬耐性菌的丰度高达65.3%~92.8%(表 4).因而推断铬处理对微生物群落的影响主要表现在铬的胁迫作用下,出现了一批对铬有高抗性的耐性菌,并且成为土壤中的优势菌群,此结论与孟庆恒等[20]关于微生物群落对铬处理响应的报道一致.
黄壤、石灰性紫色土、青紫泥、黑土、砖红壤和潮土的微生物群落多样性 Shannon指数在铬处理条件下比对照高,仅红壤的Shannon指数在铬处理下比对照低(表 5).Xiao等[18]指出,在特定的情况下,适当的胁迫能通过抑制土壤中原有优势菌群的生长而提高土壤中微生物的多样性.Nakatsu等[17]也发现铬胁迫改变了土壤中原有微生物群落组成,提高了微生物种群多样性.
3.2 铬耐性菌促进土壤中铬(VI)的还原
自从19世纪70年代第一个铬还原微生物的发现[21],目前对铬还原菌的研究越来越多,大量的菌种被报道[5,9-11,22].本研究中,芽孢杆菌Bacillus sp.、埃希氏菌Escherichia sp.、异常球菌 Deinococcus sp.、小单胞菌 Micromonospora sp.、甲基杆菌 Methylobacterium sp.、马赛菌Massilia sp.、酸杆菌Acidobacterium sp.、丛毛单胞 菌 Comamonas sp.、 慢 生 根 瘤 菌Bradyrhizobium sp.和节杆菌Arthrobacter sp. 被鉴定为六价铬耐性菌 (图2和图3).
其中部分铬耐性菌已被报道具有还原六价铬能力,如芽孢杆菌 Bacillus sp.[12,22]、埃希氏菌Escherichia sp.[11,23]、异常球菌 Deinococcus sp.[24]、丛毛单胞菌 Comamonas sp.[25]和节杆菌Arthrobacter sp.[5,26].关于这些铬还原菌还原六价铬的机理已有一定的研究,Das等[22]指出Bacillus sp.具有分泌铬还原酶的能力,并且能将该酶排出体外还原土壤中六价铬,修复铬污染土壤.Ackerley等[23]报道Escherichia coli 能分泌一种氧不敏感的硝基还原酶NfsA,此种黄素蛋白能将六价铬还原为三价铬.Lin[11]研究得出, Escherichia coli ATCC 33456 能通过共代谢作用 还 原 六 价 铬 .Fredrickson 等[24]指 出 , Deinococcus radiodurans 能参与六价铬、氧化铁与乳酸以及其他有机物之间的氧化还原反应,在氧化乳酸的同时还原六价铬和氧化铁.Bestawy等[25]报道 Comamonas sp.体内的铬还原酶能通过硫酸转运途径还原六价铬.Megharaj等[26]报道,Arthrobacter sp.所具有的六价铬还原能力主要与细胞体内的可溶蛋白组分有关.
微生物还原六价铬的机制除了铬还原菌直接参与的酶促还原[6,19],还有铁还原菌参与的间接还原[15,27]:铁还原菌将三价铁还原为二价铁,然后二价铁将六价铬还原为三价铬,自身氧化为三价铁,如此循环,土壤中六价铬不断得到还原. Wang等[28]研究证明,慢生根瘤菌Bradyrhizobium sp.具有还原铁离子的能力,是柠檬酸铁培养基中的优势菌,而 Bradyrhizobium也是本研究鉴定到的铬耐性菌之一.因此,推断Bradyrhizobium促进六价铬还原的机制可能是与其参与 Cr(VI)与Fe(II)之间的氧化还原反应有关.并且通过表6的相关分析结果,Fe(II)含量与微生物对六价铬还原的贡献率呈极显著正相关(P<0.01),也从侧面证明了这个推断.
尽管目前还没有报道指出, Micromonospora、Methylobacterium、Massilia和 Acidobacterium在六价铬还原过程中的作用,通过本研究 PCR-DGGE-克隆测序分析结果,推断这些微生物种群在六价铬还原过程中也发挥了一定的作用.下一步的研究需要对这些微生物进行分离筛选,深入探讨其在六价铬还原过程中的作用.
3.3 土壤性质对微生物还原铬(VI)的影响
土壤理化性质会影响土壤微生物群落组成
[29],因而推断,土壤性质同样也会影响土壤中铬耐性菌的组成,进而影响六价铬的还原,但是土壤性质如何影响微生物还原六价铬尚不清楚.因此,本研究通过相关分析研究土壤理化性质与微生物还原六价铬贡献率之间的相关关系.微生物对六价铬还原的贡献率与亚铁含量存在(P <0.01)极显著正相关(表 6),表明土壤微生物促进了Cr(VI)与Fe(II)之间的氧化还原反应.Tokunaga等[30]指出铁还原菌参与的 Cr(VI)-Fe(II)之间的氧化还原反应是六价铬还原的重要途径之一.Ding等[15]也报道了微生物通过还原铁的水和氧化物来促进土壤中六价铬的还原.
此外,相关系数也表明微生物对六价铬还原的贡献率与土壤黏粒含量存在显著正相关(P <0.05),而与砂粒含量存在显著负相关(P <0.05)(表 6).土壤中的微小颗粒,特别是黏土颗粒,能为微生物活动提供较大的比表面积[31-32].黏土颗粒表面的功能基团能丰富土壤微生物多样性,进而促进六价铬的还原.根据以上讨论,我们推断不同土壤中微生物对六价铬还原的贡献率差异主要归因于铬耐性菌组成和土壤性质(亚铁和颗粒组成)的差异.
4 结论
4.1 六价铬处理对微生物群落的影响主要表现为在六价铬的选择作用下,铬耐性菌成为土壤中的优势菌群.红壤、砖红壤、黄壤、石灰性紫色土、青紫泥、黑土和潮土中铬耐性菌主要为芽孢杆菌Bacillus sp.、埃希氏菌Escherichia sp.、异常 球 菌 Deinococcus sp.、 小 单 胞 菌Micromonospora sp.、甲基杆菌Methylobacterium sp.、马赛菌Massilia sp.、酸杆菌Acidobacterium sp.、丛毛单胞菌 Comamonas sp.、慢生根瘤菌Bradyrhizobium sp.和节杆菌Arthrobacter sp.,它们能显著促进土壤中六价铬的还原.
4.2 土壤性质,特别是亚铁和土壤颗粒组成,影响了微生物对六价铬还原的贡献率.铬耐性菌促进六价铬还原的机制还需要进一步的探讨研究.
[1] Dotaniya M L, Thakur J K, Meena V D, et al. Chromium pollution: a threat to environment - a review [J]. Agricultural Reviews, 2014,35(2):153-157.
[2] 朱玲玲,曹佳妮,张 文,等.一株耐铬细菌的鉴定及其还原铬性能分析 [J]. 环境科学学报, 2013,33(10):2717-2723.
[3] Mao L, Gao B, Deng N, et al. Oxidation behavior of Cr(III) during thermal treatment of chromium hydroxide in the presence of alkali and alkaline earth metal chlorides [J]. Chemosphere, 2016,145(3):1-9.
[4] 陈英旭,朱荫湄,袁可能,等.土壤中铬的化学行为研究 II.土壤对Cr(VI)吸附和还原动力学 [J]. 环境科学学报, 1989,9(2):137-143.
[5] Camargo F A O, Bento F M, Okeke B C, et al. Chromate reduction by chromium-resistant bacteria isolated from soils contaminated with dichromate [J]. Journal of Environmental Quality, 2003,32(4):1228-1233.
[6] 魏 斐,杨丽荣,薛保国,等.还原六价铬细菌及其还原酶的研究[J]. 中国生物工程杂志, 2012,32(4):53-59.
[7] Dogan N M, Kantar C, Gulcan S, et al. Chromium (VI) bioremoval by Pseudomonas bacteria: role of microbial exudates for natural attenuation and biotreatment of Cr (VI) contamination [J]. Environmental Science & Technology, 2011,45(6):2278-2285.
[8] Christl I, Imseng M, Tatti E, et al. Aerobic reduction of chromium(VI) by Pseudomonas corrugata 28: influence of metabolism and fate of reduced chromium [J]. Geomicrobiology, 2012,29(2):173-185.
[9] Mauricio G A, Peña Cabriales J J, Maldonado V M. Isolation and characterization of hexavalent chromium-reducing rhizospheric bacteria from a wetland [J]. International Journal of Phytoremediation, 2010,12(4):317-334.
[10] Joo J O, Choi J H, Kim I H, et al. Effective bioremediation of cadmium (II), nickel (II), and chromium (VI) in a marine environment by using Desulfovibrio desulfuricans [J]. Biotechnology & Bioprocess Engineering, 2015,20(5):937-941.
[11] Lin Y H. Modeling chromium (VI) reduction by Escherichia coli 33456using ceramic pearl as a supporting medium [J]. International Journal of Environmental Science and Technology, 2014,11(7):1887-1896.
[12] Xu F, Ma T, Zhou L, et al. Chromium isotopic fractionation during Cr (VI) reduction by Bacillus sp under aerobic conditions [J]. Chemosphere, 2015,130:46-51.
[13] 常文越,陈晓东,王 磊,等.土著微生物修复 Cr(VI)污染土壤还原后有效铬分析及其稳定性的初步实验研究 [J]. 环境保护科学, 2008,34(2):78-79.
[14] Achal V, Kumari D, Pan X, Bioremediation of chromium contaminated soil by a brown-rot fungus, Gloeophyllum sepiarium [J]. Research Journal of Microbiology, 2011,6:166-171.
[15] Ding W, Stewart D I, Humphreys P N, et al. Role of an organic carbon-rich soil and Fe(III) reduction in reducing the toxicity and environmental mobility of chromium(VI) at a COPR disposal site [J]. Science of the Total Environment, 2016,541:1191-1199.
[16] Tamura N, Ochi M, Miyakawa H, et al. Analysis of bacterial flora associated with peri-implantitis using obligate anaerobic culture technique and 16S rDNA gene sequence [J]. International Journal of Oral & Maxillofacial Implants, 2012,28(6):1521-1529.
[17] Nakatsu C H, Carmosini N, Baldwin B, et al. Soil microbial community responses to additions of organic carbon substrates and heavy metals (Pb and Cr) [J]. Applied & Environmental Microbiology, 2005,71(12):7679-7689.
[18] Xiao W, Yang X, He Z, et al. Chromium-resistant bacteria promote the reduction of hexavalent chromium in soils [J]. Journal of Environmental Quality, 2014,43(2):507-516.
[19] 肖 伟,王 磊,李倬锴,等.六价铬还原细菌Bacillus cereus S5.4还原机理及酶学性质研究 [J]. 环境科学, 2008,29(3):751-755.
[20] 孟庆恒,傅 珊,张海江,等.微生物在铬污染土壤中的分布及铬累积菌株的初步筛选 [J]. 农业环境科学学报, 2007,26(2):472-475.
[21] Romanenko V I, Korenkov V N. A pure culture of bacterial cells assimilating chromates and bichromates as hydrogen acceptors when grown under anaerobic conditions [J]. Microbiology, 1977,46(3):414-417.
[22] Das S, Mishra J, Das S K, et al. Investigation on mechanism of Cr(VI) reduction and removal by Bacillus amyloliquefaciens, a novel chromate tolerant bacterium isolated from chromite mine soil [J]. Chemosphere, 2014,96(2):112-121.
[23] Ackerley D, Gonzalez C, Keyhan M, et al. Mechanism of chromate reduction by the Escherichia coli protein, NfsA, and the role of different chromate reductases in minimizing oxidative stress during chromate reduction [J]. Environmental Microbiology, 2004,6(8):851-860.
[24] Fredrickson J K, Kostandarithes H M, Li S, et al. Reduction of Fe(III), Cr(VI), U(VI), and Tc(VII) by Deinococcus radiodurans 2003,47(1):51-54.
[27] 廖 萍,刘茂柯,张瀚能,等.铬污染区糙野青茅内生耐铬细菌筛选及其促生能力 [J]. 应用与环境生物学报, 2015,6:1025-1031.
[28] Wang X J, Yang J, Chen X P, et al. Phylogenetic diversity of dissimilatory ferric iron reducers in paddy soil of Hunan, South China [J]. Journal of Soils & Sediments, 2009,9(6):568-577.
[29] Murugan R, Beggi F, Kumar S. Belowground carbon allocation by trees, understory vegetation and soil type alter microbial community composition and nutrient cycling in tropical Eucalyptus plantations [J]. Soil Biology & Biochemistry, 2014, 76(1):257-267.
[30] Tokunaga T K, Wan J, Firestone M K, et al. In situ reduction of chromium (VI) in heavily contaminated soils through organic carbon amendment [J]. Journal of Environmental Quality, 2003, 32(5):1641-1649.
[31] Ramírez-Elías M A, Ferrera-Cerrato R, Alarcón A, et al. Identification of culturable microbial functional groups isolated from the rhizosphere of four species of mangroves and their biotechnological potential [J]. Applied Soil Ecology, 2014,82: 1-10.
[32] 席军强,杨自辉,郭树江,等.不同类型白刺沙丘土壤理化性状与微生物相关性研究 [J]. 草业学报, 2015,24(6):64-74. R1 [J]. Applied & Environmental Microbiology, 2000,66(5): 2006-2011.
[25] Bestawy E E, Helmy S, Hussien H, et al. Bioremediation of heavy metal-contaminated effluent using optimized activated sludge
致谢:感谢浙江省植物有害生物防控重点实验室—省部共建国家重点实验室培育基地和浙江省农业科学院青年人才培养项目对本研究的支持. bacteria [J]. Applied Water Science, 2013,3(1):181-192.
[26] Megharaj M, Avudainayagam S, Naidu R. Toxicity of hexavalent chromium and its reduction by bacteria isolated from soil contaminated with tannery waste [J]. Current Microbiology,
The effect of chromium-resistant bacteria on reduction of hexavalent chromium in soils.
XIAO Wen-dan, YE Xue-zhu*, SUN Cai-xia, ZHANG Qi, XU Ping (Institute of Quality and Standard for Agro-products, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China). China Environmental Science, 2017,37(3):1120~1129
In this study, seven representative agricultural soils with different physicochemical properties were used to investigate the response of soil microbial community to Cr contamination and the effect of indigenous chromium-resistant bacteria on reduction of hexavalent chromium in soils. Our results demonstrated that soil bacterial community was responded to Cr contamination through changes in bacterial community structure, with Cr-resistant bacteria became dominant species, and the percentage of Cr-resistant bacteria of total cultivable bacteria was 89.9%, 75.2%, 92.8%, 65.3%, 72.8%, 77.3%, and 65.4%, respectively for Periudic Argosols, Udic Ferrisols, Calcaric Regosols, Stagnic Anthrosols, Mollisols, Typic Haplustalfs, and Ustic Cambosols. Microbial reduction was an important Cr(VI) reduction pathway, and the relative contribution of microorganisms to Cr(VI) reduction was 14.4%, 44.0%, 20.6%, 34.9%, 21.9%, 21.7%, and 22.0%, respectively. Soil properties, Fe(II) and soil particle distribution, affected the microbially mediated Cr(VI) reduction. Moreover, Bacillus, Escherichia, Deinococcus, Micromonospora, Methylobacterium, Massilia, Acidobacterium, Comamonas, Bradyrhizobium, and Arthrobacter were identified as the Cr-resistant bacteria.
hexavalent chromium;chromium resistant bacteria;dominant bacteria;cloning-sequencing;correlation analysis
X172
A
1000-6923(2017)03-1120-10
肖文丹(1987-),女,湖南永州人,助理研究员,博士,主要从事土壤重金属污染生物修复研究.发表论文10余篇.
2016-07-18
浙江省农业科学院青年人才培养项目资助
* 责任作者, 副研究员, xuezhuye@aliyun.com
