石墨烯/SiO2气凝胶对苯、甲苯水溶液的吸附
2017-04-11李朝宇吕佳佳天津科技大学化工与材料学院天津300457
李朝宇,张 潇,吕佳佳,赵 磊,彭 啸,吴 燕(天津科技大学化工与材料学院,天津 300457)
石墨烯/SiO2气凝胶对苯、甲苯水溶液的吸附
李朝宇,张 潇,吕佳佳,赵 磊,彭 啸,吴 燕*(天津科技大学化工与材料学院,天津 300457)
以正硅酸乙酯(TEOS)与氧化石墨烯(GO)为原料,采用溶胶–凝胶法,经表面改性、常压干燥制备不同 GO含量的氧化石墨烯/二氧化硅气凝胶(GOS),再由高温还原得到石墨烯/二氧化硅气凝胶(GS).通过堆密度、比表面积等测试,将最佳配比的GS与活性炭(AC)、SiO2气凝胶作对比,研究其对苯和甲苯溶液的吸附性能,并探讨了GS的吸附机理.结果表明:掺杂3%GO的复合气凝胶性能有显著提升.松散堆密度为160kg/m3,比表面积、孔径分别为1039m2/g、16.56nm,对苯、甲苯水溶液的最大饱和吸附量分别达到180mg/g,210mg/g,约为活性炭吸附量的2.5倍.且吸附过程符合Langmuir等温吸附模型.
石墨烯;表面改性;气凝胶;Langmuir等温吸附;苯、甲苯溶液
芳香有机化合物如苯、甲苯是化工生产过程中的重要物质[1-2].由于这些有机化合物易燃、有毒、致癌,进入到水中难以生化降解,低浓度条件下也会严重污染环境[3-7].因此,为确保供水安全,从水中去除这些有机污染物十分关键,选择适当吸附剂以去除废水中的这类污染物是目前采用的最主要的方法之一[8-9].处理含苯、甲苯等废水较广泛采用的固体吸附剂是活性炭、膨润土、煤渣等[10-14].然而由于这些吸附剂存在灰分高、孔容小、微孔分布过宽、比表面积小和吸附选择性能差等特点,使其对污染物的吸附去除作用有限,远远不能满足国内外市场的要求.
SiO2气凝胶是一种具有低密度(3~500kg/ m3)、高比表面积(500~1200m2/g )的多孔结构材料[15-17],由于比表面积、表面能较大 ,易于吸附其它物质而稳定下来,因而具有很大的化学活性,相对于一般的吸附材料有更大的吸附容量,是一种较为理想的固相萃取吸附剂.但是其也存在孔径分布不均匀等缺点[18-19],限制了其吸附作用.石墨烯为sp2杂化碳原子形成的类六元环苯单元并无限扩展的二维纳米材料,具有超常的比表面积(2630m2/g),电荷迁移率高[20-22],能在其表面富集大量的苯、甲苯,与疏水性 SiO2气凝胶复合,能进一步提高对水溶液中苯、甲苯的吸附能力.本文采用溶胶-凝胶法,通过正硅酸乙酯(TEOS)与氧化石墨烯(GO)复合,表面改性、常压干燥、高温还原制备石墨烯/二氧化硅复合气凝胶(GS),研究其比表面积、孔径分布等基本性能,并对不同浓度苯、甲苯水溶液的吸附进行研究.
1 材料与方法
1.1 材料
天然鳞片石墨(400目,97%,青岛富润达石墨有限公司),浓硫酸(AR,国药集团化学试剂有限公司),硝酸钠(AR,天津江天化工技术有限公司),高锰酸钾(AR,天津江天化工技术有限公司),过氧化氢(30%,AR,天津百世化工有限公司),浓盐酸(AR,国药集团化学试剂有限公司),正硅酸乙酯(AR,天津福晨化学试剂厂),无水乙醇(AR,天津江天化工技术有限公司),氨水(AR,天津化学试剂一厂),正己烷(AR,天津风船化学试剂科技有限公司),三甲基氯硅烷(AR,成都科龙化工试剂厂),苯(AR,天津市北辰骅跃化学试剂厂),甲苯(AR,天津市北辰骅跃化学试剂厂).
1.2 原理
1.2.1 溶胶-凝胶 SiO2气凝胶通过溶胶-凝胶法制备,正硅酸乙酯在酸性条件下水解脱去酯基,形成正硅酸,正硅酸在碱性条件下脱水缩聚,形成交联网状结构.化学反应式如式(1)、式(2)所示:
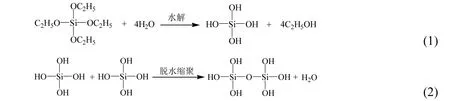
1.2.2 表面改性 为防止常压干燥过程中凝胶遇水变脆等缺点,以三甲基氯硅烷/正己烷溶液对凝胶进行表面改性,改性剂和凝胶发生如下反应,去除未反应的羟基,从而使凝胶表面具有疏水性,并且增加其柔韧性.凝胶的改性机理如式(3)、式(4)所示:

1.3 方法
通过 Hummers法制备 GO[23],按照一定wt%(1#,0%;2#,1%;3#,3%;4#,5%;5#,7%;6#,9%)将氧化石墨烯与 9mL乙醇混合,超声 30min;加入1.5mL正硅酸乙酯与5mL去离子水,搅拌;加HCl调节pH值至3~4,30℃搅拌30min;升温至40℃,加入10%的氨水乙醇溶液,调节pH值至7,等待凝胶;凝胶后,加入一定量乙醇老化24h;加入正己烷,溶剂置换48h;加入10%的三甲基氯硅烷/正己烷溶液,表面改性3d;50、80℃各干燥2h,120,150℃各干燥1h;氮气保护500℃管式炉中煅烧3h得到石墨烯/二氧化硅复合气凝胶.
1.4 表征
1.4.1 FTIR 光谱分析 采用德国布鲁克TENSOR 27型傅立叶变换红外光仪分别测试石墨、氧化石墨烯、SiO2气凝胶以及GS的红外光谱,分析改性效果.
1.4.2 堆密度测试 多孔材料的密度是其孔隙结构、化学组成和相组成的反映,密度测量时将样品研磨成粉末,通过质量与体积比测试其松散堆密度与振实堆密度.
1.4.3 比表面积测试 通过美国康塔AUTOSORB-IQ型化学吸附仪测定SiO2气凝胶以及GS的比表面积、孔径分布、孔容以及氮气吸附-脱附曲线.
1.4.4 不同浓度苯、甲苯溶液的吸附 为了研究 GS对不同浓度苯、甲苯水溶液的吸附效果,在 250ml 锥形瓶中分别加入 0.05g GS,0.05g SiO2气凝胶, 0.05g AC,再分别加入5~100mg/L不同浓度的苯、甲苯水溶液100mL,并通过HCl、NaOH分别调节pH值为3、7、11,在293K下搅拌,直至吸附平衡,10000r/min离心20min,取上层清液,通过上海美谱达UV-1800紫外可见分光光度计测定苯(270nm)和甲苯(261nm)水溶液的吸光度随时间的变化.根据苯、甲苯标准曲线计算出其饱和吸附量.
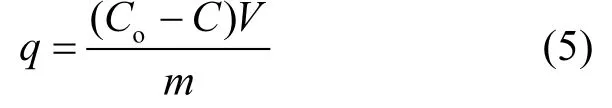
式中:q为吸附量,mg/g;Co为吸附前浓度,mg/L;C为吸附后浓度,mg/L;V为溶液体积,L;m为吸附剂质量,g.
2 结果与讨论
2.1 FTIR光谱
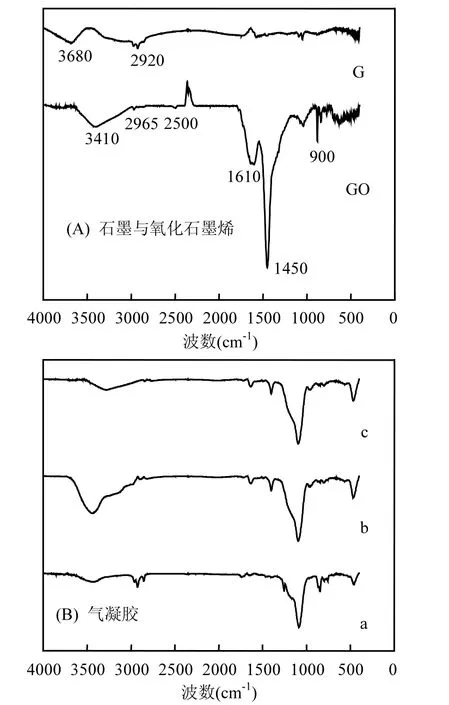
图1 FTIR光谱图Fig.1 The graph of FTIR
从图1(A)中可以看出,石墨在3680cm-1处的宽峰所对应-OH的伸缩振动峰;2965cm-1的峰是由于亚甲基中的 C—H伸缩振动引起的.除此之外,并没有出现其他特征峰.氧化石墨烯则出现了一些新的特征吸收峰,3410cm-1处的峰代表-OH的伸缩振动;2500cm-1处对应的吸收峰为羧酸的-OH伸缩振动峰与变形振动峰;1610cm-1处对应的吸收峰可能是C=C的伸缩振动峰,也可能是-OH的弯曲振动峰,表明氧化石墨烯中羟基和水分子的存在;1450cm-1及1210cm-1附近的吸收峰分别对应于 C-OH的伸缩振动峰和弯曲振动峰;900cm-1为羧酸的-OH弯曲振动吸收峰.从红外光谱图中可以看出:氧化石墨烯中引入了-OH、-C=O等大量含氧极性官能团.因-OH、-C=O、-COOH等官能团的存在,使得憎水性的石墨变成亲水性的氧化石墨烯,在水溶液中分散性增强.
图1(B)在1074,824,472cm-1处较强的吸收峰是组成疏水性SiO2气凝胶骨架的Si-O-Si伸缩振动引起的;3432cm-1小的宽峰及1610cm-l处的小峰分别对应于-OH不对称伸缩振动和弯曲振动,说明样品放置空气中易吸附水分,但量很少;2930~2840cm-l的一系列小峰是-CH3中 C-H的对称伸缩振动和不对称伸缩振动引起的;1074~1440cm-1和824cm-1附近的一系列尖峰是-CH3中C-H的剪式弯曲振动和平面弯曲振动引起的,这说明在SiO2气凝胶的末端支链上连有疏水基团-CH3,形成了疏水性SiO2气凝胶;b为氧化石墨烯/二氧化硅复合气凝胶的 FTIR光谱,3421cm-1处的吸收峰为-OH的不对称伸缩振动;2923,2852cm-1处的吸收峰对应-CH3和-CH2的伸缩振动峰;1624cm-1处的吸收峰对应于样品中吸附的水分子的弯曲振动峰,说明氧化石墨烯/二氧化硅复合气凝胶中含氧官能团的存在;c中3421cm-1处的吸收峰减弱,1583cm-1处出现的峰是C=C的伸缩振动峰;说明高温还原后部分sp3杂化的碳原子转变为 sp2杂化的石墨稀结构;1473cm-1处的吸收峰对应于-CH3和-CH2的弯曲振动峰;1000~1221cm-1范围强烈的吸收峰对应于Si-O-Si的非对称伸缩振动峰;962cm-1处的吸收峰对应于 Si-OH的振动峰;804cm-1处的吸收峰是对应于Si-O-Si的对称伸缩振动峰.
2.2 堆密度
通过质量与体积比测试样品松散堆密度与振实堆密度,实验结果如图2所示,随着GO掺杂量的增加,材料的密度逐渐增加,掺杂量为 1%、3%、5%时,密度变化幅度比较小,与SiO2气凝胶密度相差不大,基本维持在 100~300kg/m3;当掺杂量增加到7%、9%时,密度显著增加,但是最大密度在500kg/m3左右.这主要是因为GO掺杂量少时,石墨烯层与二氧化硅颗粒之间分布均匀,片层之间粘连较少,孔径与孔容较大,比表面积高,孔隙中存在大量气体;但是,随着GO掺杂量的增加,会使片状结构在反应过程中相互粘连,导致比表面积和孔容降低,部分孔结构被堵塞,从而导致材料的堆密度逐渐上升.当GO的掺杂量为3%时,石墨烯片层之间粘连较少,孔分布均匀,密度为160kg/m3.

图2 GS堆密度Fig.2 Density of GS
2.3 比表面积及孔径
结合表1可见,随着GO量的增加,GS的比表面积先增大后减小,这可能是因为GO加入过多会使片层之间在反应过程中相互粘连,导致比表面积较低;当GO的掺杂量在3%左右时,石墨烯层之间间距适宜,片层粘连较少,所以比表面积较大;随着GO量继续减少,片层粘连减少,结构疏松,烘干过程中,易坍塌,导致孔径变小或消失.GS的孔径分布在1~120nm范围内,主要集中在20nm以内,平均孔径为10nm,是典型的介孔材料.其中,掺杂3%GO的复合气凝胶性能提升最佳,比表面积由单纯 SiO2气凝胶的 979m2/g增加到1039m2/g,孔径由1.24nm增加到16.56nm.

表1 GS比表面积Table 1 GS specific surface area
2.4 氮气吸附-脱附
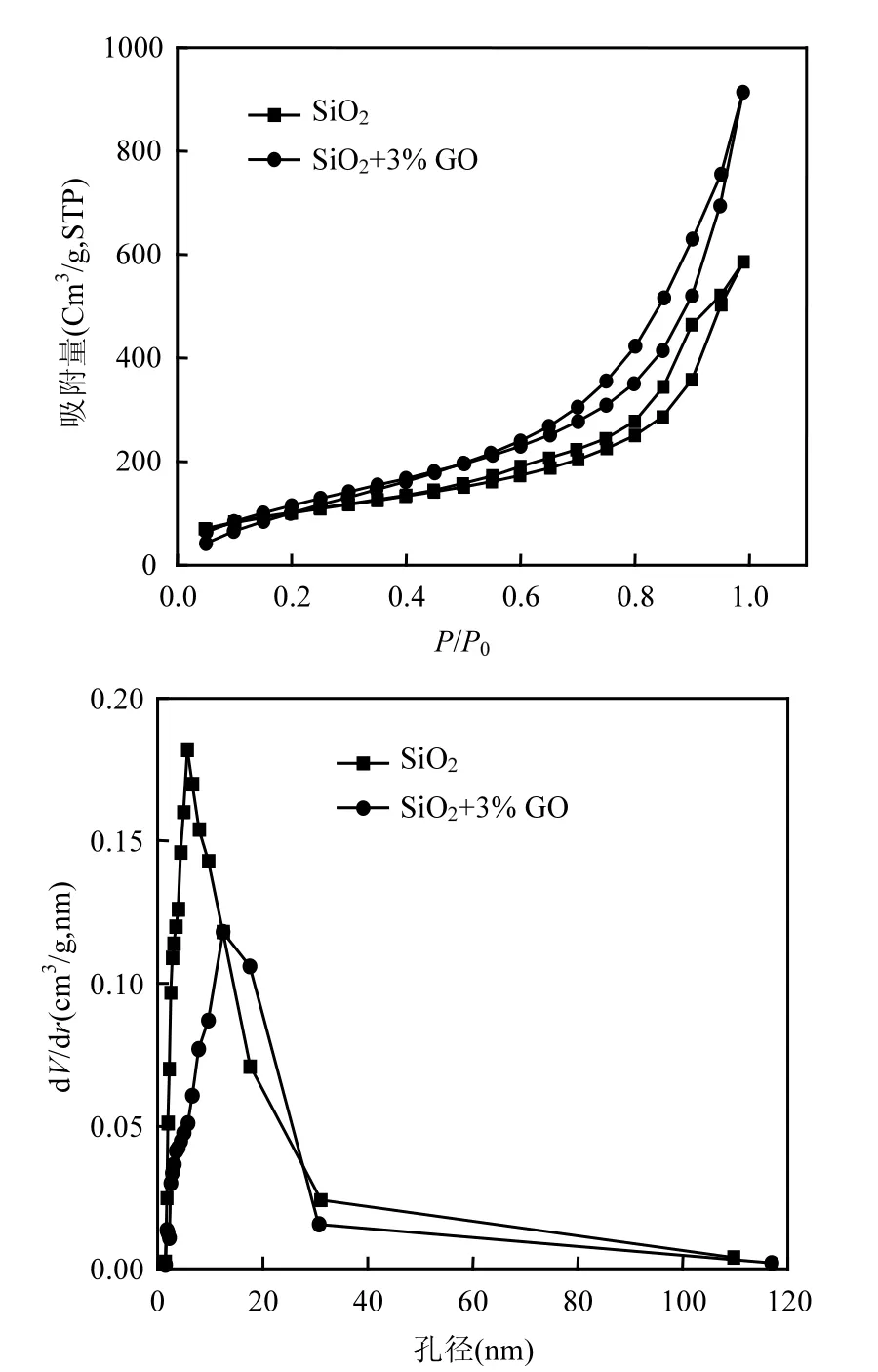
图3 氮气吸附解吸曲线Fig.3 The curve of nitrogen adsorption and desorption
图3是SiO2气凝胶以及掺杂3% GO复合气凝胶对 N2的吸附-脱附等温线,从图 3可以看出,SiO2气凝胶与GS的N2吸附-脱附等温线都属于IV型曲线,在吸附的初始阶段主要是单分子层吸附,吸附量迅速增大,但是 SiO2气凝胶吸附量低于 GS;随着相对压力的增加二者均变成多层吸附,吸附量缓慢增大;当相对压力P/P0>0.65时,发生毛细管凝聚现象,等温线上会出现一个飞跃,介孔材料的孔径越大,毛细管凝聚现象发生所需要的相对压力越高;当压力接近饱和蒸气压P0时,曲线呈趋于与纵轴平行的渐近线,是外表面的吸附,GS的表面吸附相对于SiO2气凝胶显著上升.
2.5 苯、甲苯水溶液的吸附
通过密度、比表面积等分析研究,选取掺杂3% GO的复合气凝胶作为苯、甲苯溶液的吸附研究.相比于石墨烯、二氧化硅气凝胶,GS复合气凝胶优先达到吸附平衡,吸附平衡时间在150min左右.通过比较表2给出的不同吸附剂的最大饱和吸附量,可以看出:在 pH 7,293K条件下,对于苯、甲苯水溶液的吸附,GS表现出良好的吸附效果.由于石墨烯对苯、甲苯有很强吸附能力,掺杂石墨烯对于气凝胶的吸附作用有了明显的提高,最大饱和吸附量分别达到180,210mg/g.
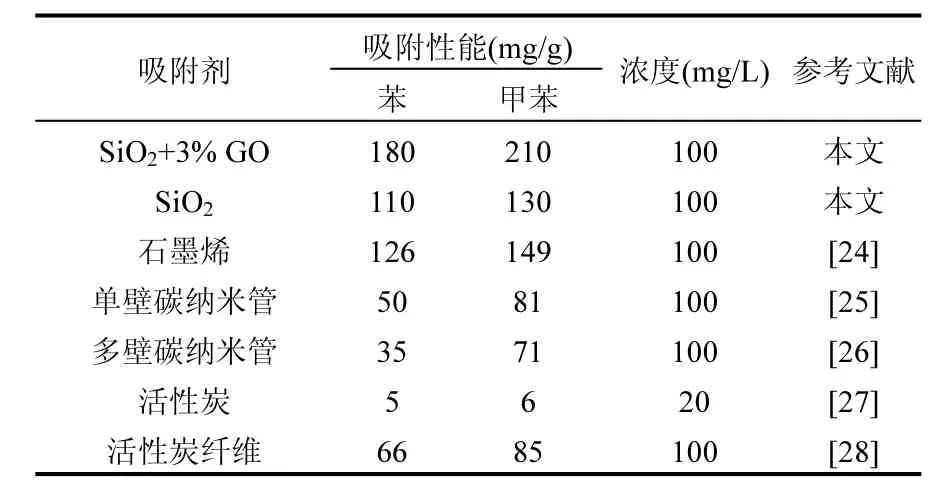
表2 不同吸附剂对苯、甲苯的吸附Table 2 Adsorption of benzene and toluene with different adsorbents
对图中不同样品的苯和甲苯的吸附平衡数据进行拟合.等温吸附方程主要包括Langmuir和Freundlich吸附,其分别描述了均匀表面单层吸附和非均匀表面非均匀吸附[29].由于Langmuir模型为广泛使用的等温吸附方程[30],故本文通过Langmuir模型对苯、甲苯溶液的吸附进行拟合.表达式如式(2)所示:
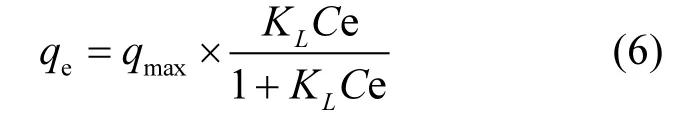
式中:qmax是吸附剂的最大吸附量,与吸附位有关,理论上与温度是无关的,qmax越大,表明吸附能力越强;KL是吸附平衡常数.

图4 苯吸附等温线与Langmuir 模型Fig.4 Adsorption isotherms of benzene and Langmuir model prediction

表3 苯吸附Langmuir方程系数Table 3 Parameters of the Langmuir equation for the adsorption of benzene
由图4和5可见Langmuir方程可以很好地描述实验数据,相关系数R2>0.96.
从图4和5可以看出,与活性炭相比,GS、SiO2气凝胶在不同浓度的苯、甲苯溶液中都表现出高的饱和吸附量,通过掺杂石墨烯的方式可以进一步提高气凝胶的吸附性能.掺杂石墨烯的复合气凝胶吸附量大约为活性炭的2.5倍.同时,在整个pH值范围内,苯、甲苯都以分子形式存在,色散力为主要作用[31],只是由于在酸性、中性条件下,复合气凝胶分散性较好,对比碱性条件下的吸附,会有所提高,但影响不大.另外,甲苯的吸附量要大于苯的吸附量.改性后的复合气凝胶其外表面由亲水性变为疏水性,减弱了水分子的竞争吸附能力,相对增加了吸附苯、甲苯的活性吸附位;另一方面掺杂石墨烯到吸附剂的内表面,取代了孔道内的部分配位,减小了水膜对苯、甲苯的吸附阻力,从而使吸附性能得以提高,削弱了形成狭窄孔道的链状结构和层与层之间的键力,使孔道被疏松,从而有利于苯、甲苯分子进入产生牢固有效的吸附.同时由于气凝胶的内部存在少部分微孔,在吸附的过程中影响了苯、甲苯溶液的分散和传输,导致了需要一定时间才能达到吸附平衡;而GO的掺杂,会堵塞大部分的微孔孔道,使得苯、甲苯溶液在介孔孔道内比较好的分散和传输,可以在较短时间内达到吸附平衡;另外由于石墨烯表面存在高面积能量吸附位,比如一些断面、边缘和褶皱区域等[32-34],因为苯、甲苯分子会优先与这些区域产生强的亲和力.这就表明而除了疏水作用和π-π键相互作用外,褶皱面的吸附机理也起到一定作用.GS内在褶皱导致电荷分布的不均一性,电荷集中的区域带有很强的化学活性.综上所述:GS吸附苯、甲苯水溶液的机理可能是,首先苯、甲苯分子通过改性气凝胶外表面的疏水作用及 π–π键之间的吸附作用而被吸附在其外表面,然后由于石墨烯褶皱区域高浓电荷的强有力吸附,表面积聚的苯、甲苯分子进入复合气凝胶的内部孔道以及石墨烯的表面而被吸附,最终将苯、甲苯分子牢固锁住.
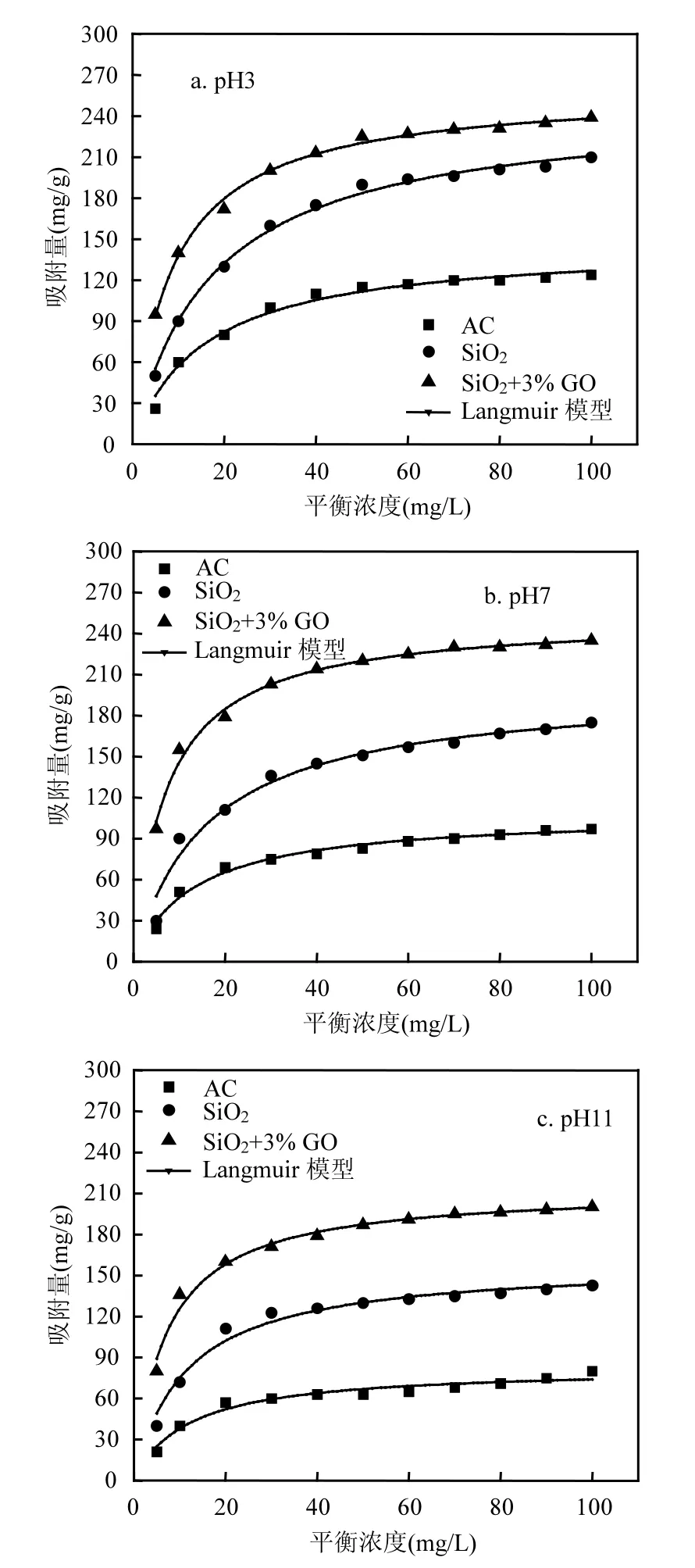
图5 甲苯吸附等温线与Langmuir模型Fig.5 Adsorption isotherms of toluene and Langmuir model prediction
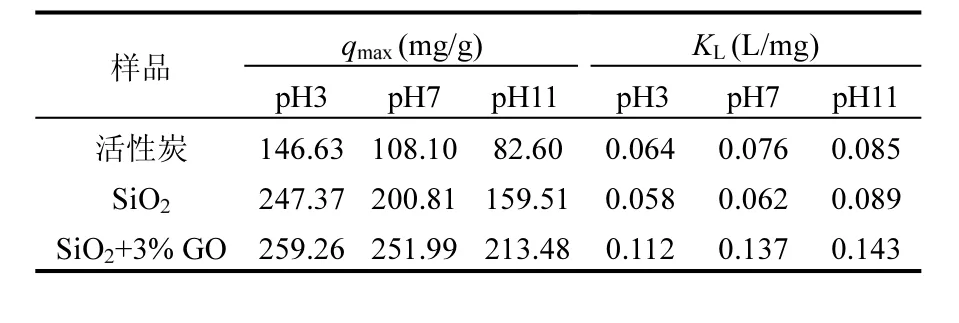
表4 甲苯吸附Langmuir方程系数Table 4 Parameters of the Langmuir equation for the adsorption of toluene
3 结论
3.1 以GO和TEOS为原料,采用溶胶-凝胶法制得复合气凝胶,密度最小为160kg/m3.当GO掺杂量为 3%时,其性能最佳.比表面积和孔径分别为1039m2/g、16.56nm,对比单纯SiO2气凝胶的比表面积 979m2/g,有了明显提高.GO 通过C-O-Si键与二氧化硅相连,增强了复合气凝胶之间的牢固程度.随着GO含量的增加,片层之间相互粘连,孔径减小,导致比表面积较低.
3.2 pH 3、pH 7时,苯、甲苯溶液的吸附要优于pH 11.与活性炭相比,GS、SiO2气凝胶在不同浓度的苯、甲苯溶液中都表现出较高的饱和吸附量,通过掺杂石墨烯的方式可以显著提高气凝胶的吸附能力.苯、甲苯的最大饱和吸附量分别达到了180,210mg/g,约为活性炭吸附量的2.5倍.
3.3 改性的GS其外表面为疏水性,减弱了水分子的竞争吸附能力,相对增加了吸附苯、甲苯的活性吸附位;另一方面掺杂石墨烯到吸附剂的内表面,会堵塞气凝胶内部的部分微孔孔道,使得苯、甲苯水溶液在介孔孔道内比较好的分散和传输,可以在较短时间内达到吸附平衡,同时石墨烯褶皱区域高浓电荷的强有力吸附,表面积聚的苯、甲苯分子进入复合气凝胶的内部孔道以及石墨烯的表面而被吸附,从而对苯、甲苯的吸附能力呈现显著上升的趋势.
[1] Lu C, Su F, Hu S. Surface modification of carbon nanotubes for enhancing BTEX adsorption from aqueous solutions [J]. Applied Surface Science, 2008,254(21):7035-7041.
[2] 邓述波.环境吸附材料及应用原理 [M]. 北京:科学出版社, 2012.
[3] 施 周,杨文浩,杨灵芳,等.等离子改性CNT/TiO2电极吸附去除水中苯酚的研究 [J]. 中国环境科学, 2015,35(9):2664–2669.
[4] Lillo M A. Behaviour of activated carbons with different pore size distributions and surface oxygen groups for benzene and toluene adsorption at low concentrations [J]. Carbon, 2005,43(8):1758–1767.
[5] 姜德彬,余 静,叶芝祥,等.磁性纳米复合物对水中亚甲基蓝的吸附及其机理 [J]. 中国环境科学, 2016,36(6):1763-1772.
[6] 高淑玲,杨翠玲,罗鑫圣,等.坡缕石黏土污泥对水相中亚甲基蓝吸附研究 [J]. 中国环境科学, 2014,34(1):78–84.
[7] 史兵方,仝海娟,左卫元,等.麻疯树籽壳生物质炭的制备及其吸附水中 PAHs性能研究 [J]. 中国环境科学, 2016,36(4):1059–1066.
[8] 曹晓强,黄学敏,刘胜荣,等.微波改性活性炭对甲苯吸附性能的实验研究 [J]. 西安建筑科技大学学报:自然科学版, 2008, 40(2):249-253.
[9] 吴光前,张 鑫,惠 慧,等.氧等离子体改性竹活性炭对苯胺的吸附特性 [J]. 中国环境科学, 2012,32(7):1188-1195.
[10] 刘景楠.改性膨润土吸附生物反应墙对地下水中BTEX的去除[D]. 合肥:合肥工业大学, 2015.
[11] 卢林刚,李冠男,刘鲁楠,等.新型改性膨润土吸附剂的制备及对苯酚的吸附性能 [J]. 河北师范大学学报:自然科学版, 2015, (1):53-57.
[12] 余美琼,杨金杯,林建钦.改性蜂窝煤残渣对刚果红的吸附 [J].过程工程学报, 2016,16(1):110-114.
[13] 李 娟,刘新春,余志晟,等.煤渣吸附水中氟和砷的研究 [J]. 中国科学院大学学报, 2014,31(4):471-476.
[14] 孟凡芳,侯凯军,高永福,等.高比表面积改性膨润土对乙苯的吸附性能研究 [J]. 石化技术与应用, 2016,34(2):98-101.
[15] 王 飞,刘朝辉,叶圣天,等.SiO2气凝胶保温隔热材料在建筑节能技术中的应用 [J]. 表面技术, 2016(2):144-150.
[16] Liu J X, Shi F, Bai L N, et al. Synthesis of TiO2–SiO2aerogel via ambient pressure drying: effects of sol pre-modification on the microstructure and pore characteristics [J]. Journal of Sol-Gel Science and Technology, 2014,69(1):93-101.
[17] Chen H, Sui X, Zhou C, et al. Preparation and characterization of monolithic Al2O3–SiO2aerogel [J]. Journal- Ceramic Society Japan, 2016,124(4):442-447.
[18] Chen Y, Feng Z, Huang X, et al. Progress in nano-sized silica gel-thermal insulation material [J]. Inorganic Chemicals Industry, 2010.
[19] Gao Q F, Zhang C R, Feng J, et al. Progress of Silica Aerogel Insulation Composites [J]. Journal of Materials Science & Engineering, 2009,27(2):302-301.
[20] Geim A K, Novoselov K S. The rise of graphene [J]. Nature Materials, 2007,6(3):183-191.
[21] Singh V, Joung D, Lei Z, et al. Graphene based materials: Past,present and future [J]. Progress in Materials Science, 2011, 56(8):1178-1271.
[22] Bai S, Shen X. Graphene–inorganic nanocomposites [J]. Rsc Advances, 2011,2(1):64-98.
[23] Stankovich S, Dikin D A, Piner R D, et al. Synthesis of graphene-based nanosheets via chemical reduction of exfoliated graphite oxide [J]. Carbon, 2007,45(7):1558-1565.
[24] Raad M T, Behnejad H, Jamal M E. Equilibrium and kinetic studies for the adsorption of benzene and toluene by graphene nanosheets: a comparison with carbon nanotubes [J]. Surface & Interface Analysis, 2016.
[25] Chin C J M, Shih L C, Tsai H J, et al. Adsorption of o-xylene and p-xylene from water by SWCNTs [J]. Carbon, 2007,45(6): 1254-1260.
[26] Lu C, Su F, Hu S. Surface modification of carbon nanotubes for enhancing BTEX adsorption from aqueous solutions [J]. Applied Surface Science, 2008,254(21):7035-7041.
[27] Wibowo N, Setyadhi L, Wibowo D, et al. Adsorption of benzene and toluene from aqueous solutions onto activated carbon and its acid and heat treated forms: Influence of surface chemistry on adsorption [J]. Journal of Hazardous Materials, 2007,146(1/2): 237-242.
[28] Mangun C L, Zhongren Yue A, Economy J, et al. Adsorption of Organic Contaminants from Water Using Tailored ACFs [J]. Chemistry of Materials, 2001,13(7):2356–2360.
[29] 阮长平,艾可龙,逯乐慧.耐酸性的磁性纳米复合材料去除水中有机污染物 [J]. 分析化学, 2016,44(2):224-231.
[30] Tabrizi N S, Yavari M. Methylene blue removal by carbon nanotube-based aerogels [J]. Chemical Engineering Research & Design, 2014,94:516-523.
[31] Wibowo N, Setyadhi L, Wibowo D, et al. Adsorption of benzene and toluene from aqueous solutions onto activated carbon and its acid and heat treated forms: influence of surface chemistry on adsorption. [J]. Journal of Hazardous Materials, 2007,146(1/2): 237-242.
[32] Glukhova O, Slepchenkov M. Influence of the curvature of deformed graphene nanoribbons on their electronic and adsorptive properties: theoretical investigation based on the analysis of the local stress field for an atomic grid. [J]. Nanoscale, 2012,4(11):3335-44.
[33] Meyer J C, Geim A K, Katsnelson M I, et al. The structure of suspended graphene sheets. [J]. Nature, 2007,446(7131):60-3.
[34] Fasolino A, Los J H, Katsnelson M I. Intrinsic ripples in graphene [J]. Nature Materials, 2007,6(11):858-61.
Adsorption of benzene and toluene from aqueous solutions onto composite graphene/ SiO2aerogel.
LI Chao-yu, ZHANG Xiao, LÜ Jia-jia, ZHAO Lei, PENG Xiao, WU Yan*(College of Chemical Engineering and Materials Science, Tianjin University of Science & Technology, Tianjin 300457, China). China Environmental Science, 2017,37(3):972~979
This paper used tetraethoxysilane (TEOS) and graphene oxide (GO) as the raw materials.Graphene/silica aerogels (GS) with different content of GO were synthesized via sol-gel method, combined with surface modification, ambient drying process and high temperature reduction. Through the consider of the density and the specific surface area, the best GS was obtained and the adsorption of benzene and toluene solution was studied compared with the activated carbon and SiO2aerogel. The results show that the specific surface area of the silica gel is improved greatly by the addition of 3% GO, which made the porous and homogeneous structure. The density is 160kg/m3, the specific surface area and pore diameter are 1039m2/g and 16.56nm, respectively. The adsorption of benzene and toluene reaches 180mg/g and 210mg/g, respectively. They are approximately 2.5 times of the amount of activated carbon adsorption. The adsorption process was in accordance with the Langmuir isotherm model.
graphene;surface modification;aerogel;Langmuir adsorption isotherm;benzene;toluene solution
X703.5
A
1000-6923(2017)03-0972-08
李朝宇(1991-),男,山西汾阳人,天津科技大学化工与材料学院硕士研究生,研究方向为污染控制化学.
2016-07-12
国家自然科学基金资助项目(21107080);天津市大学生创新创业训练计划项目(201610057143);天津科技大学大学生实验室创新基金项目(1503A212)
* 责任作者, 教授, wuyan@tust.edu.cn
