微小化体外循环对低体重小儿围术期输血量及预后的影响
2017-04-11雷迪斯章晓华周成斌肖灯科彭勤宝
雷迪斯,章晓华,周成斌,陈 星,肖灯科,彭勤宝,庄 建
·临床研究·
微小化体外循环对低体重小儿围术期输血量及预后的影响
雷迪斯,章晓华,周成斌,陈 星,肖灯科,彭勤宝,庄 建
目的 探讨体外循环(ECC)微小化对低体重先天性心脏病患儿围术期输血量及院内预后的影响。方法 回顾分析2015年3月至10月157例体重≤10 kg患儿ECC手术。传统组(C组,n=73例)采取传统ECC系统;微小化组(M组,n =84例)采用微小化ECC系统,记录围术期血气指标、围术期输血量、术后24 h胸液量、呼吸机辅助时间、ICU停留时间。结果两组均无死亡。M组平均每例术中及术后红细胞用量均显著少于C组;M组中有51例实施了无输血ECC,17例住院期间零输血。两组24 h胸液量无显著性差异。M组术后机械通气时间和ICU停留时间显著低于C组。结论 对体重≤10 kg先天性心脏病手术患儿使用微小化ECC系统,能显著减少ECC中及围术期输血量,甚至可达到围术期零输血,并对患儿术后恢复有积极作用。
微小化体外循环;婴幼儿;输血
随着麻醉、体外循环(extracorporeal circulation,ECC)、外科技术及术后监护的不断发展,先天性心脏病手术得以在越来越小的患儿甚至新生儿身上实施。低体重的新生儿及婴儿的血容量与目前传统ECC预充量不匹配,常需要预充库存红细胞来维持ECC中安全的红细胞比容(hematocrit,Hct)以保证足够的氧输送能力。但输血增加术后并发症的风险[1]。本研究采用一种微小化ECC系统,探讨其对低体重患儿围术期输血量及临床结果的影响。
1 资料与方法
1.1 临床资料与分组 回顾分析2015年3月至10月在ECC下行先天性心脏病手术、体重≤10 kg患儿共157例,根据ECC系统的不同分为传统组(C组,n=73例),微小化组(M组,n=84例)。两组术式资料见表1,应用先天性心脏病手术风险评估-1 (RACHS-1)评分系统对手术风险进行评估。ECC装置使用及预充情况见表2。相对于C组,M组改进方面包括:①使用带悬挂泵头的人工心肺机;②使用负压辅助静脉引流装置(Vacuum assisted venous drainage,VAVD);③缩短了管路和管径;④去除了动脉滤器;⑤必要时再接入超滤器。

表1 两组患儿术式
1.2 ECC方法 C组预充液包括:乳酸林格氏液,浓缩红细胞(PRBC)1 U,部分使用20%人血白蛋白50 ml或新鲜冰冻血浆(FFP)。预充药物:肝素15 mg,甲泼尼龙15 mg/kg,速尿1 mg/kg,5%碳酸氢钠等;转流复温期间再给予1 U PRBC;ECC后均使用静脉-动脉改良超滤。
M组预充液包括:乳酸林格氏液,PRBC仅在基于患儿体重、术前血红蛋白浓度(hemoglobin,Hb)、预充量及心肌保护液量估算ECC中稀释后Hb<70 g/L时给予预充0.5~1 U,部分体重<5 kg患儿使用了20%人血白蛋白20ml。预充药物肝素5~10mg,速尿1 mg/kg提前在手术开始给予患儿;转流中PRBC仅在Hb<70 g/L时输入;ECC中65例无使用超滤器;19例使用传统超滤,并在超滤后将超滤器内血液返还储血罐中。
两组患儿心肌保护均采用改良St.Thomas晶体停搏液,单次灌注20 ml/kg。ECC过程中监测全血活化凝血时间以及血气分析指标。
1.3 资料收集 观察指标包括术前一般资料、围术期体血制品用量、血气分析指标、术后24 h胸液量、机械通气时间、ICU停留时间、并发症及死亡率。
1.4 统计学分析 采用SPSS 22统计学软件进行数据处理,计量资料以均数±标准差(±s),计数资料采用频率和率表示。计量资料两组间比较采用t检验,计数资料组间比较采用X2检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 患儿一般情况见表3。M组仅19例需要使用超滤器,且其超滤量显著少于C组,但尿量则显著高于C组。

表2 患儿ECC装置使用及预充量

表3 两组患儿一般情况
2.2 围术期血制品使用 PRBC使用情况见表4。M组在术前、预充、ECC转流过程中PRBC使用量及输血率显著少于C组,总用血量及输血率也显著少于C组,仅在关胸时输血率高于C组,但输血量无显著差异。C组和M组术中血浆用量(6.3±23.6)ml vs (1.2±10.8)ml;术后血浆用量(37.3±117.3)ml vs (22.4±70.0)ml,二者均无显著性差异,P>0.05。
2.3 Hct与血浆乳酸水平 围术期Hct与血浆乳酸水平变化见表5。M组Hct仅在入ICU后首次测得低于C组,其余时间位点均与C组无显著性差异。M组血浆乳酸水平从转流中至入ICU后首次测量值显著低于C组。
2.4 术后恢复指标 两组患儿均无死亡;表6显示术后恢复指标。术后24 h胸液量两组无显著性差异,但机械通气时间与ICU停留时间M组较C组显著缩短,输血总量与呼吸机使用及ICU停留时间正相关,相关系数分别为0.713和0.708,P<0.001。

表4 围术期红细胞使用情况
表5 两组Hct及血浆乳酸水平(±s)

表5 两组Hct及血浆乳酸水平(±s)
注:组间比较*为P<0.05。
传统组(n=73)微小化组(n=84)项目Hct(L/L) 乳酸(mmol/L)Hct(L/L) 乳酸(mmol/L)入院时 0.35±0.06 -- 0.35±0.05 --麻醉后 0.33±0.06 0.9±0.7 0.33±0.06 0.8±0.6心脏停跳后 0.24±0.04 4.2±1.5 0.24±0.05 2.5±1.4*CPB结束前 0.28±0.05 3.8±2.3 0.27±0.05 2.1±1.4*入ICU后首次 0.40±5.1 2.0±1.1 0.33±0.06*1.4±0.8*出院前 0.35±0.05 -- 0.34±0.06 --
表6 两组患儿术后恢复指标(±s)
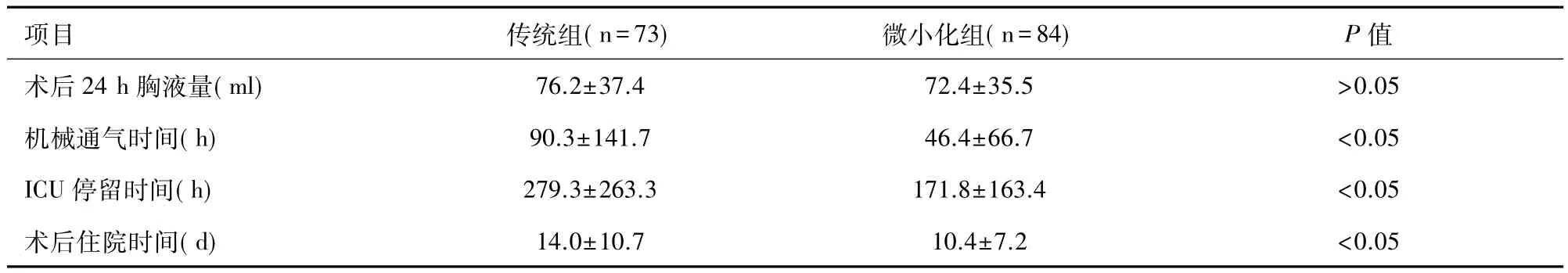
表6 两组患儿术后恢复指标(±s)
项目 传统组(n=73) 微小化组(n=84) P值术后24 h胸液量(ml) 76.2±37.4 72.4±35.5 >0.05机械通气时间(h) 90.3±141.7 46.4±66.7 <0.05 ICU停留时间(h) 279.3±263.3 171.8±163.4 <0.05术后住院时间(d) 14.0±10.7 10.4±7.2 <0.05
3 讨论
先天性心脏病患儿手术的低龄化,使传统ECC系统的预充量更显偏大,血制品的使用几乎无法避免,而输血对手术患儿将产生多方面的不良影响[1-2];ECC中输血,更可能增加术后出血和并发症[3]。微小化是ECC进步的主要体现之一,特别是对低体重小儿。近年来国内多家医院在缩短ECC管道和配合使用改良超滤等方面取得了良好效果[4-5]。ECC微小化更是一项综合改进措施,需要优化的不仅仅是ECC管道,还有相关装置的使用、ECC管理理念等多个方面。
虽然改良超滤技术在婴幼儿ECC管理中的作用已被广泛认可,但改良超滤的使用将额外增加60~80ml预充量[6]。据报道,免除超滤器最低可将预充量降低至95 ml[7]。结合综合节约用血措施,甚至可对行大动脉调转术的1.7 kg早产儿施行无输血心脏手术[8]。避免血液浓缩器使用还可减少ECC非生物表面,对术后恢复有积极影响。在本研究中,M组84例患儿有65例无使用超滤。为弥补未使用超滤器的功能缺失,笔者通过减少循环系统的入量,对部分ECC前容量充足的患儿使用自体血逆行预充技术;提前在患儿皮肤消毒时静脉给予速尿1 mg/kg,增加患儿转流中的尿量;最为重要的仍是未安装改良超滤本身就相当可观地减少了ECC系统预充量,降低了ECC过程中PRBC的使用几率。此外,由于相当程度地减少了预充量,ECC过程中容易维持较高的动脉血压,有利于患儿肾脏滤过。对ECC过程中需要使用超滤的患儿,使用免预充和低预充量的威高200型超滤器(预充量25 ml),采用常规超滤方式,超滤结束后将超滤器入血端从主泵管取下并举高使血液回流到循环中。
即使是国内在售最小的动脉滤器(Terumo的CX*AF02X,预充量40 ml),加上相关的管道,其预充量对低体重小儿ECC库血使用将产生显著影响[9]。另一方面,动脉滤器的作用和是否应该常规使用仍存在争议[10-11]。有学者认为膜式氧合器可去除大部分微栓[11],而动脉滤器并不能完全过滤剩余的微栓[12]。本研究中M组未使用动脉滤器,虽存在一定风险,但并未发现有微栓及其引起神经系统并发症的临床证据。内置动脉滤器的膜式氧合器可在不增加或少增加预充量的基础上一定程度地消除其潜在风险。
VAVD技术是体外管道微小化的核心技术,用作抵消膜肺的抬高与管径的缩小对静脉引流的影响,使ECC可在保证充分的静脉回流基础上减少预充量成为可能。为避免VAVD导致的血液破坏及微气栓形成风险,外科医生应与灌注师一起,尽量避免气体进入静脉管路;术中严密监测负压,最大负压不超过-30 mm Hg[13],并根据静脉引流状态及时进行调整,以用最小的负压达到充分的静脉引流为目标。
ECC微小化使预充量显著减少,很大程度上缓解了低体重小儿血液稀释的矛盾。笔者在M组使用单纯晶体液预充,术后未见明显组织水肿。开始转流后极少发生明显低血压的过程,可能跟血液稀释及库血使用减少有关系。除入ICU后首次测得Hct结果较低外,M组患儿的Hct在围术期与C组患儿在各观察时点无显著差异;而转流过程中及术后至ICU的乳酸值M组都较C组低;术后24 h胸液量M组与C组无显著差异;术后ICU时间与机械通气时间M组明显低于C组,与之前多个研究结果一致[1-3,7,14],可能与输血相关并发症的减少相关。
本研究观察显示,ECC系统的微小化配合ECC管理理念的改进,可显著减少低体重小儿ECC心脏直视手术的库血使用量,并改善患儿的预后;相关技术的使用并不增加心脏手术的风险。通过采取综合节约用血措施,如术前贫血的治疗,术中使用血液回收机,统一围术期严格的输血指征等,未来有望将患儿围术期输血量降至更低的程度[14]。
本研究样本量少,且非随机对照分组研究。未能监测连续静脉血氧饱和度及Hct、未进行脑氧饱和度监测。本研究中输血阈值定在70 g/L,而输血阈值目前仍存在争议[15],虽然患儿早期术后恢复未发现异常,但长期预后还有待进一步观察。
[1] Redlin M,Kukucka M,BoettcherW,etal.Blood transfusion determines postoperativemorbidity in pediatric cardiac surgery applying a comprehensive bloodsparing approach[J].J Thorac Cardiovasc Surg,2013,146(3):537-542.
[2] Kipps AK,Wypij D,Thiagarajan RR,et al.Blood transfusion is associated with prolonged duration ofmechanical ventilation in infants undergoing reparative cardiac surgery[J].Pediatr Crit Care Med,2011,12(1):52-56.
[3] .Redlin M,Boettcher W,Kukucka M,et al.Blood transfusion during versus after cardiopulmonary bypass is associated with postoperativemorbidity in neonates undergoing cardiac surgery[J].Perfusion,2014,29(4):327-332.
[4] 刘晋萍,冯正义,崔勇丽,等.低体重患儿围体外循环期实施新节约用血策略的研究[J].中国体外循环杂志,2012,10(1):6-9.
[5] 姜磊,王伟,沈佳,等.改进型体外循环管道在婴幼儿体外循环中的应用[J].上海交通大学学报(医学版),2016,36(4): 609-612.
[6] Durandy Y.Usefulness of low prime perfusion pediatric circuit in decreasing blood transfusion[J].ASAIO J,2007,53(6):659-661.
[7] Redlin M,Huebler M,BoettcherW,etal.Minimizing intraoperative hemodilution by use of a very low priming volume cardiopulmonary bypass in neonates with transposition of the great arteries[J].JThorac Cardiovasc Surg,2011,142(4):875-881.
[8] Huebler M,Redlin M,BoettcherW,et al.Transfusion-free arterial switch operation in a 1.7-kg premature neonate using a new miniature cardiopulmonary bypass system[J].J Card Surg,2008,23(4):358-360.
[9] Charette K,Hirata Y,Bograd A,etal.180ml and less:cardiopulmonary bypass techniques to minimize hemodilution for neonates and small infants[J].Perfusion,2007,22(5):327-331.
[10] Bartels C,Gerdes A,Babin-Ebell J,etal.Cardiopulmonary bypass:Evidence or experience based[J]?J Thorac Cardiovasc Surg,2002,124(1):20-27.
[11] De Somer F.Evidence-based used,yet still controversial:the arterial filter[J].JExtra Corpor Technol,2012,44(1):27-30.
[12] Mueller XM,Tevaearai HT,Jegger D,et al.Ex vivo testing of the Quart arterial linefilter[J].Perfusion,1999,14(6):481-487.
[13] Win KN,Wang S,Undar A.Microemboli generation,detection and characterization during CPB procedures in neonates,infants,and small children[J].ASAIO J,2008,54(5):486-490.
[14] Redlin M,Habazettl H,BoettcherW,et al.Effects of a comprehensive blood-sparing approach using body weight-adjustedminiaturized cardiopulmonary bypass circuits on transfusion requirements in pediatric cardiac surgery[J].JThorac Cardiovasc Surg,2012,144(2):493-499.
[15] Kipps AK,Wypij D,Thiagarajan RR,et al.Blood transfusion is associated with prolonged duration ofmechanical ventilation in infants undergoing reparative cardiac surgery[J].Pediatr Crit Care Med,2011,12(1):52-56.
Effects of m inim ized extracorporeal circu lation circuit on requirem ents of blood transfusion and outcom e in in fants w ith low body weight underwent cardiac surgery
Lei Di-si,Zhang Xiao-hua,Zhou Cheng-bin,Chen Xing,Xiao Deng-ke,Peng Qin-bao,Zhuang Jian
Guangdong Cardiovascular Institute,Department of Cardiovascular Surgery of Guangdong General Hospital,Guangdong Academy of Medical Sciences,Guangzhou 510080,China
Zhuang Jian,Email:zhuangjian5413@tom.com
Objective To analyze the effects of minimized extracorporeal circulation(ECC)circuit on transfusion requirements and in hospital outcome of infants underwent cardiac surgery.M ethods From March 2015 to October 2015,157 congenital heart disease infantswith body weight≤10 kgwere enrolled.Infantswere divided into conventional group(group C,n=73)with conventional ECC circuit and minimized group(group M,n=84)with minimized ECC circuit.All of them underwent routine cardiac surgery with ECC.Perioperative clinic data and transfusion volumewere collected.Results Therewere no deaths in two groups.Group M had significantly less requirements on blood transfusion both intraoperatively and postoperatively comparing with group C(P<0.05).There were 51 infants with bloodless ECC and 17 infants with in hospital no blood transfusion in group M.There was no significant difference between two groups in chest drainage during postoperative 24 hours.Duration of postoperative ventilation and intensive care unit stay in group M were significantly shorter than in group C.Conclusion Minimized ECC circuit significantly decreases perioperative blood transfusion requirements,and improves in hospital outcome of the infants underwent cardiac surgery with bodyweight≤10kg.
Minimized extracorporeal circulation;Infants;Blood Transfusion
2016-09-18)
2016-10-18)
10.13498/j.cnki.chin.j.ecc.2017.01.03
510080广州,广东省心血管病研究所,广东省人民医院心外科,广东省医学科学院
庄建,E-mail,zhuangjian5413@tom.com
