全肝MRI直方图分析检测结直肠癌肝转移复发的价值
2017-04-11梁和月阳朝霞傅彩霞曾蒙苏饶圣祥
梁和月,阳朝霞,傅彩霞,曾蒙苏,饶圣祥
复旦大学附属中山医院放射科,上海 200032
全肝MRI直方图分析检测结直肠癌肝转移复发的价值
梁和月,阳朝霞,傅彩霞,曾蒙苏,饶圣祥
复旦大学附属中山医院放射科,上海 200032
目的:探讨治疗前MRI直方图分析在预测结直肠癌肝转移复发中的价值。方法:选取初次诊断为结直肠癌同步肝转移的50例患者,均接受包括扩散加权成像(diffusion weighted imaging,DWI)(b=0、500 s/mm2)在内的常规腹部增强MRI扫描。对表观扩散系数(apparent diffusion coefficient,ADC)和门脉期强化率图像进行直方图分析,获得包括均值、标准差、中位数、偏斜度、峰度及百分位数(1st、10th、50th、90th、99th百分位数)在内的参数。对所得直方图参数进行统计分析,比较肝转移复发(n=20)与无复发(n=30)组患者(随访间隔在6个月内)治疗前MRI直方图的差异。结果:结直肠癌肝转移患者门静脉期强化率直方图分析显示,复发组标准差和99th百分位数高于无复发组,差异有统计学意义(P=0.025,0.024),曲线下面积均为0.68。而ADC直方图分析显示,均值、标准差、中位数、偏斜度、峰度和百分位数在复发组与无复发组之间均无统计学差异(P>0.05)。结论:MRI门静脉期强化率直方图分析对预测结直肠癌肝转移患者的短期疗效具有潜在价值。
直方图分析;强化率;结直肠癌;肝转移;复发
肝脏是结直肠癌最常见的转移部位,结直肠癌的远处转移中约60%发生于肝脏[1]。结直肠癌肝转移的预后主要取决于肝转移灶的治疗。目前,随着影像学技术的发展,术前影像学检查包括CT、MRI及PET/CT等的应用在提高病灶的检出率、帮助制订正确的治疗方案及随访中发挥着不可或缺的作用,但对结直肠癌患者的总体生存没有太多改善。结直肠癌肝转移患者预后较差,约65%的患者在肝转移灶切除术后发生肝脏复发[2],结直肠癌1年累计异时性肝转移的发生率约4.3%,而5年累计异时性肝转移的发生率约14.5%[3]。
有研究认为,恶性实体肿瘤患者正常的肝实质区可能存在微小的肝转移灶[4-5],但目前的影像学检查方法无法检测到,从而导致术后较高的复发率及异时性肝转移,引起不良预后[6]。对超声、CT及MRI的灌注研究显示,肝转移灶能改变肝脏的血供特征,导致门静脉血流下降,而动脉血流代偿增加[7-9]。MRI是评估肿瘤的重要诊断工具,其具有优良的软组织对比度和多平面重建能力[10-11]。扩散加权成像(diffusion weighted imaging,DWI)是一种功能MRI技术,能探测活体组织的水分子运动,从而提供微观水平信息[12]。表观扩散系数(apparent diffusion coefficient,ADC)用于描述DWI中不同方向分子扩散运动的速度和范围,反映的是体素的平均值,而肿瘤的异质性广泛存在[13],因此ADC不能提供肿瘤的异质性信息。
医学影像学纹理分析能获得更多肉眼无法观察的信息[14]。直方图分析是纹理分析中的一部分,能量化肿瘤内部的异质性。MRI直方图研究在肿瘤诊断及预后评价中有更多优势[15-18]。基于上述理论,笔者认为在结直肠癌肝转移患者中,正常的肝实质可能存在微小转移灶,这种肉眼无法看到的病灶导致了治疗后较高的复发率。本研究旨在通过观察结直肠癌肝转移患者治疗前ADC图和门静脉强化率图的直方图,分析其在预测肝脏复发中的作用。
1 资料和方法
1.1 患者资料
收集2009年12月—2014年11月期间复旦大学附属中山医院收治的初次诊断为结直肠癌同步肝转移的患者共50例,均接受腹部增强MRI检查(包括DWI,b值为0、500 s/mm2)。其中男性32例、女性18例;平均年龄(56.6±13.4)岁。
患者入选标准为:① 检查前未接受任何结直肠癌肿瘤相关治疗,包括手术、化疗及放疗等;② 无结直肠癌以外的其他肿瘤相关病史;③ 既往无肝脏病变治疗病史;④ 患者随访时间不短于6个月。
1.2 检查方法
采用1.5 T超导MRI机(SIEMENS公司Magneto Avanto),联用体部相控阵线圈与脊柱线圈。DWI检查采用自旋回波-平面回波(spin echo-echo planar imaging,SE-EPI)序列,b值选择0、500 s/mm2。扫描参数如下:重复时间(repetition time,TR)= 2 400~2 600 ms,回波时间(echo time,TE)=66 ms,层厚7.0 mm,层间距2.1 mm,矩阵112×128,视野(field of view,FOV) 33 cm×33 cm~38 cm×38 cm。为减少化学位移伪影,采用常规抑脂技术和全局自动校准部分并行采集(GRAPPA)技术,加速因子R=2,扫描一次屏气完成,包括全部肝脏扫描,同时完成b=0和高b值的图像重组,各向同性,自动生成ADC图。在DWI检查前行常规呼吸导航快速自旋回波T2WI (TR=3 300 ms,TE= 70 ms,反转角150º,矩阵207×384),如果呼吸无规律,则采用多次屏气快速自旋回波T2WI (TR=3 500 ms,TE=84 ms,反转角140º,矩阵194×256)和2次屏气的二维快速小角度激发梯度回波T1WI (2D-fast low angle shot-T1,2DFLASH-T1;TR= 112.00 ms,TE=4.76 ms,反转角70º,矩阵144×256),均为层厚7.0 mm,层间距2.1 mm,FOV 33 cm×33 cm~38 cm× 38 cm。完成DWI检查后,应用一次性屏气抑脂2D-FLASH-T1 (TR=230.00 ms,TE=2.47 ms,反转角70º,层厚7.0 mm,层间距2.1 mm,矩阵135×256)或一次屏气三维容积间插重建梯度回波抑脂(3D-fat suppressed-volume interpolated body examination-T1,3D-VIBE-T1-FS;TR=5.04 ms,TE=2.31 ms,反转角10º,层厚4 mm,无间距扫描,矩阵250×512)行常规动态增强成像,FOV均为33 cm×33 cm~38 cm×38 cm。增强前扫描1个回合,增强后行3个回合扫描,造影剂选择钆喷酸葡胺(gadolinium-diethylenetriamine pentaacetic acid,Gd-DTPA),总量15~20 mL,经肘静脉注射后分别于20~30 s、70~80 s、180 s行屏气多回合增强扫描。
1.3 图像分析
利用SIEMENS公司OncoTreat进行直方图分析。将图像从医院的影像归档和通信系统(Picture Archiving and Communication Systems,PACS)以DICOM格式转移到SIEMENS直方图软件工作站中,对所有患者的ADC图、门静脉期强化率图像进行测量,由一名具有2年腹部影像学诊断经验的放射科医师完成测量。感兴趣区(region of interest,ROI)包括整个正常肝实质,测量者对肝脏的每一层进行ROI勾画,勾画过程中尽可能包括全部正常肝实质,去除任何可见的肝脏病灶,包括转移灶、囊肿、血管瘤等,尽量避开大血管包括门静脉、肝静脉主干、下腔静脉。ADC图的勾画参照DWI图像(图1),门静脉期强化率图像在SIEMENS软件中进行完成(图2)。随后,对这些参数进行分析:均值(mean)、标准差(standard deviation,SD)、中位数(median)、偏斜度(skewness)、峰度(kurtosis)及百分位数(1st、10th、50th、90th、99th 百分位数)。
1.4 统计学处理
2 结 果
2.1 一般特征
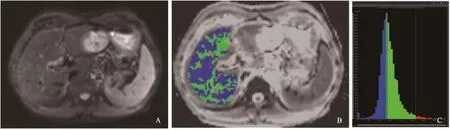
图1 DWI、ADC及ADC图直方图
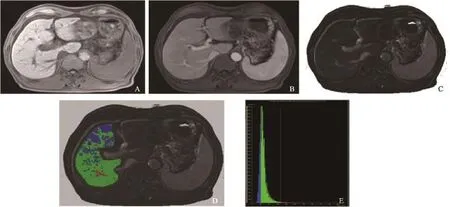
图2 门静脉期强化率图像
根据临床资料,将同步转移患者根据肿瘤治疗疗效(短期随访,约6个月)分成治疗后复发组(n=20)和无复发组(n=30)。患者均接受氟尿嘧啶为基础的化疗,包括FOLFOX(奥沙利铂+亚叶酸钙+氟尿嘧啶)、XELOX (卡培他滨+奥沙利铂)。其中47例患者接受了肝脏病灶切除(病理均证实为结直肠癌肝转移),3例未进行肝脏病灶切除。两组患者年龄、性别、原发部位无统计学差异(表1)。
2.2 直方图分析及AUC
同步肝转移患者治疗前的ADC和门静脉强化率直方图测量数据见表2、3。ADC直方图分析参数在复发与无复发组之间差异无统计学意义(P>0.05);门静脉期强化率直方图分析显示,复发组SD (P=0.025)和99th百分位数(P=0.024)高于无复发组(图3、4),差异有统计学意义,相对应的AUC均为0.68。
3 讨 论
本研究显示,同步肝转移患者中,治疗后短期复发与无复发患者的ADC直方图参数无统计学差异,而门静脉期强化率直方图参数中复发组SD和99th百分位数高于无复发组,AUC值均为0.68。
研究认为,结直肠癌肝转移患者中可能存在隐匿病灶,导致了治疗后复发甚至异时性肝转移[4-5,19],并能诱导肝实质血流变化[7-9]。与正常人群或动物对照组相比,肝实质动脉期血流量、多普勒灌注指数增高,而门静脉期相对降低[7,20]。肝转移灶导致动脉血供增加,使门静脉血流下降。但也有动物实验及临床研究得出不一样的结论[9,21-23],认为肝实质血流灌注参数在有肝转移与无肝转移患者之间没有差别。肝实质血流灌注受很多生理学因素的影响,包括血流量、血容量、毛细血管通透性和血管外间隙等,因此研究单一参数不能完全反映其血流灌注特征。
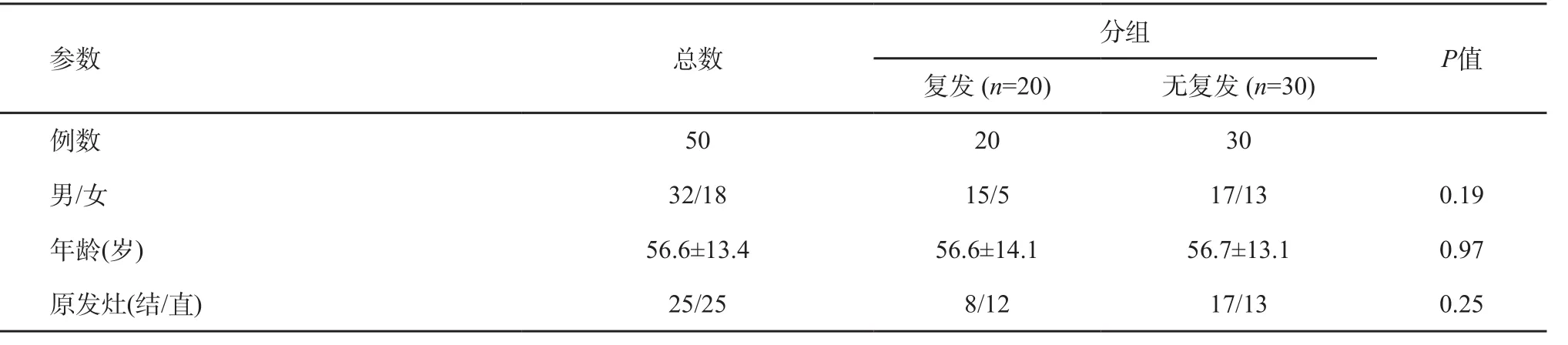
表1 患者一般特征

表2 复发与无复发组之间ADC直方图分析的比较

表3 复发与无复发组之间门静脉期强化率直方图分析的比较

图3 结肠癌肝转移治疗后复发患者直方图分析
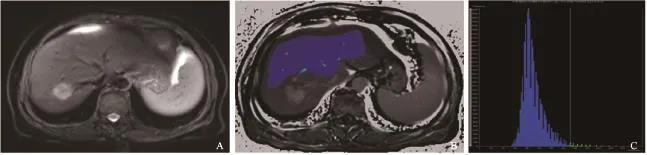
图4 结肠癌肝转移治疗后无复发患者直方图分析
本研究中,结直肠癌肝转移患者治疗前门静脉期强化率直方图分析显示复发组的99th百分位数高于无复发组。以往研究认为,结直肠癌肝转移患者门静脉血流中存在肿瘤细胞,其阻塞于毛细血管床,形成毛细血管网的微小栓塞,导致门静脉压升高,并使肝脏血供的平均渡越时间延长[9,24-25]。本研究分析了门静脉期强化率图像,反映的是正常肝实质的强化率,而非单纯的信号值。肝实质MRI强化程度与细胞外间隙的药物浓度有关。本研究推测肝转移患者肝实质内由于肿瘤细胞微小栓塞形成导致门静脉压增高、血流减慢,使增强检查时药物在细胞外间隙和血管内滞留,从而导致药物浓度发生改变,强化程度增加。复发组患者肝实质内门静脉微栓塞程度较无复发组严重,造成造影剂滞留增加。由于血流减慢,血液滞留,导致原发肿瘤脱落的肿瘤细胞进入门静脉血流中局部停留种植的概率增加。99th百分位数是一个量度,表示在该值以下99%信号强化程度的观测数据均包含其中。其剔除了直方图中1%的最大值,而这些最大值可能代表了ROI勾画过程中无法去除的部分血管分支,去除了这部分1%的最大值,能更准确地反映肝实质本身真实的强化特征。
本研究中复发组SD高于无复发组。SD反映了直方图中数值的分布特征,代表图像中数值的离散程度,各数值与均值的差异程度,差异越大,变异度越高。治疗后复发组患者的门静脉期强化率直方图SD更高,表示复发患者MRI图像中信号强化程度有较高的变异性,离散程度大,各强化率数值较平均强化率差异大,反映其肝脏血流灌注的异质性高。
在异质性肿瘤中,肿瘤细胞密集区域ADC值更低[26-27],肿瘤组织较正常肝实质具有相似或相对较低的ADC值[28]。理论上,同步肝转移患者中治疗后复发患者的正常肝实质存在更多微病灶,这些病灶对肝实质的ADC值产生影响。而本研究ADC直方图分析中,各参数在治疗后复发与无复发肝转移患者之间无差别,这可能是由于结直肠癌肝转移患者肝实质中的ADC值不仅受细胞结构的影响,还受血流灌注的影响。
本研究也有一些不足之处。首先,是一个回顾性研究,存在选择偏倚。其次,DWI只采用了两个b值(0和500 s/mm2),在以后的疗效评估中采用多b值可能有更多的利益。第三,少部分肝转移患者没有明确的肝转移灶病理结果,但对本研究影响甚微。此外,由于图像采集技术及患者条件的限制,未进行肝动脉期的研究,没有评价动脉期血流变化,希望以后能对此进行深入研究。
结直肠癌肝转移患者肝实质的门静脉期强化率直方图分析能帮助预测化疗后复发,具有一定的临床应用价值。
[1] PESTANA C, REITEMEIER RJ, MOERTEL C G, et al. The natural history of carcinoma of the colon and rectum [J]. Am J Surg, 1964, 108: 826-829.
[2] BROUQUET A, MORTENSON M M, VAUTHEY J N, et al. Surgical strategies for synchronous colorectal liver metastases in 156 consecutive patients: classic, combined or reverse strategy? [J]. J Am Coll Surg, 2010, 210(6):934-941.
[3] MANFREDI S, LEPAGE C, HATEM C, et al. Epidemiology and management of liver metastases from colorectal cancer [J]. Ann Surg, 2006, 244(2): 254-259.
[4] LAMBREGTS D M, MARTENS M H, QUAH R C, et al. Whole-liver diffusion-weighted MRI histogram analysis: effect of the presence of colorectal hepatic metastases on the remaining liver parenchyma [J]. Eur J Gastroenterol Hepatol, 2015, 27(4): 399-404.
[5] CONZELMANN M, LINNEMANN U, BERGER M R. Detection of disseminated tumor cells in the liver of cancer patients [J]. Eur J Surg Oncol, 2005, 31(9): 977-985.
[6] VIGANO L, CAPUSSOTTI L, DE ROSA G, et al. Liver resection for colorectal metastases after chemotherapy:impact of chemotherapy-related liver injuries, pathological tumor response, and micrometastases on long-term survival [J]. Ann Surg, 2013, 258(5): 731-740.
[7] KOPLJAR M, BRKLJACIC B, DOKO M, et al. Nature of Doppler perfusion index changes in patients with colorectal cancer liver metastases [J]. J Ultrasound Med, 2004, 23(10): 1295-1300.
[8] TOTMAN J J, O’GORMAN R L, KANE P A, et al. Comparison of the hepatic perfusion index measured with gadolinium-enhanced volumetric MRI in controls and in patients with colorectal cancer [J]. Br J Radiol, 2005, 78(926): 105-109.
[9] CUENOD C, LECONTE I, SIAUVE N, et al. Early changes in liver perfusion caused by occult metastases in rats: detection with quantitative CT [J]. Radiology, 2001, 218(2): 556-561.
[10] SUGAHARA T, KOROGI Y, GE Y, et al. Contrast enhancement of intracranial lesions: conventional T1-weighted spin-echo versus fast spin-echo MR imaging techniques [J]. AJNR Am J Neuroradiol, 1999, 20(8):1554-1559.
[11] GAETA M, VINCI S, MINUTOLI F, et al. CT and MRI findings of mucin-containing tumors and pseudotumors of the thorax: pictorial review [J]. Eur Radiol, 2002, 12(1): 181-189.
[12] LE BIHAN D J. Differentiation of benign versus pathologic compression fractures with diffusion-weighted MR imaging: a closer step toward the “holy grail” of tissue characterization? [J]. Radiology, 1998, 207(2): 305-307.
[13] WELCH D R. Tumor heterogeneity-a ‘contemporary concept’ founded on historical insights and predictions [J]. Cancer Res, 2016, 76(1): 4-6.
[14] CASTELLANO G, BONILHA L, LI L M, et al. Texture analysis of medical images [J]. Clin Radiol, 2004, 59(12):1061-1069.
[15] EMBLEM K E, NEDREGAARD B, NOME T, et al. Glioma grading by using histogram analysis of bloodvolume heterogeneity from MR-derived cerebral blood volume maps [J]. Radiology, 2008, 247(3): 808-817.
[16] CHOI Y S, KIM D W, LEE S K, et al. The added prognostic value of preoperative dynamic contrastenhanced MRI histogram analysis in patients with glioblastoma: analysis of overall and progression-free survival [J]. AJNR Am J Neuroradiol, 2015, 36(12):2235-2241.
[17] POPE W B, KIM H J, HUO J, et al. Recurrent glioblastoma multiforme: ADC histogram analysis predicts response to bevacizumab treatment [J]. Radiology, 2009, 252(1): 182-189.
[18] Nishiguchi T, Iwakiri T, Hayasaki K, et al. Postembolisation susceptibility changes in giant meningiomas:multiparametric histogram analysis using non-contrastenhanced susceptibility-weighted PRESTO, diffusionweighted and perfusion-weighted imaging [J]. Eur Radiol, 2013, 23(2): 551-561.
[19] LEEN E. The detection of occult liver metastases of colorectal carcinoma [J]. J Hepatobiliary Pancreat Surg, 1999, 6(1): 7-15.
[20] LEEN E, GOLDBERG J A, ANGERSON W J, et al. Potential role of Doppler perfusion index in selection of patients with colorectal cancer for adjuvant chemotherapy [J]. Lancet, 2000, 355(9197): 34-37.
[21] HOHMANN J, MULLER C, OLDENBURG A, et al. Hepatic transit time analysis using contrast-enhanced ultrasound with BR1: A prospective study comparing patients with liver metastases from colorectal cancer with healthy volunteers [J]. Ultrasound Med Biol, 2009, 35(9):1427-1435.
[22] HOHMANN J, NEWERLA C, MULLER A, et al. Hepatic transit time analysis using contrast enhanced MRI with Gd-BOPTA: A prospective study comparing patients with liver metastases from colorectal cancer and healthy volunteers [J]. J Magn Reson Imaging, 2012, 36(6): 1389-1394.
[23] ROUMEN R M, SCHELTINGA M R, SLOOTER G D, et al. Doppler perfusion index fails to predict the presence of occult hepatic colorectal metastases [J]. Eur J Surg Oncol, 2005, 31(5): 521-527.
[24] MORRIS V L, MACDONALD I C, KOOP S, et al. Early interactions of cancer cells with the microvasculature in mouse liver and muscle during hematogenous metastasis: videomicroscopic analysis [J]. Clin Exp Metastasis, 1993, 11(5): 377-390.
[25] JHAUGEBERG G, STROHMEYER T, LIERSE W, et al. The vascularization of liver metastases. Histological investigation of gelatine-injected liver specimens with special regard to the vascularization of micrometastases [J]. J Cancer Res Clin Oncol, 1988, 114(4): 415-419.
[26] LYNG H, HARALDSETH O, ROFSTAD E K. Measurement of cell density and necrotic fraction in human melanoma xenografts by diffusion weighted magnetic resonance imaging [J]. Magn Reson Med, 2000, 43(6): 828-836.
[27] DENG J, RHEE T K, SATO K T, et al. In vivo diffusion-weighted imaging of liver tumor necrosis in the VX2 rabbit model at 1.5 Tesla [J]. Invest Radiol, 2006, 41(4): 410-414.
[28] BRUEGEL M, HOLZAPFEL K, GAA J, et al. Characterization of focal liver lesions by ADC measurements using a respiratory triggered diffusionweighted single-shot echo-planar MR imaging technique [J]. Eur Radiol, 2008, 18(3): 477-485.
Potential of whole-liver MRI histogram analysis of remaining liver parenchyma to predict recurrence of colorectal liver metastases
LIANG Heyue, YANG Zhaoxia, FU Caixia, ZENG Mengsu, RAO Shengxiang
(Department of Radiology, Zhongshan Hospital, Fudan University, Shanghai 200032, China)
RAO Shengxiang E-mail: raoxray@163.com
Objective: To explore whether magnetic resonance imaging (MRI) histogram analysis of apparently diseasefree liver parenchyma can help predict the recurrence of colorectal liver metastases. Methods: Standard enhanced MRI including diffusion weighted imaging (b=0, 500 s/mm2) were performed at the first stage of diagnosis in 50 patients with colorectal liver metastases. Histograms were performed for apparent diffusion coefficient (ADC) maps and enhanced rate image of portal venous phase (PVP), thereafter the mean, standard deviation, median, skewness, kurtosis and Nth percentiles (1st, 10th, 50th, 90th , 99th) were generated. Quantitative histogram parameters were compared between the patients with recurrence (n=20) and without recurrence (n=30) after a short period (about 6 months) of chemotherapy with or without surgery. Receiver operating characteristic (ROC) analyses was further analyzed for the significant parameters. Results: The mean, standard deviation, median, skewness, kurtosis and percentiles of ADC maps had no significant difference between the patients with and without hepatic recurrence (P>0.05) after a short period of chemotherapy. The standard deviation and 99th percentile of enhanced rate image of portal venous phase were significantly higher in the patients with recurrence compared with those without recurrence (P=0.025, 0.024), and the areas under curve (AUCs) were both 0.68. Conclusion: Whole-liver MRI histogram analysis of apparently disease-free liver parenchyma can help predict hepatic recurrence in the patients with colorectal liver metastases.
Histogram analysis; Enhanced rate; Colorectal cancer; Liver metastasis; Recurrence
R445.2
A
1008-617X(2017)01-0018-07
2017-02-01)
饶圣祥 E-mail:raoxray@163.com
