18F-FDG PET/CT在结肠癌术前TNM分期中的价值及SUVmax与患者临床特征的相关性研究
2017-04-11刘长存宋建华赵晋华
吴 珊,刘长存,宋建华,陈 香,赵晋华
上海交通大学附属第一人民医院核医学科,上海 200080
18F-FDG PET/CT在结肠癌术前TNM分期中的价值及SUVmax与患者临床特征的相关性研究
吴 珊,刘长存,宋建华,陈 香,赵晋华
上海交通大学附属第一人民医院核医学科,上海 200080

赵晋华,主任医师,教授,博士研究生导师。现任上海交通大学医学院附属上海市第一人民医院核医学科主任。擅长PET/CT、ECT影像诊断、甲亢碘-131放射性核素治疗。主要社会职务有中华医学会核医学分会委员、淋巴瘤PET/CT工作委员会主任委员、PET学组副组长、上海核学会临床核医学专业委员会主任委员、上海医学会核医学专科委员会副主任委员、中国女医师协会影像专业委员会副主任委员、中国医学影像技术研究会常务理事、上海市核医学质控中心专家委员会委员、《中华分子影像与核医学杂志》编委、《肿瘤影像学》杂志常务编委。发表国内外专业论文100余篇(其中SCI收录期刊发表论文30余篇)。
目的:探讨PET/CT在结肠癌术前TNM分期中的临床价值及病灶最大标准化摄取值(maximum standardized uptake value,SUVmax)的临床意义。方法:回顾性分析44例经术后病理证实为结肠癌患者的PET/CT影像学资料,评价PET/CT术前TNM分期的准确性。分别按患者年龄和性别,病灶部位、长径、TNM分期、美国癌症联合会(American Joint Committee on Cancer,AJCC)分期、病理类型及组织学分化程度、癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原199(carbohydrate antigen 199,CA199)、CA242 进行分组,分析各组间SUVmax值差异有无统计学意义,并用受试者工作特征(receiver operating characteristic,ROC)曲线评价SUVmax对组织学分化程度的诊断效能。结果:PET/CT对T分期、M分期的诊断结果与术后病理分期的一致性较好(Kappa=0.776、1.0;P<0.05),而对N分期的诊断结果与术后病理分期的一致性一般(Kappa=0.493;P<0.05)。病灶SUVmax与患者年龄和性别、病灶部位、CA199、CA242无关(P>0.05);与病灶长径、TNM分期、AJCC分期、病理类型及分化程度、CEA有关(P<0.05)。ROC曲线下面积(area under curve,AUC)为0.862,阈值14.6,以此阈值来判断组织学分化程度的灵敏度和特异度均为77.8%。结论:PET/CT可用于术前TNM准确分期。SUVmax与病灶的长径、TNM分期、AJCC分期、病理类型、分化程度及CEA有关,可反映病灶的增殖、侵袭能力。
PET/CT;结肠癌;TNM分期;最大标准化摄取值
结直肠癌严重威胁人类生命健康,发病率居恶性肿瘤第3位,死亡率仅次于肺癌、肝癌、胃癌,排第4位[1]。随着我国经济的发展、居民生活方式及膳食结构的改变,近年来结肠癌的发病率逐年增长[2]。手术是目前治疗结直肠癌的主要方式,但术后患者存在一定的复发率与转移率,主要原因在于大部分患者确诊结直肠癌时已伴有邻近组织侵犯或远处转移。因此,早期诊断和准确的术前分期是结肠癌治疗及预后的关键因素,对提高患者生存质量、延长患者生命有重要意义。传统的影像学技术如CT、MRI、超声等基于病灶解剖形态对病灶进行判断,有时对病灶的良恶性鉴别存在一定困难,对判断淋巴结或远处转移存在局限性[3],而PET/CT显像可将全身解剖成像与功能代谢显像相结合,对病灶的良恶性、远处转移等有较好的判断能力,在肿瘤诊断及术前分期中有独特的优势[4]。目前,PET/CT应用于结肠癌术前分期的大部分研究所选取的病例除结肠癌外还包含直肠癌,亦有研究对象为所有腹部肿瘤,而仅含结肠癌的研究也只探讨了PET/CT在N分期中的应用[5-7]。患者的某些临床特征将影响预后,而最大标准化摄取值(maximum standardized uptake value,SUVmax)是PET/CT的一个半定量指标,了解SUVmax与临床特征的相关性可进一步指导临床治疗,了解预后。本研究对44例手术确诊为结肠癌患者的病理检查结果和术前18F-脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)PET/CT检查资料进行回顾性分析,评估PET/CT在结肠癌术前TNM分期中的价值及SUVmax与患者临床特征的相关性。
1 资料和方法
1.1 一般资料
回顾性分析2011年6月—2016年11月于上海交通大学附属第一人民医院手术且术后病理证实为结肠癌的44例患者(男性26例、女性18例)的PET/CT影像学资料。所有患者均于术前2周内接受18F-FDG PET/CT检查,年龄24~95岁,中位年龄62.5岁。均为首次诊断结肠癌,检查前未行任何肿瘤相关性治疗。
1.218F-FDG的制备
18F-FDG由GE公司PET trace回旋加速器生产并通过合成模块自动合成,放化纯度>95%。
1.3 检查方法
检查使用GE公司Discovery STE 16 PET/CT一体化扫描机。患者于检查前4~6 h禁食,空腹血糖浓度<6.1 mmol /L,静脉注射显像剂18F-FDG 0.15 mCi/kg,静卧1 h后行全身显像。先行CT扫描,扫描条件: 140 kV,160 mA,层厚3.75 mm;PET采用3D模式采集,一般采集6~8个床位,采集时间2 min/床位。经迭代法重建,并基于CT对PET图像进行衰减校正,校正后的PET与CT图像在Xeleris工作站上进行自动融合。SUV由工作站根据受检者体重、注射剂量、时间等自动生成。
1.4 资料分析
由2名有经验的核医学科医师共同阅片,在放射性浓聚灶最明显的层面沿病灶范围勾画感兴趣区(region of interest,ROI),工作站自动计算SUV,本研究以SUVmax为测量指标。
1.5 PET/CT术前分期标准
参考美国癌症联合会(American Joint Committee on Cancer,AJCC)和国际抗癌联盟(Union for International Cancer Control,UICC)提出的结直肠癌TNM分期系统[8]和其他PET研究[5-6],本研究分期标准如下,T0期:未发现原发肿瘤;T1~T2期:管腔局限性增厚,但外壁尚光整,周围脂肪间隙尚清晰,病灶在PET图像上呈放射性浓聚(SUVmax≥2.5);T3期:管壁局限性增厚,管腔明显狭窄,管壁形态不规则、不光整,脂肪间隙不清晰,模糊发现邻近器官或组织的侵犯,原发灶及受侵器官或组织PET图像上呈放射性浓聚;T4期:肿块突破浆膜层,管壁增厚较显著,管腔狭窄较明显,外周脂肪间隙内密度增高,并侵犯邻近器官结构,肿块及侵犯器官PET图像上呈放射性浓聚。N0:无区域淋巴结转移;N1:有1~3枚区域淋巴结转移(CT示淋巴结长径>1.0 cm或长径未达1.0 cm,但SUVmax≥2.0);N2:有4枚以上区域淋巴结转移。M0:无远处转移;M1:有远处转移(转移灶PET图像呈放射性浓聚,同时相应部位CT上可见病灶影)。
1.6 统计学处理
采用SPSS 22.0软件包,计量资料用x±s表示,分别计算PET/CT判定结肠癌TNM分期及AJCC分期各期的灵敏度、特异度、准确率、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV)。采用Kappa检验评估PET/CT对术前TNM分期与病理诊断的一致性,Kappa值<0.4为检验结果一致性较差,Kappa值0.4~0.75为一致性一般,Kappa值>0.75为一致性较高。两组间SUVmax均值比较采用独立样本t检验,P<0.05为差异有统计学意义。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,分析SUVmax对组织学分化程度的诊断效能。
2 结 果
2.1 手术病理结果
44例患者病灶部位:回盲部3例、升结肠9例、结肠肝曲11例、横结肠4例、降结肠2例、乙状结肠12例、直乙交界区3例。术后病理结果:高分化腺癌10例、中-高分化腺癌1例、中分化腺癌15例、中-低分化腺癌1例、低分化腺癌9例(其中3例部分伴黏液腺癌改变)、高分化黏液腺癌4例、中分化黏液腺癌1例、低分化黏液腺癌3例。
2.2 PET/CT与手术病理结果的比较
2.2.1 原发病灶
44例结肠癌病灶均明显摄取18F-FDG (图1),SUVmax为14.84±8.34 (5.3~48.6) 。
术后病理结果:38例侵及浆膜,6例未侵及浆膜。PET/CT判定8例浆膜未受侵,其中病理诊断2例侵及浆膜(分别为T3、T4期);PET/CT判断36例侵及浆膜(T3+T4),与病理诊断结果一致。PET/CT诊断结肠癌T分期各期的灵敏度、特异度、准确率、阳性预测值、阴性预测值及Kappa值见表1,检查结果与手术病理结果具有较高的一致性(Kappa =0.776,P<0.05)。

图1 PET图像示结肠癌病灶明显摄取18F-FDG

表1 PET/CT判定T分期与病理结果对照
2.2.2 淋巴结转移
44例结肠癌患者中,术后病理证实30例发生区域淋巴结转移,转移部位主要位于肠旁、肠系膜、腹膜后及髂血管旁等。PET/CT判定无淋巴结转移的11例患者中,2例术后病理证实为淋巴结转移;而PET/CT判定有淋巴结转移的33例患者中,5例术后病理证实未发生区域淋巴结转移,淋巴结为反应性增生(图2)。PET/CT诊断结肠癌N分期各期的灵敏度、特异度、准确率、阳性预测值、阴性预测值及Kappa值见表2,检查结果与手术病理结果的一致性一般(Kappa=0.493,P<0.05)。

图2 PET/CT误诊肿块旁淋巴结转移

表2 PET/CT判定N分期与病理结果对照
2.2.3 远处转移
44例结肠癌患者中,19例伴肝内转移灶,2例肺转移(图3)及1例右侧胸膜转移。其中肝转移灶均由术后病理证实,肺及胸膜转移经术后其他影像学随访确证。对于PET/CT术前未发现远处转移灶的病例,术中盆腹腔探查亦未发现远处转移灶。PET/CT诊断结肠癌M分期各期的灵敏度、特异度、准确率、阳性预测值、阴性预测值及Kappa值见表3,检查结果与手术病理结果的一致性极高(Kappa=1.0,P<0.05)。
2.2.4 AJCC分期
44例结肠癌患者的病理分期结果及PET/CT分期的灵敏度、特异度、准确率、阳性预测值、阴性预测值、Kappa值见表4。Ⅰ期和Ⅳ期PET/ CT与手术病理结果的一致性较高(Kappa=0.789,1.0;P<0.05),Ⅱ期和Ⅲ期PET/CT与手术病理结果的一致性一般(Kappa=0.553, 0.722;P<0.05)。

图3 PET/CT示结肠癌伴双肺多发性转移

表3 PET/CT判定M分期与病理结果对照

表4 PET/CT判定AJCC分期与病理分期结果对照
2.3 SUVmax与患者临床特征及血清肿瘤标志物的相关性分析
病灶的SUVmax与患者性别和年龄、病灶部位、糖类抗原199(carbohydrate antigen 199,CA199)、CA242无关(P>0.05),与肿瘤长径、是否侵犯浆膜层、是否发生淋巴结或远处转移、病理类型、组织学分化程度(依据Broder 法对病灶进行分级)、癌胚抗原(carcinoembryonic antigen,CEA)有关(P<0.05)(表5)。
2.4 SUVmax 对结肠癌组织学分化程度诊断效能的分析
绘制组织学分化程度诊断效能ROC曲线(图4),曲线下面积(area under curve,AUC)为0.862,Youden指数为0.556,阈值为14.6。SUVmax=14.6时灵敏度和特异度均为77.8%,为本研究的最佳诊断临界点。SUVmax>14.6时,病灶的组织学分化程度更低,倾向恶性的可能性更大。
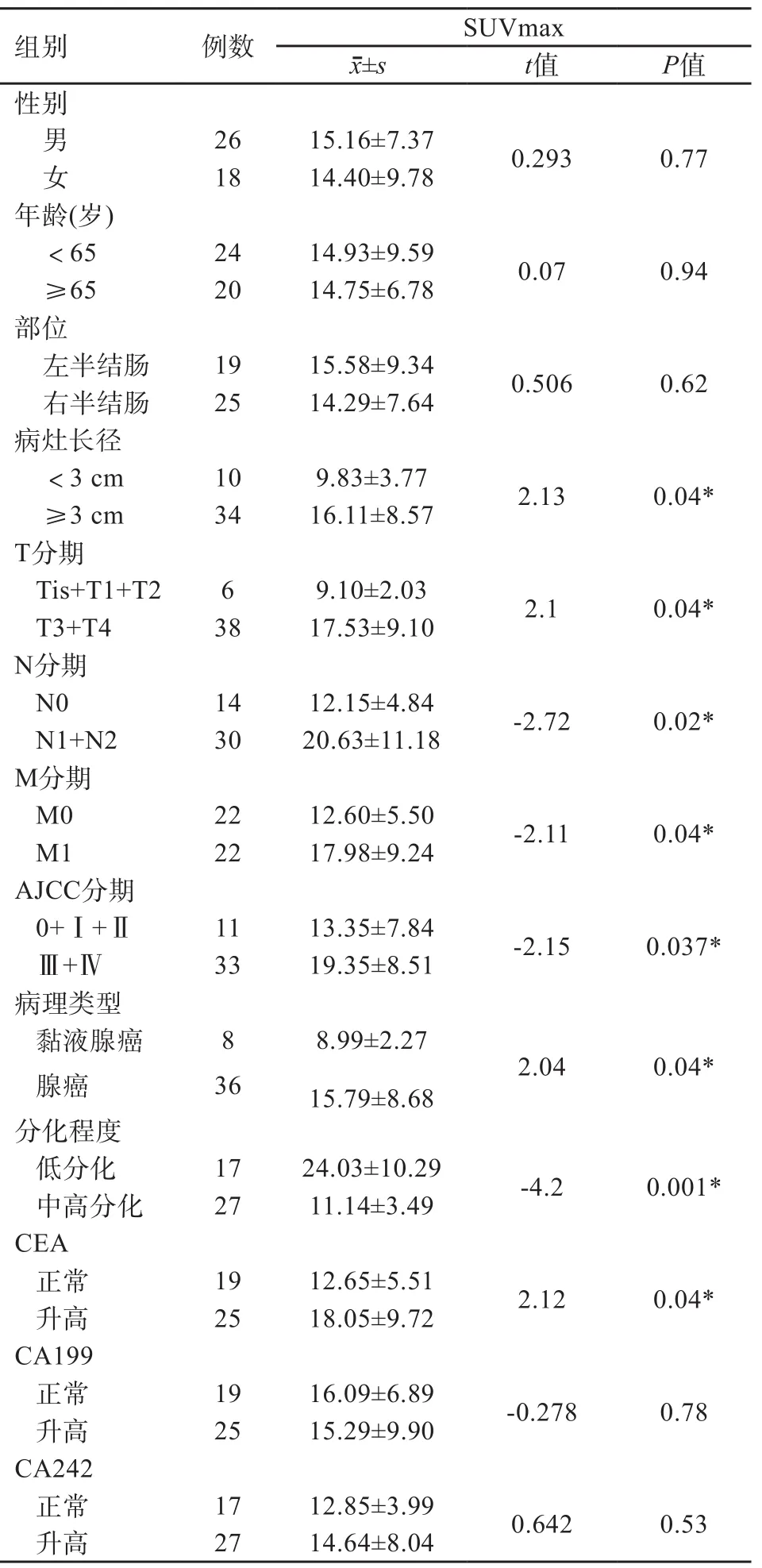
表5 SUVmax与临床特征及血清肿瘤标志物的关系
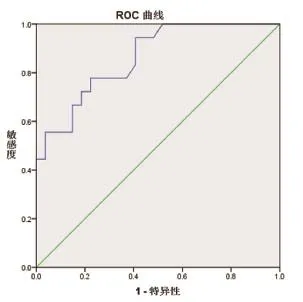
图4 PET/CT SUVmax对组织学分化程度诊断效能的ROC曲线
3 讨 论
随着结肠癌诊疗技术的发展,个体化治疗已成为临床关注的重点。个体化治疗可减少盲目手术带来的风险及并发症,改善患者预后[9]。对手术医师而言,术前除需明确肿瘤病灶的部位、大小及性质外,还需明确病灶的局部浸润范围、是否发生淋巴结或远处转移。本组病例随访中发现1例患者因肝脏占位手术,术后病理提示肿瘤为胃、肠腺癌转移可能,进而行PET/CT寻找原发灶,PET/CT结果提示原发灶在横结肠,患者随后进行了第2次手术,术后病理证实为橫结肠中低分化腺癌。如果手术医师术前采用PET/CT对该患者进行全身情况评估,将改变治疗方案,避免二次手术。因此,准确的术前分期可优化结肠癌患者的治疗方案,指导外科手术。
恶性肿瘤细胞代谢活跃,糖酵解水平高,18F-FDG摄取增多并在细胞内积聚,可经PET/CT探测成像[10]。18F-FDG PET/CT通过半定量指标SUV来反映病灶的代谢情况,并通过CT观察病灶的形态学改变,共同判别病灶的性质[11],适用于各年龄患者,尤其适用于不能行肠镜检查的患者,在肿瘤的定位、分期、疗效监测、寻找远处转移灶等方面起重要作用,近年来逐渐用于评估结肠癌的术前分期[12]。
本研究中,术前PET/CT对T分期各期的灵敏度、特异度、准确率均较高。但PET/CT将1例原位癌、1例T3期、1例T4期误判为T1~2期,这是因为CT不能很好地区分肠壁的多层结构而导致过度分期[13];当病灶刚刚侵及浆膜层时,周围脂肪间隙尚清晰,此时CT可能误判为T2期而导致过低分期。对于T1、T2期病灶,PET/CT与术后病理分期的一致性尚可(Kappa=0.732,P<0.05),对于T3、T4期病灶,PET/CT与术后病理分期的一致性较高(Kappa=0.818,0.792;P<0.05)。对于T分期,从整体上看一致性较高(Kappa=0.776,P<0.05),充分表明PET/CT对T分期的诊断效能较好,尤其适用于T3、T4期患者。
淋巴结转移是结肠癌最常见的转移方式[14],临床上主要通过触诊、超声、CT或MRI来观察淋巴结的形态、大小,以此判断淋巴结受累情况。通常将长径>1 cm的淋巴结判定为转移[15],这样易漏诊一些已有转移的小淋巴结,对肿大的淋巴结也不能鉴别是反应性增生还是转移。目前认为,CT对N分期的灵敏度和特异度分别为76%和55%[16]。虽然PET/CT综合了PET与CT的优势,降低了检查的假阳性率与假阴性率,但本研究中N分期各期的灵敏度、特异度均较低,有部分反应性增生的淋巴结既有淋巴结肿大,亦有FDG高摄取,导致PET/CT呈假阳性,而部分已发生转移的淋巴结长径小,代谢正常,此时PET/CT呈假阴性。对N分期PET/CT与术后病理分期的一致性一般(Kappa=0.493,P<0.05)。目前,PET/CT用于临床诊断淋巴结转移尚缺少明确证据,有研究认为增强CT对N分期的准确率和灵敏度均高于PET/CT[17]。因此,未来可尝试对怀疑淋巴结转移的患者行增强PET/CT以提高N分期的准确率和灵敏度。同时,迫切需要发现和发展新的核素及新的显像技术,以评价肿瘤是否累及淋巴结。
约20%新确诊为结直肠癌的患者伴有远处转移[18],最常见的转移部位为肝脏,肝转移灶的数目、位置将影响手术方式的选择[19]。有研究认为,CT发现远处转移灶的准确率差异较大,从55%[20]至100%[15]不等,而PET/CT对远处转移灶的灵敏度高于CT和MRI[21]。本研究中,22例患者发生远处转移,肝转移19例(术后病理证实),肺转移2例,胸膜转移1例(由其他影像学技术随访证实),PET/CT的诊断改变了这些患者的分期及治疗方案。对结肠癌M分期PET/CT与术后病理分期的一致性极高(Kappa=1.0,P<0.05),可有效用于患者的M分期。
AJCC分期是依据结肠癌病灶是否侵及浆膜层、是否发生淋巴结和远处转移。美国国立综合癌症网络(National Comprehensive Cancer Netnork,NCCN)诊疗指南提出,对于Ⅲ、Ⅳ期患者,需在术前先进行新辅助放化疗以降低术后复发率;Ⅰ、Ⅱ期患者可直接进行手术[15]。本研究中,33例AJCC分期处于Ⅲ、Ⅳ期的患者均未在术前行新辅助放化疗,于PET/CT检查后2周内行手术治疗。将PET/CT术前AJCC分期与术后病理分期进行比较,一致性较高(Kappa=0.789,P<0.05),对以后指导临床治疗方案的选择有重要意义。
PET/CT以SUV衡量组织对18F-FDG的摄取程度。本研究选取SUVmax作为评估指标,分析其与患者临床特征的相关性,发现结肠癌病灶SUVmax与患者性别和年龄、病灶部位、CA199、CA242无关(P>0.05),与病灶的长径、TNM分期、AJCC分期、病理类型、组织学分化程度、CEA有关(P<0.05)。病灶大小反映肿瘤的增殖能力,侵犯周围组织、淋巴结或远处转移反映了肿瘤的侵袭能力。本研究发现,长径≥3 cm的病灶SUVmax比长径<3 cm者高,侵及浆膜层组高于未侵及浆膜层组,伴有淋巴结或远处转移组高于无转移组,差异均有统计学意义(P<0.05)。因此,本研究认为SUVmax越高,肿瘤的侵袭性、增殖能力也越高。
本研究44例患者中大部分为腺癌(36例),只有8例为黏液腺癌。黏液腺癌因为含黏液成分多,实性成分少,病灶摄取FDG少[22],SUVmax总体上低于腺癌(P<0.05),PET/CT可呈假阴性。因此,当怀疑恶性病变而PET/CT代谢低时,须借助肠镜来诊断。一般而言,低分化肿瘤含恶性细胞多,代谢水平高[23]。本研究按Broder法对病灶进行分级,观察不同组织学分化程度之间SUVmax是否具有差异性。结果发现,低分化组SUVmax高于中-高分化组(图5,P<0.05)。进一步研究SUVmax对组织学分化程度是否具有诊断效能,绘制诊断效能ROC曲线,AUC为0.862,表明用SUVmax诊断组织学分化程度的诊断效能较好,14.6是区分病灶低分化与中-高分化的最佳阈值,其灵敏度和特异度均为77.8%,SUVmax>14.6时肿瘤倾向低分化的可能性大,恶性程度高,预后差。
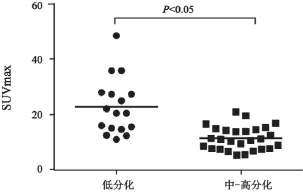
图5 SUVmax与组织学分化程度的关系
临床上常通过监测肿瘤标记来预测肿瘤的发生,CEA、CA199和CA242 是消化道常见的肿瘤标志物。本研究发现,CEA升高组SUVmax高于正常组(P<0.05),而CA199和CA242正常组与升高组之间SUVmax差异均无统计学意义(P>0.05),表明SUVmax与CEA可能存在一定联系。本研究中,1例患者无任何临床症状,因体检发现肿瘤标志物持续升高而就诊,行全身PET/CT检查后诊断为结肠癌伴肝转移并随后进行了治疗。因此,当肿瘤标志物进行性升高时,患者要尤为注意,定期随访加PET/CT全面评估可早期监测体内是否存在肿瘤病灶。一旦确诊肿瘤,可及时治疗,从而延长患者生存期,提高生活质量。
18F-FDG PET/CT集功能代谢显像与解剖形态学成像于一体,在结肠癌原发及远处转移病灶的检出方面优于CT和MRI[24]。本研究证实,18F-FDG PET/CT在结肠癌术前TNM分期中有独特优势。半定量指标SUVmax与患者性别和年龄、病灶部位、CA199、CA242无关,而与病灶的长径、TNM分期、AJCC分期、病理类型、组织学分化程度及CEA有关,表明SUVmax可在一定程度上反映结肠癌的侵袭和增殖能力及预后。但PET/CT依然存在一定的局限性:肠道的生理性摄取可掩盖早期微小病灶;高分化黏液腺癌等摄取FDG较低,会导致PET/CT假阴性,故PET/CT对结肠癌的优势更多体现在术前分期上。
本研究尚存在不足之处。首先,病例数相对较少。其次,只分析了SUVmax与一些临床特征是否相关,至于两者之间相关性如何还有待进一步探讨;再次,SUVmax与肿瘤的侵袭和增殖能力及恶性程度有关,这些均影响患者预后,但本组病例中含青年患者,尚未对其进行生存期的相关分析。
[1] FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012 [J]. Int J Cancer, 2015, 136(5): E359-E386.
[2] LI X P, XIE Z Y, FU Y F, et al. Colorectal cancer concealment predicts a poor survival: a retrospective study [J]. Asian Pac J Cancer Prev, 2013, 14(7): 4157-4160.
[3] 刘国兵, 李艳丽, 胡鹏程, 等. PET/CT显像中肝脏18F-FDG摄取的影响因素 [J]. 中华核医学与分子影像杂志, 2015, 35(6): 506-508.
[4] LU J, SUN X D, YANG X, et al. Impact of PET/CT on radiation treatment in patients with esophageal cancer:A systematic review [J]. Crit Rev Oncol Hematol, 2016, 107: 128-137.
[5] 王大龙, 于丽娟, 田墨涵, 等. 18F-FDG PET/CT显像在结直肠癌术前分期中的价值 [J]. 临床反射学杂志, 2012, 31(1): 70-74.
[6] 任浩棠, 王毅均, 李瑞平, 等. 64层18F-FDG PET/ CT在结肠癌N分期中的诊断价 [J]. 结直肠肛门外科, 2015, 21(6): 402-406.
[7] LEE J H, LEE M R. Positron emission tomography/ computed tomography in the staging of colon cancer [J]. Ann Conoproctol, 2014, 30(1): 23-27.
[8] SOBIN L H, FLEMING I D. TNM classification of malignant tumors, fifth edition(1997) [J]. Cancer, 1997, 80(9): 1803-1804.
[9] CUNNINGHAM D, ATKIN W, LENZ H J, et al. Colorectal cancer [J]. Lancet, 2010, 375(9719): 1030-1047.
[10] NGUYEN V X, NGUYEN B D, RAM P C. Occult colon cancer with initial cutaneous metastatic manifestation: PET/CT Detection [J]. Clin Nucl Med, 2012, 37(5): 506-508.
[11] VAIDYANATHAN S, PATEL C N, SCARSBROOK A F, et al. FDG PET/CT in infection and inflammationcurrent and emerging clinical applications [J]. Clin Radiol, 2015, 70(7): 787-800.
[12] MAFFIONE A M, LOPCI E, BLUEMEL C, et al. Diagnostic accuracy and impact on management of18F-FDG PET and PET/CT in colorectal liver metastasis:a meta-analysis and systematic review [J]. Eur J Nucl Med Mol Imaging, 2015, 42(1): 152-163.
[13] THOENI R F, ROGALLA P. Current CT/MRI examination of the lower intestinal tract [J]. Baillieres Clin Gastroenterol, 1994, 8(4): 765-796.
[14] 孟军, 徐世康. CT及MRI诊断早期结肠癌淋巴结转移研究 [J]. 实用医院临床杂志, 2016, 13(2): 134-135.
[15] CADEMARTIRI F, LUCCICHENTI G, ROSSI A, et al. Spiral hydro-CT in the evaluation of colo-sigmoideal cancer [J]. Radiol Med, 2002, 104(4): 295-306.
[16] MAUCHLEY D C, LYNGE D C, LANGDALE L A, et al. Clinical utility and cost-effectiveness of routine preoperative computed tomography scanning in patients with colon cancer [J]. Am J Surg, 2005, 189(5): 512-517.
[17] 赵娓娓, 王胜军, 文娣娣, 等. 增强CT和18F-FDG PET/CT在胃癌术前分期评估中的临床价值比较 [J].现代生物医学进展, 2016, 16(19): 3683-3686.
[18] LEUFKENS A M, VAN DEN BOSCH M AAJ, VAN LEEUWEN M S, et al. Diagnostic accuracy of computed tomography for colon cancer staging: a systematic review [J]. Scand J Gastroenterol, 2011, 46(7-8): 887-894.
[19] RUERS T,BLEICHRODT R P. Treatment of liver metastases, an update on the possibilities and results [J]. Eur J Cancer, 2002, 38(7): 1023-1033.
[20] MCANDREW M R, SABA A K. Efficacy of routine preoperative computed tomography scans in colon cancer [J]. Am Surg, 1999, 65(3): 205-208.
[21] BIPAT S, VAN LEEUWEN M S, COMANS EFI, et al. Colorectal liver metastases: CT, MR imaging, and PET for diagnosis-Meta-analysis [J]. Radiology, 2005, 237(1):123-131.
[22] YUN M J, LIM J S, NOH S H, et al. Lymph node staging of gastric cancer using18F-FDG PET: a comparison study with CT [J]. J Nucl Med, 2005, 46(10): 1582-1588.
[23] TANG-CHRISTENSEN M, VRANG N,LARSEN P J. Glucagon-like peptide 1(7-36) amide’s central inhibition of feeding and peripheral inhibition of drinking are abolished by neonatal monosodium glutamate treatment [J]. Diabetes, 1998, 47(4): 530-537.
[24] GALLAMINI A, ZWARTHOED C, BORRA A. Positron emission tomography (PET) in Oncology [J]. Cancer, 2014, 6(4): 1821-1889.
Clinical value of18F-FDG PET/CT in preoperative TNM staging and SUVmax in patients with colon cancer
WU Shan, LIU Changcun, SONG Jianhua, CHEN Xiang, ZHAO Jinhua
(Department of Nuclear Medicine, Shanghai General Hospital, Shanghai Jiao Tong University, Shanghai 200080, China)
ZHAO Jinhua E-mail: zhaojinhua1963@126.com
Objective: To evaluate the clinical value of18F-fluorodeoxyglucose (18F-FDG) PET/CT in preoperative TNM staging, and explore the clinical value of maximum standardized uptake value (SUVmax) in the patients with colon cancer. Methods: PET/CT preoperative images of forty-four patients diagnosed with colon cancer were retrospectively analyzed to evaluate the accuracy of PET/CT in TNM staging before surgery. The groups were matched by sex, age, lesion position, diameter, TNM stage, American Joint Committee on Cancer (AJCC) stage, pathological type, differentiation state, carcinoembryonic antigen (CEA), carbohydrate antigen 199 (CA199) and CA242, and SUVmax was calculated. The accuracy of SUVmax for differentiation was analyzed by receiver operating characteristic (ROC) curve. Results: There was a good consistency between PET/CT and pathologyresults in T stage and M stage (Kappa=0.776, 1.0;P<0.05), while a worse consistency in N stage (Kappa=0.493;P<0.05). There was no correlation between SUVmax and sex, age, lesion position, CA199 and CA242 (P>0.05). But SUVmax was correlated with lesion diameter, TNM stage, AJCC stage, pathological type, differentiation state and CEA (P<0.05). The area under ROC curve of SUVmax was 0.862. Taking SUVmax=14.6 as threshold value to evaluate the differentiation state of colon cancer, the sensitivity and specificity were both 77.8%. Conclusion: PET/CT should be applied in preoperative TNM staging in the patients with colon cancer. SUVmax may be related to lesion diameter, TNM stage, AJCC stage, pathological type, differentiation state and CEA. SUVmax can reflect the invasion and proliferation ability of colon cancer.
PET/CT; Colon cancer; TNM staging; Maximal standardized uptake value
R445.5
A
1008-617X(2017)01-0035-08
2017-02-01)
国家自然科学基金(No:81401440)
赵晋华 E-mail:zhaojinhua1963@126.com
