高频超声造影诊断结直肠癌微小肝转移瘤的价值
2017-04-11王怡敏文艳玲刘广健
覃 斯,陈 瑶,王怡敏,文艳玲,刘广健
中山大学附属第六医院超声科,广东 广州 510655
·专题论著·
高频超声造影诊断结直肠癌微小肝转移瘤的价值
覃 斯,陈 瑶,王怡敏,文艳玲,刘广健
中山大学附属第六医院超声科,广东 广州 510655

刘广健,博士,副主任医师,硕士生导师。2001年毕业于中山医科大学,从事消化系统疾病的超声诊断及介入治疗工作15年,期间于日本东京医科大学研修两年。擅长肝胆胰、胃肠、肛门等消化系统疾病的超声诊断和肿瘤消融治疗等各项超声引导介入治疗。
担任中国超声医学工程学会介入超声专业委员会青年委员会副主任委员及腹部超声专业委员会青年委员、中国医师协会超声医师分会青年委员会委员、广东省医学会超声分会青年委员会副主任委员、广东省超声工程学会理事、《中国医学影像技术》杂志编委等。
主持和参与国家自然科学基金等省部级项目8项。以第一作者或通信作者发表论著32篇,SCI收录17篇。
目的:探讨使用高频线阵探头超声及超声造影(contrast-enhanced ultrasound,CEUS)诊断结直肠癌微小肝转移瘤(colorectal liver metastases,CRLMs)的能力。方法:微小CRLM患者85例,共156个病灶,平均长径(7.40±1.90) mm。使用GE公司Logiq E9超声仪,分别配备凸阵及高频探头对肝脏行超声及CEUS扫查,不同年资医师进行图像分析及诊断。结果:高频探头超声及CEUS的诊断价值略优于凸阵探头。高年资医师的诊断能力高于低年资医师,使用凸阵探头时更明显(P<0.05)。高频探头有助于提升不同年资医师对CRLMs边界、声晕、增强水平及增强形态观察的一致性(边界Kappa值:0.928vs. 0.860;声晕Kappa值:0.909vs. 0.816;增强水平Kappa值:0.714vs. 0.572;增强形态Kappa值:0.893vs. 0.600),进而提高诊断一致性(超声Kappa值:0.628vs. 0.479;CEUS Kappa值:0.658vs. 0.363)。结论:高频线阵探头能高分辨率、高对比度地显示微小CRLMs特点,有助于提高诊断准确率及不同经验水平医师诊断的一致性。
超声造影;高频超声;结直肠癌;肝转移瘤;诊断
结直肠癌微小肝转移瘤(colorectal liver metastases,CRLMs)发生率高达50%,是临床诊疗的重点和难点[1]。CRLMs的早期准确诊断对肿瘤分期、指导治疗及估计预后具有重要意义[2]。经腹超声是CRLMs的首选筛查手段[3],但受仪器、检查者经验、受检者条件、病灶位置及大小等多种因素影响,对转移瘤的诊断能力差异较大[4]。微小CRLMs是指肝内长径≤10 mm的转移瘤。目前,经腹肝脏超声常规使用凸阵探头,平扫频率3~5 MHz,造影频率2~3 MHz,空间分辨率较低,且表浅气泡破坏较显著,导致造影成像时近程图像增强不均匀,不利于表浅病灶的观察。因此,临床急需高空间分辨率的实时对比增强影像学方法来提高微小CRLMs的诊断率。
本研究拟通过比较使用高频线阵和凸阵探头的二维超声与超声造影(contrast-enhanced ultrasound,CEUS)经腹诊断微小CRLMs的能力,探讨其对不同经验水平医师诊断能力的影响,为临床CRLMs的有效评价寻找更好的检查方法。
1 资料和方法
1.1 病例资料
共纳入2013年11月—2015年12月于中山大学附属第六医院就诊的微小CRLMs患者85例,其中男性49例、女性36例;平均年龄(55.2±14.3)岁(23~89岁)。共156个病灶,包括CRLMs 143个(临床诊断131个,病理诊断12个)、血管瘤9个(临床诊断6个,病理诊断3个)、局灶性化疗相关性肝损伤4个(临床诊断2个,病理诊断2个)。CECT/MRI测量病灶平均长径(7.40±1.90) mm (3~10 mm)。
1.2 方法
使用GE公司Logiq E9超声仪,配备凸阵探头(C1-5,平扫频率3.0~5.0 MHz,造影频率2.0~3.0 MHz)和线阵探头(9L,平扫频率6.0~9.0 MHz,造影频率5.0 MHz)。超声造影剂(ultrasonic contrast agent,UCA)为BRACCO公司SonoVue®,每次2 mL经肘静脉团注。造影剂特异性成像软件为低机械指数(mechanical index,MI)编码脉冲反向技术,MI设为0.1~0.2。所有扫查由同一名具有10年以上造影经验的超声科医师完成。首先使用凸阵探头对全肝进行扫查,记录所测及病灶影像学特征,锁定目标病灶(显示最清晰、受呼吸运动影响最小的病灶)后注射UCA进行CEUS,必要时再次注射UCA观察其他病灶的灌注情况,两次造影间隔时间5 min。凸阵探头扫查结束后切换高频线阵探头,重复上述检查过程。所有静态及动态影像学数据保存于机器硬盘并刻录光盘留待图像分析。CRLMs的超声诊断标准如下,① 超声:肝内新发实性结节,低或高回声,有或无晕征;② CEUS:病灶动脉期呈周边环状均匀或不均匀高或等增强,增强消退迅速,门静脉期及延迟期呈低增强。肝内良性病变的超声诊断标准如下,① 超声:低或高回声,边界清,无晕征;② CEUS:动脉期呈均匀或周边结节状高或等增强,门静脉期及延迟期维持不变或消退为等增强,或病灶在3期中均呈无增强。根据诊断标准,对肝内局灶性病变进行定性诊断,分为肯定符合、可能符合、不能确定是否符合、可能不符合、肯定不符合CRLMs声像改变5个等级。图像分析由未参与扫查的一名高年资医师和一名低年资医师分别进行。以高年资医师的图像分析为准,分析CRLMs的超声表现情况,比较两名医师的观察及诊断一致性。
1.3 统计学处理
采用SPSS 16.0及MedCalc x64统计软件进行分析,P<0.05为差异有统计学意义。定量资料用表示,比较用t检验;分类资料比较用四格表χ2检验。以CECT/MRI为金标准,绘制受试者工作特征(receiver operating characteristic,ROC)曲线,比较曲线下面积(area under curve,AUC)。一致性分析用Kappa值表示:Kappa值=0,两者完全无关;Kappa值≤0.4,一致性差;0.4<Kappa值≤0.6,中度一致;0.6<Kappa值≤0.8,高度一致;Kappa值>0.8,一致性极好;Kappa值=1,完全一致。
2 结 果
高频超声探及的微小CRLMs位置较表浅[深度(55.23±20.50) mm vs. (42.03±16.03) mm,P<0.05],对微小CRLMs声晕、边界的显示更清晰(边界:50.00% vs. 32.53%;声晕:27.08% vs. 14.46%;P<0.05)(表1、图1)。高频CEUS较凸阵探头对微小CRLMs增强水平及增强形态的观察更清晰(P<0.05)(表2)。凸阵探头CEUS观察到32个微小CRLMs动脉期呈均匀等增强,高频CEUS观察到其中28个(87.50%)病灶呈高增强(周边环状增强11个,34.38%;均匀增强11个,34.38%;不均匀增强6个,18.75%)(图2),其余1个(3.13%)病灶呈均匀等增强,3个(9.38%)病灶因位置太深,高频CEUS无法探及。

图1 结肠癌术后CECT示肝S6包膜下转移瘤超声表现

表1 CRLMs在两种探头二维超声上的表现
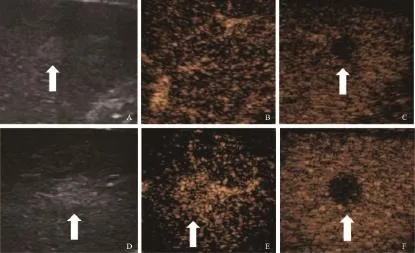
图2 直肠癌CECT示肝S5转移瘤超声表现
高频超声及CEUS的诊断价值略优于凸阵探头(超声AUC:0.896 vs. 0.853;CEUS AUC:0.931 vs. 0.899;P>0.05)(表3、图3)。凸阵探头超声将3例血管瘤误诊为CRLMs,高频超声仅误诊1例血管瘤。凸阵探头超声漏诊4例化疗后改变,高频超声漏诊1例化疗后改变,将2例化疗后改变误诊为CRLMs。凸阵探头CEUS将1例血管瘤误诊为CRLMs,高频CEUS无误诊。凸阵探头CEUS漏诊3例化疗后改变,将1例化疗后改变误诊为CRLMs。高频CEUS无漏诊,将1例化疗后改变误诊为CRLMs。
高年资医师的诊断能力高于低年资医师,采用凸阵探头时更明显(高频超声AUC:0.896 vs. 0.847,P>0.05;凸阵探头超声AUC:0.853 vs. 0.801,P<0.05;高频CEUS AUC:0.931 vs. 0.905,P>0.05;凸阵探头CEUS AUC:0.899 vs. 0.854,P<0.05)(表3)。高频探头有助于提升不同年资医师对微小CRLMs边界、声晕、增强水平及增强形态的观察一致性(边界Kappa值:0.928 vs. 0.860;声晕Kappa值:0.909 vs. 0.816;增强水平Kappa值:0.714 vs. 0.572;增强形态Kappa值:0.893 vs. 0.600)(表4),进而提高诊断一致性(超声Kappa值:0.628 vs. 0.479;CEUS Kappa值:0.658 vs. 0.363)(表5)。

表3 高低年资医师使用不同探头的诊断结果比较
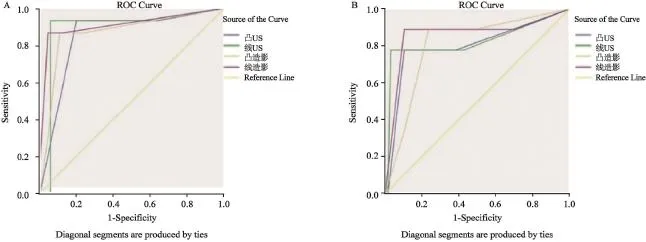
图3 不同年资医师诊断的ROC曲线

表4 高低年资医师对微小CRLMs超声特征的观察一致性分析

表5 高低年资医师对微小CRLMs的诊断一致性分析
3 讨 论
肝转移瘤多源于血行播散,常位于近肝包膜区。临床中发现微小CRLMs常位于近肝包膜或膈肌等表浅位置,本研究中深度在60 mm以内的微小CRLMs约占82.05%。因此,常规凸阵探头超声常不能满足肝表浅微小病灶的诊断。
CRLMs的二维超声声像图表现多样化,典型表现为病灶周边有晕征,呈“牛眼征”或“同心圆征”[5]。但微小CRLMs大多边界清晰,形态规则,无明显晕征,不易与良性病变鉴别。研究表明,凸阵探头对>2 cm的转移瘤灵敏度为100%,对1~2 cm的病灶灵敏度为61%,对<1 cm的病灶灵敏度只有20%[6]。本研究中,高频超声通过提高探头频率来提高空间分辨力,与相对频率较低的凸阵探头相比,在可探及范围内对病灶的声晕、边界显示更清晰,从而更利于CRLMs的诊断。
CRLMs的超声增强表现受多种因素影响,包括血供、大小、内部坏死及纤维化程度等[3]。CRLMs的典型增强表现为动脉期周边环状或均匀高增强,增强消退迅速,门静脉期及延迟期呈低增强[5]。CRLMs生长迅速,病灶内部常因血供不足而出现液化坏死,因此较大病灶在动脉期多呈周边环状增强;而小转移瘤内部不易出现坏死,因此动脉期多呈均匀增强[7]。文献报道,凸阵探头CEUS对肝内>2 cm病灶的灵敏度>90%,对1~2 cm病灶的灵敏度为84.9%,对<1 cm病灶的灵敏度为80.6%[8]。本研究中,高频CEUS显示97.32%的CRLMs呈高增强,仅2.68%的CRLMs呈等增强,与凸阵探头CEUS相比能更清晰地显示转移瘤动脉性新生血管的丰富程度。在凸阵探头CEUS动脉期呈等增强的32个微小CRLMs中,29个病灶可被高频CEUS探及,其中96.55% (28/29)病灶可清晰显示动脉期高增强。部分微小转移瘤因内部新生血管不成熟,增强水平较周围肝实质差异不甚明显,空间分辨力相对较低的凸阵探头CEUS不易观察到此类病灶的稍高增强;而高频CEUS空间分辨力高,能明显提高图像质量,在可探及范围内能更细致地观察微小病灶的灌注方式,从而有利于病灶的定性诊断。
欧洲医学和生物学超声协会联盟(European Federation of Societies for Ultrasound in Medicine and Biology,EFSUMB)的肝脏超声造影规范和临床应用指南指出,CEUS动脉期主要用于肝内局灶性病变的定性诊断,而延迟期主要用于恶性病灶的检出[9]。有报道显示,约8%的血管瘤及20%的局灶性结节性增生在延迟期呈低增强,若未同时观察其动脉期灌注情况,可能被误诊为转移瘤[10-11]。本研究中,1例血管瘤及1例化疗后改变延迟期呈低增强,凸阵探头CEUS显示其动脉期呈均匀等增强,误诊为CRLMs;高频CEUS可清晰显示上述血管瘤动脉期呈血管瘤典型的周边结节状高增强的增强表现,而上述化疗后改变动脉期呈均匀稍高增强,增强消退缓慢,与典型CRLMs增强表现不甚相符。
超声诊断需较为系统的培训及经验积累,尤其对肝内微小病灶,初学者常因经验不足、观察不细致而出现漏诊或误诊。高频探头可通过提高空间分辨力来提高显像质量,使病灶显示更客观明确,从而更利于病灶的定性诊断。本研究结果表明,诊断经验对微小CRLMs诊断有一定影响。低年资医师的诊断能力低于高年资医师,使用凸阵探头时更明显。凸阵探头超声与CEUS的诊断一致性不高,尤其在凸阵探头进行CEUS的诊断一致性差(Kappa值<0.6)。高频探头则有利于提高CRLM边界、声晕、增强水平、增强形态的观察一致性(Kappa值>0.6),从而提高诊断一致性。
本研究尚存在一些不足:① 基于临床伦理要求,并非所有病灶都获得了病理诊断,但本研究的最终诊断是基于病史、实验室检查、影像学资料及随访情况,诊断依据充足可信。② 病例数较少,尤其对良性病例数。③ 使用Logiq E9及线阵探头9L,获得了满意图像,但未尝试其他超声仪器及探头,不能保证获得相同的结果。
高频线阵探头能高分辨率、高对比度地显示微小CRLMs的特点,有助于提高诊断准确率及不同经验水平医师的诊断一致性。
[1] ADAM R, DE GRAMONT A, FIGUERAS J, et al.The oncosurgery approach to managing liver metastases from colorectal cancer: a multidisciplinary international consensus [J]. Oncologist, 2012, 17(10): 1225-1239.
[2] LARSEN L P. Role of contrast enhanced ultrasonography in the assessment of hepatic metastases: a review [J]. World J Hepatol, 2010, 2(1): 8-15.
[3] KONG W T, JI Z B, WANG W P, et al. Evaluation of liver metastases using contrast-enhanced ultrasound:enhancement patterns and influencing factors [J]. Gut Liver, 2016, 10(2): 283-287.
[4] CANTISANI V, GRAZHDANI H, FIORAVANTI C, et al. Liver metastases: contrast-enhanced ultrasound compared with computed tomography and magnetic resonance [J]. World J Gastroenterol, 2014, 20(29): 9998-10007.
[5] QIN S, LIU G J. Ultrasound examination in detection and characterization of colorectal liver metastases [J]. Int J Radiol, 2015, 2(2): 14-45.
[6] LARSEN L P. Role of contrast enhanced ultrasonography in the assessment of hepatic metastases: a review [J]. World J Hepatol, 2010, 2(1): 8-15.
[7] CELLI N, GAIANI S, PISCAGLIA F, et al. Characterization of liver lesions by real-time contrastenhanced ultrasonography [J]. Eur J Gastroenterol Hepatol, 2007, 19(1): 3-14.
[8] STROBEL D, BERNATIK T, BLANK W, et al. Diagnostic accuracy of CEUS in the differential diagnosis of small (≤20 mm) and subcentimetric (≤10 mm) focal liver lesions in comparison with histology. Results of the DEGUM multicenter trial [J]. Ultraschall Med, 2011, 32(6): 593-597.
[9] CLAUDON M, DIETRICH C F, CHOI B I, et al. Guidelines and good clinical practice recommendations for contrast enhanced ultrasound (CEUS) in the liver-update 2012: a WFUMB-EFSUMB initiative in cooperation with representatives of AFSUMB, AIUM, ASUM, FLAUS and ICUS [J]. Ultraschall Med, 2013, 34(1): 11-29.
[10] WANG W, CHEN L D, LU M D, et al. Contrastenhanced ultrasound features of histologically proven focal nodular hyperplasia: diagnostic performance compared with contrast-enhanced CT [J]. Eur Radiol, 2013, 23(9):2546-2554.
[11] JANG H J, YU H, KIM T K. Contrast-enhanced ultrasound in the detection and characterization of liver tumors [J]. Cancer Imaging, 2009, 9: 96-103.
High-frequency contrast-enhanced ultrasound in characterization of small colorectal liver metastases
QIN Si, CHEN Yao, WANG Yimin, WEN Yanling, LIU Guangjian
(Department of Medical Ultrasonics, The Sixth Affiliated Hospital of Sun Yat-Sen University, Guangzhou 510655, Guangdong Province, China)
LIU Guangjian E-mail: guangjian1977@126.com
Objective: To investigate the value of ultrasound (US) and contrast-enhanced ultrasound (CEUS) using highfrequency linear probe in the characterization of small colorectal liver metastases (CRLMs). Methods: A total of 85 patients with final diagnosis of CRLMs were included in this study. A total of 156 small CRLMs [(7.40±1.90) mm in diameter] were investigated. Logiq E9 (GE Healthcare, USA) equipped with a convex probe (C1-5) and a linear probe (9L) was used. The convex and linear probes were used for US and CEUS, respectively. Senior and junior radiologists separately reviewed all the images and made the final diagnosis. Results: The diagnostic value of US and CEUS using high-frequency linear probe were slightly superior to those using convex probe. Senior radiologist’s diagnostic ability was better than junior radiologist, especially when using convex probe (P<0.05). High-frequency US and CEUS helped to improve the observe agreement in lesion boundary, halo sign, enhancement level and pattern (boundary Kappa: 0.928vs.0.860; halo sign Kappa: 0.909vs.0.816; enhancement level Kappa: 0.714vs.0.572; enhancement pattern Kappa: 0.893vs.0.600). High-frequency linear probe helped to improve the diagnostic consistency of two radiologists (US Kappa: 0.628vs.0.479; CEUS Kappa: 0.658vs.0.363). Conclusion: US and CEUS using high-frequency linear probe could depict thesmall CRLMs in high spatial resolution and high contrast, which may help to improve the characterization of small CRLMs and the diagnostic consistency of radiologists with different levels of experience.
Contrast-enhanced ultrasound; High-frequency ultrasound; Colorectal cancer; Liver metastasis; Diagnosis
R445.1
A
1008-617X(2017)01-0012-06
2017-02-11)
刘广健 E-mail:guangjian1977@126.com
