入侵植物喜旱莲子草和本地种接骨草光合生理特征对增温响应的差异
2017-04-10王琼,唐娅,谢涛,王辉
王 琼,唐 娅,谢 涛,王 辉
1 西南野生动植物资源保护教育部重点实验室(西华师范大学),南充 637009 2 西华师范大学生命科学学院, 南充 637009 3 西华师范大学环境科学与工程学院, 南充 637009
入侵植物喜旱莲子草和本地种接骨草光合生理特征对增温响应的差异
王 琼1,2,*,唐 娅3,谢 涛2,王 辉2
1 西南野生动植物资源保护教育部重点实验室(西华师范大学),南充 637009 2 西华师范大学生命科学学院, 南充 637009 3 西华师范大学环境科学与工程学院, 南充 637009
利用红外加热器模拟增温,比较入侵植物喜旱莲子草和本地种接骨草的光合特性对增温响应的差异,以预测气候变暖背景下入侵植物的入侵潜力,并为筛选替代控制植物提供依据。结果表明:增温导致喜旱莲子草和接骨草的叶绿素a/b值分别比对照显著提高6.21%和降低5.55%。无论增温与否,接骨草的叶绿素b含量显著高于喜旱莲子草,而叶绿素a/b值则相反。增温导致喜旱莲子草净光合速率显著提高9.23%,由于气孔导度增大引起蒸腾速率大幅度增加,使得其水分利用效率比对照显著降低10.64%。增温仅导致接骨草的气孔导度显著增加10.95%,而对其他气体交换特征无显著影响。对照条件下,尽管接骨草的气孔导度和胞间 CO2浓度分别显著低于喜旱莲子草7.03%和4.57%,但是前者的净光合速率和水分利用效率分别显著高于后者10.30%和11.92%。增温条件下,两种植物的净光合速率和气孔导度无显著差异,由于接骨草的蒸腾速率显著低于喜旱莲子草18.02%,故其水分利用效率显著高于后者26.45%。增温、物种及其两者的交互作用对光补偿点、光饱和点、最大净光合速率、暗呼吸速率和初始量子效率等光响应参数影响均不显著。总之,对照条件下,接骨草凭借较高的叶绿素b含量、净光合速率和水分利用效率,比喜旱莲子草具有更强的光合能力。但增温后,接骨草的光合优势被削弱。研究从光合生理角度证明接骨草有望作为喜旱莲子草的替代控制植物,但是未来气候变化背景下喜旱莲子草的入侵潜力可能增强。
外来入侵植物;增温;光合色素含量;气体交换特征;光合-光响应曲线;替代控制
Distinctive responses of photosynthetic characteristics to warming of invasive
生物入侵严重威胁着群落的生物多样性和生态系统的稳定性[1-2],由此造成了巨大的经济损失和生态后果[3-4]。大量研究表明,全球气候变暖会加剧外来种入侵[5-7],因为气温升高通过影响物种间的相互作用,打破外来种与本地种的竞争平衡[8-10]。选择竞争能力强的本地种对入侵种进行替代控制,是入侵生境生态恢复的一种有效措施[11-12]。目前,替代控制研究主要集中于筛选竞争能力强的本地种,揭示其竞争机制等方面[13-14]。由于入侵种和本地种对气候变暖响应的差异,改变了两者的竞争能力[15],因而可能影响本地种替代控制的效果。
喜旱莲子草(Alternantheraphiloxeroides(Mart.)Griseb)原产南美洲,入侵多个国家[16-17],是一种经济和环境危害极其严重的恶性杂草[18]。2003年名列国家环保总局公布的“中国第一批外来入侵物种名单”[19]。增温将促进该植物入侵[20-21],而替代控制在该植物防控方面具有广泛的应用前景[11,13,22 ]。野外调查发现,本地种接骨草(SambucuschinensisLindl.)能抑制喜旱莲子草生长;盆栽竞争实验也证实了这一点[23]。因此,接骨草有望成为喜旱莲子草替代控制的好材料,但是这两种植物的竞争机制及其增温后替代控制的效果仍不明了。
综上,本文通过红外加热器模拟增温,比较了上述两种植物的光合色素含量、气体交换特征和光响应参数对增温响应的差异,以探讨外来入侵植物与本地种竞争的机制,预测未来气候条件下该入侵植物的入侵趋势,并为全面评估替代控制的效果提供有意义的参考。
1 材料与方法
1.1 研究区域
本实验地点位于西华师范大学生命科学学院试验基地(106.02° E,30.23° N,276 m)。该地区属于亚热带湿润季风气候,年平均气温17.4 ℃,年平均降雨量1021 mm,年无霜期300 d 左右。土壤为红棕紫泥[24]。
1.2 实验设计
2010年3月下旬,将取自试验基地附近的砂土和粘土均匀混合,去除石子和植物根系等杂质后装入塑料花盆,花盆上口径为30 cm。供试植物喜旱莲子草和接骨草均采自西华师范大学新校区附近的西河岸边。接骨草选用约10 cm高的实生苗,喜旱莲子草截取约10 cm长的匍匐茎顶端,每盆栽种1株植物,共计60盆。将栽有实验植株的花盆摆放于2个2 m × 1.8 m的小区中,每小区5 × 6盆。其中,1个小区为增温小区,另1个为不增温小区即对照。进行增温处理的小区,红外辐射加热器(HS-2420, Kalglo Electronics, Bethlehem,USA)悬挂于第3排和第4排花盆之间上方,距离花盆上口1.8 m,为了避免红外加热器直射对实验植株产生不良影响,第3排和第4排花盆的间距设为20 cm。实验期间,适时除草、浇水和施肥,确保植株正常生长。
1.3 光合色素含量的测定
2010年10月中旬,测定两种增温处理下每种植物的光合色素含量,5次重复。取茎顶端第二片完全展开的叶片放入冰盒带回实验室备用。具体操作如下:取新鲜叶片,剪去粗大的叶脉并剪成细丝,称取0.200 g放入10 mL离心管中,用移液枪加10 mL 80%丙酮于离心管内。加盖,避光保存,待叶片全部浸泡发白后,摇匀静置,用APL-754N型紫外可见分光光度仪(上海奥普勒仪器有限公司)分别在663 nm、646 nm和470 nm处测定提取液的吸光度。根据Lichtenthaler和Wellburn对Arnon的修正公式[25],计算叶绿素a、叶绿素b以及类胡萝卜素等的浓度。最后,根据稀释倍数和叶片鲜重计算各类光合色素的含量。
1.4 气体交换特征和光合—光响应曲线的测定
2010年10月3日— 9日晴天上午9:00 —11:30,采用Li-6400便携式光合作用系统(LI-COR,Lincoln,Nebraska,USA),人工控制叶室内CO2浓度为380 μmol/mol,温度为24 —25 ℃,空气相对湿度为50%—60%,使用开放式气路,用红蓝光源设定光强梯度为2 000、1 800、1 600、1 400、1 200、1 000、800、600、400、300、200、150、100、80、50、30、0 μmol m-2s-1,测定净光合速率Pn、气孔导度Gs、胞间CO2浓度Ci、蒸腾速率Tr。对每种处理的每种植物,各随机选择5—7株健壮植株上的一片完好叶片进行测定。为了避免单一光强下的气体交换特征不具有代表性,本研究中用测定光合光响应曲线时获得的数据进行气体交换特征的比较。瞬时水分利用效率WUE= 净光合速率/蒸腾速率,气孔限制值Ls= 1-Ci/Ca(环境CO2浓度)。
用直角双曲线修正模型对光响应曲线进行拟合,该模型可以直接估算植物的饱和光强和最大净光合速率,与实测值最为接近,且适用于有光抑制现象的光响应曲线[26-27]。并根据模型计算光补偿点、光饱和点、最大净光合速率、暗呼吸速率和初始量子效率。
1.5 空气温度的监测
增温从2010年6月20日开始,10月31日结束。期间,分别在对照和增温小区的第2和第5排花盆中间位置安装温度传感器(DS1921G-F5,Maxim/Dallas Semiconductor Inc.,USA),每小时监测并记录空气温度。温度传感器安装于距离地面50 cm 高处。
1.6 数据统计与分析
所有数据用SPSS17.0软件进行统计分析。分别对光合色素含量、光响应参数进行双因素方差分析(Two-way ANOVA),以检验增温(W)和物种(S)及其交互作用(W×S)对各指标影响的显著性。用单因素方差分析(One-way ANOVA)检验4种实验处理间平均值差异的显著性,若差异显著,再用S-N-K法进行多重比较。同一种植物两种增温处理之间、同一增温处理两种植物之间气体交换特征差异的显著性,对照组和增温组空气日平均温度差异的显著性均采用配对样本t检验。两种植物或两种增温处理之间指标的比较采用独立样本的t检验。
2 结果与分析
2.1 红外加热器的增温效应
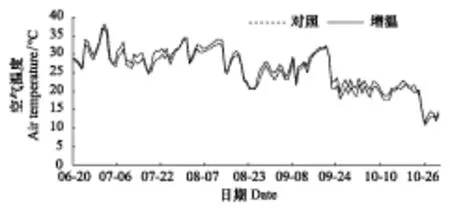
图1 2010年6月20日—10月31日对照组与增温组的空气日平均温度变化Fig.1 Variation of daily mean air temperature from June 20 to October 31, 2010 in the control and warming groups
模拟增温期间,对照组空气日平均温度为(25.53±5.70) ℃,温度变幅10.63—37.79 ℃;增温组空气日平均温度为(26.28±5.28) ℃,温度变幅11.40—36.17 ℃。配对样本t检验表明,增温组空气日平均温度比对照组显著提高(0.76±0.10) ℃(t= 7.752,P< 0.001)(图1)。
2.2 光合色素含量
不论增温与否,接骨草的叶绿素b含量显著高于喜旱莲子草,而叶绿素a/b则相反。接骨草对照和增温条件下的叶绿素b含量分别比喜旱莲子草高 43.10% (t=5.999,P<0.001)和30.61% (t=3.208,P<0.05),而叶绿素a/b分别比后者低17.02% (t=12.032,P<0.001)和26.21% (t=17.463,P<0.001)(图2)。
双因素方差分析表明,独立增温对两种植物所有光合色素指标影响均不显著。
增温和物种的交互作用仅对叶绿素a/b影响显著。增温使喜旱莲子草叶绿素a/b比对照显著升高6.21% (t=4.209,P<0.01),而使接骨草的相应值比对照显著降低5.55% (t=2.993,P<0.05)。增温与物种的交互作用对其它3个光合色素指标影响均不显著(图2)。

图2 增温对喜旱莲子草和接骨草光合色素含量的影响Fig.2 Effects of warming on photosynthetic pigment content of A. philoxeroides and S. chinensis每个图中,不同小写字母表示不同处理间平均值差异显著(P<0.05);W: 增温效应; S: 物种效应; W×S: 增温与物种的交互效应;显著度水平;NS: 无显著影响; * P<0.05; ** P<0.01; *** P <0.001
2.3 气体交换特征
接骨草与喜旱莲子草在气体交换特征方面的差异因增温处理而异。对照条件下,接骨草的净光合速率、气孔限制值和水分利用效率分别显著高于喜旱莲子草10.30%、14.93%和11.92%(t=6.198,P<0.001;t=5.983,P<0.001;t=2.826,P<0.05),而前者的气孔导度和胞间CO2浓度分别显著低于后者7.03%和4.57%(t=2.235,P<0.05;t= 6.166,P<0.001)。增温条件下,两种植物的净光合速率和气孔导度无显著差异,但是接骨草的气孔限制值和水分利用效率分别显著高于喜旱莲子草15.35%和 26.45%(t=5.148,P<0.001;t=6.968,P<0.001),前者的胞间CO2浓度和蒸腾速率显著低于后者4.30% 和 18.02%(t=5.237,P< 0.001;t=6.065,P<0.001)(图3) 。
配对样本t检验表明,增温分别显著提高喜旱莲子草的净光合速率、气孔导度、蒸腾速率9.23%、11.10% 和21.46%(t=3.261,P<0.01;t= 2.641,P<0.05;t=7.399,P<0.001),相反显著降低其水分利用效率10.64%(t=2.968,P<0.01)。相比而言,增温仅使接骨草气孔导度显著增加10.95%(t=8.398,P<0.001),而对其它5个气体交换特征无显著影响(P> 0.05)(图3)。

图3 增温对喜旱莲子草和接骨草气体交换特征的影响Fig.3 Effects of warming on gas exchange characteristics of A. philoxeroides and S. chinensis
2.4 光响应参数
双因素方差分析表明,增温、物种以及两者的交互作用对光补偿点、光饱和点、最大净光合速率、暗呼吸速率和初始量子效率影响均不显著。但是,两个独立样本的t检验表明,增温使接骨草的初始量子效率显著高于喜旱莲子草26.98%(t= 2.710,P<0.05)(表1)。

表1 喜旱莲子草和接骨草在增温条件下的光响应曲线参数
每一行中,不同小写字母表示不同处理间平均值差异显著(P< 0.05)
3 讨论
气候变化影响着植物的生理和生长,入侵种和本地种对增温响应的差异,改变了两者的竞争平衡[15],最终影响外来种的入侵潜力和本地种替代控制的效果。本文通过红外加热器模拟增温,从光合生理角度揭示了本地种接骨草替代控制入侵种喜旱莲子草的机制,并预测在未来气候变化背景下其替代控制的效果。研究发现,接骨草的光合能力强于喜旱莲子草,特别是在不增温条件下。但是,增温显著提高了喜旱莲子草的净光合速率,气候变暖背景下,接骨草替代控制的效果可能会降低。
3.1 两种植物光合能力的比较
光合作用是植物最重要的基础生理活动。通常认为,外来入侵植物比本地种拥有更强的光合能力[28-30]。但是本研究中,本地种接骨草叶绿素b相对含量、净光合速率、水分利用效率、初始量子效率显著高于喜旱莲子草,表现出较强的光合能力和较高的资源利用效率。这也许是接骨草抑制喜旱莲子草生长的重要原因之一。接骨草净光合速率高要归功于较高的叶绿素b 含量和初始量子效率(图2,表1),较多的叶绿素b增强了对光能的捕获[31];初始量子效率高则有利于把光能转化为净能量[27]。同时,由于接骨草气孔导度低,蒸腾速率相应较弱,因而其水分利用效率较高(图3)。
增温改变了两种植物光合生理特征的对比关系。增温条件下,接骨草的水分利用效率仍然显著高于喜旱莲子草,这要归因于两者在净光合速率无显著差异的条件下,接骨草具有较低的蒸腾速率(图3)。说明接骨草在增温引起的水分亏缺状态下具有较高的节约用水的能力。增温削弱接骨草净光合速率的优势,这也解释了接骨草在增温条件下为什么生长没有被促进[23]。Verlinden和 Nijs也发现,增温限制了本地种而不是外来种的生长[8]。
3.2 两种植物光合特征对增温响应的差异
温度是影响植物光合生理最重要的生态因子之一。温度升高一定程度上提高了酶的活性,从而促进叶绿素合成[32]。本研究中,增温显著提高了喜旱莲子草叶绿素a/b值,而降低了接骨草的相应值(图2)。叶绿素a/b值反映了植物对弱光环境的适应[31]。本研究表明增温后,喜旱莲子草更能适应强光的环境,而接骨草则更能适应林下等弱光环境。由此推测,气候变暖背景下,接骨草在林下等弱光生境竞争能力可能强于喜旱莲子草。
增温可以通过影响气孔限制因素和非气孔限制因素影响光合速率[33]。本研究中,增温导致喜旱莲子草净光合速率升高,气孔限制因素方面:增温促进气孔开放(图3),胞间CO2浓度增加,为光合作用提供更多的原料;非气孔限制因素方面:适度的增温提高了光合作用关键酶的活性,如Rubisco活性增强[34],从而促进了光合作用。同时,类似于其他植物[35],喜旱莲子草也可能通过下调呼吸速率适应增温的环境。当然,增温对入侵植物光合作用的促进作用具有物种特异性[36]。增温在促进喜旱莲子草光合作用的同时,气孔导度增加伴随蒸腾速率的大幅度提高,最终导致水分利用效率降低。接骨草气体交换特征对增温的响应格局与喜旱莲子草不同。增温后,尽管接骨草的气孔导度显著增加,但其净光合速率无显著变化,推测与非气孔限制有关[37]。上述结果说明,喜旱莲子草的光合生理对增温的耐受性较本地种接骨草高,这与入侵植物具有宽的生理生态位是一致的[38]。同时,两种植物对增温响应的差异与喜旱莲子草喜光[39],接骨草耐阴[40]的生物学特性密切相关。
3.3 对替代控制的启示
喜旱莲子草是一种水陆两栖的多年生克隆植物,生长快,繁殖强, 危害重[19],替代控制是防治其入侵的有效方法之一。与物理和化学控制方法相比,该方法具有安全、经济、环保和可持续等优点[12]。有研究认为入侵种比本地种具有更强的竞争能力,用本地种控制入侵种不可行,可用竞争能力更强的入侵种如葎草(Humulusscandens)抑制喜旱莲子草生长[11],尽管防控效果较好,但它毕竟是一种入侵植物,用其进行替代控制仍然存在较大的风险。在我国,喜旱莲子草主要以克隆生长产生后代,因而在局部呈集群分布,可选择生长型与之类似的本地种,如扁穗牛鞭草(Hemarthriacompressa(Linn. f.)R. Br.)进行替代控制。但是,在集群条件下喜旱莲子草比牛鞭草更容易逃离拥挤的环境,因而降低了替代控制的效果[13]。本地种接骨草具有较高的药用、食用和观赏等价值,既能进行有性生殖又能通过根茎进行克隆繁殖[41],不论从地上和地下生长[23],还是从光合生理角度看,均表明接骨草是喜旱莲子草替代控制的理想材料,有利于实现生态和经济效益的双赢。
总之,本地种接骨草的光合能力比入侵种喜旱莲子草更强,这要归功于较高的叶绿素b、净光合速率和水分利用效率。本研究从光合生理角度再次证实,接骨草有望作为喜旱莲子草的替代控制植物。增温后,喜旱莲子草净光合速率的增加,可能会促进其入侵。所以,气候变暖背景下,要特别加强该入侵植物的监测和防控。本研究增温幅度较低,且属于短期增温,未来需要开展长期深入地跟踪研究,以期更全面、准确地评估喜旱莲子草的入侵潜力和本地种替代控制的效果。
致谢:西华师范大学周松月、聂中香等同学,陈兰英女士,胥晓教授给予支持帮助,澳大利亚西澳大学植物生物学系何新华副教授帮助写作,特此致谢。
[1] Mack R N, Simberloff D, Lonsdale W M, Evans H, Clout M, Bazzaz F A. Biotic invasions: causes, epidemiology, global consequences, and control. Ecological Applications, 2000, 10(3): 689-710.
[2] Powell K I, Chase J M, Knight T M. Invasive plants have scale-dependent effects on diversity by altering species-area relationships. Science, 2013, 339(6117): 316-318.
[3] Pimentel D, Zuniga R, Morrison D. Update on the environmental and economic costs associated with alien-invasive species in the United States. Ecological Economics, 2005, 52(3): 273-288.
[4] Xu H G, Ding H, Li M Y, Qiang S, Guo J Y, Han Z M, Huang Z G, Sun H Y, He S P, Wu H R, Wan F H. The distribution and economic losses of alien species invasion to China. Biological Invasions, 2006, 8(7): 1495-1500.
[5] He W M, Li J J, Peng P H. A congeneric comparison shows that experimental warming enhances the growth of invasiveEupatoriumadenophorum. PLoS One, 2012, 7(4): e35681.
[6] Sandel B, Dangremond E M. Climate change and the invasion of California by grasses. Global Change Biology, 2012, 18(1): 277-289.
[7] Lu X M, Siemann E, Wei H, Shao X, Ding J Q. Effects of warming and nitrogen on above- and below-ground herbivory of an exotic invasive plant and its native congener. Biological Invasions, 2015, 17(10): 2881-2892.
[8] Verlinden M, Nijs I. Alien plant species favoured over congeneric natives under experimental climate warming in temperate Belgian climate. Biological Invasions, 2010, 12(8): 2777-2787.
[9] Verlinden M, De Boeck H J, Nijs I. Climate warming alters competition between two highly invasive alien plant species and dominant native competitors. Weed Research, 2014, 54(3): 234-244.
[10] 张斯斯. 模拟增温对菊科2种入侵植物繁殖生态学及光合特性的影响[D]. 重庆: 西南大学, 2014.
[11] Cao Y S, Wang T, Xiao Y A, Zhou B. The interspecific competition betweenHumulusscandensandAlternantheraphiloxeroides. Journal of Plant Interactions, 2014, 9(1): 194-199.
[12] Shen S C, Xu G F, Clements D R, Jin G M, Chen A D, Zhang F D, Kato-Noguchi H. Suppression of the invasive plant mile-a-minute (Mikaniamicrantha) by local crop sweet potato (Ipomoeabatatas) by means of higher growth rate and competition for soil nutrients. BMC Ecology, 2015, 15(1): 1-10.
[13] Liao J X, Tao M, Jiang M X. Spatial arrangements affect suppression of invasiveAlternantheraphiloxeroidesby nativeHemarthriacompressa. Acta Oecologica, 2014, 59: 46-51.
[14] Perry L G, Cronin S A, Paschke M W. Native cover crops suppress exotic annuals and favor native perennials in a greenhouse competition experiment. Plant Ecology, 2009, 204(2): 247-259.
[15] Anderson L J, Cipollini D. Gas exchange, growth, and defense responses of invasiveAlliariapetiolata(Brassicaceae) and nativeGeumvernum(Rosaceae) to elevated atmospheric CO2and warm spring temperatures. American Journal of Botany, 2013, 100(8): 1544-1554.
[16] Julien M H, Skarratt B, Maywald G F. Potential geographical distribution of alligator weed and its biological control byAgasicleshygrophila. Journal of Aquatic Plant Management, 1995, 33: 55-60.
[17] Gunasekera L, Bonila J. Alligator weed: tasty vegetable in Australian backyards? Journal of Aquatic Plant Management, 2001, 39: 17-20.
[18] 李振宇, 谢焱. 中国外来入侵种. 北京: 中国林业出版社, 2002: 103-103.
[19] 潘晓云, 耿宇鹏, Sosa A, 张文驹, 李博, 陈家宽. 入侵植物喜旱莲子草——生物学、生态学及管理. 植物分类学报, 2007, 45(6): 884-900.
[20] 褚延梅, 杨健, 李景吉, 彭培好. 三种增温情景对入侵植物空心莲子草形态可塑性的影响. 生态学报, 2014, 34(6): 1411-1417.
[21] Wu H, Carrillo J, Ding J Q. Invasion by alligator weed,Alternantheraphiloxeroides, is associated with decreased species diversity across the latitudinal gradient in China. Journal of Plant Ecology, 2015, doi: 10.1093/jpe/rtv060.
[22] 王颖, 李为花, 李丹, 张震. 喜旱莲子草入侵机制及防治策略研究进展. 浙江农林大学学报, 2015, 32(4): 625-634.
[23] 班芷桦, 王琼. 喜旱莲子草和接骨草竞争对模拟增温的响应. 植物生态学报, 2015, 39(1): 43-51.
[24] 南充市《顺庆区志》编纂委员会. 南充市顺庆区志(1993—2005). 北京: 方志出版社, 2009: 46-48.
[25] Lichtenthaler H K, Wellburn A R. Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents. Biochemical Society Transactions, 1983, 11(5): 591-592.
[26] Ye Z P. A new model for relationship between irradiance and the rate of photosynthesis inOryzasativa. Photosynthetica, 2007, 45(4): 637-640.
[27] 叶子飘. 光合作用对光和CO2响应模型的研究进展. 植物生态学报, 2010, 34(6): 727-740.
[28] McDowell S C L. Photosynthetic characteristics of invasive and noninvasive species of Rubus (Rosaceae). American Journal of Botany, 2002, 89(9): 1431-1438.
[29] Zou J, Rogers W E, Siemann E. Differences in morphological and physiological traits between native and invasive populations ofSapiumsebiferum. Functional Ecology, 2007, 21(4): 721-730.
[30] Wang W B, Wang R F, Lei Y B, Liu C, Han L H, Shi X D, Feng Y L. High resource capture and use efficiency and prolonged growth season contribute to invasiveness ofEupatoriumadenophorum. Plant Ecology, 2013, 214(6): 857-868.
[31] 潘瑞炽. 植物生理学(第四版). 北京: 高等教育出版社, 2001: 93-93.
[32] Yin H J, Liu Q, Lai T. Warming effects on growth and physiology in the seedlings of the two conifersPiceaasperataandAbiesfaxonianaunder two contrasting light conditions. Ecological Research, 2008, 23(2): 459-469.
[33] Ruiz-Vera U M, Siebers M, Gray S B, Drag D W, Rosenthal D M, Kimball B A, Ort D R, Bernacchi C J. Global warming can negate the expected CO2stimulation in photosynthesis and productivity for soybean grown in the Midwestern United States. Plant Physiology, 2013, 162(1): 410-423.
[34] Martinez C A, Bianconi M, Silva L, Approbato A, Lemos M, Santos L, Curtarelli L, Rodrigues A, Mello T, Manchon F. Moderate warming increases PSII performance, antioxidant scavenging systems and biomass production inStylosanthescapitataVogel. Environmental and Experimental Botany, 2014, 102: 58-67.
[35] Slot M, Kitajima K. General patterns of acclimation of leaf respiration to elevated temperatures across biomes and plant types. Oecologia, 2015, 177(3): 885-900.
[36] Verlinden M, Van Kerkhove A, Nijs I. Effects of experimental climate warming and associated soil drought on the competition between three highly invasive West European alien plant species and native counterparts. Plant Ecology, 2013, 214(2): 243-254.
[37] Rosenthal D M, Ruiz-Vera U M, Siebers M H, Gray S B, Bernacchi C J, Ort D R. Biochemical acclimation, stomatal limitation and precipitation patterns underlie decreases in photosynthetic stimulation of soybean (Glycinemax) at elevated [CO2] and temperatures under fully open air field conditions. Plant Science, 2014, 226: 136-146.
[38] Higgins S I, Richardson D M. Invasive plants have broader physiological niches. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(29): 10610-10614.
[39] Longstreth D J, Bolaos J A, Goddard R H. Photosynthetic rate and mesophyll surface area in expanding leaves of Alternanthera philoxeroides grown at two light levels. American Journal of Botany, 1985, 72(1): 14-19.
[40] 董磊磊, 黎云祥, 权秋梅, 范曾丽. 中药接骨草光合生理特性研究. 草地学报, 2013, 21(4): 816-820.
[41] 方建新. 接骨草的开发利用. 中国林副特产, 2007, (6): 85-87.
Alternantheraphiloxeroidesand nativeSambucuschinensis
WANG Qiong1,2,*, TANG Ya3, XIE Tao2, WANG Hui2
1KeyLaboratoryofSouthwestChinaWildlifeResourcesConservation,ChinaWestNormalUniversity,MinistryofEducation,Nanchong637009,China2CollegeofLifeScience,ChinaWestNormalUniversity,Nanchong637009,China3CollegeofEnvironmentalScienceandEngineering,ChinaWestNormalUniversity,Nanchong637009,China
Global climate change could exacerbate biological invasions by changing competitive interactions, and hence, threaten ecosystem biodiversity and stability. Replacement control, which relies on the growth advantage of native plants, is one of the most effective methods to suppress invasion. In the present study, distinctive photosynthetic responses to warming of invasive (Alternantheraphiloxeroides) and native (Sambucuschinensis) plants were compared to determine the invasive potential of alien plants, and to screen native species for replacement control under climate change scenarios. Plants were grown in two different air temperatures (unwarmed or ambient temperature and warmed at (0.76±0.10)℃ by using an infrared heater) for a 5-month short-term period, and photosynthetic pigment concentrations and gas exchange characteristics were determined. The results showed that warming significantly and positively improved the chlorophyll a/b ratio by 6.21% inA.philoxeroides(P<0.01), but negatively by 5.55% inS.chinensis(P<0.05). Meanwhile, chlorophyll b, rather than both chlorophyll a and carotenoid, was significantly higher inS.chinensisthan inA.philoxeroides, at ambient (P<0.001) and increased temperatures (P<0.05). Increased temperatures significantly increased the net photosynthetic rate by 9.23% inA.philoxeroides(P<0.01), but decreased the water use efficiency by 10.64% (P<0.01) due to a respective increase in stomatal conductance by 11.10% (P<0.05) and transpiration rate by 21.46% (P<0.001). In contrast, increased temperatures significantly enhanced stomatal conductance by 10.95% inS.chinensis(P<0.001), but had no effect on other gas exchange traits. Under the control conditions, the stomatal conductance and intercellular CO2concentration were 7.03% (P<0.05) and 4.57% (P<0.001) higher, but the net photosynthetic rate and water use efficiency were 10.30% (P<0.001) and 11.92% (P<0.05) lower inA.philoxeroidesthan inS.chinensis, respectively. However, under increased temperatures no significant differences in net photosynthetic rate and stomatal conductance were observed between the two plant species. In contrast, under increased temperatures, water use efficiency was 26.45% higher inS.chinensisthan inA.philoxeroides(P<0.001), possibly because of lower transpiration rates inS.chinensis. Increased temperatures, species, and their interactions did not have significant effects on photosynthetic-light curve parameters. In general,S.chinensishad a stronger photosynthetic capacity than the invasiveA.philoxeroidesin terms of chlorophyll b content, net photosynthetic rate, and water use efficiency, especially in control conditions. However, the photosynthetic advantage ofS.chinensiswas eliminated with increased temperatures. Collectively, our results suggested thatS.chinensiscould potentially be used in ecological restoration to replaceA.philoxeroidesin invaded habitats.
Alien invasive plant; increased temperatures; photosynthetic pigment content; gas exchange; photosynthetic-light response curve; replacement control
四川省教育厅自然科学重点项目(14ZA0122);西华师范大学博士科研启动基金项目(13E001)
2015- 09- 02;
日期:2016- 06- 13
10.5846/stxb201509021817
*通讯作者Corresponding author.E-mail: wangqiong800@tom.com
王琼,唐娅,谢涛,王辉.入侵植物喜旱莲子草和本地种接骨草光合生理特征对增温响应的差异.生态学报,2017,37(3):770- 777.
Wang Q, Tang Y, Xie T, Wang H.Distinctive responses of photosynthetic characteristics to warming of invasiveAlternantheraphiloxeroidesand nativeSambucuschinensis.Acta Ecologica Sinica,2017,37(3):770- 777.
