谷胱甘肽高产酵母融合子的制备及发酵工艺
2017-04-10钱卫东吴启航刘昱辰毛培宏
钱卫东, 吴启航, 刘昱辰, 王 婷, 毛培宏
(1.陕西科技大学 食品与生物工程学院, 陕西 西安 710021; 2.西北大学 生命科学学院, 陕西 西安 710069; 3.新疆大学 物理科学学院, 新疆 乌鲁木齐 830046)
谷胱甘肽高产酵母融合子的制备及发酵工艺
钱卫东1, 吴启航1, 刘昱辰1, 王 婷2, 毛培宏3
(1.陕西科技大学 食品与生物工程学院, 陕西 西安 710021; 2.西北大学 生命科学学院, 陕西 西安 710069; 3.新疆大学 物理科学学院, 新疆 乌鲁木齐 830046)
为构建谷胱甘肽(glutathione,GSH)高产酵母菌株,本实验利用原生质体融合方法制备多形汉逊酵母和粟酒裂殖酵母融合子,结合自主设计的耐高温、钼酸钠和乙醇耐受性培养基方法高通量筛选酵母融合子,进而利用DTNB法定量测定GSH高产酵母融合子,并分析GSH高产酵母融合子的遗传稳定性,最后对其发酵工艺进行研究.结果表明,本实验利用原生质融合方法成功构建一株GSH产量高、遗传稳定的GSH高产酵母融合子,为低成本、高效生产GSH提供了新途径.
多形汉逊酵母菌; 粟酒裂殖酵母菌; 原生质体融合; 融合子
0 引言
谷胱甘肽(Glutathione,GSH)是一种由谷氨酸、半胱氨酸及甘氨酸组成的活性三肽,几乎存在于生物体的所有细胞中,由于半胱氨酸上所具有的活性基团巯基可与重金属、碘乙酸等毒素相结合,使其具有整合解毒作用,即GSH具有广谱解毒作用[1];此外,GSH还具有抗氧化作用,达到延缓机体衰老的功效.因此,GSH在医药、保健食品和化妆品等行业有着广泛的应用[2].
目前,国内GSH的市场需求量日益增多,但我国GSH几乎完全依赖进口.GSH的生产方法有化学合成法、萃取法、酶法和发酵法[3].其中,发酵生产GSH法因其产量高、生产成本低、易分离、无污染等优点,日益备受国内外学者关注.目前,国外在利用微生物发酵生产GSH的研究水平较高,而国内发酵生产GSH的整体水平与国外相比仍有差距,这归因于缺乏高质量的菌株发酵生产菌株,因此开发性能优良的GSH高产菌株意义明显.目前,用于发酵GSH最常用的菌株主要为酵母菌,其中GSH含量较高的为多形汉逊酵母属、裂殖酵母属、酿酒酵母属和假丝酵母属[4-6].
作为食品级的多形汉逊酵母(Hansenula polymorpha)DL-1因其具有安全性高、培养成本低、耐高温、生长速度快及易高密度发酵等优点,近年来备受关注.加上遗传背景清晰、遗传操作简单的粟酒裂殖酵母也具备优良的GSH生产能力.因此,如何充分整合两株酵母GSH生产性能,进而结合两者清晰的遗传操作背景开展定向分子改良,将为高效生产GSH提供新思路.为此,本实验以多形汉逊酵母菌株DL-1和粟酒裂殖酵母为出发菌株,利用细胞融合技术整合两种酵母优良性能,并结合自主设计的高通量筛选方法,构建GSH高产酵母融合子[7,8].
1 材料与方法
1.1 材料
1.1.1 菌种
多形汉逊酵母(Hansenulapolymorpha,H.polymorpha)DL-1,源于中国工业微生物保藏中心,保藏号为ATCC No.26012;粟酒裂殖酵母(Schizosaccharomycespombe,S.promb)(S.promb2.1794),购自中国科学院微生物研究所.
1.1.2 试剂及仪器
(1)主要试剂: 5,5′-二硫代双(2-硝基苯甲酸)(DTNB)和GSH标准品,来源于Sigma公司;其余试剂均来源于天津市天力化学试剂有限公司;
(2)主要仪器:高速冷冻离心机(sigma)、电热恒温培养箱(上海普度实验设备有限公司)、超净工作台(苏州苏洁净化设备公司)、高压蒸汽灭菌锅(上海赛默生物科技发展有限公司)、紫外可见分光光度计(上海光谱仪器厂).
1.2 方法
1.2.1 酵母融合子的制备
(1)原生质体的制备
分别取多形汉逊酵母和粟酒裂殖酵母种子液200μL,转接于10 mLYPD培养基(1%酵母浸粉,2%蛋白胨,2%葡萄糖,pH7.2)中,37 ℃和28 ℃,140 r/min,培养16~18 h.取新鲜发酵液1 mL,离心后弃上清液,PBS缓冲液洗涤3次,再加入1 mL预处理液(0.05 mol/L EDTA水溶液0.02 mL、β-巯基乙醇0.02 mL溶于PB缓冲液,定容于20 mL),摇匀,30 ℃水浴10 min后,离心后弃上清液,PBS缓冲液洗涤3次,再加入1 mL 2.5%的蜗牛酶溶液,摇匀,35 ℃水浴1 h,离心后弃上清液,PBS缓冲液洗涤3次,最后加入1 mL高渗缓冲液(5.2 g KCl溶于PB缓冲液,定容至100 mL)中得原生质体悬液.
(2)原生质体的融合
取两种原生质体1 mL,紫外灭活3 min,黑暗中保存20 min,将二者混合,2 500 r/min离心10 min,弃上清液,加入1 mL PEG-CaCl2促融剂(PEG6000 8 g、CaCl20.9 g、β-巯基乙醇0.04 mL溶于PB缓冲液,定容至20 mL),震荡摇匀,30 ℃水浴20 min,立即用高渗缓冲液稀释菌体[9].
(3)融合子的筛选
①生长性能筛选:取融合子悬液0.5 mL,涂布于固体蔗糖高渗培养基(1%酵母浸粉,2%蛋白胨,2%葡萄糖,15%蔗糖,2%琼脂粉,pH7.2)上,37 ℃恒温培养24 h,随机挑选生长较快、长势较好的菌株,37 ℃恒温培养48 h.
②耐高温筛选:将基于生长性能筛选获得的初筛菌株,连同作为阳性对照和阴性对照的多形汉逊酵母菌和粟酒裂殖酵母菌,接种于固体蔗糖高渗培养基上,在48 ℃恒温培养48 h,筛选能耐高温的菌株,该实验步骤可达到排除粟酒裂殖酵母,得到酵母融合子和多形汉逊酵母的目的.
③钼酸钠和乙醇耐受性筛选:将生长性能良好、耐高温的融合子,连同作为阴性对照和阳性对照的多形汉逊酵母菌株和粟酒裂殖酵母菌株,将经梯度稀释后的菌液接种于乙醇(4%)选择固体培养基中,37 ℃恒温培养48 h后,转接在钼酸钠(2.5 mmol/L)选择固体培养基中,37 ℃恒温培养48 h,可获得具有钼酸钠和乙醇耐受性的融合子,该实验步骤可实现排除多形汉逊酵母,得到酵母融合子的效果[10,11].
(4)融合子遗传稳定性
将性能优良的GSH高产融合子,接种到液体YPD培养基中,37 ℃,130 r/min,恒温培养,每48 h传一代,连续传8代,依次对每一代进行GSH含量的检测[12].
1.2.2 DTNB方法检测GSH产量
按照参考文献[13]的方法进行操作,分别取融合子、多形汉逊酵母和粟酒裂殖酵母的新鲜发酵液5 mL,离心得上清液和细胞沉淀.上清液用于测定胞外GSH的含量,细胞用于测定胞内GSH的含量,GSH的总含量为二者之和.
细胞干重测定方法为将发酵液离心后,蒸馏水洗涤2~3次,在85 ℃烘干至恒重,称重.在新鲜发酵液离心得到的上清液和菌体细胞经破壁处理后得到的上清液中,分别加入1.5 mL 0.06% NaOH和0.5 mL 0.03%甲醛,摇匀,静止2 min,再加入2.5 mL DTNB分析液(1 mL 0.01 mol/L DTNB溶液与99 ml 0.25 mol/L Tris-Hcl缓冲液混合,pH8.0),摇匀,25 ℃水浴5 min,测412 nm吸光值.再根据吸光度与GSH浓度的关系计算出样品中GSH的含量[14].
1.2.3 酵母融合子的发酵工艺
将酵母融合子接种至YPD培养基中,37 ℃,180 r/min培养18h.取对数增长期的酵母液进行GSH含量测定.
(1)发酵条件的优化
在单因素试验的基础上,设置正交试验,确定最佳组合方式.运用极差分析法对试验数据进行分析处理,确定最佳发酵工艺.选定发酵时间、接种量、碳源(葡萄糖)添加量和氮源(酵母浸粉)添加量为4个考察因素,每个因素分为3个水平,以GSH产量为考察指标,因素水平见表1所示[15].

表1 正交试验因素水平表
(2)培养温度
①恒温发酵试验:温度对微生物的生长及其代谢产物合成有明显影响,本实验设置不同温度(20 ℃、25 ℃、30 ℃、34 ℃、37 ℃、40 ℃、45 ℃、49 ℃)条件下恒温发酵48 h,每隔6 h取样一次,测定细胞干重(DCW)及GSH产量.
②变温发酵试验:由于高温条件对菌体具有一定的胁迫作用,可根据恒温发酵试验结果,设计变温条件,以提高GSH产量.
2 结果与讨论
2.1 培养温度酵母融合子的制备
2.1.1 培养温度高温筛选
由于裂殖酵母的最高耐受温度为46 ℃,而汉逊酵母的最高耐受温度为50 ℃,所以在48 ℃下恒温培养48 h,可去除粟酒裂殖酵母.如图1所示,在48 ℃恒温培养条件下,多形汉逊酵母菌可顺利生长且长势较好,粟酒裂殖酵母菌无法生长,初筛得到的融合子在48 ℃恒温培养条件下能正常生长.

(a)多形汉逊酵母 (b)粟酒裂殖酵母 (c)初筛得到的融合子图1 菌体在48 ℃恒温培养条件下的生长情况
2.1.2 钼酸钠和乙醇抗性筛选
如图2所示,在乙醇和钼酸钠选择固体培养基中,多形汉逊酵母菌和酵母融合子长势均较好,而粟酒裂殖酵母菌均无法生长,可筛出具有乙醇和钼酸钠耐受性的菌株,即可以进一步去除多形汉逊酵母,得到目标GSH高产酵母融合子.
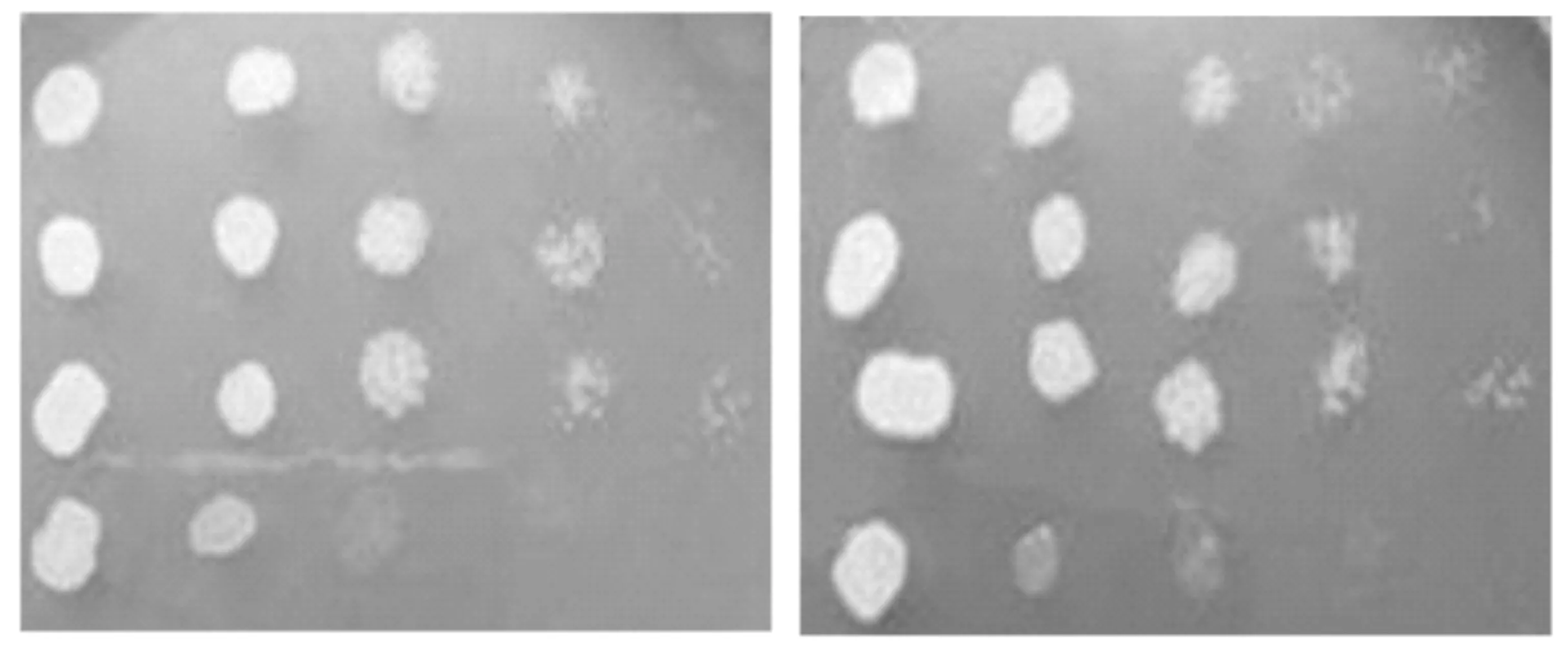
(a)乙醇选择固体培养基 (b)钼酸钠选择固体培养基图2 酵母融合子在选择培养基上的生长情况
2.1.3 DTNB法检测GSH的含量
由表2可知,DTNB法测得35#和67#酵母融合子的GSH产量均高于多形汉逊酵母出发菌株和粟酒裂殖酵母出发菌株.
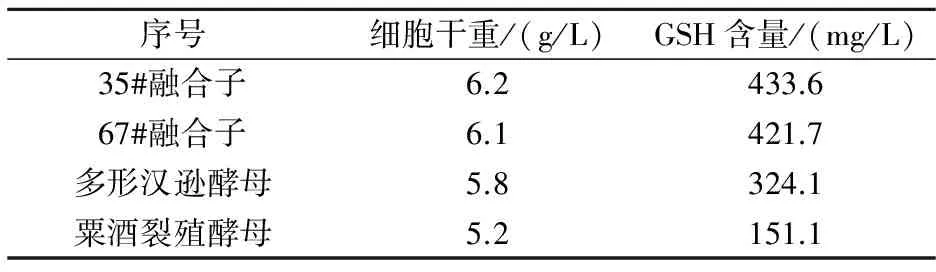
表2 融合子的GSH产量
2.1.4 融合子稳定性分析
从以35# GSH高产融合子为发酵菌株,连续传8代,对每一代进行GSH含量的检测.由图3可知,35#菌株的GSH产量下降大致在10%之内,表明该高产菌株遗传稳定.

图3 GSH高产融合子遗传性
2.2 酵母融合子的发酵工艺研究
2.2.1 正交试验结果
由表3可知,各因素极差顺序为RB>RD>RC>RA,影响因子先后顺序为接种量>酵母浸粉>葡萄糖>接种时间,各因素最佳组合为A2B2C2D3,即接种时间为18 h,接种量为4%,葡萄糖为30 g/L,酵母浸粉为15 g/L.

表3 L9(34)正交试验结果
2.2.2 验证试验
为了验证所得试验结果的准确性,将最佳发酵条件组合A2B2C2D3(接种时间为18 h,接种量为4%,葡萄糖为20 g/L,酵母浸粉为20 g/L)与正交试验中A1B2C2D2(接种时间为17 h,接种量为4%,葡萄糖为20 g/L,酵母浸粉为15 g/L)进行对比验证试验.如表4所示,2种方案对比验证后发现,在最优发酵条件下所得的GSH产量高于正交试验中的2号组合,说明经过正交试验筛选得出的条件组合可信.

表4 对比验证试验结果
2.2.3 培养温度对GSH产量的影响
(1)恒温发酵试验
如图4~5所示,温度对DCW和GSH产量有着一定的影响.由图4可见,当培养温度为30 ℃时,DCW高达到6.2 g/L;从图5可见,当培养温度为37 ℃时,GSH产量高达489.6 mg/L.37 ℃时GSH产量相比于30 ℃时提高了3.69倍,但是,其DCW却下降了56.4%.由此可见,GSH高产酵母融合子的最适生长温度与发酵生产GSH的温度不同,表明可通过变温发酵试验来提高酵母融合子生物合成GSH的能力.
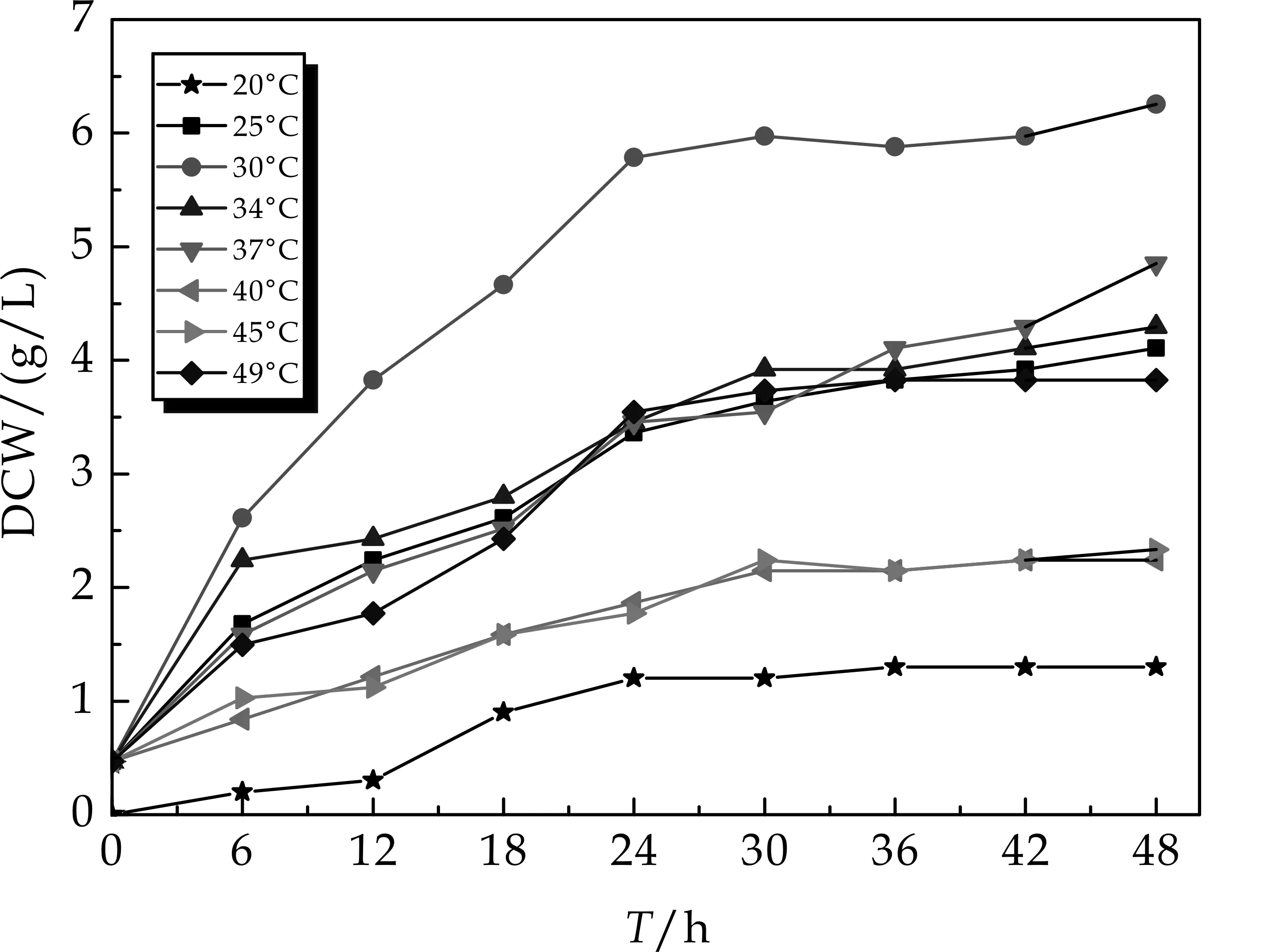
图4 温度对菌体生物量的影响
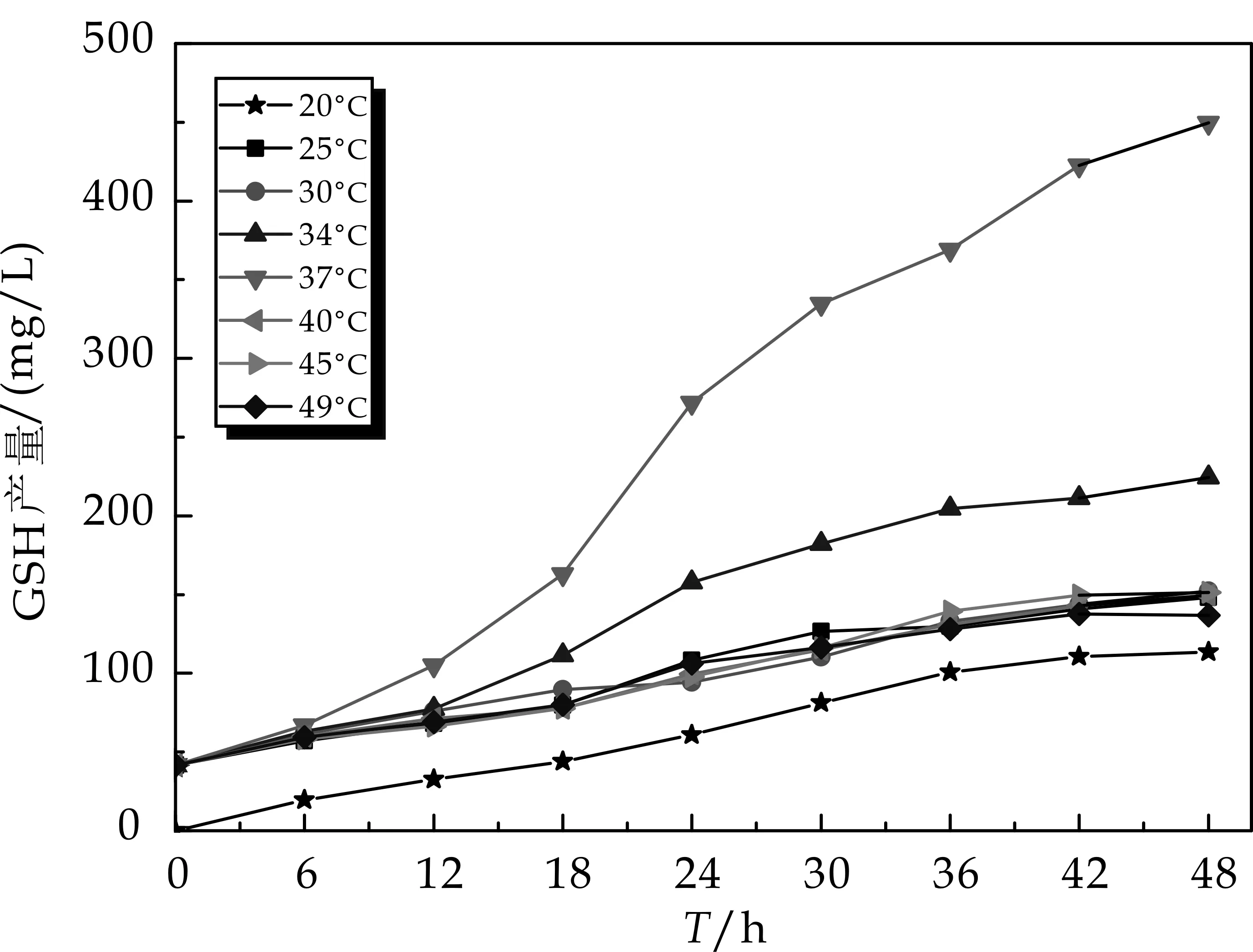
图5 温度对GSH产量的影响
(2)变温发酵试验
由于细胞在高温条件下可受到胁迫作用,且该酵母融合子属于一种耐高渗酵母,当温度升高时,细胞脱水形成高渗环境,这为酵母发酵生产应激产物GSH提供了动力.所以,本实验设计变温发酵试验,将酵母融合子在最适生长温度30 ℃恒温培养24 h,再升温至最适发酵温度37 ℃继续恒温培养24 h.此外,将酵母融合子在最适生长温度30 ℃恒温培养24 h后,再升温至胁迫温度49 ℃恒温培养18 h,再降温至最适发酵温度37 ℃继续恒温培养24 h.如表5所示,结果表明两者变温发酵策略都可以提高GSH产量.

表5 变温发酵后的DCW和GSH的产量
3 结论
该融合子是来源于多形汉逊酵母菌和粟酒裂殖酵母菌,两个亲本在生理生化方面有着一定的差异,但融合子整合了两个亲本的生长性能.
GSH高产酵母融合子的筛选方法主要为耐高温筛选和乙醇、钼酸钠耐受性筛选.在耐高温筛选实验中,由于多形汉逊酵母菌和粟酒裂殖酵母菌的最高耐受温度分别为50 ℃和46 ℃,所以在48 ℃培养时,多形汉逊酵母菌和酵母融合子长势均较好,而粟酒裂殖酵母菌均无法生长.可排除粟酒裂殖酵母菌的存在,说明在耐高温特性上,融合子表现出多形汉逊酵母菌特点,而在乙醇和钼酸钠耐受性筛选实验中,粟酒裂殖酵母可顺利生长,多形汉逊酵母菌无法生长,从而可排除多形汉逊酵母菌的存在,表明在钼酸钠和乙醇耐受性筛选实验中,融合子表现出粟酒裂殖酵母菌生长特性.
从以上的实验结果可以看出,35#和67# 融合子是由多形汉逊酵母菌和粟酒裂殖酵母菌融合得到的.这表明PEG法融合多形汉逊酵母菌和粟酒裂殖酵母菌是行之有效的方法.融合子在生长方面具有多形汉逊酵母菌和粟酒裂殖酵母菌的特性,其遗传物质也来自于两亲本.本实验结果表明利用原生质体融合方法构建的融合子生产GSH的能
力均强于两个亲本,加上其遗传背景清晰、遗传操作简单的特性,这为后续分子定向改良GSH生产性能提供了实践依据.
[1] 袁尔东,郑建仙.功能性食品基料——谷胱甘肽的研究进展[J].食品与发酵工业,1999,25(5):52-57.
[2] 闫慧芳,毛培胜,夏方山.植物抗氧化剂谷胱甘肽研究进展[J].草地学报,2013,21(3):428-434.
[3] 黄景春,梁立冰.还原型谷胱甘肽的生产方法及其应用[J].轻工科技,2013(1):10-12.
[4] 孙金旭.酿酒酵母谷胱甘肽发酵培养基优化研究[J].衡水学院学报,2011,13(1):116-118.
[5] 黎 明,池 娇,张 波,等.高产谷胱甘肽酵母菌筛选及发酵条件研究[J].食品与发酵科技,2013,49(2):10-12.
[6] 聂 敏.发酵法生产谷胱甘肽及其高产策略研究[D].苏州:苏州大学,2010.
[7] 钱卫东,施春阳,王 婷,等.多形汉逊酵母作为细胞工厂的应用研究进展[J].中国畜牧兽医,2012,39(4):55-56.
[8] 刘玉岭,柳云帆,谢建平.粟酒裂殖酵母全基因组中含信号肽蛋白质的研究[J].遗传,2007,29(2):250-256.
[9] 黎永学,张德纯,李代昆.双歧杆菌和酿酒酵母原生质体融合子筛选方法的探讨[J].食品科学,2006,27(2):84-86.
[10] Francesco Mezzetti,Luciana Da Vero,Paolo Giudici.Evolved saccharomyces cerevisiae wine strains with enhanced glutathione production obtained by an evolution-based[J].Fems Yeast Research,2014,14:977-987.
[11] Dorota Grabek Lejko,Olena O Kurylenko,Vladimir A Sibirny,et al.Alcoholic fermentation by wild-type Hansenula polymorpha and saccharomyces cerevisiae versus recombinant strains with an elevated level of intracellular glutathione[J].Journal of Industrial Microbiology & Biotechnology,2011,38(11):1 853-1 859.
[12] 钱卫东,赵德志,付云芳,等.一步重组法构建产龙胆苦苷酵母重组菌的研究[J].陕西科技大学学报(自然科学版),2014,32(5):123-128.
[13] 钱卫东,付云芳.利用变温提高汉逊酵母发酵生产谷胱甘肽的研究[J].食品工业科技,2013,34(6):207-210.
[14] 攀跃平,于健春,余 跃,等.谷胱甘肽的生理意义及其各种测定方法比较、评价[J].中国临床营养杂志,2003,11(2):136-139.
[15] 李 寅,陈 坚,周楠迪,等.环境条件及摇瓶补糖策略对谷胱甘肽发酵的影响[J].生物工程学报,1998,14(2):147-152.
【责任编辑:蒋亚儒】
Preparation and fermentation process of GSH high-yield yeast fusant
QIAN Wei-dong1, WU Qi-hang1, LIU Yu-chen1, WANG Ting2, MAO Pei-hong3
(1.School of Food and Biological Engineering, Shaanxi Unversity of Science & Technology, Xi′an 710021, China; 2.College of Life Sciences, Northwest University, Xi′an 710069, China; 3.School of Physics and Technology, Xinjiang University, Urumqi 830046, China)
To construct glutathione (GSH) high-yield yeast fusant,the fusants were derived from protoplast fusion betweenHansenulapolymorphaandSchizosaccharomycespombeby polyethylene glycol(PEG) fusion method.Based on-high temperature screening was adopted in prescreening,and ethanol and Sodium molybdate culture medium were utilized in second screening.Then GSH content was determined by 5,5′-Dithio bis-(2-nitrobenzoic acid)(DTNB).Finally,the genetic stability of the glutathione (GSH) high-yield yeast fusants was analyzed.One GSH yeast fusant strain high-yield and genetic stability was constructed.Therefore,a breeding strategy based on the protoplast fusion method would be a valuable alternative to improve glutathione production.
Hansenulapolymorpha;Schizosaccharomycespombe; protoplast fusion; fusant
2016-12-11 基金项目:国家自然科学基金项目(11575149); 陕西省科技厅自然科学基础研究计划项目(2016JM3020); 陕西省教育厅专项科研计划项目(15JK1088)
钱卫东(1980-),男,安徽芜湖人,副教授,博士,研究方向:高附加功能性有效成分开发
1000-5811(2017)02-0126-05
R284.1
A
