基于组氨酸与Cu(II)配位作用的凝胶光子晶体传感器研究
2017-04-10张小芳余莉萍
张小芳,余莉萍
(天津大学理学院化学系,天津 300350)
光子晶体是指由2种或2种以上具有不同介电常数(折射率)的材料在空间按照一定的周期性排列所形成的有序结构,其具有光子带隙性质,在光学上遵循Bragg衍射定律[1-6]。智能型水凝胶是聚合物溶胀交联形成的不溶于水的三维网状结构,在受到外部环境刺激时其结构将发生明显变化,表现为其体积的溶胀或收缩[7-8]。凝胶光子晶体是指采用模板填充和原位聚合的方法将胶体晶体嵌入水凝胶中而得到的三维有序结构体系,该体系中光子晶体的特定周期性结构通过水凝胶的交联固化得以稳定存在[9-10]。凝胶光子晶体既具有智能型水凝胶的环境敏感性,又具有光子晶体的光子带隙可调制性[11-12],在物理或化学条件刺激下,凝胶光子晶体的体积溶胀和收缩会引起其光子带隙的变化。人们将不同的功能基团引入到光子晶体中制备出一系列对重金属离子[13-14]、阿托品[15]、葡萄糖[16-17]、蛋白质[18-20]、杀虫剂[21]、兴奋剂[22]、醇类[23-25]、香兰素[26]等物质具有响应性的光子晶体传感器。
铜是人体内第3丰富的过渡金属元素,Cu(II)在人体内的适量存在有益于维持机体的正常工作,若Cu(II)含量过高,会对人体产生毒害作用[27-29]。组氨酸是氨基酸中与金属配位能力最强的氨基酸之一,是含有多个供电子基团(氨基、羧基及侧链咪唑基团)的金属螯合剂,能与多种金属离子如Cu(II)、Ni(II)、Co(II)、Zn(II)等进行配位[30]。利用组氨酸或其衍生物与金属离子之间的配位作用开展研究一直以来都受到研究者的关注[30-35]。
本研究利用Cu(II)与组氨酸的咪唑基团间的较强配位能力,通过将组氨酸固载于凝胶光子晶体基质中,使溶液中的Cu(II)与光子晶体发生作用,引起光子晶体的Bragg衍射峰发生变化。我们利用光纤光谱仪实时在线监测凝胶光子晶体的Bragg衍射峰变化,得到Cu(II)浓度与衍射峰位移之间的函数关系,实现了对Cu(II)的简便定量测定,对进一步研究组氨酸或其衍生物与Cu(II)之间的配位作用具有重要意义。
1 实验部分
1.1 仪器与试剂
JKHQ-D1型光纤光谱仪(波长范围380~1 050 nm,天津津科浩强科技有限公司);FE20K型 pH计(德国梅特勒-托利多公司);BT-125D电子天平(德国赛多利斯科学仪器有限公司);KQ2200B型数控超声波清洗器(昆山市超声仪器有限公司);DZG-4018电热真空干燥箱(天津市天宇实验仪器有限公司);场发射扫描电镜(Nova Nano SEM 430,FEI, 操作电压为5 kV)。
苯乙烯(分析纯,天津市江天化工技术有限公司);丙烯酰胺、丙烯酸、N′N-亚甲基双丙烯酰胺、过硫酸铵、醋酸、醋酸钠、醋酸铜、浓盐酸及硝酸钾(均为分析纯,天津大学科威公司);组氨酸 (分析纯,天津光复公司)。醋酸-醋酸钠缓冲溶液:在0.1 mol·L-1醋酸钠溶液中加入醋酸调节pH值而配制成一系列不同pH值的溶液。
1.2 制备固载有组氨酸的凝胶光子晶体
1.2.1聚苯乙烯胶体晶体模板的制备
先采用乳液聚合法制备出粒径200 nm的单分散聚苯乙烯(PS)微球,再将一定量的PS微球与去离子水以1∶20的体积比加入烧杯中,超声,使PS微球在水中均匀分散。然后,将已经处理过的载玻片(EDGES: 25.4×76.2 mm;THICK: 1.0~1.2 mm)垂直浸入盛有PS微球溶液的烧杯中,置于43 ℃水浴中。随着烧杯中水的挥发, PS微球会在毛细力作用下于载玻片上进行自组装,得到表面平整的PS胶体晶体模板。最后,将其放入80 ℃的烘箱中加热干燥,经自然降温后得到牢固的PS胶体晶体模板。
1.2.2固载组氨酸的凝胶光子晶体的制备
将功能单体丙烯酸(1.5 mL)和丙烯酰胺(2.5 g)、交联剂N′N-亚甲基双丙烯酰胺(0.09 g)、引发剂过硫酸铵(0.09 g)和一定量的组氨酸溶于4 mL去离子水中,超声混匀,然后采用毛细力渗透法将其填充到PS胶体晶体模板中。在50 ℃的烘箱中热引发聚合5 h后,便得到固载组氨酸的凝胶光子晶体。不固载组氨酸的空白凝胶光子晶体的制备方法与之相同。
1.3 凝胶光子晶体传感器的构建
将制备好的固载组氨酸的凝胶光子晶体放在醋酸-醋酸钠缓冲溶液中溶胀活化,用光纤光谱仪监测其Bragg衍射峰。待Bragg衍射峰不再变化时,认为其已达到溶胀平衡,此时波长记为其在空白缓冲溶液中的初始值。测量时,将此凝胶光子晶体从空白缓冲溶液中取出,放入10 mL不同浓度的pH值相同的Cu(II)溶液(用配制好的醋酸-醋酸钠缓冲溶液配制而成)中,待凝胶在溶液中达到新的溶胀平衡后,计算此时波长相对空白缓冲溶液中初始值的位移,记为Δλ。完成每次测量后,需要将凝胶光子晶体置于0.1 mol·L-1稀盐酸溶液中浸泡5 min,取出后用大量去离子水冲洗,使其波长恢复至初始值再进行下一次测量,测量顺序按浓度由低到高。
2 结果与讨论
2.1 凝胶光子晶体形貌分析
利用扫描电镜(SEM)对聚苯乙烯胶体晶体模板及固载组氨酸的凝胶光子晶体的表面微观结构分别进行了表征。如图1所示,采用垂直沉积法制得的PS胶体晶体模板[图1a)]表面结构平整,呈现出结构有序、紧密堆积的三维面心立方结构,固载组氨酸的凝胶光子晶体[图1b)]也具有相同的三维面心立方结构。这表明在聚合物单体填充并热引发聚合过程中,胶体晶体模板结构没有被破坏,并且被很好地固定在凝胶光子晶体中。
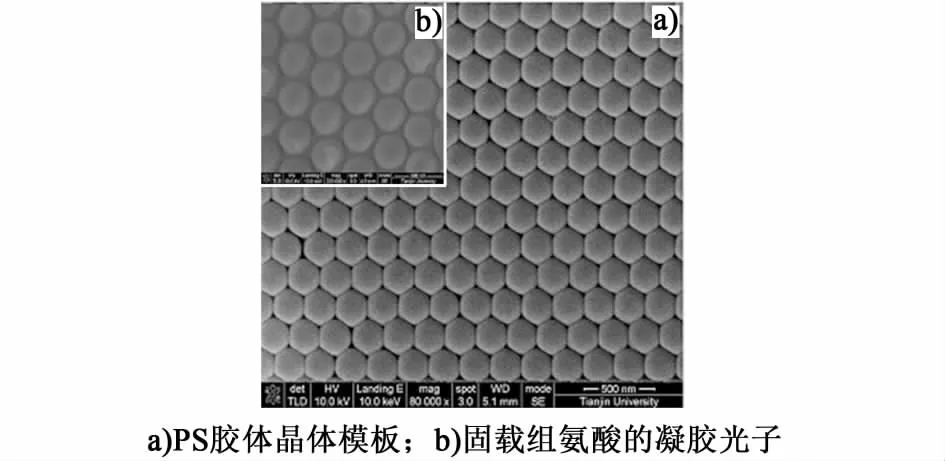
图1 晶体的SEM照片Fig.1 Scanning electron microscopy photographs
2.2 凝胶光子晶体传感性能影响因素研究
2.2.1组氨酸用量的影响
将固载不同含量组氨酸的凝胶光子晶体活化后分别浸于10 mL 10-4mol·L-1Cu(II)溶液(pH=5.5)中,利用光纤光谱仪监测Bragg衍射峰变化。

图2 不同组氨酸含量时凝胶光子晶体的衍射峰位移Fig.2 Diffraction peak shift of hydrogel photonic crystal with different contents of histidine
由图2可以看出,当组氨酸摩尔分数在0~0.08%范围内时,Bragg衍射峰值随着其含量的增加而增大,之后再增加组氨酸含量,衍射峰则保持不变。实验表明凝胶光子晶体中组氨酸摩尔分数为0.08%,溶液中Cu(II)浓度为10-4mol·L-1时,组氨酸和Cu(II)之间的作用位点已经达到饱和,所以衍射峰不再继续发生位移。后续研究中凝胶光子晶体中组氨酸摩尔分数都为0.08%。
2.2.2pH值的影响
溶液pH值不仅影响凝胶光子晶体对金属离子响应的灵敏度,也影响响应的选择性。
我们将凝胶光子晶体浸于不同pH值(3.0~6.0)的缓冲溶液及与其相同pH值的10-4mol·L-1Cu(II)溶液中,考察Bragg衍射峰在2种溶液中的位移与pH值的关系,实验结果如图3所示。
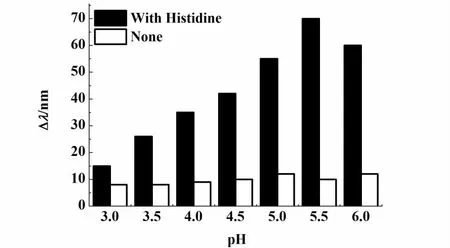
图3 pH值对固载组氨酸以及未固载组氨酸的凝胶光子晶体响应Cu(II)的影响Fig.3 Effect of pH on responsive properties of histidine-immoblized and non-immobilized hydrogel photonic crystal to Cu(II)
当pH值从3.0增加到5.5,凝胶光子晶体的Bragg衍射峰位移值逐渐增大;在pH=5.5时,其衍射峰位移达到最大;继续增加pH值到6.0,其衍射峰位移值开始变小,该结果表明溶液的pH值影响固载组氨酸的凝胶光子晶体对Cu(II)的响应灵敏度,pH=5.5是固载组氨酸的凝胶光子晶体对Cu(II)的最佳响应pH值。我们也考察了同样条件下未固载组氨酸的凝胶光子晶体对Cu(II)响应性。由图3可以看出:未固载组氨酸的凝胶光子晶体在各种pH值下衍射峰位移值基本不变,说明其对Cu(II)基本没有响应。
已有研究表明:Fe(III)与组氨酸的配位作用主要发生在较强酸性条件下,Mn(II)在酸性条件下与组氨酸不发生配位作用;虽然2价的金属离子倾向于在弱酸性条件下与组氨酸配位,但配位选择性大小的顺序为:Cu(II)>Zn(II)>Ni(II)>Co(II),是因为Cu(II)与组氨酸的配位常数最大[30]。另有研究表明:Zn(II)在碱性条件下更容易与组氨酸配位[32-33]。我们在实验中也考察比较了同样pH值下Cu(II)与Zn(II)的响应性,结果表明固载组氨酸的凝胶光子晶体对Cu(II)的响应性大于Zn(II),在pH=5.5下具有最高的选择性。
2.2.3离子强度的影响
在10-5mol·L-1Cu(II)溶液中加入不同浓度硝酸钾,考察了离子强度对凝胶光子晶体响应Cu(II)的影响。由图4可知,当硝酸钾浓度分别为0、10-5、10-4、10-3、10-2、 0.1和1.0 mol·L-1时,凝胶光子晶体衍射峰位移值变化不大,说明硝酸钾浓度在1.0 mol·L-1以下时,离子强度不会影响该凝胶光子晶体对Cu(II)的响应性。
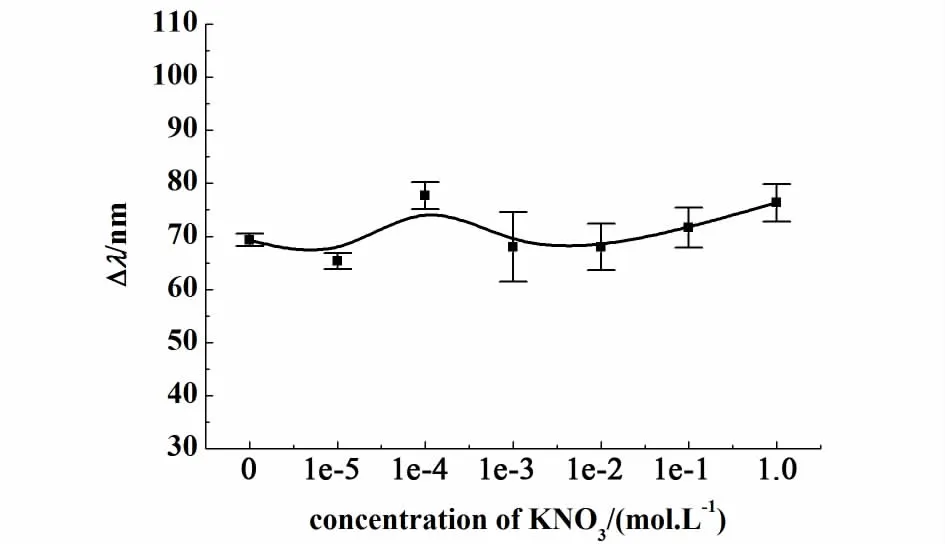
图4 离子强度对凝胶光子晶体响应Cu(II)的影响Fig.4 Effect of ionic strength on hydrogel photonic crystal to Cu(II)
2.3 固载组氨酸的凝胶光子晶体对铜离子的定量传感
将固载组氨酸的凝胶光子晶体依次浸入10 mL pH值为5.5的不同浓度的Cu(II)溶液中,测定其衍射峰位移值。如图5所示,随着Cu(II)浓度从10-9mol·L-1增加到10-5mol·L-1时,凝胶光子晶体衍射峰波长从688 nm逐渐增大到758 nm,再继续增加Cu(II)浓度时,其衍射峰不再发生明显移动,说明当Cu(II)浓度达到10-5mol·L-1时,Cu(II)已在固载组氨酸的凝胶光子晶体表面达到配位平衡。拟合衍射峰位移与金属Cu(II)离子的浓度关系曲线,得到在10-9~10-5mol·L-1浓度范围内,衍射峰位移值Δλ与Cu(II)的浓度对数lgc呈线性关系(图5),其线性方程为Δλ=15.76lgc+147.94,线性相关系数R2=0.99267,此方程可以作为Cu(II)的定量测定依据。
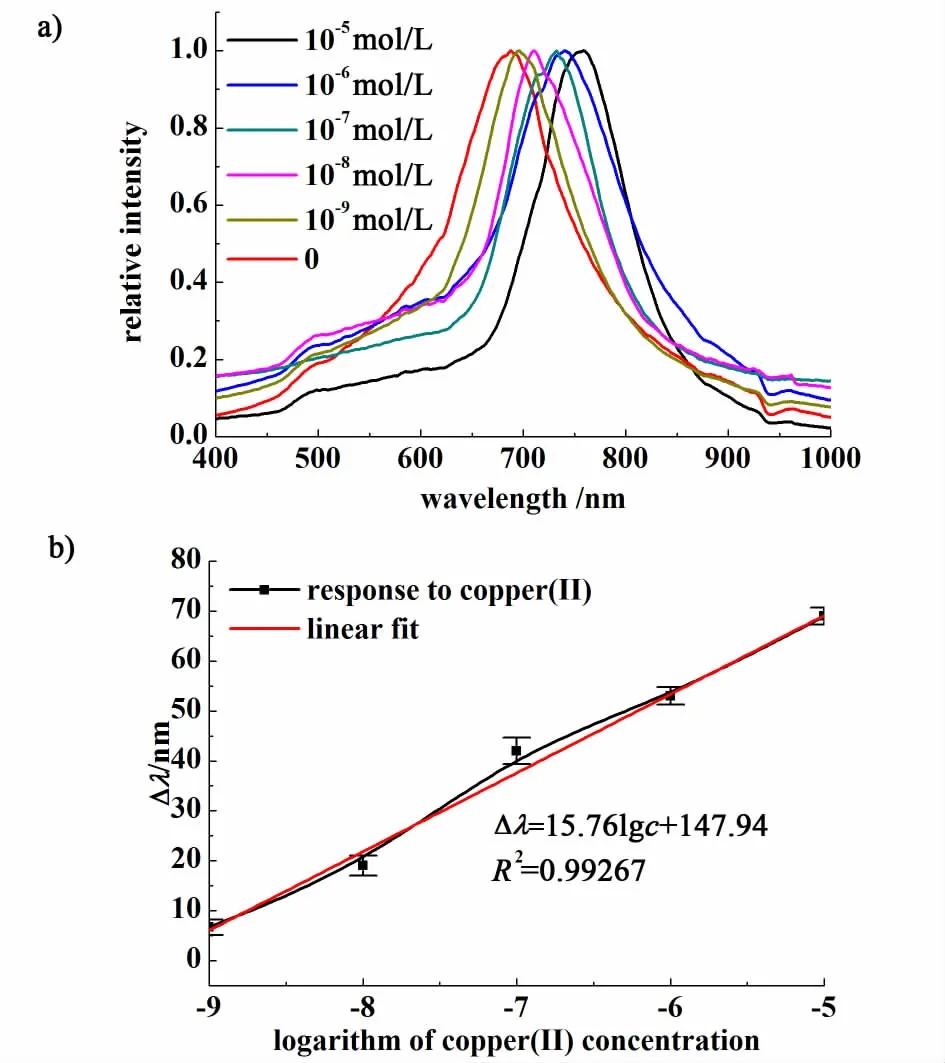
图5 固载组氨酸的凝胶光子晶体在不同浓度Cu(II)溶液中的衍射峰波长变化曲线;衍射峰位移与金属Cu(II)离子的浓度关系曲线Fig.5 Diffraction peaks of responses of hydrogel photonic crystal to Cu(II)with its concentration ranging from 10-9 M to 10-5 M; Liner relationship between logarithm of Cu(II) concentrations and the diffraction peak shift (Δλ)
2.4 响应速度
将固载组氨酸的凝胶光子晶体浸入10 mL pH=5.5的醋酸-醋酸钠缓冲溶液中,待溶胀达到平衡后将其取出放入10 mL同样pH值的10-5mol·L-1的Cu(II)溶液中,每隔1 min记录1次衍射峰值。
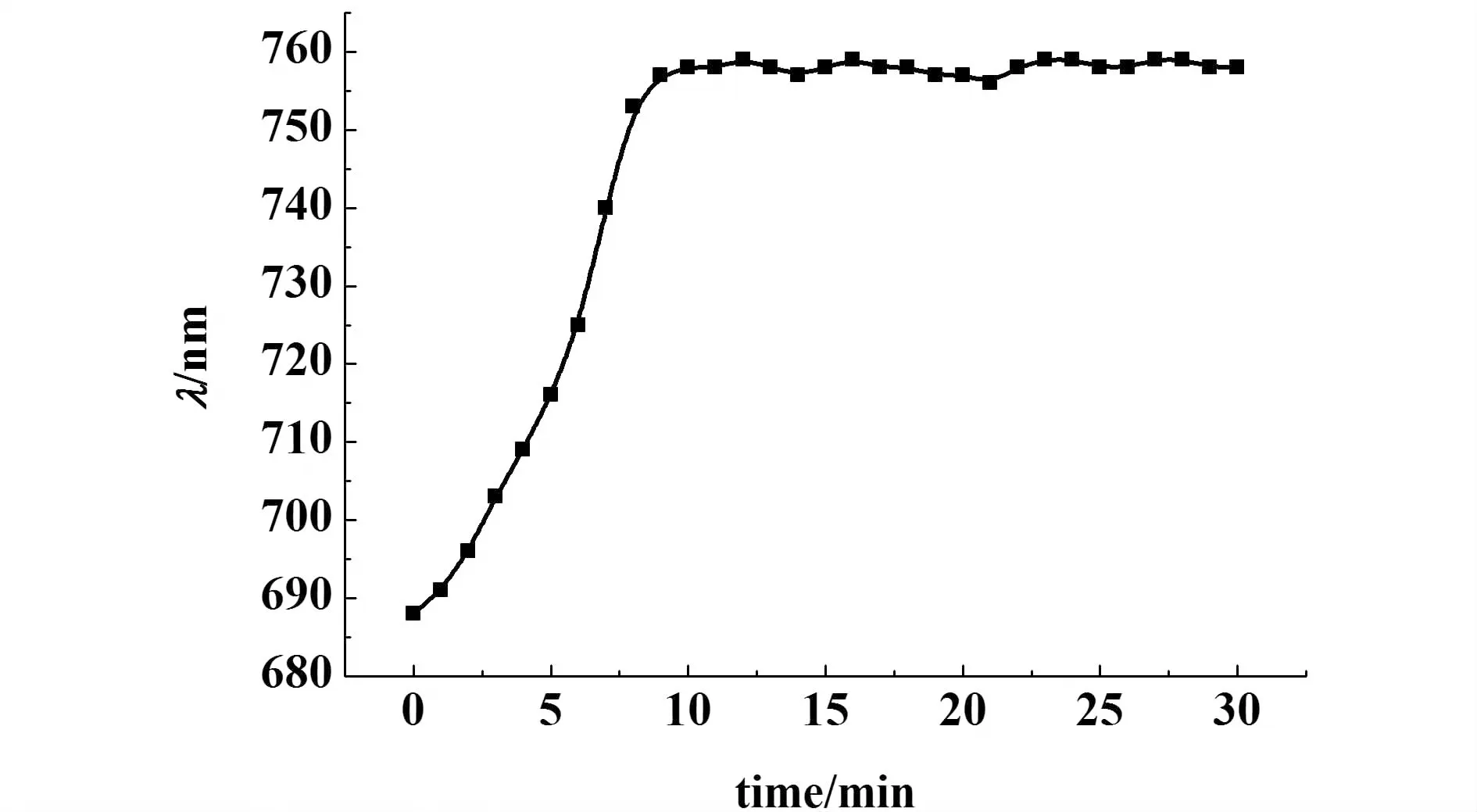
图6 固载组氨酸的凝胶光子晶体对Cu(II)的时间响应曲线Fig.6 Response time of histidine-immoblized hydrogel photonic crystal with Cu(II)
由图6可以看出,10 min以后,凝胶光子晶体衍射峰值不再发生变化,说明固载有组氨酸的凝胶光子晶体对Cu(II)在10 min内已达到响应稳定。文献中,Cu(II)在浸有组氨酸的树脂上达到吸附平衡的时间是24 h[30]。本研究使用的凝胶光子晶体是薄膜状的材料,固载在其中的组氨酸与Cu(II)接触表面积相对较大,所以响应速度较快。
2.5 可逆性研究
考察凝胶光子晶体对Cu(II)响应可逆性时,先将凝胶光子晶体浸入10 mL pH=5.5的10-5mol·L-1Cu(II)溶液中,测得其衍射峰值是758 nm,再将其浸入0.1 mol·L-1盐酸溶液中5 min除掉Cu(II),用大量蒸馏水冲洗后,在缓冲溶液中测得其衍射峰值为688 nm。此过程循环5次的实验结果如图7所示,表明凝胶光子晶体对Cu(II)响应过程具有良好的可逆性,也说明我们的凝胶光子晶体薄膜有很好的机械强度,可以反复多次使用。
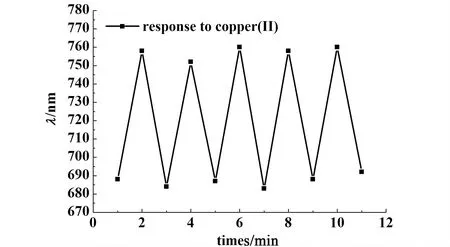
图7 固载组氨酸的凝胶光子晶体响应Cu(II)的可逆性Fig.7 Recoverability for the response of the histidine-immobilized hydrogel photonic crystal to Cu(II)
3 机理探索
在固载过程中,组氨酸分子中的羧基、氨基与凝胶功能单体丙烯酸分子中的羧基形成氢键,保证组氨酸能被稳定地固载到凝胶光子晶体体系中。组氨酸分子中的咪唑基团作为电子供体更容易与具有空轨道的金属离子发生配位作用[31]。在溶液中,Cu(II)与凝胶光子晶体中的咪唑基团在配位力的驱动下发生作用,使凝胶内部渗透压发生改变,引起凝胶体积发生膨胀,导致光子晶体胶体微球间的距离变大,从而使光子晶体的衍射峰发生红移[5,11,14,18]。
4 结论
成功地制备了具有良好溶胀性和响应性的凝胶光子晶体,实现了对Cu(II)的快速简便传感测定。在组氨酸固载量为0.08%(摩尔分数),溶液pH值为5.5,Cu(II)浓度在10-9~10-5mol·L-1范围内时,凝胶光子晶体的衍射峰位移值Δλ与Cu(II)浓度对数lgc呈良好的线性函数关系,可以实现Cu(II)定量分析。
参考文献:
[1]陈义, 李晋成. 光子晶体在分析化学中的应用[J]. 色谱, 2009, 27(5): 573-583
Chen Yi, Li Jincheng. Photonic crystals for analytical chemistry[J]. Chinese Journal of Chromatography, 2009, 27(5): 573-583(in Chinese)
[2]Zong Y, Xia J. Photonic band structure of two-dimensional metal/dielectric photonic crystals[J]. J Phys D: Appl Phys, 2015, 48(35): 355 103-355 110
[3]傅小勤, 郭明, 张晓辉, 等. 光子晶体传感器的研究进展[J]. 材料导报A: 综述篇,2011, 25(2): 57-62
Fu Xiaoqin, Guo Ming, Zhang Xiaohui,etal. Recent development of photonic crystals sensors[J]. Materials Review A:Review Article, 2011, 25(2): 57-62(in Chinese)
[4]段廷蕊, 李海华, 孟子晖, 等. 光子晶体应用于化学及生物传感器的研究进展[J]. 化学通报, 2009, 4: 298-306
DuanTingrui, Li Haihua, Meng Zihui,etal. Application of photonic crystals in chemical and bio-sensors[J]. Chemistry Bulletin, 2009, 4: 298-306(in Chinese)
[5]Ge J, Yin Y. Responsive photonic crystals[J]. Angew Chem Int Ed, 2011, 50(7): 1 492-1 522
[6]Li M, He F, Liao Q,etal. Ultrasensitive DNA detection using photonic crystals[J]. Angew Chem Int Ed, 2008, 47(38): 7 258-7 262
[7]Burnham M R, Turner J N, Szarowski D,etal. Biological functionalization and surface micropatterning of polyacrylamide hydrogels[J]. Biomaterials, 2006, 27(35): 5 883-5 891
[8]Samchenko Y, Ulberg Z, Korotych O. Multipurpose smart hydrogel systems[J]. Adv Colloid Interface Sci, 2011, 168(1/2): 247-262
[9]Zhang R, Wang Y, Yu L. Specific and ultrasensitive ciprofloxacin detection by responsive photonic crystal sensor[J]. J Hazard. Mater, 2014, 280: 46-54
[10]Cai Z, Smith N L, Zhang J,etal. Two-Dimensional photonic crystal chemical and biomolecular sensors[J]. Anal Chem, 2015, 87(10): 5 013-5 025
[11]Alivisatos P. The use of nanocrystals in biological detection[J]. Nat Biotechnol, 2004, 22(1): 47-52
[12]Fenzl C, Hirsch T, Wolfbeis O S. Photonic crystals for chemical sensing and biosensing[J]. Angew Chem Int Ed, 2014, 53(13): 3 318-3 335
[13]Lin F, Yu L. Thiourea functionalized hydrogel photonic crystal sensor for Cd2+detection[J]. Anal Methods, 2012, 4(9): 2 838-2 845
[14]Reese C E, Asher S A. Photonic crystal optrode sensor for detection of Pb2+in high ionic strength environments[J]. Anal Chem, 2003, 75(15): 3 915-3 918
[15]Meng L, Meng P, Tang B,etal. Molecularly imprinted photonic hydrogels for fast screening of atropine in biological samples with high sensitivity[J]. Forensic Sci Int, 2013, 231(1/3): 6-12
[16]Nakayama D, Takeoka Y, Watanabe M,etal. Simple and precise preparation of a porous gel for a colorimetric glucose sensor by a templating technique[J]. Angew Chem Int Ed, 2003, 42(35): 4 197-4 200
[17]Hong X, Peng Y, Bai J,etal. A novel opal closest-packing photonic crystal for naked-eye glucose detection[J]. Small, 2014, 10 (7): 1 308-1 313
[18]MacConaghy K I, Geary C I, Kaar J L,etal. Photonic crystal kinase biosensor[J]. J Am Chem Soc, 2014, 136(19): 6 896-6 899
[19]Xie Z, Zhao Y, Sun L,etal. Photo-Bleaching immunity encoded photonic suspension array for label-free multiplex analysis[J]. Chem Comm, 2009, 45: 7 012-7 014
[20]Choia E, Choib Y, Nejadc Y H P,etal. Label-Free specific detection of immunoglobulin G antibody using nanoporous hydrogel photonic crystals[J]. Sens Actuators, B, 2013, 180: 107-113
[21]Wang X, Mu Z, Liu R,etal. Molecular imprinted photonic crystal hydrogels for the rapid and label-free detection of imidacloprid[J]. Food Chem, 2013, 141(4): 3 947-3 953
[22]Hu X, Li G, Li M,etal. Ultrasensitive specific stimulant assay based on molecularly imprinted photonic hydrogels[J]. Adv Funct Mater, 2008, 18(4): 575-583
[23]Wang F, Zhu Z, Xue M,etal. Cellulose photonic crystal film sensor for alcohols[J]. Sens Actuators B, 2015, 220: 222-226
[24]Sai N, Wu Y, Sun Z,etal. Molecular imprinted opal closest-packing photonic crystals for the detection of trace 17β-estradiol in aqueous solution[J]. Talanta, 2015, 144: 157-162
[25]Li J, Zhang Z, Xu S,etal. Label-Free colorimetric detection of trace cholesterol based on molecularly imprinted photonic hydrogels[J]. J Mater Chem, 2011, 21(48): 19 267-19 274
[26]Peng H, Wang S, Zhang Z,etal. Molecularly imprinted photonic hydrogels as calorimetric sensors for rapid and label-free detection of vanillin[J]. J Agric Food Chem, 2012, 60(8): 1 921-1 928
[27]Gaggelli E, Kozlowski H, Valensin D,etal. Copper homeostasis and neurodegenerative disorders (alzheimer’s, prion, and parkinson’s diseases and amyotrophic lateral sclerosis) [J]. Chem Rev, 2006, 106(6): 1 995-2 044
[28]Deschamps P, Zerrouk N, Nicolis I,etal. Copper(II)/L-glutamine complexation study in solid state and in aqueous solution[J]. Inorg Chim Acta, 2003, 353: 22-34
[29]Løvstad R A. A kinetic study on the distribution of Cu(II)-ions between albumin and transferring[J]. Biometals, 2004, 17(2): 111-113
[30]Oshima T, Ishizaka S, Morizono H,etal. Adsorption behavior of metal ions on alkylhistidine extractant impregnated resins: Effect of functional groups of histidine[J]. Sep Purif Technol, 2013, 114: 11-16
[31]Deschampsa P, Kulkarnia P P, Gautam-Basakb M,etal. The saga of copper(II)-L-histidine[J]. Coord Chem Rev, 2005, 249(9/10): 895-909
[32]Ferrer P, Jimenez-Villacorta F, Rubio-Zuazo J.etal. Environmental influence on Zn-histidine complexes under no-packing conditions[J]. J Phys Chem B, 2014, 118(11): 2 842-2 850
[33]Thirupathi P, Lee K, A ratiometric fluorescent detection of Zn(II) in aqueous solutions using pyrene-appended histidine[J]. Bioorg Med Chem Lett, 2013, 23(24): 6 811-6 815
[34]Weng Y C, Fan F F, Bard A J. Combinatorial biomimetics optimization of a composition of copper(II) poly-L-histidine complex as an electrocatalyst for O2reduction by scanning electrochemical microscopy[J]. J Am Chem Soc, 2005, 127(50): 17 576-17 577
[35]Kurzak B, Kamecka A, Bogusz K,etal. Stabilities and coordination modes of histidine in copper(II) mixed-ligand complexes with ethylenediamine, diethylenetriamine or N,N,N′,N″,N″-pentamethyl diethylenetriamine in aqueous solution[J]. Polyhedron, 2008, 27(13): 2 952-2 958
