沙门氏菌和金黄色葡萄球菌DNA提取方法的比较
2017-04-10肖茜文王艳蕊任大勇
肖茜文,王艳蕊,刘 桐,刘 爽,何 苗,任大勇,陈 萍
(1.吉林农业大学食品科学与工程学院,吉林长春 130118;2.吉林省安信食品技术服务有限责任公司,吉林长春 130012)
沙门氏菌和金黄色葡萄球菌DNA提取方法的比较
肖茜文1,王艳蕊1,刘 桐1,刘 爽1,何 苗2,任大勇1,*陈 萍1
(1.吉林农业大学食品科学与工程学院,吉林长春 130118;2.吉林省安信食品技术服务有限责任公司,吉林长春 130012)
采用水煮法、试剂盒法、改良CTAB法、DNA提取液法及TEX裂解液法提取沙门氏菌和金黄色葡萄球菌基因组DNA,比较5种方法提取的DNA品质,选取适用于农产品中沙门氏菌和金黄色葡萄球菌多重PCR检测的DNA提取方法。结果表明,TEX裂解液法提取的DNA纯度高、操作简单、省时省力、成本低,提取的沙门氏菌基因组DNA纯度为1.88,质量浓度为412.6 ng/μL;金黄色葡萄球菌DNA纯度为1.84,质量浓度为366.7 ng/μL。以TEX裂解液法提取的基因组DNA为模板进行PCR扩增,电泳检测扩增产物有清晰的目的条带。
沙门氏菌;金黄色葡萄球菌;基因组DNA提取
食品安全国家标准规定沙门氏菌和金黄色葡萄球菌是农产品中致病菌检测的常检项目;食品安全国家标准食品中致病菌限量规定,肉制品、粮食制品、即食豆制品、即食果蔬制品(含酱腌菜类)等农产品中沙门氏菌和金黄色葡萄球菌为安全卫生必检项目[1]。为缩短检测周期,农产品中沙门氏菌和金黄色葡萄球菌可应用多重PCR同时检测,在进行PCR检测之前需同时快速高效地提取出品质优良的2种致病菌基因组DNA。
金黄色葡萄球菌细胞壁较厚,不易裂解,有些金黄色葡萄球菌自身还分泌一种耐热核酸酶可降解核酸,使DNA提取难度加大[2]。目前,提取沙门氏菌基因组DNA的方法有很多,但这些方法并不能同时有效地提取金黄色葡萄球菌基因组DNA。为了提高检测效率、简化检测程序、降低检测成本、保证检测正确性,试验就快速有效提取沙门氏菌和金黄色葡萄球菌基因组DNA的方法进行研究比较,进而缩短农产品中沙门氏菌和金黄色葡萄球菌多重PCR检测的时间,便于实际检测。
1 材料与方法
1.1 试验材料
沙门氏菌(Salmonella spp.)ASI1859、金黄色葡萄球菌(Staphylococcus aureus) CMCC21600,吉林农业大学食品安全实验室保藏菌株;沙门氏菌invA基因特异性引物、金黄色葡萄球菌nuc基因特异性引物,由上海生工生物工程技术服务有限公司合成;2×Taq PCR StarMix with Loading Dye,DNA MarkerDL2000、溶菌酶、蛋白酶K等,购自北京鼎国昌盛生物技术有限责任公司。
1.2 主要仪器
722E型紫外可见分光光度计,上海光谱仪器有限公司产品;Red-96G型梯度PCR仪,上海山富科学仪器有限公司产品;DYY-12C型电泳仪,北京市六一仪器厂产品。
1.3 试验方法
1.3.1 菌悬液的制备
从冷冻管中取出100 μL保存菌液放入100 mL营养肉汤中,于37℃条件下过夜培养。将培养后的菌液用无菌生理盐水进行10倍梯度稀释,划平板,于37℃条件下过夜培养。挑取单菌落至100 mL LB培养基中过夜培养。菌液于4℃条件下保存,用于基因组DNA的提取。
1.3.2 细菌基因组DNA提取方法
取沙门氏菌、金黄色葡萄球菌菌液各1 mL加入1.5 mL离心管中,以转速10 000 r/min离心2 min,弃上清液,备用。
(1)水煮法。细菌沉淀用灭菌ddH2O洗涤2次,每次100 μL,离心后弃上清液,用100 μL灭菌ddH2O悬浮沉淀,煮沸15 min后以转速10 000 r/min离心5 min,取上清液作为DNA模板,于-20℃条件下保存[3]。
(2)试剂盒法。使用细菌基因组DNA提取试剂盒(Tiangen),参照说明书的操作步骤完成。
(3)TEX裂解液法。细菌沉淀用90 μL TEX裂解液(20mmol/LTris-HCl,20mmol/LEDTA,1%(V/V)TritonX-100(pH值8.0),加入20 mg/mL溶菌酶)混悬,于37℃条件下孵育30min,再加20mg/mL蛋白酶K 10 μL,于100℃条件下煮沸10 min,离心后取上清液作为DNA模板[4]。
(4)DNA提取液法。细菌沉淀用100 μL DNA提取液(20 mmol/L Tris-HCl,2 mmol/L EDTA,1.2%(V/V)TritonX-100(pH值8.0))混悬,于56℃条件下孵育30 min,后沸水浴10 min,冰上放置10 min;以转速10 000 r/min离心2 min,上清液即为DNA模板[5]。
(5)改良CTAB法。离心后得到细菌沉淀,进行液氮研磨,依次加入10%SDS 30 μL,高盐缓冲液(Tris-Cl 50 mmol/L,pH值8.0;EDTA 10 mmol/L;NaCl 0.7 mol/L;CTAB 1.5%)150 μL,80 μL CTAB/ NaCl,并分装到1.5 mL的离心管中,于60℃条件下水浴40min;加入等体积的酚∶氯仿∶异戊醇(25∶24∶1),轻轻混匀,于4℃条件下以转速10 000 r/min离心5 min;取上清液,加入400 μL异丙醇混匀,于4℃条件下以转速10 000 r/min离心5 min;弃上清液,加入70%的乙醇洗涤沉淀,自然晾干后,用100 μL含有胰RNA酶(20 mg/mL)的TE溶解DNA,于-20℃条件下冷冻保存备用[6]。
2.4 基因组DNA浓度和纯度的测定
提取的沙门氏菌和金黄色葡萄球菌基因组DNA,在紫外分光光度计下测量其在波长260,280 nm处的OD值,计算基因组DNA浓度和纯度OD260/280。
2.5 PCR扩增检测
参照文献[7],选择沙门氏菌invA基因为靶基因,其引物为:正向引物5'-gtcatgatattccgccccatatt-3',反向引物5'-cggtgcgatgaagtttatcaaag-3';选择金黄色葡萄球菌nuc基因为靶基因,其引物为:正向引物5'-gctaagcaaatgcatcataaac-3',反向引物5'-agcgtt gtcttcgctccaaa-3'。反应体系:2×Taq PCR Star Mix with Loading Dye 12.5 μL,DNA模板1 μL,引物浓度0.1 μmol/L,加ddH2O补至25 μL。PCR反应条件:95℃预变性5 min;95℃变性40 s,56℃退火40 s,72℃延伸1 min,30个循环;72℃延伸7 min。将扩增产物用2%琼脂糖凝胶电泳检测,进行凝胶成像。
2 结果与分析
2.1 比较5种不同方法提取的基因组DNA
不同方法提取沙门氏菌、金黄色葡萄球菌基因组DNA比较见表1。
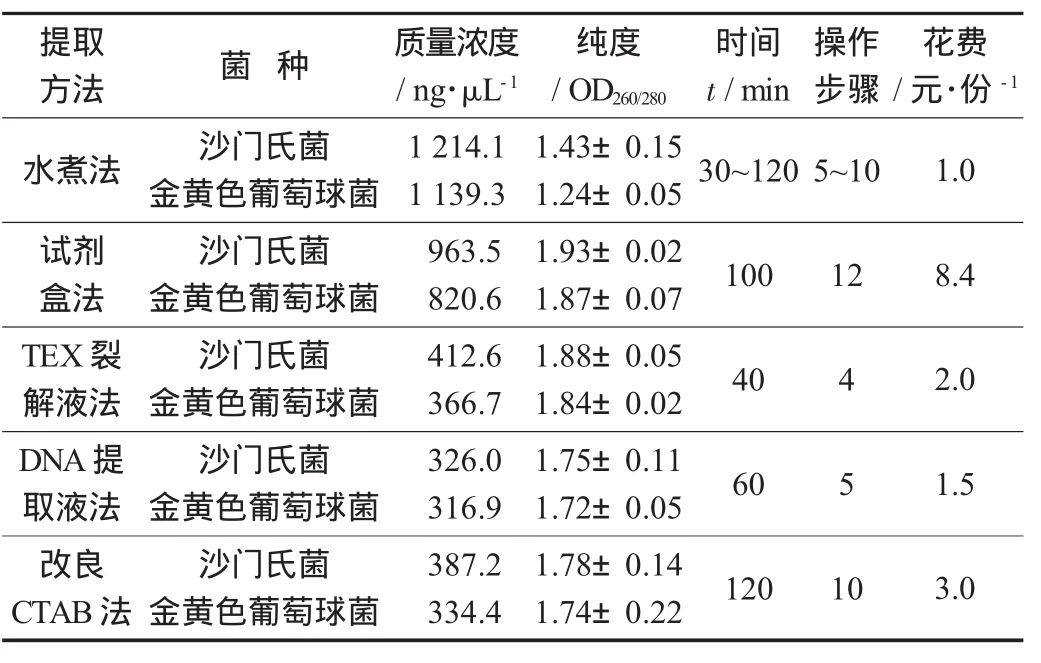
表1 不同方法提取沙门氏菌、金黄色葡萄球菌基因组DNA比较
为评价不同方法提取的基因组DNA品质,分别对5种方法提取的基因组DNA进行浓度和纯度比较。由表1可知,水煮法提取的基因组DNA质量浓度最高,之后依次为试剂盒法、TEX裂解液法、改良CTAB法、DNA提取液法。水煮法提取的基因组DNA纯度最低,原因是水煮法提取的基因组DNA中含有较多的杂质(如蛋白质等),符合Psifidi A等人[8]的研究结果;试剂盒法和TEX裂解液法提取的基因组DNA纯度较高,且OD260/280值均在1.8~2.0。试剂盒法提取基因组DNA纯度和质量浓度都是最为理想的,但是其操作步骤复杂、成本高;而TEX裂解液法操作简单、省时省力,大大节省了检测成本。
2.2 PCR扩增结果
不同方法提取基因组DNA为模板的PCR产物琼脂糖凝胶电泳见图1。
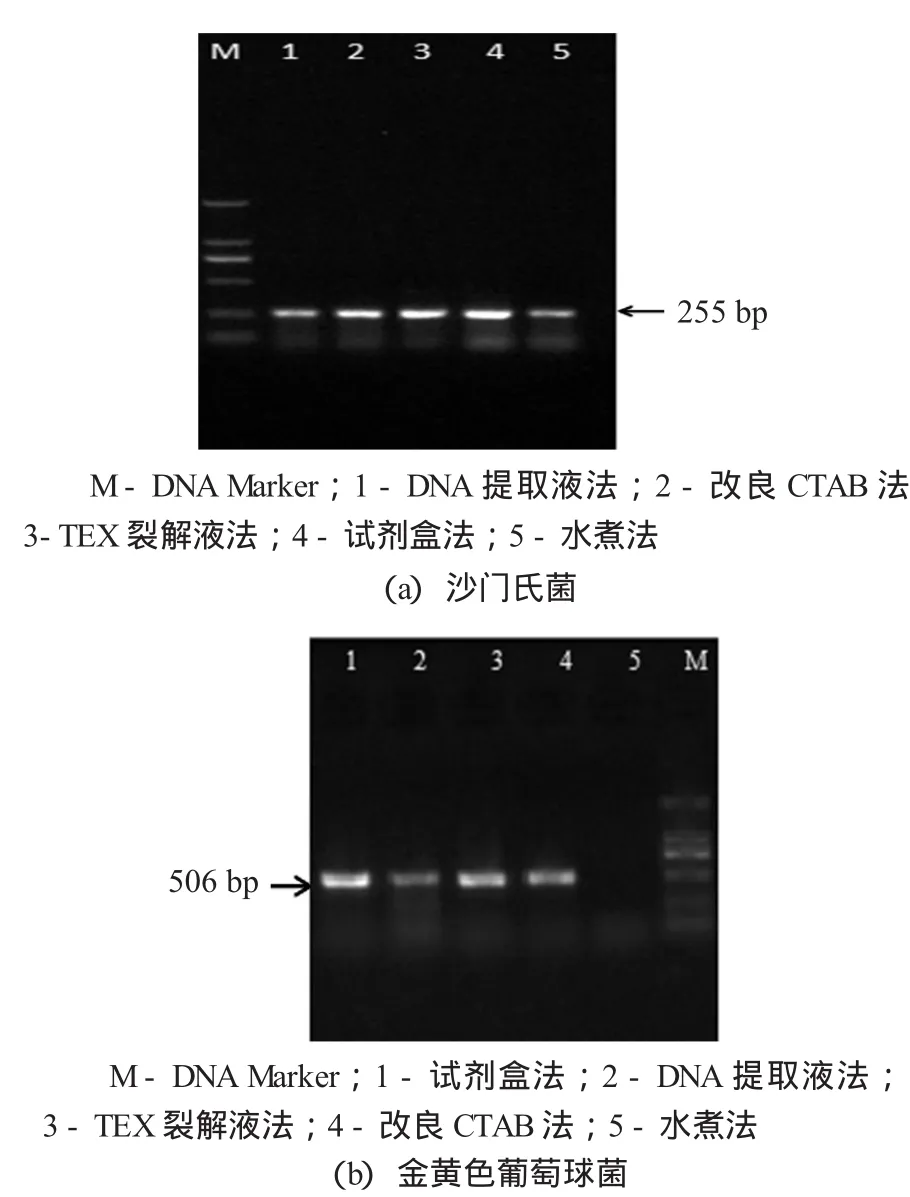
图1 不同方法提取基因组DNA为模板的PCR产物琼脂糖凝胶电泳
以5种方法提取的沙门氏菌和金黄色葡萄球菌基因组DNA为模板,进行PCR扩增检测。由图1(a)可知,5种方法提取的沙门氏菌DNA均能够成功用于沙门氏菌invA基因的扩增,目的片段大小为255 bp,扩增产物经电泳检测后得到清晰的目的条带;TEX裂解液法和试剂盒法提取的沙门氏菌基因组DNA扩增产物的目的条带最为清晰明亮。由图1(b)可知,除水煮法外其他4种方法提取的金黄色葡萄球菌DNA,均能够成功用于金黄色葡萄球菌nuc基因的扩增,目的片段大小为506 bp,扩增产物经电泳检测后都得到清晰的目的条带;试剂盒法和TEX裂解液法提取的金黄色葡萄球菌DNA条带清晰,DNA提取液法提取的DNA扩增条带有拖尾现象。
2.3 多重PCR检测TEX裂解法提取的基因组DNA
以TEX裂解液法提取的沙门氏菌和金黄色葡萄球菌基因组DNA为模板,多重PCR扩增,扩增产物电泳结果见图2。
多重PCR检测TEX裂解液法提取的基因组DNA见图2。
3 讨论
细菌基因组DNA提取制备的品质是决定PCR成败的关键环节之一,如果提取时不能完全释放DNA,或未去除干净的蛋白质、有机试剂残留在所制备的模板中,都可能导致后续的PCR反应效率和灵敏度降低,甚至导致反应失败。目前,细菌基因组DNA的提取方法有很多,试验选择5种提取方法对沙门氏菌和金黄色葡萄球菌基因组DNA的提取效果进行比较。找到简易高效、稳定可靠同时提取沙门氏菌和金黄色葡萄球菌基因组DNA的方法,用于农产品中沙门氏菌和金黄色葡萄球菌多重PCR检测。
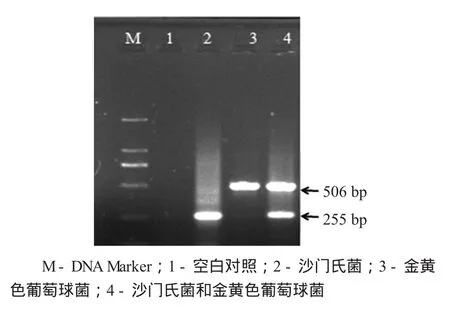
图2 多重PCR检测TEX裂解液法提取的基因组DNA
水煮法所需费用低、操作简单、耗时短,与其他方法相比,提取的基因组DNA质量浓度显著增加,但DNA纯度显著降低,同时因为金黄色葡萄球菌细胞壁较厚,水煮法并不能对其进行有效地提取。改良CTAB法是目前最常用的基因组DNA提取方法,所需费用低,但操作繁琐、耗时长、DNA损失量大,且使用的有机溶剂有污染和毒性作用。试验使用改良CTAB法提取DNA的OD260/280值不理想,可能是残留的有机溶剂或所用溶剂去除蛋白的能力有限所导致,与Murray J R等人研究结果相同[9]。TEX裂解液法和DNA提取液法避免了有机溶剂对人体的危害,操作省时省力。TEX裂解液法样本裂解更为充分,蛋白质消化更为完全,溶菌酶使金黄色葡萄球菌破除细胞壁,释放细胞内DNA。商业试剂盒法提取基因组DNA效率高且可减少有机试剂对人体的伤害,近年来得到普遍的认可和应用,但是商业试剂盒成本较高,如不考虑成本的因素,试剂盒法最为理想。在实际现场检测过程中,需要大批量检测样本,基层单位在检测过程中对成本的限制较大,需要在保证检测品质的同时降低成本,以适应市场的需求。TEX裂解液法在保证提取DNA品质的同时,成本大大低于试剂盒法。
因沙门氏菌和金黄色葡萄球菌为农产品致病菌检测中必检项目,通过多重PCR可对2种致病菌进行同时检测。经试验比较后,选择TEX裂解液法对沙门氏菌和金黄色葡萄球菌基因组DNA进行同时提取,为后续PCR检测找到了经济适用、操作简单快速的基因组DNA提取方法。
[1]中华人民共和国国家标准.食品安全国家标准食品中致病菌限量GB 29921—2013[S].北京:中国标准出版社,2013.
[2]唐俊妮.金黄色葡萄球菌耐热核酸酶相关基因的功能与特征分析 [D].武汉:华中农业大学,2007.
[3]Gussow D,Clackson T.Direct clone characterization from plaques and colonies by the polymerase chain reaction[J]. Nucleic Acids Res,1989,17(10):4 000-4 010.
[4]金姝,邹玉涵,闫佩毅,等.耐甲氧西林金黄色葡萄球菌DNA提取方法的改进 [J].国际检验医学杂志,2016,37(3):303-305.
[5]中华人民共和国出入境检验检疫行业标准委员会.出口食品中致病菌环介导恒温扩增检测方法第一部分:金黄色葡萄球菌:SN/T 2754.1—2011[S].北京:中国标准出版社,2011.
[6]贾爱荣,张永刚,王萍,等.食品检测中革兰氏阳性菌DNA提取新方法的研究 [J].食品工业,2011(12):104-107.
[7]刘道文,陈萍,魏琼,等.Percoll分离法与多重PCR快速检测肉品中沙门氏菌、金黄色葡萄球菌和志贺氏菌 [J].中国预防兽医学报,2010,32(11):871-874.
[8]Psifiedi A,Dovas C I,Banos G.A comparison of six methods for genomic DNA extraction suitable for PCR-based genotyping applications using ovine milk samples[J].Mol Cell Probes,2010,24(2):93-98.
[9]Murray J R,Rajevan M S.Evaluation of DNA extraction from granulocytes discarded in the separation medium after isolation of peripheral blood mononuclear cells and plasma from whole blood[J].MBC Research.,2013(6):440-444.
A Comparative Study on Salmonella spp.and Staphylococcus aureus DNA Extraction Methods
XIAO Qianwen1,WANG Yanrui1,LIU Tong1,LIU Shuang1,HE Miao2,REN Dayong1,*CHEN Ping1
(1.Food Science and Engineering College,Jilin Agricultural University,Changchun,Jilin 130118,China;2.Anxin Food Technology Services of Limited Liability Company in Jinlin Province,Changchun,Jilin 130012,China)
To extract Salmonella spp.and Staphylococcus aureus DNA by the methods of boiling water extraction,kit assay,improved CTAB method,DNA extracting solution method and TEX cracking liquid method,compare the quality of the extracted DNA by the five methods.Choosing an extraction method applied to multiplex PCR detection of Salmonella spp.and Staphylococcus aureus in agricultural products.The results show that TEX cracking liquid method to extract high purity of DNA,simple operation,save time and effort,low costs.The purity of Salmonella DNA is 1.88,and the concentration is 412.6 ng/μL;the purity of Staphylococcus aureus DNA is 1.84 with the concentration 366.7 ng/μL by using the TEX cracking liquid method.The extraction of DNA by PCR can amplify objective band with extraction DNA as template.
Salmonella spp.;Staphylococcus aureus;genome DNA extraction
TS201.3
A
10.16693/j.cnki.1671-9646(X).2017.02.015
1671-9646(2017)02a-0048-03
2016-12-01
吉林省发改委产业技术研究与开发项目资助(2014Y106)。
肖茜文(1990— ),女,硕士,研究方向为食品质量与安全。
*通讯作者:陈 萍(1968— ),女,博士,教授,研究方向为食品质量与安全。
