药用铁基纳米材料及其发展前景
2017-04-10陈博,顾宁
陈 博,顾 宁
(1.东南大学生物科学与医学工程学院 江苏省生物材料与器件重点实验室生物电子学国家重点实验室,江苏南京 210096)(2.苏州纳米科技协同创新中心 纳米药物与生物材料专业中心,江苏苏州 215123)
药用铁基纳米材料及其发展前景
陈 博1,2,顾 宁1,2
(1.东南大学生物科学与医学工程学院 江苏省生物材料与器件重点实验室生物电子学国家重点实验室,江苏南京 210096)(2.苏州纳米科技协同创新中心 纳米药物与生物材料专业中心,江苏苏州 215123)

顾 宁
铁基纳米材料是指以天然或人工方法得到的纳米尺度范围的铁、铁氧体及铁合金等的功能性材料。根据结构组成可分为超顺磁性氧化铁纳米粒、磁性氧化铁微球、磁性铁蛋白、磁小体、磁性氧化铁脂质体及铁合金纳米粒等。铁基纳米材料具有优良的尺寸效应、表面效应与量子效应,尤为重要的是独特的磁学性质,使其在生物医药领域,包括核磁共振造影、体外生物分离、肿瘤磁热疗、药物递送及组织工程等方面得到了广泛应用,且已有产品被批准上市或处于临床试验研究。理想的药用铁基纳米材料应具有结构明确、性质稳定、高度分散、可规模化生产以及体内应用安全有效等特性。限制铁基纳米材料医学应用的问题在于铁离子在体内产生的氧化应激反应与铁过载对机体的毒性。综述了药用铁基纳米材料的研究现状以及面临的机遇与挑战,并展望了其发展前景。
铁基纳米材料;药用;制备方法;临床研究;发展前景
1 前 言
铁元素在地球上含量高且分布广泛,长期以来铁基材料也在不断发展,应用于多个领域。药用铁基纳米材料由于在临床应用中的安全有效性,极具研究价值和发展前景。药用铁基纳米材料是指以天然或人工制备得到的纳米尺度范围的铁、铁氧体及铁合金等可用于生物医药领域的功能性材料。药用铁基纳米材料由铁基组分和功能性材料两大部分构成,铁组分主要发挥磁性和补铁等生理作用,而功能性材料在提高整体材料的生物相容性与保证铁组分稳定的同时,兼具特有的药用功能。与其他纳米材料相比,药用铁基纳米材料不仅具有尺寸效应、表面效应及量子效应等性质,同时还体现出其它显著的优势,如低毒性、低免疫原性和高生物降解性能,在体内使用的安全有效性,以及优良的磁学特性。其中特殊的磁学性质包括超顺磁性[1]、高磁化性、低居里温度等。但药用铁基纳米材料仍面临一些较为严重的体内应用问题,如对细胞内信号通路的异常诱导,致使基因表达特性改变,产生氧化应激及其他对铁稳态潜在的破坏等[2]。美国FDA批准上市的铁基纳米药物数量稀少,目前允许在临床上单独应用的铁基纳米药物仅有Ferumoxytol一种,Ferumoxytol因具有良好的安全性,已被作为‘Off Label’药物广泛应用于炎症和肿瘤区域成像的临床试验。越来越多种类的药用铁基纳米材料在不断涌现,本文就目前铁基纳米材料在医药领域的研究现状进行了综述,并展望了其发展前景。
2 药用铁基纳米材料的分类及其制备方法
药用铁基纳米材料根据结构组成,即铁基部分与修饰材料的不同可分为超顺磁性氧化铁纳米颗粒(SPIOs)、磁性氧化铁类微球、铁蛋白类纳米颗粒、磁小体及各种铁基纳米复合物(见图1)等。

图1 几种药用铁基纳米材料的电子显微镜照片:(a)磁性微球[3],(b)锰锌铁氧体[4],(c)铁蛋白[5],(d)磁小体[6],(e)共沉淀法制备的超顺磁性氧化铁纳米粒[7]Fig.1 Electron microscope photographs of different pharmaceutical iron based nano-materials: (a) magnetic microspheres[3],(b) Mn-Zn ferrite nanoparticle[4], (c) ferritin[5], (d) magnetosome[6], and (e) SPIOs prepared by co-precipitation[7]
2.1 超顺磁性氧化铁纳米粒
超顺磁性氧化铁纳米颗粒(SPIOs)是目前发展最为迅速的药用铁基纳米材料,尺寸效应是其在体内发挥功能的基础。SPIOs的组成一般分为两个部分:氧化铁核心和医用材料组成的外壳。氧化铁核的组成主要为Fe3O4或γ-Fe2O3。外壳包裹材料改善了颗粒的溶解性与稳定性,由各种生物相容性良好的天然物质或人工合成材料组成,如葡聚糖、壳聚糖、聚乙二醇、聚乙烯醇等。
SPIOs的制备方法多样,包括物理法、生物法、化学法与物化法等,目前能够满足药用与工业生产需求的只有化学共沉淀法。该方法所需的原料廉价易得,制备过程易于调控,产率相当可观。该制备方法的原理为三价与二价铁盐溶液加碱后形成过饱和溶液而瞬间大量成核,继而通过缓慢的升温熟化过程制备SPIOs。该法最初由Massart等[8]开发出来,在酸或碱介质中未添加稳定剂共沉淀制备SPIOs。共沉淀法的工艺改善主要包括初始溶液中铁价态的比例和浓度,表面包覆剂或稳定剂的种类与浓度,终溶液中的pH和离子强度及反应温度等。Chen等[7]基于SPIOs在交变磁场中的磁滞产热原理,利用共沉淀法原理在中频交变磁场中制备纳米药物Ferumoxytol,在形貌和磁性方面比普通共沉淀法的产品大有改善。除此之外,另一种广泛使用的制备SPIOs的方法为高温热解法,利用高温热解法可制备出形貌和粒径更为均一且磁学性能更佳的SPIOs。该方法采用如五羰基铁、乙酰丙酮铁及油酸铁等较为昂贵的前驱体原料,在包覆剂和非极性的高沸点溶剂存在下高温分解铁前驱体生成粒度分散均一的颗粒。除此之外,SPIOs制备手段还包括水热法、微乳法、溶胶-凝胶法、多元醇法、流动注射合成法、电化学法、蒸气/气雾法与超声分解法等[8]。
2.2 磁性氧化铁类微球
磁性微球的粒径大于超顺磁性氧化铁纳米粒,范围是100 nm~2 μm,一般小于4 μm,以避免在体内循环中堵塞毛细血管。磁微球表面修饰的功能性分子决定了其医学应用,目前大多磁性微球用于药物载体与免疫分离。根据用途可分为治疗型磁微球、体内诊断型磁微球与体外诊断型磁微球等。
磁性微球的化学制备方法主要包括7种:复乳法、交联法、碱共沉淀法、反相悬浮聚合法、声化学法、溶胀和渗透法以及低温水热法等[9]。根据表面材料的包覆形式也可分为原位法与两步法。Molday等[10]混合甲基丙烯酸甲酯、甲基丙烯酸羟乙酯、甲基丙烯酸、乙二醇二甲基丙烯酸酯与四氧化三铁纳米颗粒,真空下经γ辐射聚合生成磁微球,继续使用溴化氰在微球表面衍生化二氨基庚烷功能基团并偶联上异硫氰酸荧光素,构建出可标记与分离细胞的免疫磁性微球。Deng等[11]使用多步法合成了表面可固定胰岛素酶的磁性微球,首先采用溶胶-凝胶法在Fe3O4纳米粒表面包裹一层硅质,硅层可防止水热过程中对微球的腐蚀,同时也为硅酸盐晶体的生长提供了基底,继续在硅层表面修饰聚二烯丙基二甲基氯化铵,分解带电荷的硅酸盐晶种,凭借库仑相互作用,硅酸盐晶种纳米粒吸附在微球表面,在140oC的氨蒸汽中将硅层转化为硅酸盐晶体,由此获得核壳结构的硅酸盐磁性微球。
2.3 铁蛋白类纳米颗粒
人体内存在多种处于纳米尺度的铁类蛋白质如转铁蛋白。纳米铁蛋白外壳拥有一个位于颗粒重链区域的催化位点,可将溶液中的二价铁导入并启动三价铁核的成核反应,从而形成纳米铁蛋白。已有研究[12,13]通过人工合成,将病毒衣壳、铁蛋白及热休克蛋白等作为外壳,将铁核心包裹在内形成纳米蛋白质笼结构。该类铁蛋白纳米粒在体内外的生物相容性高,易被机体吸收而发挥作用。铁蛋白纳米粒的基本制备步骤为:首先通过基因工程技术合成出蛋白外壳,继而利用矿化作用在壳内生成氧化铁颗粒。Masaki等[14]使用铁蛋白笼氧化铁颗粒制备新型的超顺磁性T2核磁共振造影剂,方法为将编码人源H链铁蛋白(HFn)的基因利用PCR技术扩增,并克隆入NdeI/BamHI限制性内切酶位点,在大肠杆菌中表达出重组的人源H链铁蛋白HFn蛋白(rHFn),再将rHFn蛋白分离提纯,以硫酸铁铵为铁源、双氧水为氧化剂进行矿化反应,在rHFn的内部生成Fe3O4,使用尺寸排阻色谱分离出单分散性的矿化rHFn纳米粒。Fan等[5]运用基因工程技术在大肠杆菌体内表达出重组人转铁蛋白(HFn),经纯化得到单分散且形貌规整的HFn蛋白壳,将氧化铁装载入内部并氧化得到稳定的HFn,其铁核尺寸约为4.7 nm,整体粒径为12~16 nm,并发现这些铁蛋白具有类过氧化氢酶活性。
2.4 磁小体
趋磁细菌在自然界中分布广泛,其吸收生长环境中的铁离子并在胞内生成磁性纳米铁颗粒,即为磁小体。磁小体由含有蛋白质的磷脂双分子层包覆,单个磁小体形态多样呈球状与长柱状等,而整体一般呈链状排列。铁基组分为Fe3O4、FeS、Fe3S4或FeS2等,一般呈超顺磁性。控制发酵罐中的溶氧量、铁源与多种营养元素保证趋磁菌菌体的生长,可批量制备磁小体。该生物合成的方法绿色环保,适合规模化生产,尤为重要的是在绝氧程度极高的情况下,可得到磁性优越的产品。Blakemore[15]首先报道了趋磁螺旋菌生产四氧化三铁磁小体的条件:约1%的氧含量与氮氧化物的添加,后者可提供终端电子受体以促进Fe3O4生成。Heyen等[16]通过筛选趋磁螺菌在微氧下培养的介质与生长条件,创制了一种规模化制备磁小体的发酵法,产率相比传统方法有大幅提高。
2.5 铁合金纳米粒
为了得到满足临床应用需求的高磁性铁基纳米材料,掺杂自然界中其他金属元素制备新一代铁杂合磁性颗粒已成为一种重要手段。将不同的金属盐如锰、锌、钴等与铁元素前驱体的胶束溶液混合,相应的金属阳离子可以取代二价铁组成铁合金核,如MnFe2O4,CoFe2O4,NiFe2O4等。晶体结构组成可由加入的前驱体的比例来调控,掺杂后能够改变颗粒的尺寸、表面状态及磁晶相,与单独铁氧体相比具有较大的磁各向异性与较高的磁化率,显著改善其核磁共振性质与热疗性能。Adam等[17]使用微乳液法制备了纳米CoFe2O4,混合氯化钴与氯化亚铁溶液,加入表面活性剂十二烷基硫酸钠形成了十二烷基硫酸铁和十二烷基硫酸钴的胶束溶液,并以此为前驱体得到铁钴纳米颗粒。Xie等[4]以乙酰丙酮金属盐(铁、锰、锌)在油酸与油胺存在下高温分解制备出单分散性良好的超顺磁性锰锌铁氧体,并可通过改变晶体生长速率调控纳米颗粒的形貌使其出现球形-立方形-星型结构的变化,可用于动物体内乳腺癌的核磁共振成像与热疗。
3 药用铁基纳米材料的应用现状
药用铁基纳米材料已被多个药物企业开发成商品并批准在临床上进行诊断或治疗。临床上批准使用的商品主要应用于三大领域:核磁共振造影、体外生物分离与肿瘤磁流体热疗。表1展示了目前已被批准用于临床或正处于临床试验的铁基纳米药物。除此之外,各种新的诊疗功能如药物载体、基因转染、组织工程等也在不断开发。表2列举了一些用于临床前研究或仅供动物试验的药用铁基纳米材料。以下详细叙述了药用铁基纳米材料的应用现状。
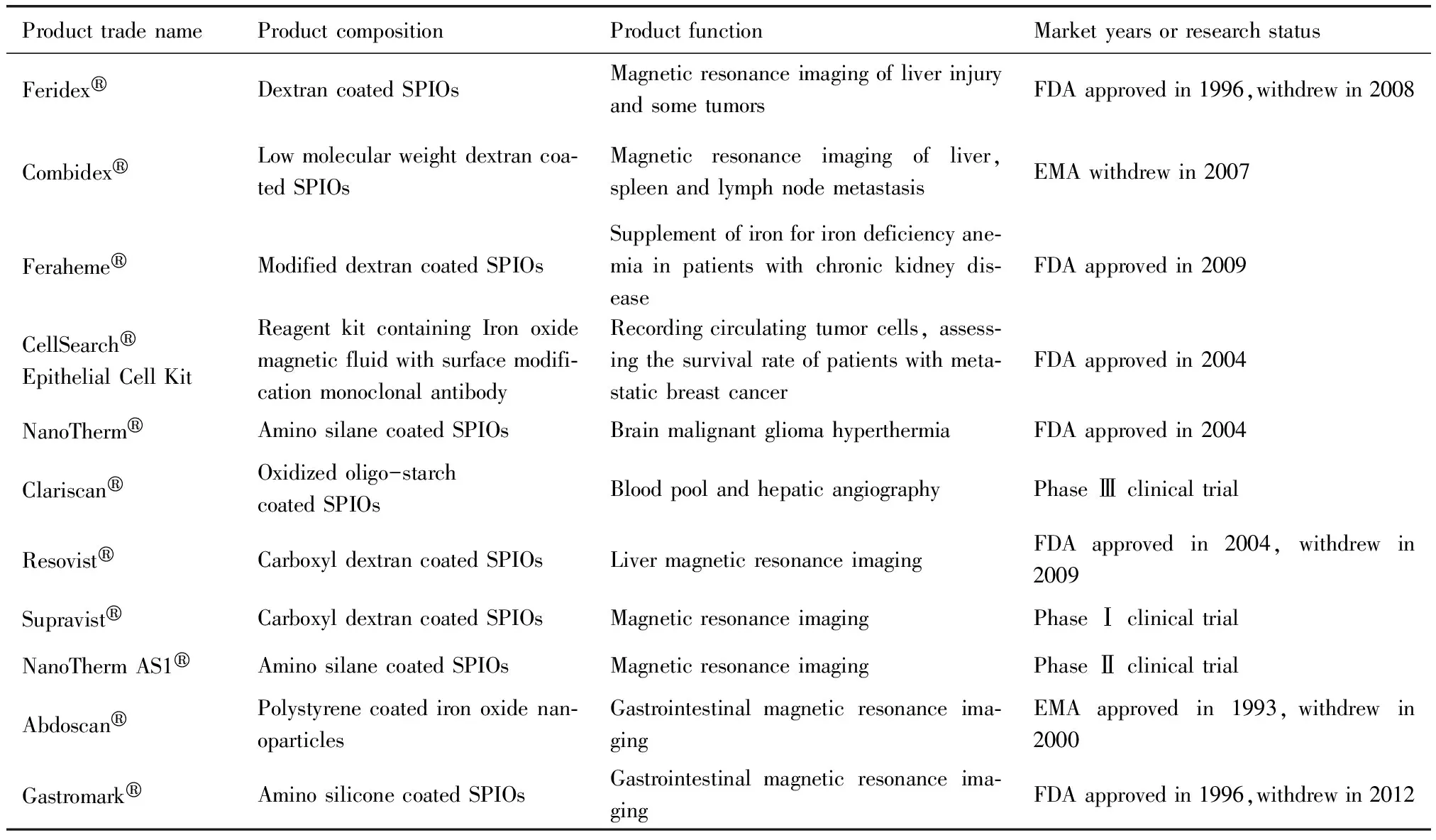
表1 已被批准用于临床或正处于临床试验的铁基纳米药物
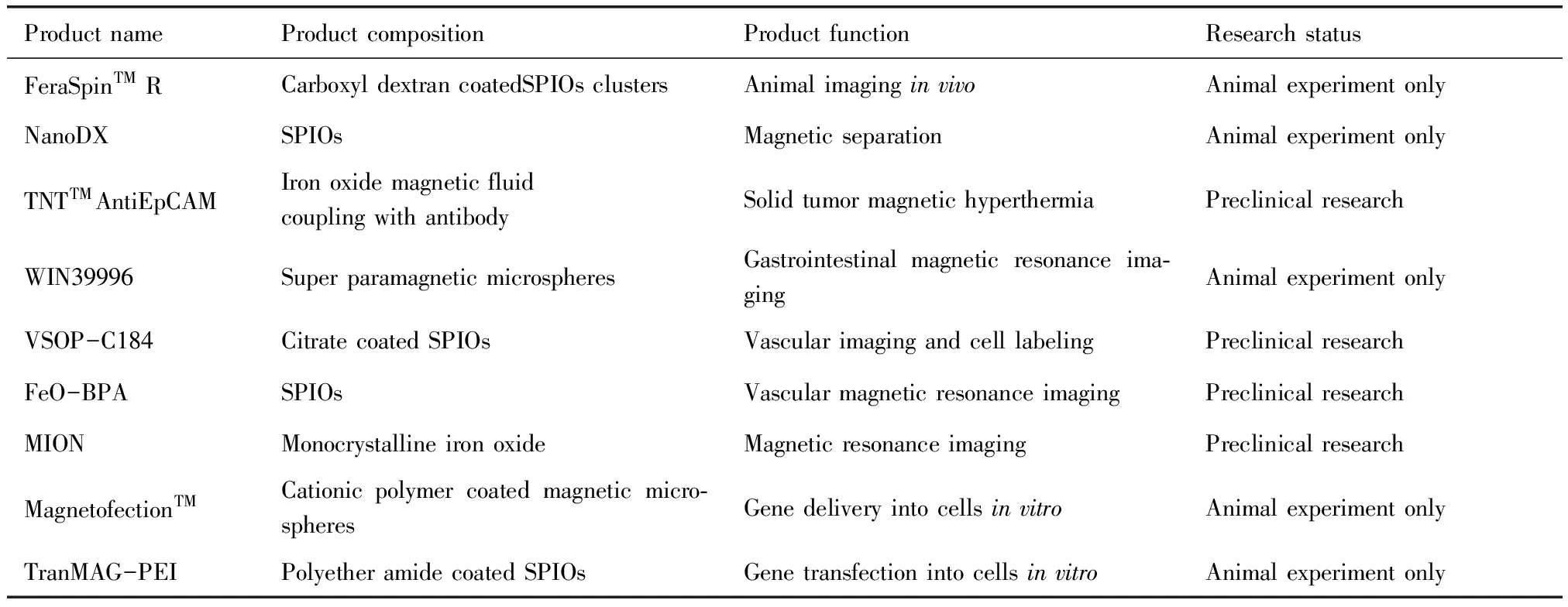
表2 处于临床前研究或仅供动物试验的药用铁基纳米材料
3.1 核磁共振造影剂
SPIOs具有优良的超顺磁性,可影响待检测组织周围的水分子质子自旋弛豫,扰乱磁场的均质性,增强T2成像的精确度,有利于区分肿瘤或炎症区域,提高病变区域检出率与定性诊断的准确率。已经上市的SPIOs类造影剂中,早期多应用于增强单核细胞吞噬系统的肝脾、淋巴结与骨髓等部位的造影,目前有临床试验也在针对一些恶性肿瘤如胶质瘤等的成像。
适宜MRI的SPIOs尺寸在10~200 nm之间。一般来说大于4 μm的颗粒会堵塞肺部,200 nm~4 μm 易被肝脾的巨噬细胞和单核细胞吞噬(MPS系统),小于7 nm的颗粒则易外渗并被肾脏清除出血液循环。只有尺寸为10~200 nm的颗粒在体内应用最为有效[18-19]。如Resovist®(62 nm)静脉注射后,经血液循环后富集于肝脏的网状内皮系统,显示出T2和T1加权造影信号的下降;而恶性的肝肿瘤区域并不包含MPS细胞,不会引起Resovist®的富集,因此与正常区域产生了信号明暗的差异,由此确定肿瘤位置[20]。Feridex®(50 nm左右)被批准上市应用于肝脏造影,而稍小粒径的Combidex®被批准上市应用于淋巴造影,能够被正常的淋巴结吞噬而不会进入转移性淋巴结。一项应用于多发性硬化症的临床试验中[21],Feraheme®(30 nm)相比钆剂能够将检测区域更为清晰地标记出来,检测率得到显著提高(NCT01973517)。
利用新的生物材料或靶向分子结合SPIOs,能够显著提高MRI效果。Lee[22]等使用高生物相容性的聚乙烯基吡咯烷包裹氧化铁颗粒,终产品与Ferumoxides相比饱和磁化强度高达110 emu/g Fe,在体内外实验中显示出良好的吞噬细胞摄取率,有潜力应用于临床。
3.2 体外生物分离
磁性铁基纳米材料可在外周血液中迅速灵敏地记录循环肿瘤细胞,临床上可有效检测肿瘤的复发与转移情况。该方法具有明显的优势[8]:磁性分离过程简单易操作、敏感性高,所有的步骤均在一个试管内完成且不需要昂贵的液相色谱系统。使用磁性微球进行体外分离的步骤大致为:凭借其表面功能化的材料如抗体、活性官能团等与待分离的细胞或蛋白亲和性吸附,清洗除去未吸附的物质,外加磁场介入下将结合靶细胞或蛋白的磁微球解吸下来。目前被FDA批准的铁基磁流体的体外分离诊断系统为CellSearch®。该系统由以下组分构成:测试盒、操作设备与远程工作站,分别负责样品采集、制备与分析。主要过程是根据免疫磁分离原理富集得到血液中的上皮源性的肿瘤细胞,荧光显微镜观察细胞核染色情况,流式细胞仪记录细胞角蛋白的表达量来计数肿瘤细胞,以此监测如乳腺癌、结肠癌及前列腺癌等患者的肿瘤转移情况[23]。该操作半自动化,易于控制,精确高效,测试结果可重复性高。除了细胞分离,磁性铁基微纳材料还可用于多种生物分子如DNA、蛋白质和病毒等的分离、检测与纯化。GeneMAG-DNA 96/Blood试剂盒利用二氧化硅磁性微球简易高效地分离并纯化血液细胞中的DNA,为PCR扩增等生物应用提供了便利[24]。
3.3 磁流体热疗
磁流体热疗的概念为:在细胞层面,针对肿瘤细胞对热敏感(42~52℃)的特性[25],通过维持一定时间和温度的热疗,致使胞内热休克蛋白的高水平表达,诱导蛋白质变性,折叠和凋亡,从而对肿瘤细胞进行杀伤并抑制其自身的修复系统;在组织层面,热疗升温使肿瘤局部微环境的pH、灌注和含氧量情况发生改变,抑制肿瘤的增长。该技术主要应用于恶性程度高、一线治疗手段难以起效的脑部癌症等实体瘤。采用磁纳米颗粒进行热疗的设想首先出现在Jordan[26]的开创性工作中,注射氧化铁磁流体于10位前列腺癌患者肿瘤部位,每周进行6次共持续60 min的热疗,观察瘤内最高温度至55oC,而周围温度为40.2oC。2010年由欧洲药品管理局批准了一种氨基硅烷包裹的磁性氧化铁纳米颗粒NanoThermTM,辅助交变磁场施加装置,用于瘤内注射临床治疗复发性胶质母细胞瘤。该热疗系统包括:氧化铁磁流(NanoThermTM),模拟软件(NanoPlan®)与交变磁场设备(NanoActivator®)。Targeted Nano-Therapeutics (TNTTM) System是处于临床前研究的一种实体瘤磁热疗系统,包括T探针和磁场装置两部分,其中铁基部分的T探针为表面偶联单抗的约40 nm尺寸的氧化铁纳米颗粒,注射后可与肿瘤细胞特异性结合并聚集[27]。Hauff 等[28]评估了对复发性多形性胶质瘤进行SPIOs磁流体热疗的可行性和耐受性。经热疗后瘤内中心温度可达44.6oC,所有病人并未出现副作用。后续实验发现经治疗后病人的中位总生存期达到23.2个月,显著改善了未治疗组的14.6个月。Le等[29]报道了磁性氧化铁脂质体的靶向热疗作用,在磷脂膜的EMC-DPPE上交联抗体得到主动靶向的磁性脂质体,体内应用检测有60%能够靶向胶质瘤细胞,极大提高了热疗效果,肿瘤细胞在两周后即出现抑制。
3.4 静脉补铁
缺铁性贫血是由于人体内铁元素不足或代谢问题而导致红细胞生成减少的症状,在世界范围内普遍存在,危害极大,多发于妇女和儿童,临床上主要通过口服或静脉应用补铁剂来进行治疗。纳米铁剂与传统铁剂相比,结构稳定、铁离子不易泄露、体内毒性低、利用率高。Ferumoxytol(FMT)是目前唯一上市作为补铁剂的铁基纳米材料,于2009年在FDA批准用于治疗慢性肾病患者的缺铁性贫血。FMT可一次性静脉注射17 mL并补充510 mg铁,具有良好的体内代谢动力学性质。此外,Powell研究组开发了一种由酒石酸修饰的水铁矿纳米粒,铁核粒径为2~3 nm,体外胃溶解试验显示在60 min内即可完全释放出铁离子,在缺铁的大鼠模型上应用后观察,机体对硫酸亚铁和纳米铁剂的铁吸收率相当,可快速有效补铁,同时能避免铁离子在胃肠造成的氧化应激反应,极具潜力成为新型口服补铁剂[30]。
3.5 药物载体
铁基纳米药物载体系统应用广泛,特点为:既可通过外部磁场定位与表面修饰的特异性靶向分子实现对病区的主动靶向,也可利用外置磁场进行热疗与药物释放,兼具了诊断与治疗的作用。药物载入的方法主要包括物理吸附、包埋或者化学偶联。早期开发出载有多柔比星的磁性白蛋白微球,随后研制出SPIOs与磁小体的磁靶向药物载体系统。而由脂质材料(聚乙二醇与磷脂等)包裹同时表面偶联有特异靶向分子(单抗、叶酸与短肽等)的磁性氧化铁颗粒具有对肿瘤组织的主动靶向功能,及对肿瘤的高通透性和滞留效应的被动靶向,成为了目前的研究热点(图2)。Kaittanis等[31]以FMT为载体,利用其表面改性的右旋糖酐外壳这种纳米孔的静电吸附作用将疏水性药物紫杉醇载入颗粒。体外MRI发现T2信号与载药量呈正性关系,并应用于移植人乳腺瘤的裸鼠,对肿瘤诊断进行实时监测。Sun等[32]在细菌中提取纯化出磁小体,加入戊二醛将阿霉素分子与磁小体共价结合,发现对荷H22肝癌细胞小鼠的抑瘤率与阿霉素媲美,且呈现更低的心脏毒性。Fuchigami等[33]使用水热法合成了一种载药的脂质铁基纳米胶囊,先由Fe/Pt纳米粒和修饰上阳离子脂质聚(二芳基二甲基氯化铵)的硅壳构成胶囊模板,使用薄膜水化法将水溶性的抗癌药物载入硅壳的中空孔道,最后包裹上卵磷脂避免药物泄露,在磁场引导下可富集入胃癌细胞并增强抗肿瘤效果。

图2 易渗漏的肿瘤血管及其增强渗透和滞留效应(a),外置磁场可提高氧化铁纳米颗粒在肿瘤区域的聚集(b)[34]Fig.2 Tumors leaky vascular and their enhanced permeability and retention (a), and presence of an externally applied magnetic field can increase the accumulation of the IONPs in tumor area (b)[34]
3.6 细胞标记、示踪与成像
药用铁基纳米材料在体外标记入各种功能性的细胞,体内通过MRI示踪可实现多种诊疗目的。Mya等[35]将肝素、鱼精蛋白与Ferumoxytol混合一起形成HPF复合物,标记入干细胞,用于细胞示踪。Karussis等[36]设计了Ferumoxides标记间充质干细胞(MSC)的临床试验,在转录前加入多聚赖氨酸将MSC与Ferumoxides共孵育24~48 h,成功对脑部和脊髓完成核磁共振成像检测。图像显示这类细胞主要迁移入脑膜脊髓和神经根脊髓薄壁组织,同时也会因巨噬细胞吞噬氧化铁颗粒而迁移至炎症区域。Richards等[37]成功将Feridex®标记入人外周血单核细胞,对健康志愿者肌内和静脉注射后并无显著副作用出现,而在肝脾组织处信号降低,说明标记后的细胞体内安全性高且具有追踪局部炎症病灶的功能(NCT00972946,NCT01169935)。
3.7 模拟酶与固定化酶
某些铁基纳米材料具有类似生物酶的性质,催化效率极高,在体内外可模拟生物酶来发挥功能,也称为纳米酶。同时,以铁基纳米材料为承载物,将生物酶固定在材料表面,可由外部磁场调控并能多次重复使用。Fan等[5]利用磁转铁蛋白纳米粒(M-HFn)与肿瘤细胞表面过表达的转铁蛋白受体的强亲和力,以及M-HFn类似天然辣根过氧化物酶的催化活性,在过氧化氢存在时催化过氧化物酶的底物发生颜色反应,完成对肿瘤组织的可视化检测。Chen[38]等研究发现SPIOs具有pH依赖的类过氧化物酶与类过氧化氢酶催化活性,具体表现为当溶酶体(pH约4.8)中的SPIOs逃逸至细胞质(pH约7.4)内,随着pH的变化,其类过氧化物酶活性将转变为类过氧化氢酶活性,将H2O2分解为H2O与O2,从而降低对细胞的长时毒性。Zhang等[39]制备了普鲁士蓝氧化铁纳米颗粒,发现在不同pH环境中均体现出类超氧化物歧化酶的作用,可清除体内的超氧阴离子自由基,具有良好的抗炎作用。Deng等[11]报道了一种新型核壳结构的磁性沸石氧化铁微球,对胰蛋白酶具有强吸附能力与亲和力,胰蛋白酶固定化在微球上后可在微波辐射下15 s内完全消化蛋白质,催化效率远高于溶液状态中的反应,且可重复使用7次。
3.8 肿瘤介入栓塞疗法
磁性纳米颗粒的栓塞疗法随着肿瘤动脉介入技术的发展也日渐兴起。由于小尺寸的铁基磁性纳米颗粒可滞留于末梢血管处来结束循环过程,可形成理想的永久性末梢栓塞,有效地弥补了传统材料难以完全阻断肿瘤血供的缺陷;同时该栓塞在外加交变磁场的作用下还可进行磁感应热疗。Chung等[40]制备出高度球形的壳聚糖磁微球,经动脉导管栓塞应用于雄性新西兰兔的右侧肾动脉中,通过核磁共振监测到微球富集并滞留了18周。Qiu等[41]使用反相悬浮交联法合成了一种新型的载药磁凝胶微球,呈现类碘油的流动性,在体内靶向形成固体栓子,可应用于肿瘤栓塞的热化疗。药用铁基纳米材料的栓塞疗法也有临床试验进行,Magforce公司已将MFH300F型磁感应热疗机联合应用Resovist®与MFL AS两种磁流体,进行肝部肿瘤的栓塞化疗。
3.9 基因转染
基于磁性铁基纳米材料在药物载体方面的良好应用,其在基因载体领域也受到青睐。采用特定技术使磁性纳米铁颗粒与核酸分子结合,借助外部磁场将复合物导入靶细胞,保证高效的转染,实现快速完成基因调控的目的。MagnetofectionTM和TranMAG-PEI是两种使用广泛的磁转染试剂,前者主要包括CombiMAG和PloyMAG两种纳米铁颗粒,后者由聚醚酰亚胺包裹的氧化铁纳米颗粒和外置的永磁铁构成。Mah等[42]在聚苯乙烯磁性微球表面,通过可清除的硫酸肝素偶联上腺相关病毒编码的绿色荧光蛋白,并将该磁性铁颗粒应用于DNA的靶向递送。肌注入129/svJ小鼠体内后观察到病毒对C12s细胞的转染效率发生了显著提高。Namiki等[43]制备了Fe16N2阳离子脂质纳米粒,与质粒DNA混匀结合后转染入肿瘤细胞,可检测到荧光色素酶的高表达。
3.10 组织工程
在组织修复或替代工程中,细胞接种于3D支架的浅层时常会导致移植后支架中部出现组织坏死。为了解决该问题,Takuro等[44]利用磁性氧化铁颗粒来提高细胞侵入支架的程度。实验结果发现,这种生物相容良好的壳聚糖包裹的磁性颗粒引入细胞后,在磁铁吸引下可大幅提高其向支架内入侵的效率,同时基质金属蛋白酶和黏附因子也明显上调。Meng等[45-46]利用静电纺丝技术制备出掺有SPIOs的纳米纤维膜支架结构,体外细胞实验结果显示该纳米纤维膜能够促进成骨细胞的分化,植入骨缺损动物模型后发现其在静磁场的作用下能大幅促进骨缺损的修复。Sun等[47]使用磁场组装SPIOs得到的条纹状组装体作为基底培养大鼠原代骨髓细胞,发现该组装体能够诱导细胞成骨分化。Wang等[48]的研究进一步发现纳米药物Ferumoxytol能够促进间充质干细胞的成骨分化,且这种促进效应与颗粒本身的磁学性质相关。此外,Han等[49]发现氧化铁纳米颗粒还能加强心肌细胞之间的连接,Xiong等[50]的实验结果表明SPIOs具有心肌保护样的药物活性,可促进心肌组织损伤的修复。这些研究结果为药用铁基纳米材料在器官移植及再生医学领域的应用开辟了新方向。
4 结 语
药用铁基纳米材料生物相容性好,原料廉价易得,制备过程经济、环保,产品结构明确,化学性质较为稳定,体内易于降解代谢。这些优势使其在临床应用中大有用武之地。但铁基纳米材料在体内仍存在一些问题,主要包括铁离子产生的氧化应激反应、炎症与基因毒性,在细胞层面会造成主要的细胞器如自噬体、溶酶体、内质网与线粒体等的功能不全[51]。因此药用铁基纳米材料的发展前景是在保证其高生物相容性和生物降解性的前提下,改善氧化铁核的形貌与磁学性能,并通过表面修饰的材料拓展其生理功能,以开发更多适应临床病症的产品。相信未来会有结构组成更多元化、功能更加智能化和全面化的药用铁基纳米材料应用于临床研究。
References
[1] Colombo M, Carregal-Romero S, Casula M F,etal.ChemicalSocietyReviews[J], 2012, 41 (11): 4306-4334.
[2] Laurent S, Saei A A, Behzadi S,etal.ExpertOpiniononDrugDelivery[J], 2014, 11 (9): 1449-1470.
[3] Chung T H, Pan H C, Lee W C.JournalofMagnetismandMagneticMaterials[J], 2007, 311 (1): 36-40.
[4] Xie J, Yan C Z, Zhang Y,etal.ChemistryofMaterials[J], 2013, 25 (18): 3702-3709.
[5] Fan K L, Cao C Q, Pan Y X,etal.NatureNanotechnology[J], 2012, 7 (7): 459-464.
[6] Alphandery E, Guyot F, Chebbi I.InternationalJournalofPharmaceutics[J], 2012, 434 (1-2): 444-452.
[7] Chen B, Li Y, Zhang X Q,etal.MaterialsLetters[J], 2016, 170: 93-96.
[8] Laurent S, Forge D, Port M,etal.ChemicalReviews[J], 2010, 110 (4): 2574-2574.
[9] Duguet E, Vasseur S, Mornet S,etal.Nanomedicine[J], 2006, 1 (2): 157-168.
[10]Molday R S, Yen S P S, Rembaum A.Nature[J], 1977, 268 (5619): 437-438.
[11]Deng Y H, Deng C H, Qi D W,etal.AdvancedMaterials[J], 2009, 21 (13): 1377-1382.
[12]Uchida M, Flenniken M L, Allen M,etal.JournaloftheAmericanChemicalSociety[J], 2006, 128 (51): 16626-16633.
[13]Douglas T, Strable E, Willits D,etal.AdvancedMaterials[J], 2002, 14 (6): 415-+.
[14]Uchida M, Terashima M, Cunningham C H,etal.MagneticResonanceinMedicine[J], 2008, 60 (5): 1073-1081.
[15]Blakemore R P, Short K A, Bazylinski D A,etal.GeomicrobiologyJournal[J], 1985, 4 (1): 53-71.
[16]Heyen U, Schuler D.AppliedMicrobiologyandBiotechnology[J], 2003, 61 (5-6): 536-544.
[17]Rondinone A J, Samia A C S, Zhang Z J.JournalofPhysicalChemistryB[J], 1999, 103 (33): 6876-6880.
[18]Neuberger T, Schopf B, Hofmann H,etal.JournalofMagnetismandMagneticMaterials[J], 2005, 293 (1): 483-496.
[19]Moghimi S M, Hunter A C, Murray J C.PharmacologicalReviews[J], 2001, 53 (2): 283-318.
[20]Wang R B, Billone P S , Mullett W M.JournalofNanomaterials[J], 2013, 2013(3):1.
[21]Tourdias T, Roggerone S, Filippi M,etal.Radiology[J], 2012, 264 (1): 225-233.
[22]Lee H Y, Lee S H, Xu C J,etal.Nanotechnology[J], 2008, 19 (16):165101.
[23]Naoe M, Ogawa Y, Morita J,etal.Cancer[J], 2007, 109 (7): 1439-1445.
[24]Sonvico F, Dubernet C, Colombo P,etal.CurrentPharmaceuticalDesign[J], 2005, 11 (16): 2091-2105.
[25]Oh Y, Lee N, Kang H W,etal.Nanotechnology[J], 2016, 27 (11): 115101.
[26]Jordan A, Wust P, Fahling H,etal.InternationalJournalofHyperthermia[J], 1993, 9 (1): 51-68.
[27]Jain K K.TechnologyinCancerResearch&Treatment[J], 2005, 4 (4): 407-416.
[28]Maier-Hauff K, Ulrich F, Nestler D,etal.JournalofNeuro-Oncology[J], 2011, 103 (2): 317-324
[29]Le B, Shinkai M, Kitade T,etal.JournalofChemicalEngineeringofJapan[J], 2001, 34 (1): 66-72.
[30]Powell J J, Bruggraber S F A, Faria N,etal.Nanomedicine-NanotechnologyBiologyandMedicine[J], 2014, 10 (7): 1529-1538.
[31]Kaittanis C, Shaffer T M, Ogirala A,etal.NatureCommunications[J], 2014, 5 (3): 3384
[32]Sun J B, Duan J H, Dai S L,etal.CancerLetters[J], 2007, 258 (1): 109-117.
[33]Fuchigami T, Kawamura R, Kitamoto Y,etal.Langmuir[J], 2011, 27 (6): 2923-2928.
[34]Arami H, Khandhar A, Liggitt D,etal.ChemicalSocietyReviews[J], 2015, 44 (23): 8576-8607.
[35]Thu M S, Bryant L H, Coppola T,etal.NatureMedicine[J], 2012, 18 (3): 463-U165.
[36]Karussis D, Karageorgiou C, Vaknin-Dembinsky A,etal.ArchivesofNeurology[J], 2010, 67 (10): 1187-1194.
[37]Richards J M J, Shaw C A, Lang N N,etal.Circulation-CardiovascularImaging[J], 2012, 5 (4): 509-517.
[38]Chen Z, Yin J J, Zhou Y T,etal.ACSNano[J], 2012, 6 (5): 4001-4012.
[39]Zhang W, Hu S L, Yin J J,etal.JournaloftheAmericanChemicalSociety[J], 2016, 138 (18): 5860-5865.
[40]Chung E Y, Kim H M, Lee G H,etalCarbohydratePolymers[J], 2012, 90 (4): 1725-1731.
[41]Qiu S, Ge N J, Sun D K,etal.IeeeTransactionsonBiomedicalEngineering[J], 2016, 63 (4): 730-736.
[42]Mah C, Fraites T J, Zolotukhin I,etal.MolecularTherapy[J], 2002, 6 (1): 106-112.
[43]Namiki Y, Fuchigami T, Tada N,etal.AccountsofChemicalResearch[J], 2011, 44 (10): 1080-1093.
[44]Sasaki T, Iwasaki N, Kohno K,etal.JournalofBiomedicalMaterialsResearchPartA[J], 2008, 86A (4): 969-978.
[45]Meng J, Zhang Y, Qi X,etal.Nanoscale[J], 2010, 2 (12): 2565-2569.
[46]Meng J, Xiao B, Zhang Y,etal.ScientificReports[J], 2013, 3: 2655.
[47]Sun J, Liu X, Huang J,etal.ScientificReports[J], 2014, 4: 5125.
[48]Wang Q, Chen B, Cao M,etal.Biomaterials[J], 2016, 86: 11-20.
[49]Han J, Kim B, Shin J-Y,etal.ACSNano[J], 2015, 9 (3): 2805-2819.
[50]Xiong F, Wang H, Feng Y,etal.ScientificReports[J], 2015, 5: 8579.
[51]Wang Y, Santos A, Evdokiou A,etal.JournalofMaterialsChemistryB[J], 2015, 3 (36): 7153-7172.
(本文为本刊约稿 编辑 盖少飞)
Current Status and Development of Pharmaceutical Iron Based Nanomaterials
CHEN Bo1,2, GU Ning1,2
(1.Jiangsu Key Laboratory for Biomaterials and Devices, State Key Laboratory of Bioeletronics, School of Biological Sciences & Medical Engineering, Southeast University, Nanjing 210096, China)(2.Collaborative Innovation Center of Suzhou Nano-Science and Technology, Suzhou 215123, China)
Iron-based nanomaterial is made of nano-sized iron, iron oxide and ferroalloy by nature product or artificial synthesis. According to different structures and compositions, iron-based pharmaceutical nanomaterials can be classified into super paramagnetic iron oxide nanoparticles, magnetic iron oxide microspheres, magnetoferritin, magnetic iron oxide liposome, ferroalloy nanoparticle andetc. Iron-based nanomaterial has remarkable size effect, surface effect and quantum effect, especially unique magnetic properties, which makes it be widely used in magnetic resonance imaging, bioseparationinvitro, magnetic hyperthermia and drug delivery. Moreover, quite a few products have been approved in market or under clinical trials. Ideal iron-based nanomedicine should own important characteristic including definite structure, stable physical properties, uniform distribution, scalable production, safety and effectivenessinvivo. The drawbacks that confine medicinal application of iron-based nanomaterial depend on oxidative stress induced by iron ion and toxicity by iron overload in body. This article reviews research status of iron-based medicinal nanomaterials and the facing opportunities and challenges, and gives a prospects for the development finally.
iron-based nanomaterials; medicinal application; preparation method; clinical research; development prospect
2016-10-18
国家自然科学基金国际合作重点项目(61420106012)
陈 博,男,1987年生,博士研究生
顾 宁,男,1964年生,教授,博士生导师, Email:guning@seu.edu.cn
10.7502/j.issn.1674-3962.2017.03.08
O614.811; TB383
A
1674-3962(2017)03-0211-08
