UPLC-Q-TOF/MS在烘焙食品中羧甲基赖氨酸和羧乙基赖氨酸检测中的应用
2017-04-08郑小严周燕琼
林 钦,郑小严,陈 纯,戴 明,周燕琼,张 英
(1.福建省产品质量检验研究院,福建 福州 350002;2.浙江大学 生物系统工程与食品科学学院,浙江 杭州 310058)
研究报告
UPLC-Q-TOF/MS在烘焙食品中羧甲基赖氨酸和羧乙基赖氨酸检测中的应用
林 钦1*,郑小严1,陈 纯2,戴 明1,周燕琼2,张 英2
(1.福建省产品质量检验研究院,福建 福州 350002;2.浙江大学 生物系统工程与食品科学学院,浙江 杭州 310058)
建立了烘焙食品中羧甲基赖氨酸(CML)和羧乙基赖氨酸(CEL)的UPLC-Q-TOF/MS检测方法。烘焙食品经脱脂、还原、沉淀蛋白、酸水解释放出CML和CEL,使用FMOC-Cl柱前衍生和HLB小柱固相萃取净化后,采用UPLC-Q-TOF/MS检测。CML和CEL在1~700 ng/mL浓度范围内均呈良好的线性关系,线性回归系数r>0.999。CML和CEL的检出限均为0.1 mg/kg;回收率为94.4%~108.3%;相对标准偏差(RSD,n=6)为0.4%~6.2%。该方法定性、定量准确,灵敏度高,能很好地应用于烘焙食品中CML和CEL的检测。
超高效液相色谱-四极杆-飞行时间质谱仪;烘焙食品;羧甲基赖氨酸;羧乙基赖氨酸
羧甲基赖氨酸(CML)和羧乙基赖氨酸(CEL)是食品在加工过程中发生美拉德反应时产生的蛋白质化学修饰以及生物体内的糖氧化、脂质氧化和羰基应激的一个重要的生物指标。它是晚期糖基化终末产物(Advanced glycosylation end products,AGEs)最主要的单体之一,常作为食品中或生物体内AGEs含量的重要生物标记物。AGEs与许多疾病的病理机制有关,与人类健康有着密切联系,它积累于机体的不同组织器官,如血管内皮细胞、神经细胞、肾皮质等组织纤维,不仅可以直接影响细胞和组织功能,参与疾病的产生,也可通过与特异受体结合发生反应来改变蛋白质和细胞功能,导致机体的病理变化,如糖尿病及其多种并发症[1]。
建立灵敏、有效的AGEs检测以及鉴定方法,并研究抑制AGEs的形成是国内外的一个研究重点。福建省是烘焙食品的生产和消费大省,市场正以每年20%以上的增速稳步递增,全省规模企业的产值已超过50亿元,并向规模化、品牌化的方向发展。由于烘焙食品常具有高糖、高脂特点,又由高温烘焙制得,因此,最容易产生美拉德反应,如何控制好美拉德反应和提高加工工艺是企业长远发展亟需面对的问题。
目前,已报道的CML检测方法有:(1)酶联免疫吸附法(ELISA)[2-3]。通过单克隆抗CML抗体来检测CML,但该方法的缺点是缺乏选择性和非特异性,可能会出现假阳性或导致实验结果过高。(2)液相色谱法。使用高效液相色谱结合荧光检测器对样品中的CML进行分析时,需采用衍生剂邻苯二甲醛对样品进行柱前衍生[4-5],但该方法衍生产物不稳定;或采用FMOC-Cl对生物样品进行柱前衍生[6],CML在激发波长260 nm和发射波长310 nm处有特征吸收峰,利用荧光检测器对其进行定性及定量,但该方法耗时长,干扰较大,定量准确度差。(3)使用气相色谱-质谱法(GC-MS)[7-9]。该方法需采用易挥发的衍生剂对样品进行衍生,衍生时间较长,并且操作过程比较复杂。(4)液相色谱-串联质谱检测法[10]。该方法的缺点是离子抑制较强,样品前处理和流动相中均使用九氟戊酸离子对试剂,该试剂易在质谱仪中残留,造成仪器灵敏度下降,并且由于处理后溶液中离子对试剂含量的不同会造成CML和CEL色谱峰的保留时间不稳定,不利于定性与定量分析。本研究在已有文献方法的基础上进行优化和改进,采用柱前衍生化、固相萃取、UPLC-Q-TOF/MS、同位素稀释等技术同时检测烘焙食品中CML和CEL含量,具有高效、准确、灵敏的特点。
1 实验部分
1.1 实验仪器
超高效液相色谱仪Waters Acquity UPLC系统配G2-S QTof质谱仪(美国沃特世公司);20管固相萃取装置(美国安捷伦公司);DHG-9140A恒温干燥箱(上海精宏试验设备有限公司);Avanti J-E冷冻高速离心机(美国贝克曼公司);Milli-Q超纯水纯化系统(美国Millipore公司,Advantage);BSA224S分析天平(赛多利斯北京有限公司);涡旋混合器(美国热电,VORTEX MAXI MIXⅡ)。
1.2 试剂和材料
实验用水为超纯水;甲醇、乙腈(色谱纯,山东禹王实业有限公司化工分公司);衍生剂:9-芴基甲基氯甲酸酯(FMOC-Cl,色谱纯,纯度≥97.0%,上海安谱实验科技股份有限公司);标准品:羧甲基赖氨酸(C8H16N2O4,纯度98%)、氘代羧甲基赖氨酸(CML-D4,C8H12D4N2O4,纯度98%)均为加拿大TRC公司生产;羧乙基赖氨酸(C9H18N2O4,纯度98.6%)和氘代羧乙基赖氨酸(CEL-D4,C9H14D4N2O4,纯度91.1%)为法国PolyPeptide Laboratories生产;固相萃取柱:Oasis HLB 60 mg/3 mL(美国Waters公司),使用前分别以2 mL甲醇和2 mL 0.5%甲酸溶液活化平衡,保持柱体湿润。各种代表性样品,包括油炸食品(薯片、薯条、沙琪玛等)、焙烤食品(曲奇、面包、饼干等)均购自当地超市。
标准溶液和内标溶液配制:分别准确称取适量CML和CEL标准品,用70%甲醇(如无特殊说明均为体积分数)溶解配成CML和CEL浓度约为200 μg/mL的标准储备溶液,置于4 ℃冰箱中保存;分别称取适量的CML-D4和CEL-D4标准品,用70%甲醇溶液溶解配制成约40 μg/mL的内标标准储备溶液,置于4 ℃冰箱中保存;移取适量CML和CEL标准溶液,准确加入同位素内标溶液,用水稀释定容至5 mL,混匀;标准系列浓度约为1~700 ng/mL,内标浓度均为80 ng/mL。
1.3 样品处理
1.3.1 样品处理方法 称取1.0 g(精确至0.1 mg)研磨粉碎后的样品置于50 mL聚丙烯离心管中,加入10 mL正己烷,充分涡旋,于4 ℃,10 000 r/min离心3 min,弃去正己烷层,重复上述正己烷脱脂过程2次,氮吹(40 ℃)挥去正己烷。向脱脂后的样品中加入10 mL 0.2 mol/L硼砂盐缓冲液,涡旋混匀,加入1.0 mL 2 mol/L硼氢化钠溶液,轻轻振摇混匀,4 ℃放置过夜。还原后的样品中加入2.5 mL 60%(质量分数)三氯乙酸溶液,混匀,4 ℃下以10 000 r/min离心5 min,吸出上清液弃去。将离心管中沉淀的物质用20 mL 6 mol/L HCl溶液转移至50 mL水解反应釜中,110 ℃下水解22~24 h,取出冷却至室温。将水解液用水转移定容至50 mL容量瓶中,混匀,滤纸过滤,收集滤液。准确吸取1.00 mL滤液于5 mL刻度试管中,加入2 mL水,再加入100 μL浓度均为4.0 μg/mL 的CML-D4和CEL-D4同位素内标混合溶液,混匀,用50%(质量分数)KOH溶液调pH值为7.0~9.0,用水定容至5 mL,涡旋混匀备用。
1.3.2 样品的衍生和净化 准确移取上述溶液500 μL,加入500 μL乙腈,涡旋混匀,加入200 μL 5%(质量分数)硼砂溶液和200 μL 15 g/L FMOC-Cl乙腈溶液,涡旋混匀,静置10 min,加入10 μL甲酸,混匀,再用40%乙腈溶液稀释至约3 mL,涡旋混匀;将该衍生后溶液以1~2滴/s的速度过Oasis HLB 60 mg/3 mL固相萃取柱,待样液完全流出后,用2 mL 40% 乙腈溶液淋洗,真空抽干,再用2 mL二氯甲烷淋洗,弃去全部流出液,真空抽干,最后用5 mL 5% 氨水甲醇溶液洗脱,真空抽干并收集流出液。将洗脱液于40 ℃氮吹浓缩至近干,用50%乙腈溶液溶解残留物定容至2 mL,涡旋混匀,过0.22 μm PTFE滤膜后上机测试。
1.4 UPLC-Q-TOF/MS分析条件
1.4.1 色谱分析条件 色谱柱:Waters BEH C18(1.7 μm,2.1 mm×100 mm);柱温:35 ℃;进样量:10 μL;流速:0.3 mL/min;流动相:A为0.5%甲酸溶液,B为乙腈;洗脱梯度:0~4.5 min,50%~41% A;4.5~5.0 min,41% A;5.0~7.0 min,41%~2% A;7.0~9.0 min,2%~50% A。
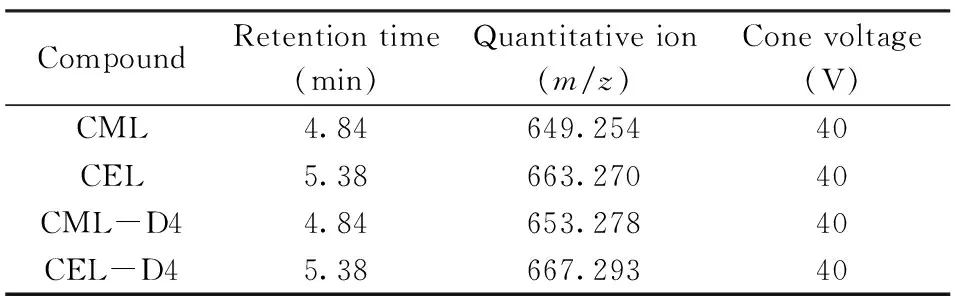
表1 主要质谱参数Table 1 Q-TOF/MS parameters
1.4.2 Q-TOF/MS分析条件 电离源:大气压电喷雾离子源正离子模式(ESI+);毛细管电压3.00 kV;源温度100 ℃;脱溶剂气温度400 ℃;脱溶剂气流量700 L/h;锥孔反吹气流量50 L/h;检测方式:MS Scan灵敏度模式;扫描m/z范围:500~900 Da;扫描时间:0.3 s;采集时间:3~6.5 min;质量校准溶液:1 ng/mL脑啡肽溶液;校准液m/z:556.277 1;校准频率:10 s;定量离子质量精度:0.02 Da;特征离子及参数见表1。
2 结果与讨论
2.1 质谱条件的优化
取浓度约为800 ng/mL的CML,CEL,CML-D4和CEL-D4混合标准溶液,按“1.3.2”步骤衍生和净化处理,由于处理后溶液中仍含有大量衍生副产物,直接注入质谱仪扫描时,目标物的峰往往掩盖在大量的杂质峰下,不利于分辨。因此,本研究将标准处理溶液经色谱柱分离后,根据出峰时间进行质谱全扫描,得到比较简单的质谱扫描图。扫描结果发现在ESI(+)模式下,衍生物加H+后得到上述4种化合物的母离子m/z分别为649.255 6,663.269 7,653.280 5,667.294 8,同时还存在加Na+的离子峰,m/z为671.237 5,685.250 7,675.262 1和689.276 1,其优化锥孔电压等参数见表1,研究显示加H+模式具有更好的灵敏度。
已有文献建立了采用UPLC-MS/MS检测CML和CEL的方法[11],但发现大量的食品样品均存在某种氨基酸类物质,该物质与CML难以达到基线分离,其衍生产物的质荷比(653.198 3)与CML-D4(653.277 0)非常接近,并且具有相同的碎片离子,因此,在只能达到单位质量分辨的情况下,该物质的存在会造成一定的定量偏差。本研究利用Q-TOF/MS高质量分辨的特点,在分辨率为0.1 Da时排除了该杂质对CML-D4的干扰,同时,即使将分辨率降到0.01 Da,对峰高也基本无影响,因此,为保证检测的灵敏度并尽可能减少干扰,本方法最终设定质量分辨率为0.02 Da。由于CML-D4和干扰杂质碰撞碎裂后得到的灵敏度最大的碎片离子均为衍生剂碎片(m/z179.086 1)(见图1),采用Q-TOF/MS的MSMS模式将达不到分离干扰的目的,因此,本方法采用Q-TOF/MS的MS模式检测,经优化后最终确定的质谱仪参数如“1.4.2”。
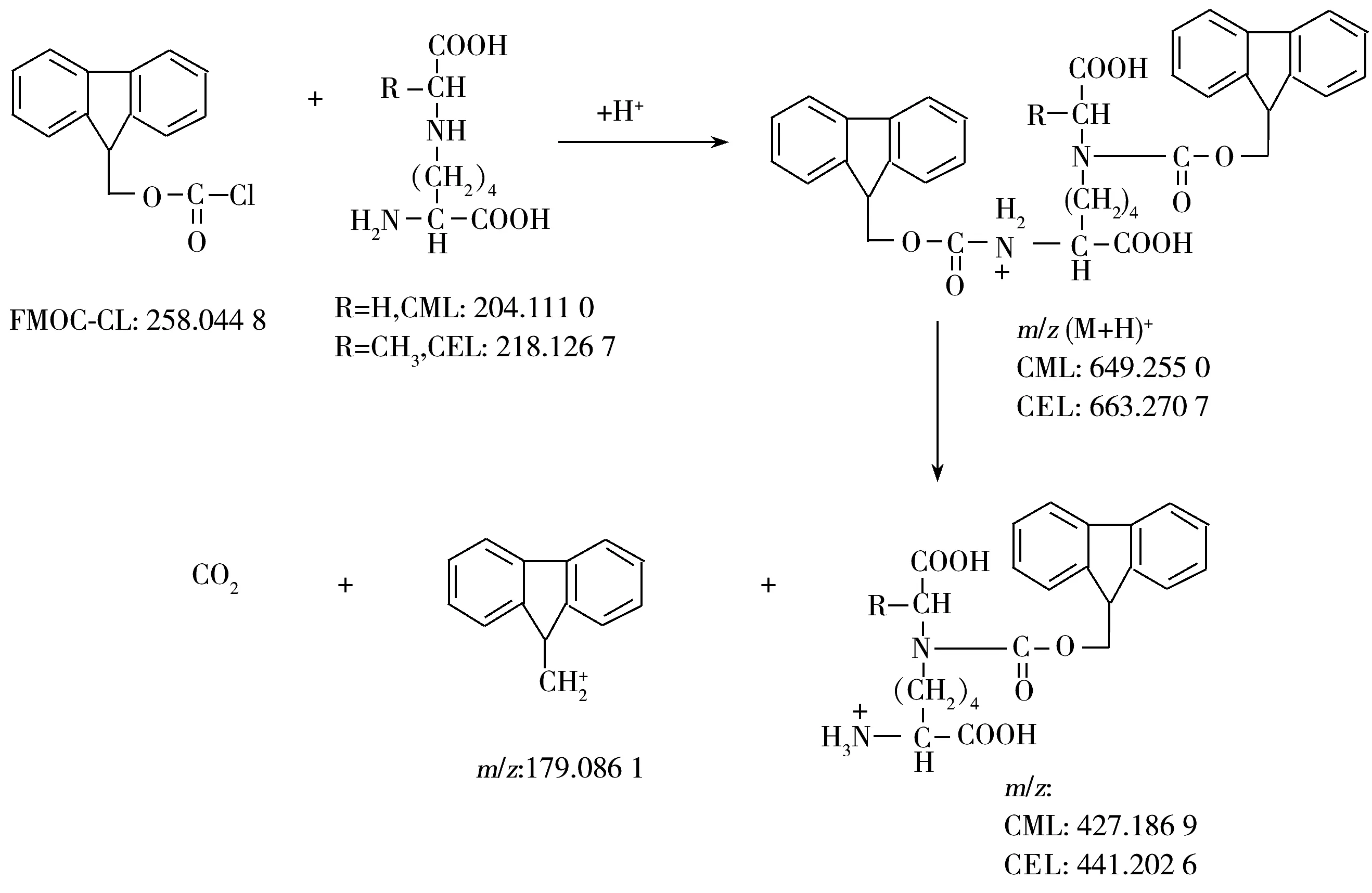
图1 CML和CEL的衍生途径和碰撞碎裂产物图Fig.1 Proposed reaction schematic for the derivatization of CML and CEL with FMOC-Cl and their proposed fragmentation pathways
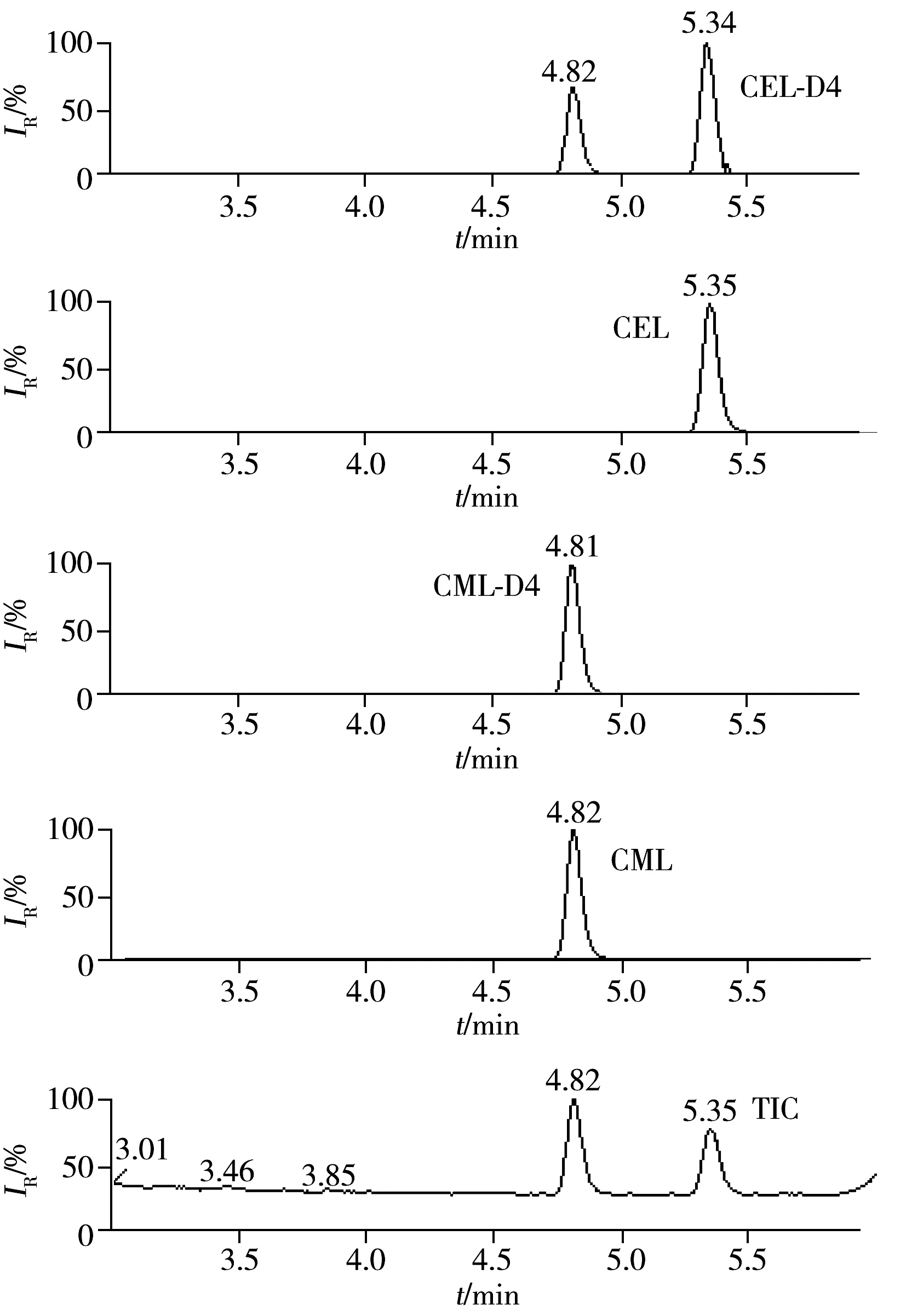
图2 标准品的总离子流图和提取离子监测图Fig.2 TIC and quantitative ion chromatograms of standard
2.2 色谱条件的优化
本方法采用超高效液相色谱技术和美国Waters公司1.7 μm粒径的C18色谱柱,具有极高的分离效率,考察了纯水-乙腈体系、0.1%甲酸-乙腈体系、0.3%甲酸-乙腈体系、0.5%甲酸-乙腈体系作为流动相的分离效果,实验发现0.5%甲酸-乙腈体系时,待测物CML与CEL具有最佳的峰形、分离度和灵敏度。调整洗脱梯度为“1.4.1”条件时,色谱分离图见图2。
2.3 前处理条件的优化
FMOC-Cl以其反应产物稳定、反应速度快且完全而成为一种十分理想的对氨基酸分析的衍生试剂[11]。本研究使用在UPLC-MS/MS检测法[12]中研制的FMOC-Cl柱前衍生和固相萃取方法处理样品。由于CML和CEL在食品中主要以与蛋白质中的氨基残基结合的方式存在,其蛋白加成产物一旦形成是非常稳定且不可逆的[13]。因此,目前文献基本采用将样品按脱脂、还原、沉淀蛋白、酸水解蛋白的步骤来释放样品中的CML和CEL[14]。本实验比较了4种样品处理方法的CML和CEL检测结果:①将样品直接酸水解;②将样品按脱脂、沉淀蛋白、酸水解蛋白的步骤处理;③将样品按脱脂、还原、沉淀蛋白、酸水解蛋白的步骤处理;④用水直接提取,在与水解法同样稀释倍数下测定样品中游离的CML和CEL浓度;同时将按方法③处理样品检测结果,以及与UPLC-MS/MS法检测结果相比较,结果见表2。

表2 不同处理方法和检测方法的结果比较(n=3)Table 2 The result comparsion of different processing methods and detection methods(n=3) ρ/(μg·L-1)
表2结果表明,未经还原处理的样品(方法①②)测得的CML含量明显高于经过还原处理的样品(方法③),说明硼氢化钠(NaBH4)能有效抑制CML的形成,NaBH4将形成CML的主要中间产物Fructoselysine(FL,果糖赖氨酸)还原为己糖醇赖氨酸,终止其在水解过程中氧化裂解生成CML[15]。因此,在测定生物样本或食品体系中CML的含量时,通常需将样品经过NaBH4还原处理,防止在高温水解过程中赖氨酸与糖类反应可能转化为CML,导致样品中CML的含量测定值过高。结果(方法④)还表明样品中的游离CML和CEL约占总量的0.6%~13%,CML和CEL在食品中主要以结合的方式存在。比较UPLC-Q-TOF/MS和UPLC-MS/MS检测结果,CEL的检测结果基本一致,CML的结果则由于CML-D4与干扰物的分离不完全,造成UPLC-MS/MS检测结果偏低约3%~9%。由此可确定,采用方法③的处理步骤和UPLC-Q-TOF/MS的检测方法能够得到最佳的检测结果。
2.4 线性范围与检出限
在1~700 ng/mL浓度范围内,以进行衍生反应的标准工作溶液浓度(X)为横坐标,以CML和CEL定量离子峰面积除以内标峰面积的值与内标浓度的乘积(Y)为纵坐标,绘制标准工作曲线,线性方程CML为Y=0.625X-0.483,CEL为Y=1.606X-1.486,相关系数均达到0.999。由最低浓度标准溶液的峰高与噪音的信噪比按3倍噪音峰高计算得到CML和CEL的仪器检出限均为0.1 mg/kg,按10倍噪音峰高计算CML和CEL的仪器定量下限均为0.3 mg/kg;同时,用CML浓度为11.0 ng/mL,CEL浓度为8.4 ng/mL的薯片样品峰高按3倍噪音峰高和10倍噪音峰高计算CML的方法检出限和定量下限分别为0.04 mg/kg和0.14 mg/kg,CEL的方法检出限和定量下限分别为0.05 mg/kg和0.15 mg/kg。用标准工作曲线对试样中待测组分进行内标法定量,试样溶液的响应值应在标准工作曲线的线性范围内。本方法具有良好的线性范围和灵敏度,适合对烘焙食品中微量CML和CEL的检测。

表3 不同烘焙食品中CML和CEL的加标回收率与相对标准偏差(n=6)Table 3 Spiked recoveries and RSDs of CML and CEL in different baking food samples(n=6)
2.5 回收率与精密度
实验发现烘焙食品中均含有CML和CEL,因此,取CML和CEL含量较低的薯片、沙琪玛和蛋糕3种样品进行3个水平的标准加标试验,每个加标做6个平行,结果见表3。该方法对CML的回收率为94.4%~107.2%,相对标准偏差(RSD)为0.4%~6.2%;对CEL的回收率为94.5%~108.3%,RSD为0.9%~6.2%。可见该方法对CML和CEL均具有良好的回收率和精密度,适合烘焙食品的检测。
2.6 实际样品的检测
采集市场上福建省企业生产的薯片、饼干和蛋糕等烘焙和油炸类等样品68个批次,采用本方法进行检测,由于CML和CEL的生成与蛋白质特别是蛋白质中赖氨酸的含量有很大的关系,因此,本文参照国外文献[14]检测了食品样品中的蛋白质和赖氨酸含量,并将CML和CEL含量进行相应折算,检测结果见表4。
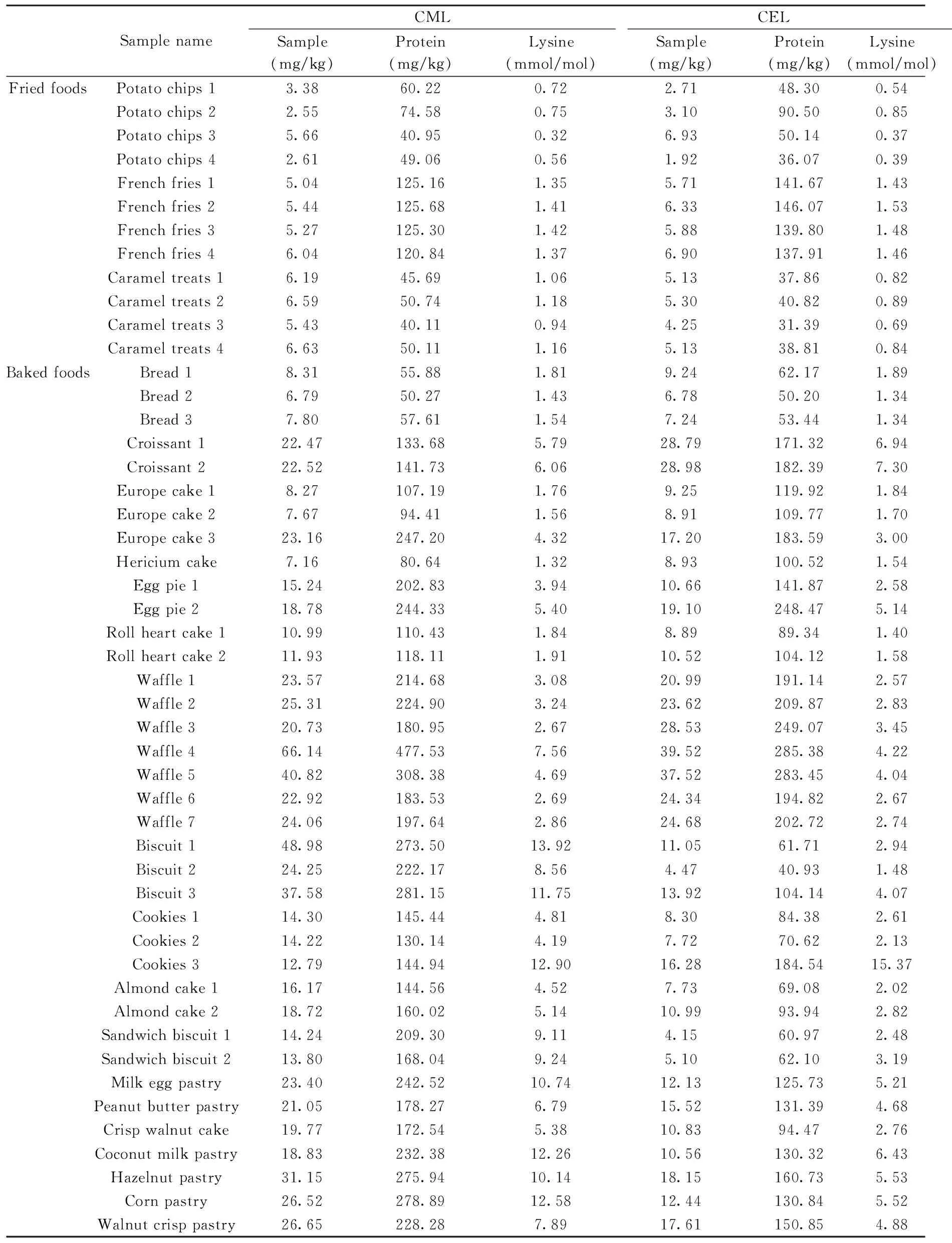
表4 市售各类加工食品中CML和CEL的实测含量(n=3)Table 4 Contents of CML and CEL in various processed foods(n=3)
(续表4)
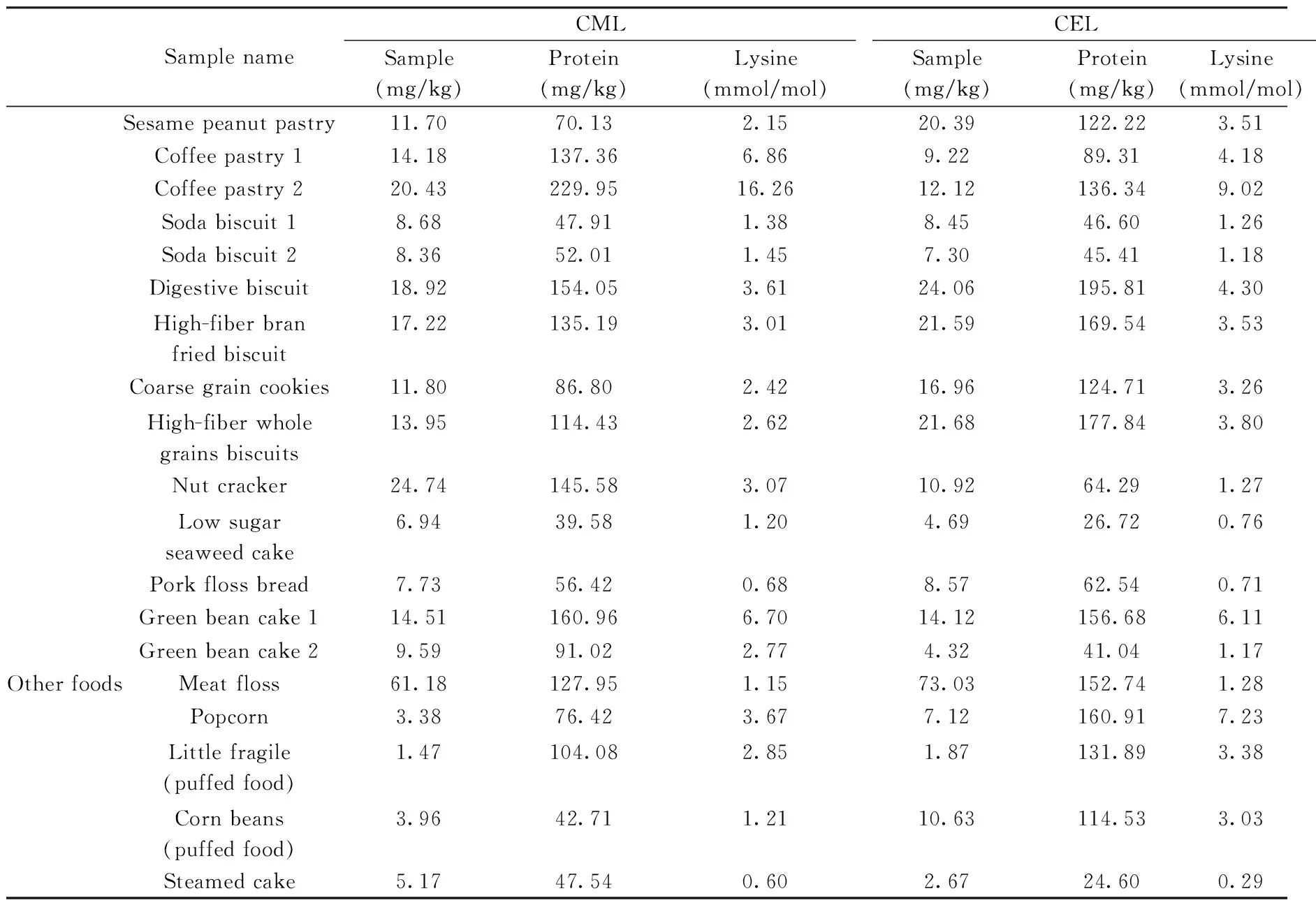
SamplenameCMLCELSample(mg/kg)Protein(mg/kg)Lysine(mmol/mol)Sample(mg/kg)Protein(mg/kg)Lysine(mmol/mol)Sesamepeanutpastry11.7070.132.1520.39122.223.51Coffeepastry114.18137.366.869.2289.314.18Coffeepastry220.43229.9516.2612.12136.349.02Sodabiscuit18.6847.911.388.4546.601.26Sodabiscuit28.3652.011.457.3045.411.18Digestivebiscuit18.92154.053.6124.06195.814.30High-fiberbranfriedbiscuit17.22135.193.0121.59169.543.53Coarsegraincookies11.8086.802.4216.96124.713.26High-fiberwholegrainsbiscuits13.95114.432.6221.68177.843.80Nutcracker24.74145.583.0710.9264.291.27Lowsugarseaweedcake6.9439.581.204.6926.720.76Porkflossbread7.7356.420.688.5762.540.71Greenbeancake114.51160.966.7014.12156.686.11Greenbeancake29.5991.022.774.3241.041.17OtherfoodsMeatfloss61.18127.951.1573.03152.741.28Popcorn3.3876.423.677.12160.917.23Littlefragile(puffedfood)1.47104.082.851.87131.893.38Cornbeans(puffedfood)3.9642.711.2110.63114.533.03Steamedcake5.1747.540.602.6724.600.29
从测定结果看,油炸类食品薯片、薯条和沙琪玛等中的CML和CEL含量分别在2.55~6.63 mg/kg和1.92~6.93 mg/kg之间。焙烤类食品包括面包、蛋糕、曲奇、饼干等,CML的含量在6.79~66.14 mg/kg之间,CEL的含量在4.15~39.52 mg/kg之间。同一种食品,可能由于生产工艺控制的不同,造成了产品中CML和CEL含量有很大区别,如7个华夫饼中有5个的CML和CEL含量均在20~25 mg/kg和20~30 mg/kg之间,但有1个为40.82 mg/kg和37.52 mg/kg,另有1个为66.14 mg/kg和39.52 mg/kg;3个欧式蛋糕中,2个CML和CEL含量均在8 mg/kg和9 mg/kg左右,但有1个含量为23.16 mg/kg和17.20 mg/kg。此外,采用较低温度制作的蒸蛋糕中CML和CEL的含量明显低于高温烘烤的蛋糕。同时,分析发现以蛋白质含量折算的烘焙食品中CML含量在39.58~477.53 mg/kg蛋白之间,以赖氨酸含量折算的烘焙食品中CML含量在0.32~16.26 mmol/mol赖氨酸之间;以蛋白质含量折算的烘焙食品中CEL含量在24.60~285.38 mg/kg蛋白之间,以赖氨酸含量折算的烘焙食品中CEL含量在0.37~15.37 mmol/mol赖氨酸之间。可见,食品中CML和CEL含量与蛋白质含量或赖氨酸含量不存在简单的定量关系,其含量与食品中糖类、脂肪含量及加工工艺等都有很大关系,这些还有待今后做更细致的研究。
3 结 论
本文建立并优化了UPLC-Q-TOF/MS同步检测烘焙类等食品中CML和CEL的方法,与UPLC-MS/MS检测方法相比,本方法有效解决了相近分子量氨基酸对检测的干扰,具有更优的定性、定量能力,在实际样品检测中取得了良好的效果,有助于指导生产工艺的改进。该方法适用性好,准确度和灵敏度高,能很好地应用于食品中CML和CEL的检测。
[1] Singh R,Barden A,Mori T,Beilin L.Diabetologia,2001,44:129-146.
[2] Liu Z Q,Hou F F,Wang L,Shu Y M.Med.J.Chin.PLA(刘志强,侯凡凡,王力,舒友梅.解放军医学杂志),2000,25(6):391-393.
[3] Tauer A,Hasenkopf K,Kislinger K,Frey I,Pischetsrieder M.Eur.FoodRes.Technol.,1999,209:72-76.
[4] Friess U,Waldner M,Wahl H G,Lehmann R,Haring H U,Voelter W,Schleicher E.J.Chromatogr.B,2003,794:273-280.
[5] Spanneberg R,Osswald F,Kolesov I,Anton W,Radusch H J,Glomb M A.J.Agric.FoodChem.,2010,58(6):3580-3585.
[6] Van de Merbel N C,Mentink C J,Hendriks G,Wolffenbuttel B H.J.Chromatogr.B,2004,808(2):163-168.
[7] Wang J,Tian S L,Sun W H,Lin H,Li Z X.Chin.J.Anal.Chem.(王菁,田盛兰,孙伟红,林洪,李振兴.分析化学),2015,43(8):1187-1192.
[8] Brand M,Pamplona R,Portero-Otín M,Requena J,Roebuck S,Buckingham J,Clapham J,Cadenas S.Biochem.J.,2002,368:597-603.
[10] Beisswenger P J,Howell S K,Russell G,Miller M E,Rich S S,Mauer M.AminoAcids,2014,46(2):311-319.
[11] Liu Y,Xie M X,Long M,Zhang X T.Mod.Instrum.(刘媛,谢孟峡,龙梅,张晓彤.现代仪器),1999,6:14-17.[12] Zhou Y Q,Lin Q,Jin C,Cheng L,Zheng X Y,Dai M,Zhang Y.J.FoodSci.,2015,80(2):207-217.
[13] Schmidt A M,Yan S D,Wautier J L,Stern D.Circ.Res.,1999,84:489-497.
[14] Assar S H,Moloney C,Lima M,Magee R,Ames J M.AminoAcids,2009,36(2):317-326.
[15] Hartkopf J,Pahlke C,Liidemann G,Erbersdobler H F.J.Chromatogr.A,1994,672:242-246.
Application of Ultra Performance Liquid Chromatography-Quadrupole Time-of-flight Mass Spectrometry in Determination of CML and CEL in Baking Foods
LIN Qin1*,ZHENG Xiao-yan1,CHEN Chun2,DAI Ming1,ZHOU Yan-qiong2,ZHANG Ying2
(1.Fujian Inspection and Research Institute for Product Quality,Fuzhou 350002,China;2.College of Biosystems Engineering and Food Science,Zhejiang University,Hangzhou 310058,China)
A method was developed for the determination of Nε-(carboxymethyl)lysine(CML) and Nε-(carboxyethyl)lysine(CEL) in baking food using ultra performance liquid chromatography-quadrupole Time-of-flight mass spectrometry(UPLC-Q-TOF/MS).CML and CEL were released from the baking foods through the process of sample degreasing,reduction reaction,precipitation and acid hydrolysis of acquired protein,treated by pre-column derivation with FMOC-Cl,and purified with HLB solid-phase extraction(SPE) column.Then the contents of CML and CEL in pretreated samples were determined by UPLC-Q-TOF/MS.All the target compounds exhibited good linearity(r>0.999) over the concentration range of 1-700 ng/mL.The detection limits of CML and CEL were all 0.1 mg/kg and the mean recoveries were in the range of 94.4%-108.3% with relative standard deviations(RSD,n=6) of 0.4%-6.2%.The method was accurate and sensitive,and was suitable for the detection of CML and CEL contents in baking foods.
ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry(UPLC-Q-TOF/MS);baking foods;Nε-(carboxymethyl)lysine(CML);Nε-(carboxyethyl)lysine(CEL)
10.3969/j.issn.1004-4957.2017.03.001
2016-08-15;
2016-10-26
福建省科技厅民生科技专项(2013Y6003)
O657.7;O657.63
A
1004-4957(2017)03-0297-08
*通讯作者:林 钦,高级工程师,研究方向:食品安全检测,Tel:0591-83762015,E-mail:phlqfcii@126.com
