嵌合抗原受体T细胞在白血病中的研究及应用
2017-04-08王文媛李莉娟许丽丽张连生
王文媛,李莉娟,许丽丽,周 文,张连生
(兰州大学第二临床医学院 兰州大学第二医院 血液科,甘肃 兰州 730030)
·综述·
嵌合抗原受体T细胞在白血病中的研究及应用
王文媛,李莉娟,许丽丽,周 文,张连生
(兰州大学第二临床医学院 兰州大学第二医院 血液科,甘肃 兰州 730030)
嵌合抗原受体T细胞是通过单抗识别肿瘤抗原,将抗原抗体的高亲和性与T细胞的杀伤作用相结合,通过非MHC限制性的方法特异性杀伤肿瘤细胞。目前嵌合抗原受体T细胞CD19在治疗急性淋巴细胞白血病(ALL)及慢性淋巴细胞白血病(CLL)中均取得了良好的疗效。本文将嵌合抗原受体T细胞在ALL及CLL中治疗进展做一综述。
白血病,T细胞;T淋巴细胞;嵌合素蛋白质类
嵌合抗原受体(chimericantigenreceptor,CAR)T细胞疗法是近年来发展非常迅速的一种新的细胞免疫治疗技术。目前,CAR技术已从基本理论研究过渡到临床应用,在血液系统肿瘤和实体瘤的治疗上取得了显著成绩。本文将CAR-T技术在急性淋巴细胞白血病(ALL)及慢性淋巴细胞白血病(CLL)的治疗进展做一介绍。
1 CAR-T作用机制
CAR-T疗法是通过单抗识别肿瘤抗原,将抗原抗体的高亲和性和T淋巴细胞的杀伤作用相结合,构建特异性CAR[1]。通过病毒载体、转位子融合、电穿孔等方式[2]将编码CAR的基因插入到T淋巴细胞使T淋巴细胞表达这种CAR,然后经体外扩增纯化这种基因修饰过的T细胞,输入到体内。CAR-T在体内特异性识别靶抗原,通过活化扩增及分泌细胞因子,以非主要组织相容性抗原(MHC)限制性的方式特异性杀伤靶细胞[3]。同时CAR-T细胞不仅可识别蛋白质抗原,也可识别糖类抗原[4]、蛋白多糖[5]、糖化蛋白[6]、神经节苷脂[7],扩大了靶向抗原的范围。理想的肿瘤靶抗原是仅表达在肿瘤细胞上,而不表达在正常细胞上,也不进入循环系统,且为肿瘤细胞生长存活所必须,这样就大大减小了CAR治疗的选择压力[8]。
2 CAR的基本结构及发展
目前,大多数CAR由胞外抗原结合区[由来源于单克隆抗体的轻链(VL)和重链(VH)组成, 中间由带韧性的铰链区连接形成单链抗体(singlechainfragmentvariable,scFv)]、跨膜区域和胞内信号转导区组成[9-10]。第一代CAR-T将免疫球蛋白样scFv和FcεRI受体(γ链)或CD3复合物(ζ链)胞内结构域融合形成嵌合受体[11]。第二代CAR-T细胞加入了共刺激分子,如CD28,CD27,CD134(OX40)[12-13],CD137(4-1BB)[14],DAP10[15]。这些共刺激分子能提供不同的效应功能,相比于第一代有更强的抗肿瘤活性[10,16-17]。第三代CAR-T包含了更多的共刺激分子,以提高T细胞的细胞毒活性、增殖性与存活时间,促进细胞因子的释放[18](图1)。第四代CAR(又称TRUCKs),是在第三代CAR的基础上增加了编码CAR和(或)其反应性启动子的载体,在转基因产生的细胞因子作用下CAR产生有效信号,并能够招募免疫系统其他成员,放大抗肿瘤免疫效应[15,19](图2)。
3 CAR-T在B系白血病治疗中的应用
目前,在CAR-T治疗中已经有很多靶抗原,虽然CD19不是最早提出的肿瘤靶抗原,但是目前研究最成熟的,很多临床试验都是基于CD19进行研究的。CD19可作为一种理想的靶抗原,因为它可表达在大多数的B细胞恶性肿瘤上,包括B-ALL,CLL等,且不表达在造血干细胞上,即使消除所有的CD19+B细胞,临床也是可治疗的[20],但潜在的缺陷是CD19的表达不是肿瘤发生所必需的细胞表型,同时表型变异及逃逸也在相关研究中被提到[21-22]。
3.1CAR-T在急性淋巴细胞白血病中的应用 急性淋巴细胞白血病是一类造血干细胞的恶性克隆性疾病。临床结果显示,CD19在治疗急性淋巴细胞白血病中取得了良好的疗效,甚至在复发难治和化疗无效的患者中。
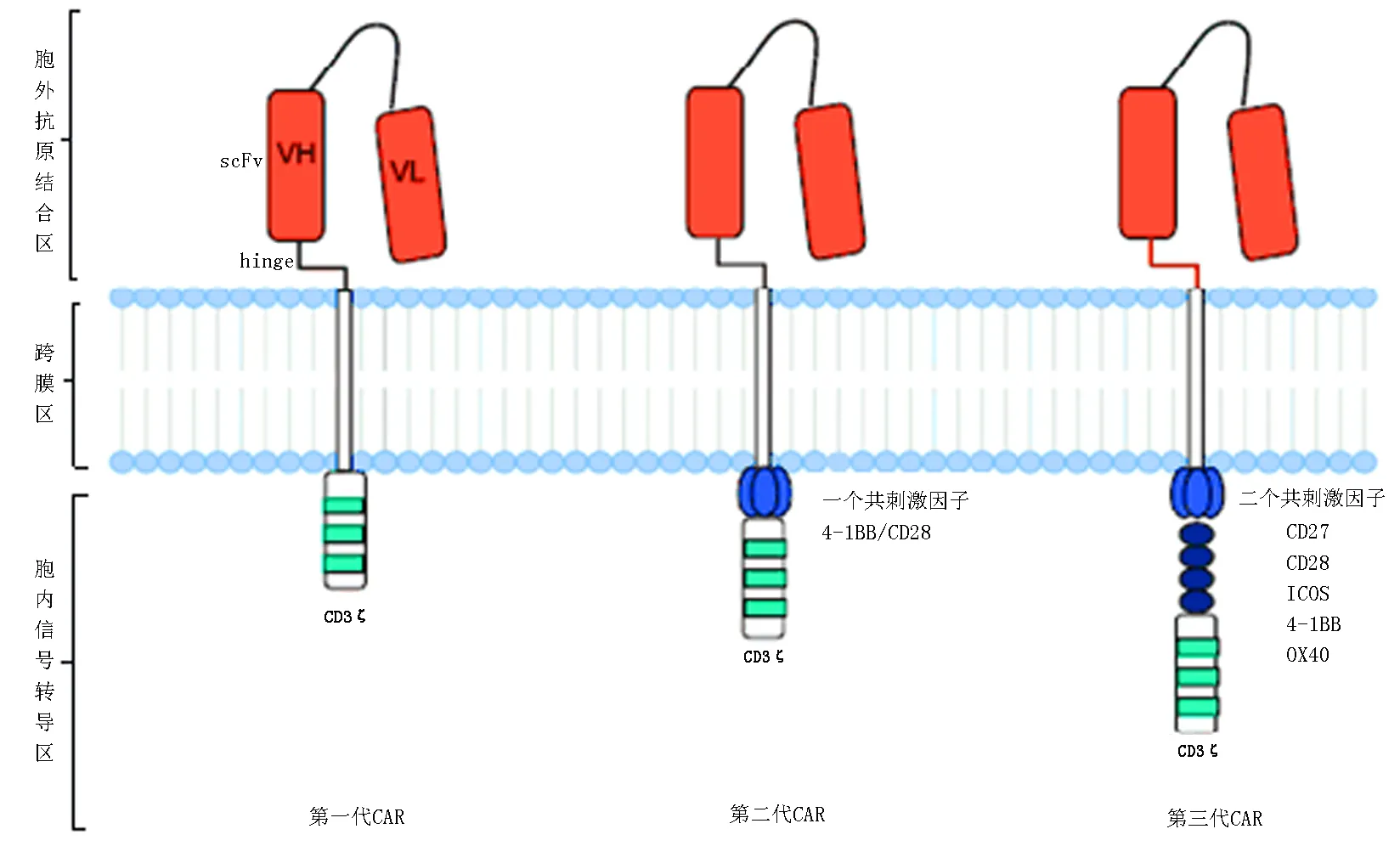
图1 第一、二、三代CAR的结构
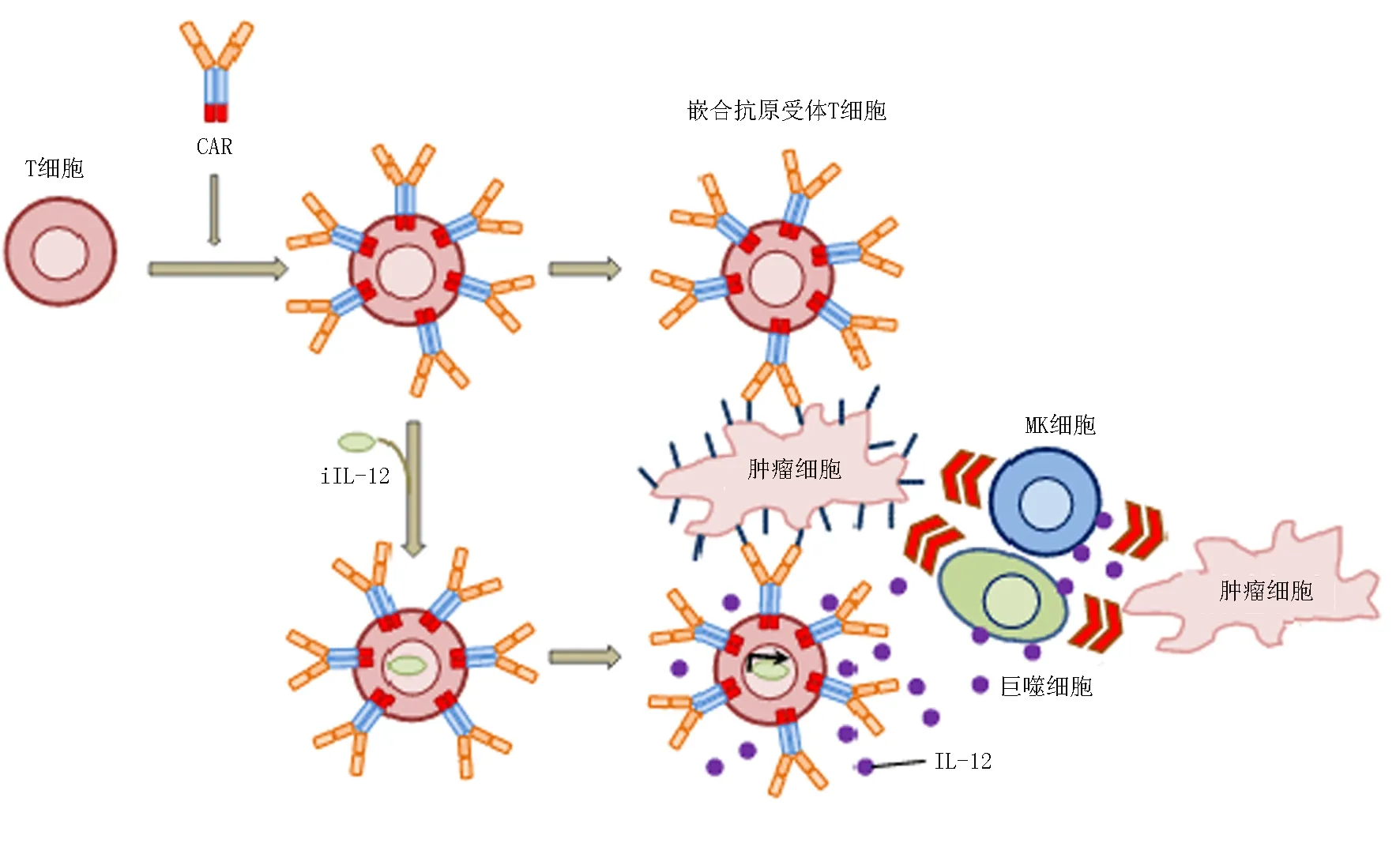
图2 第四代CAR/TRUCK的基本结构
2011年来自MSKCC的Brentjens等[23]首次报道应用CD19-CART治疗1例ALL得到完全缓解。然后再次应用CD19CAR-T细胞治疗16例复发成人B-ALL[24],行淋巴细胞清除后输注CAR-T[25],CR率达88%(75%MRD-)。所有的患者在输注后的1~2周CAR-T的数量达到高峰,且在输注后的2~3月仍可检测到CAR-T细胞[26]。2015年研究组再次纳入33例成人B-ALL,在可评估的32例患者中,CAR-T输注后CR率达91%,MRD阴性达82%,有趣的是,2例复发的患者CD19阴性。2013年来自宾夕法尼亚大学的Grupp等[27]首次报道应用CD19CAR-T细胞(CTL019细胞)治疗2例经异基因造血干细胞移植(allogeneichematopoieticstemcelltransplantation,allo-HSCT)治疗后复发难治的前B-ALL患儿,输注后CTL019细胞在患儿体内扩增超过1 000倍,并可在骨髓及脑脊液中检测到。输注后1个月外周血及骨髓CD19阳性细胞均被清除,且获得骨髓形态学CR,MRD低于0.01%,其中1例基因水平持续缓解达9月,另1例则在缓解2月后复发,但复发后的原始细胞不表达CD19,推测这可能是对CAR-T治疗耐药的原因。2014年Grupp等[21]将病例扩大至30例,其中儿童25例,包括18例allo-HSCT后复发的B-ALL患者,进一步证实了CAR-T细胞治疗的良好疗效,其CR率高达90%,在外周血、骨髓及脑脊液中均可发现CTL019细胞的扩增。从长期疗效看,6个月的无事件生存率(EFS)达67%,总生存率(OS)达78%。NCI研究组运用CD19CAR-T治疗20例复发难治的ALL,14例患者达CR(70%),其中12例MRD阴性,2例在输注后3~5月复发,检测发现CD19阴性[28]。2015年欧洲血液学会议上报道,48例ALL患者经CAR-T治疗后,可达94%的CR率及72%的DFS(6个月)[29]。
总之,多个研究组提出运用CD19CAR-T治疗复发难治的B-ALL取得了良好的疗效,在成熟的研究组中取得了88%~94%的CR率,但后期的随访很难进行,因为大多数患者在缓解后接受了造血干细胞移植,无法准确评估其治疗效果。在未行造血干细胞移植的患者中,部分患者再次复发,首先可能与CD19阴性的白血病细胞有关,表明在治疗过程中出现了免疫逃逸;其次,可能与体内CAR-T细胞的缺失有关,表明修饰的T细胞只能暂时地控制肿瘤细胞,而不能达到完全清除。
3.2CAR-T慢性淋巴细胞白血病中的应用CLL是主要发生在中老年的一种B淋巴细胞克隆性增殖的肿瘤性疾病,虽然目前提出很多靶向治疗药物及免疫治疗的措施,但除了造血干细胞移植外,耐药的发生使得其仍是一不可治愈的疾病。目前已有大量的临床研究证实运用CD19-CART治疗复发难治的CLL取得了良好的临床疗效。
2011年Porter等[30]应用第二代CD19-CAR-T细胞治疗了3例CLL患者,其中2例CR,1例PR。研究结果显示,CAR-T细胞不仅能在体内扩增1 000倍以上,而且能在患者外周血和骨髓中保持治疗活性达6个月,且发现部分CD19-CAR-T细胞以记忆T淋巴细胞形式存在,存活时间达3年之久,当再次遇到CLL细胞时候能够快速活化并发挥杀伤作用。2014年Porter等[31]在一项Ⅱ期随机临床试验中提到CD19-CAR-T治疗CLL的OS率在35%~57%,所有反应的患者CAR-T在体内的存活时间达到4年。2015年运用CD19-CAR治疗14例复发难治的CLL,OS率达57%(8/14),其中4例CR,4例PR,在反应的这些患者中,CAR-T细胞可存活4年之久,最让人欣喜的是,CR的4例患者MRD持续阴性达4年之久[32],此研究结果也被后来的其他学者在类似临床试验中得到了验证。2016年Fraietta等[33]提出在CLL患者中依鲁替尼可增强CAR-T的功能及治疗活性,因此两者联合治疗CLL可能得到更好的临床疗效。
目前大多的临床试验表明,CAR-T在体内的增殖高峰时间约在输注后的2周,但在体内的存活时间差异较大,可能与CAR-T的结构有关。对输注后的CAR-T细胞的免疫表型进行分析,在输注后的早期可发现少量记忆细胞,在输注的后期主要以记忆细胞的形式存在[30],这说明在这些患者中,CAR-T细胞可产生持久的记忆细胞来杀伤肿瘤细胞。有些患者甚至可达4年之久的微小残留病阴性,有治愈的可能。总之,不同的临床试验均提出CAR-T治疗CLL的有效性,但其都是小样本,反应率也相差较大,需进一步优化CAR-T的结构使临床疗效得到进一步的改善。
4 相关问题
虽然目前CAR-T是细胞免疫治疗研究的热点,其不仅依赖于CAR-T对于复发难治肿瘤的较高的CR率,还可能与长期的缓解有关,其具有持久的抗肿瘤活性,但最短的缓解时间还未知。目前初始的CR率在不同的研究组不同,因为不同研究组采用不同的T细胞影响CAR的设计,不同的共刺激分子、基因转染技术、临床设计以及不同的患者肿瘤负荷,导致临床结果的差异。同时,因为成人与儿童胸腺功能和T细胞亚群的差异及免疫衰老,这可能解释了为什么CAR-T在儿童中有更好的疗效。
通常CAR-T在CLL患者体内的存活时间长于ALL,但ALL的CR率高于CLL[34],且相比于ALL的细胞因子释放综合征(cytokinereleasesyndrome,CRS),CLL的严重程度明显低于ALL,这可能有以下几个原因,首先来源于CLL的CAR-T细胞因为本身T细胞的功能紊乱而导致功能异常[35-36];其次,需要进一步明确CAR-T进入淋巴结与骨髓的能力是否相同;此外T细胞抑制受体的免疫抑制作用,免疫抑制相关细胞因子的产生,不同类型免疫细胞的产生都可能不同程度地影响CAR-T的疗效[37],使得CLL细胞可能处于抑制CAR-T功能的肿瘤微环境中。还可能与CLL持续表达的抗原特点及其肿瘤生长动力学的差异有关[31]。
对于运用CAR-T治疗后的B-ALL再次复发的患者目前仍然是很棘手的问题。CAR-T细胞的活性及持久性的降低导致B-ALL中CD19的原始细胞仍存在,可通过进一步优化CAR-T的设计、基因转移技术,使产物最大化来发挥杀伤作用,从而进一步提高反应率。第二代及第三代即可通过更强地激发T细胞的持久性而避免了复发。但是对于CD19阴性的原始细胞,其无法通过CA19-CART治疗,单一的靶向抗原在肿瘤抗原变异或缺失的时候无法靶向治疗。Haso等[38]发现运用CD19-CART治疗的B-ALL中,有2例患者的原始细胞CD19阴性,而CD22持续阳性,遂可通过设计CD19-CD22-CART治疗这类患者。联合CD19和CD22设计的CART可能避免肿瘤抗原的变异或缺失所导致的治疗无效,但需要进一步的研究。再者,CAR-T治疗能否成为异基因造血干细胞移植的桥梁,是一个开放性话题。目前对于复发难治的B-ALL,异基因造血干细胞移植是目前标准治疗方案,但因复发难治患者的高肿瘤负荷使得其无法立即行造血干细胞移植,CAR-T可使这些患者达到2次甚至3次缓解,使得患者可再有机会进行移植,从而取得良好疗效。
总之,虽然CAR-T免疫治疗在B-ALL及CLL患者中取得了较好的疗效,但不同研究组之间临床疗效的差异、治疗后复发以及治疗过程中细胞因子风暴等不良反应的处理仍是CAR-T广泛应用于临床前亟需解决的问题。应进一步优化CAR的设计,革新基因转染技术,选择理想的效应细胞,同时还需合理的临床设计,寻求新的肿瘤靶抗原,克服免疫抑制的肿瘤微环境,增强肿瘤组织的趋化功能,增强效应细胞的扩增能力,以进一步提高CAR-T的免疫治疗疗效,从而为患者提供更大的收益。
[1] 李莉娟,张连生, 细胞免疫治疗现状与前景[J]. 临床血液学杂志, 2015,28(5):370-373,379.
[2]GhorashianS,PuleM,AmroliaP,CD19chimericantigenreceptorTcelltherapyforhaematologicalmalignancies[J].BrJHaematol, 2015,169(4):463-478.
[3]JenaB,DottiG,CooperLJ.RedirectingT-cellspecificitybyintroducingatumor-specificchimericantigenreceptor[J].Blood, 2010. 116(7):1035-1044.
[4]WestwoodJA,SmythMJ,TengMW,etal.AdoptivetransferofTcellsmodifiedwithahumanizedchimericreceptorgeneinhibitsgrowthofLewis-Y-expressingtumorsinmice[J].ProcNatlAcadSciUSA, 2005,102(52):19051-19056.
[5]AbkenH,HombachA,HeuserC,etal.Anovelstrategyintheeliminationofdisseminatedmelanomacells:chimericreceptorsendowTcellswithtumorspecificity[J].RecentResultsCancerRes, 2001,158:249-264.
[6]ChekmasovaAA,RaoTD,NikhaminY,etal.SuccessfuleradicationofestablishedperitonealovariantumorsinSCID-BeigemicefollowingadoptivetransferofTcellsgeneticallytargetedtotheMUC16antigen[J].ClinCancerRes, 2010,16(14):3594-3606.
[7]LouisCU,SavoldoB,DottiG,etal.Antitumoractivityandlong-termfateofchimericantigenreceptor-positiveTcellsinpatientswithneuroblastoma[J].Blood, 2011,118(23):6050-6056.
[8]MaudeS,BarrettDM.Currentstatusofchimericantigenreceptortherapyforhaematologicalmalignancies[J].BrJHaematol, 2016,172(1):11-22.
[9]SrivastavaS,RiddellSR.EngineeringCAR-Tcells:Designconcepts[J].TrendsImmunol, 2015,36(8):494-502.
[10]AnurathapanU,LeenAM,BrennerMK,etal.EngineeredTcellsforcancertreatment[J].Cytotherapy,2014,16(6):713-733.
[11]EshharZ,WaksT,GrossG,etal.Specificactivationandtargetingofcytotoxiclymphocytesthroughchimericsinglechainsconsistingofantibody-bindingdomainsandthegammaorzetasubunitsoftheimmunoglobulinandT-cellreceptors[J].ProcNatlAcadSciUSA, 1993,90(2):720-724.
[12]FinneyHM,AkbarAN,LawsonAD.ActivationofrestinghumanprimaryTcellswithchimericreceptors:costimulationfromCD28,induciblecostimulator,CD134,andCD137inserieswithsignalsfromtheTCRzetachain[J].JImmunol, 2004,172(1):104-113.
[13]PuleMA,StraathofKC,DottiG,etal.AchimericTcellantigenreceptorthataugmentscytokinereleaseandsupportsclonalexpansionofprimaryhumanTcells[J].MolTher, 2005,12(5):933-941.
[14]ZhongXS,MatsushitaM,PlotkinJ,etal.Chimericantigenreceptorscombining4-1BBandCD28signalingdomainsaugmentPI3kinase/AKT/Bcl-XLactivationandCD8+Tcell-mediatedtumoreradication[J].MolTher, 2010,18(2):413-420.
[15]DaiH,WangY,LuX,etal.ChimericantigenreceptorsmodifiedT-cellsforcancertherapy[J].JNatlCancerInst, 2016,108(7).
[16]HolohanDR,LeeJC,BluestoneJA.ShiftingtheevolvingCARTcellplatformintohighergear[J].CancerCell, 2015,28(4):401-402.
[17]ZhangT,CaoL,XieJ,etal.EfficiencyofCD19chimericantigenreceptor-modifiedTcellsfortreatmentofBcellmalignanciesinphaseIclinicaltrials:ameta-analysis[J].Oncotarget,2015,6(32):33961-33971.
[18]KarlssonH,SvenssonE,GiggC,etal.Evaluationofintracellularsignalingdownstreamchimericantigenreceptors[J].PLoSOne, 2015,10(12):e0144787.
[19]ChmielewskiM,HombachAA,AbkenH.OfCARsandTRUCKs:chimericantigenreceptor(CAR)Tcellsengineeredwithaninduciblecytokinetomodulatethetumorstroma[J].ImmunolRev, 2014,257(1):83-90.
[20]ScheuermannRH,RacilaE.CD19antigeninleukemiaandlymphomadiagnosisandimmunotherapy[J].LeukLymphoma,1995,18(5-6):385-397.
[21]MaudeSL,FreyN,ShawPA,etal.ChimericantigenreceptorTcellsforsustainedremissionsinleukemia[J].NEnglJMed, 2014,371(16):1507-1517.
[22]EvansAG,RothbergPG,BurackWR,etal.EvolutiontoplasmablasticlymphomaevadesCD19-directedchimericantigenreceptorTcells[J].BrJHaematol, 2015.
[23]BrentjensRJ,RiviereI,ParkJH,etal.SafetyandpersistenceofadoptivelytransferredautologousCD19-targetedTcellsinpatientswithrelapsedorchemotherapyrefractoryB-cellleukemias[J].Blood,2011,118(18):4817-4828.
[24]BrentjensRJ,DavilaML,RiviereI,etal.CD19-targetedTcellsrapidlyinducemolecularremissionsinadultswithchemotherapy-refractoryacutelymphoblasticleukemia[J].SciTranslMed, 2013,5(177):177ra38.
[25]DavilaML,RiviereI,WangX,etal.Efficacyandtoxicitymanagementof19-28zCARTcelltherapyinBcellacutelymphoblasticleukemia[J].SciTranslMed, 2014,6(224):224ra25.
[26]MillerBC,MausMV.CD19-targetedcarTcells:anewtoolinthefightagainstBcellmalignancies[J].OncolResTreat, 2015,38(12):683-690.
[27]GruppSA,KalosM,BarrettD,etal.Chimericantigenreceptor-modifiedTcellsforacutelymphoidleukemia[J].NEnglJMed, 2013,368(16):1509-1518.
[28]LeeDW,KochenderferJN,Stetler-StevensonM,etal.TcellsexpressingCD19chimericantigenreceptorsforacutelymphoblasticleukaemiainchildrenandyoungadults:aphase1dose-escalationtrial[J].Lancet, 2015,385(9967):517-528.
[29]GruppSA,MaudeSL,ShawP,etal.Tcellsengineeredwithachimericantigenreceptor(CAR)targetingCD19 (CTL019)havelongtermpersistenceandinducedurableremissionsinchildrenwithrelapsed,refractoryall[J].Blood, 2014,124(21):380-380.
[30]KalosM,LevineBL,PorterDL,etal.Tcellswithchimericantigenreceptorshavepotentantitumoreffectsandcanestablishmemoryinpatientswithadvancedleukemia[J].SciTranslMed, 2011,3(95):95ra73.
[31]PorterDL,FreyNV,MelenhorstJJ,etal.Randomized,phaseⅡdoseoptimizationstudyofchimericantigenreceptormodifiedtcellsdirectedagainstcd19 (ctl019)inpatientswithrelapsed,refractorycll[J].Blood, 2014,124(21):1982-1982.
[32]PorterDL,HwangWT,FreyNV,etal.ChimericantigenreceptorTcellspersistandinducesustainedremissionsinrelapsedrefractorychroniclymphocyticleukemia[J].SciTranslMed, 2015,7(303):303-139.
[33]FraiettaJA,BeckwithKA,PatelPR,etal.IbrutinibenhanceschimericantigenreceptorT-cellengraftmentandefficacyinleukemia[J].Blood,2016,127(9):1117-1127.
[34]BrownJR,PorterDL,O'BrienSM.Noveltreatmentsforchroniclymphocyticleukemiaandmovingforward[J].AmSocClinOncolEducBook, 2014:e317-25.
[35]ChristopoulosP,PfeiferD,BartholomeK,etal.DefinitionandcharacterizationofthesystemicT-celldysregulationinuntreatedindolentB-celllymphomaandveryearlyCLL[J].Blood, 2011. 117(14):3836-3846.
[36]RichesJC,DaviesJK,McClanahanF,etal.TcellsfromCLLpatientsexhibitfeaturesofT-cellexhaustionbutretaincapacityforcytokineproduction[J].Blood, 2013. 121(9):1612-1621.
[37]Saulep-EastonD,VincentFB,QuahPS,etal.TheBAFFreceptorTACIcontrolsIL-10productionbyregulatoryBcellsandCLLBcells[J].Leukemia, 2016,30(1):163-172.
[38]HasoW,LeeDW,ShahNN,etal.Anti-CD22-chimericantigenreceptorstargetingB-cellprecursoracutelymphoblasticleukemia[J].Blood, 2013,121(7):1165-1174.
张连生,Email:zhangliansheng@medmail.com.cn
R
A
1004-583X(2017)04-0347-05
10.3969/j.issn.1004-583X.2017.04.019
2017-02-14 编辑:武峪峰
