向家坝和溪洛渡蓄水对圆口铜鱼不同年龄个体下行移动的影响
2017-04-08杨志唐会元龚云董纯高少波熊美华陈小娟
杨志, 唐会元, 龚云, 董纯, 高少波, 熊美华, 陈小娟
(水利部中国科学院水工程生态研究所,水利部水工程生态效应与生态修复重点实验室,武汉430079)
向家坝和溪洛渡蓄水对圆口铜鱼不同年龄个体下行移动的影响
杨志*, 唐会元, 龚云, 董纯, 高少波, 熊美华, 陈小娟
(水利部中国科学院水工程生态研究所,水利部水工程生态效应与生态修复重点实验室,武汉430079)
拦河筑坝所导致的物理阻隔和生态阻隔是影响鱼类迁徙的关键因素。圆口铜鱼Coreiusguichenoti(Sauvage & Dabry de Thiersant, 1874)作为长江上游重要的河流性洄游鱼类,其迁徙不可避免受到金沙江下游向家坝和溪洛渡大型水电站蓄水的影响。关于向家坝和溪洛渡蓄水是否会显著阻隔圆口铜鱼个体的下行以及不同年龄个体之间受阻隔的影响是否存在差异,迄今为止,还未有相关报道。本文拟通过2012—2014年对长江上游永善江段和宜宾江段圆口铜鱼年龄结构变动的研究,探讨向家坝和溪洛渡蓄水对圆口铜鱼不同年龄个体下行阻隔的影响程度。结果表明:1)向家坝和溪洛渡蓄水对圆口铜鱼下行产生了明显的阻隔效应;2)向家坝和溪洛渡蓄水对1龄个体的下行阻隔最明显且最严重;3)与单一的大型水库和大坝相比,多个梯级的大型水库和大坝会对圆口铜鱼的下行产生更为严重的阻隔效应。本文拟为金沙江下游圆口铜鱼的资源保护提供基础数据支持。
大型水电站;阻隔效应;梯级累积效应;圆口铜鱼;单位捕捞努力量渔获量
拦河筑坝作为水利工程重要的组成部分,在发挥防洪、发电、灌溉等效益的同时,也被认为是显著改变水生态系统的关键人为因素(Baxter,1977;Mims & Olden,2013)。拦河筑坝对水生态系统产生多种负面效应,其中通过大坝的物理阻隔和水库的生态阻隔所产生的阻隔效应是影响水生态系统完整性的最主要效应之一(Mims & Olden,2013;Waltersetal.,2013;Chengetal.,2015)。研究表明,拦河筑坝所产生的阻隔效应不仅会减少某些鱼类的种群规模,也会改变物种多样性和丰富度及种群的空间结构,严重时甚至会使一些物种灭绝(Waltersetal.,2013;Pessetal.,2016)。与小型水电站(装机容量小于5万kW)相比,大型水电站(装机容量大于30万kW)对鱼类的上行和下行均产生更加严重的影响,因为大型水电站除在坝体处产生更高的水头落差以及流速外,其修建所形成的巨大水库还可能产生明显的环境梯度,从而使适应流水生境的鱼类难以从库尾江段进入坝址区域而下行到坝下江段(Peliciceetal.,2015)。尽管如此,目前关于大型大坝对鱼类的下行阻隔影响多集中在对某一大型大坝的研究上,而对多个大型大坝,特别是梯级大型大坝对鱼类下行阻隔影响的研究较少(Hahnetal.,2007;Peliciceetal.,2015)。
金沙江下游作为长江上游的重要组成部分,是我国重要的水电能源基地,其干流的向家坝和溪洛渡2座大型梯级水电站已分别于2012年10月和2013年5月开始蓄水发电,另外2座大型水电站也正在建设中。当这些工程建设完成后,金沙江下游干流大部分江段的自然河流生境将被首尾相连的库区生境所代替,从而不可避免地对圆口铜鱼Coreiusguichenoti(Sauvage & Dabry de Thiersant, 1874)等许多鱼类在这些江段的生存造成明显的影响(Chengetal.,2015)。圆口铜鱼作为典型的河流洄游性鱼类,其产卵场主要分布在巧家及以上的金沙江中下游干流以及雅砻江干流部分江段(余志堂等,1984;刘乐和等,1990;张轶超,2009;唐会元等,2012;高少波等,2015),其在受到关键生境破坏的同时,也比其他许多鱼类更易受到下行阻隔的影响。这是因为不仅在这些江段出生的圆口铜鱼鱼苗和幼鱼需要顺水漂流到向家坝以下的江段进行育肥(余志堂等,1984;刘乐和等,1990;高少波等,2015),而且产卵后的亲鱼也很可能下行到向家坝以下饵料较为丰富的江段补充因繁殖而消耗的脂肪,以便为来年新一轮的繁殖活动积累能量。向家坝和溪洛渡大型水电站的修建是否会显著阻隔这些个体的下行以及不同年龄圆口铜鱼之间受阻隔的影响是否存在差异,迄今为止还没有相关报道。本文拟通过2012—2014年在金沙江下游永善江段和宜宾江段采集的圆口铜鱼,对向家坝和溪洛渡蓄水前后圆口铜鱼在这些江段的年龄结构变动进行研究,旨在回答:1)向家坝和溪洛渡蓄水是否对圆口铜鱼个体的下行造成了明显的阻隔;2)向家坝和溪洛渡蓄水对圆口铜鱼哪个年龄阶段个体下行的影响最大;3)多个梯级的大型水库和大坝是否比单一的大型水库和大坝对圆口铜鱼个体的下行产生更为严重的影响。
1 材料与方法
1.1 采样江段
采样江段包括金沙江下游永善江段(YSH)和宜宾江段(YB)(图1)。YSH位于溪洛渡坝下附近,是向家坝库区的回水区域,该区域在2012年10月向家坝未蓄水前具有典型山地急流特征,而蓄水后则表现出典型水库过渡带特征。YB位于向家坝坝下与岷江入长江口之间的长江上游干流区段,为长江上游珍稀特有鱼类国家级自然保护区(保护区)的重要组成部分,附近目前仍分布有60多种鱼类,圆口铜鱼为该区域在向家坝蓄水前的优势种类之一(李雷等,2013)。上述2个采样江段分别位于1个和2个大型水库和大坝下游(图1)。
1.2 采样方法
参照马琴等(2014)的方法,采用三层刺网对圆口铜鱼进行捕捞。为尽可能地捕捞规格小的个体,三层刺网的网目大小为1~10 cm,网高为2~5 m,网长为80~130 m。每个江段在采样期间均雇2~3艘渔船,每艘渔船配有各种网目大小的三层刺网各1套。各江段每次采样的持续时间均为8~11 d。相同江段雇佣的渔民在各年采样时均相同,使其作业方式与作业习惯在各年间无明显变化。各江段的采样时间为2012—2014年每年6月。参照《四川鱼类志》(丁瑞华,1994)对圆口铜鱼的描述进行种类鉴定,并测量每尾鱼类个体的全长(精确到1 mm)、体长(精确到1 mm)、体质量(精确到0.1 g)。测量时,在每尾圆口铜鱼的背鳍起点下方与侧线中间摘取5~10枚形状规则、环片轮纹清晰的鳞片(杨志等,2011),对其进行年龄鉴定。
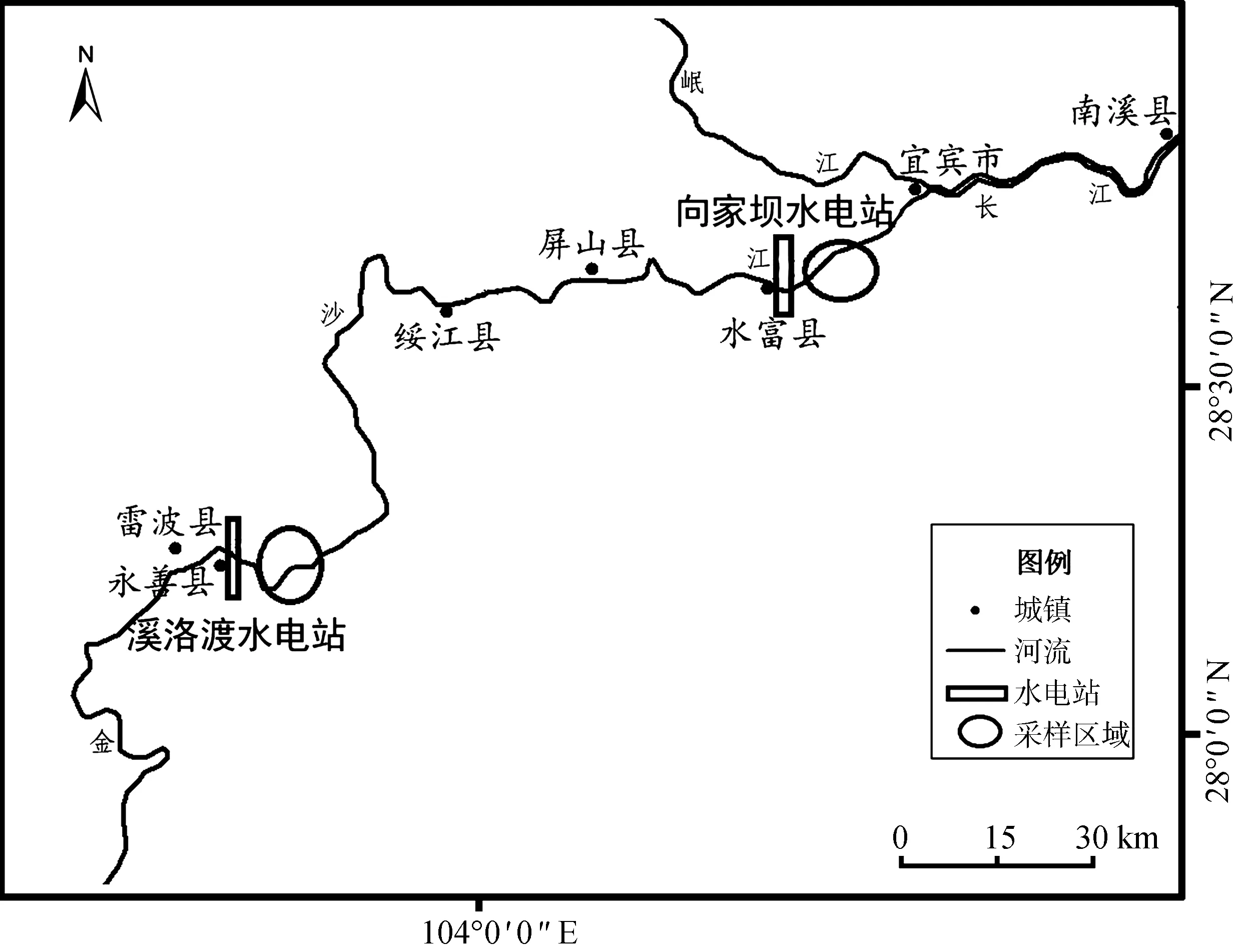
图1 采样江段示意图
Fig. 1 Schematic diagram of the sampling sections
1.3 年龄鉴定
将鳞片用1%氢氧化钾溶液浸泡3 h后,用清水冲洗表面胶质及污物并置于2个载玻片之间。将载玻片用胶带固定制成观测标本(曹玉琼,2003)。观测标本参照杨志等(2011)的方法进行年龄鉴定。
1.4 数据分析
统计不同江段圆口铜鱼不同年龄个体的尾数,并确定其年龄分布范围及平均年龄。同时基于某一采样江段不同年龄个体的尾数以及这个江段调查期间捕获的总尾数,计算该江段不同年龄个体数占总个体数的百分比,比较同一年龄个体的尾数比例在同一江段不同年份及不同江段相同年份之间的差异。采用配对样本t检验对2个江段圆口铜鱼的平均年龄进行比较(Kapuscinski & Farrell,2014)。
计算不同江段不同年龄个体的单位捕捞努力量渔获量(catch per unit effort,CPUE;Gaoetal.,2010),并基于不同年龄个体的CPUE,以Bray-Curtis相似性系数为基础构建不同年份、不同江段之间的相似性矩阵,采用等级聚类(cluster analysis,CA)和非度量多维标度排序方法(nonmetric multidimensional scaling, NMDS)分析采样江段2012—2014年圆口铜鱼的年龄结构变化(杨少荣等,2010;杨志等,2015)。采用胁强系数衡量NMDS分析结果的优劣(杨少荣等,2010)。采用One-Way ANOSIM方法对CA和NMDS的分组情况进行显著性检验(杨少荣等,2010;杨志等,2015)。采用PRIMER 6 (Version 1.0.6)进行CA、NMDS和One-Way ANOSIM分析,并使用CorelDRAW 12.0和SigmaPlot 12.5绘图。
2 结果
2.1 年龄分布
2012—2014年共在2个江段采集到圆口铜鱼样本1 092尾,其中YB采集的样本数较多,共578尾,占总采集样本数的52.93%。YSH圆口铜鱼的年龄为1~4龄,YB为1~5龄,2个江段的优势年龄组均为1~3龄组(图2)。

图2 2012—2014年2个采样江段采集到的圆口铜鱼尾数
YSH. 永善, YB. 宜宾; 下同。
YSH. Yongshan, YB. Yibin; the same below.
2个江段捕获的圆口铜鱼平均年龄:YSH为1.85龄±0.80龄、YB为1.85龄±0.89龄(图3)。配对样本t检验显示YSH和YB平均年龄之间的差异无统计学意义(P=0.98>0.05)。

图3 2012—2014年2个采样江段采集到的圆口铜鱼的平均年龄
2.2 不同年龄组的数量百分比
2012—2014年采样期间,YSH 1~4龄个体数比例总体呈上升趋势,其中1龄个体数比例呈先上升后下降的趋势,而2~4龄个体数比例则呈先下降后上升的趋势。YB 1龄和2龄个体数比例分别呈逐年下降和逐年上升趋势,而3龄和4龄个体数比例则分别呈先下降后上升和逐年上升趋势。总体而言,1龄个体数比例在YB呈明显逐年下降的趋势,而在YSH则呈先上升后下降的趋势(图4)。
2.3 不同年龄组的CPUE
不同江段不同年龄组的CPUE变动如图5所示。在年际变化上,总CPUE在2个江段表现出相反的变化趋势,其中YSH的呈逐年上升的趋势,而YB的呈逐年下降的趋势。对不同年龄组而言,2012—2014年YSH所有年龄组的CPUE均呈上升趋势;YB 1龄以及3~5龄组的CPUE均呈逐年下降趋势(图5),2龄组的CPUE在3年间也呈总体下降趋势,其值从2012年的每船每天1.41尾下降到2014年每船每天1.37尾。
基于CPUE数据,可在64.2%的Bray-Curtis相似性水平上将2个采样江段2012—2014年的圆口铜鱼按年龄结构分为2组:Ⅰ组包括2013年和2014年YB的以及2012年YSH的年龄结构(YB2013、YB2014和YSH2012),Ⅱ组则包括2012年YB的以及2013年和2014年YSH的年龄结构(YB2012、YSH2013和YSH2014)(图6:A)。One-Way ANOSIM检验显示Ⅰ组和Ⅱ组的差异无统计学意义(R=0.74,P=0.10>0.05)。NMDS的分析结果见图6:B,胁强系数为0.01,表明分类结果较好。在NMDS图中,样本之间的距离代表其相似度,距离越大,样本之间的相似度越小,因此,YB和YSH圆口铜鱼的年龄结构相似度在2012—2014年均呈逐年下降趋势(图6:B)。
3 讨论
图2的结果显示无论在坝上江段还是坝下江段,圆口铜鱼的优势年龄组均为1~3龄组,该结果与2005—2007年YB的优势种年龄构成相符(程鹏,2008)。而且向家坝坝上坝下2个江段圆口铜鱼的平均年龄差异很小,表明仅从平均年龄无法判别圆口铜鱼的年龄结构是否受到向家坝和溪洛渡蓄水影响。

图4 2012—2014年同一采样江段不同年龄组圆口铜鱼个体数占该江段圆口铜鱼总采集个体数的比例

图5 2012—2014年不同年龄组圆口铜鱼在2个采样江段的单位捕捞努力量渔获量变动

图6 2012—2014年间2个采样江段圆口铜鱼年龄结构的等级聚类(A)和非度量多维标度排序(B)
向家坝和溪洛渡蓄水后,YB圆口铜鱼各年龄个体数比例均发生了一定变化,但其变化主要受1龄个体数比例减少的影响,表明上下游对该江段圆口铜鱼低龄个体的补充作用减弱,由于研究期短(3年),因此同一江段各年的渔业捕捞强度的差异不大,故就同一江段而言,各年捕捞对圆口铜鱼年龄结构的影响程度也很可能相近。尽管如此,上游对该江段低龄个体补充作用的削弱是主要的,这是因为:1)高少波等(2015)的研究表明,向家坝的蓄水不仅淹没了圆口铜鱼在库区原有的产卵场,而且完全阻碍了圆口铜鱼鱼卵和鱼苗的下行,因此向家坝和溪洛渡的蓄水,特别是2013年5月以后溪洛渡的蓄水,将会使从溪洛渡库尾以上江段进入YB的卵苗数量明显减少,从而减少1龄个体的补充量。2)由于幼鱼游泳能力较弱(涂志英等,2016),因此经过YB的幼鱼个体在长江上游高的流速下(通常断面平均流速在1.5 m·s-1以上;危起伟等,2012)从宜宾以下江段上溯回到YB的概率应该较低,因此该江段的幼鱼群体也不可能得到下游幼鱼群体大量的补充。特别地,宜宾下游分布有三峡水库,库区内丰富的食物以及广阔的庇护生境有利于圆口铜鱼幼鱼在库区停留而不向上游动到上游产卵场。已有研究表明,河流成库后,三峡库区库尾江段的圆口铜鱼幼鱼个体数量明显增加(杨少荣等,2010;杨志等,2015)。而且,圆口铜鱼作为上游产卵、卵苗漂流到下游生长的鱼类,其生活史特征也决定了其幼鱼不可能大规模地向上游产卵场迁徙(刘乐和等,1990;张轶超,2009)。许多研究也表明,产卵场下游的鱼类只有在达到一定规格或年龄时才开始向上游产卵场迁徙(Sloane,1984;Banks,2006;Orelletal.,2007;Matthewetal.,2009)。
已有研究表明,鱼类的下行受流速、水温、洪水事件以及食物可获得性等多种因子的影响(Hvidstenetal.,1995;Giorgietal.,1997;Sommeretal.,2001;Armstrongetal.,2003;Orelletal.,2007),而大型水库不仅通过产生明显的水动力学梯度阻碍适应流水生境的鱼类进入库首江段(Peliciceetal.,2015),而且也可能会在库区形成水温分层影响某些鱼类的丰度,进而减少这些鱼类下行的数量(Mtada,1987)。同时,水库的形成对洪水的发生频率、洪峰流量以及洪水持续时间均有较大影响(Murchieetal.,2008),不利于鱼类在洪水季节的向下散布(Jiménez-Seguraetal.,2010)。此外,库区丰富的饵料以及广阔的水面,很可能有利于某些适应库区生境鱼类的生长(Gaoetal.,2010)。作为一种喜流水生境的鱼类,圆口铜鱼主要分布在库区中部及以上具有一定流水的江段(Gaoetal.,2010;杨志等,2015),特别是在库尾江段能够形成大规模的种群(张轶超等,2009;杨少荣等,2010),表明库区江段特别是库尾江段的水温适宜圆口铜鱼生长,而库区丰富的食物、库首江段形成的静水区域以及减少的洪水事件很可能是导致圆口铜鱼更愿意停留在库区静水区域而不下行的重要因素。YSH的结果也证实了这一点。向家坝蓄水后,YSH圆口铜鱼的丰度特别是1龄个体的丰度呈明显的逐年上升趋势,表明从溪洛渡库区下行的个体更愿意停留在向家坝库区而不是下行到向家坝坝下。同时,当YSH各年龄组丰度在2014年均显著增加时,坝下YB 1~4龄组的丰度在2014年仍呈下降趋势,表明即使增加向家坝库区圆口铜鱼数量,也仅有少数个体下行到向家坝坝下。由于金沙江下游溪洛渡库区上游的产卵场均分布在皎平渡及以上江段(危起伟等,2012),其最下游产卵场距溪洛渡坝址300~320 km,在如此长的距离下圆口铜鱼已发育到仔鱼期或稚鱼期,因此其在向家坝库区的个体绝大多数应为具有一定游泳能力的个体,从而具有规避静水区域以及自由选择生境的能力(不会随着流水而被迫下行)。母红霞(2014)曾指出三峡大坝蓄水后,漂流到葛洲坝坝下的鱼类个体中仔鱼和稚鱼数量比例高达98%以上,而幼鱼和成鱼数量比例仅占不到2%,表明相对于幼鱼与成鱼,仔鱼和稚鱼更容易被水流带入坝下江段。
CPUE的结果显示,2012—2014年YB圆口铜鱼各年龄组的总CPUE呈逐年下降趋势,而YSH的总CPUE在总体上呈上升趋势,表明向家坝和溪洛渡蓄水后圆口铜鱼的丰度已在这些江段发生明显变化。特别地,在YSH 2014年1~3龄组个体的丰度不仅大于2013年同一年龄组个体的丰度,而且也大于2013年低一年龄组个体的丰度(2013年的i龄个体在2014年采样期间,将全部成为i+1龄个体,圆口铜鱼的年轮形成时间为4~7月;程鹏,2008),表明溪洛渡蓄水后似乎仍有大量个体从溪洛渡库区进入向家坝库区。但是考虑到向家坝蓄水是逐步进行的,其回水区末端会随着蓄水的进行而延伸到更上游的区域,在此过程中圆口铜鱼将向上迁徙,并集中在库尾江段,从而导致库尾流水江段圆口铜鱼丰度的升高(Gaoetal.,2010;杨少荣等,2010;杨志等,2015),因此2014年YSH圆口铜鱼丰度的增加除上游的补充外,许多个体很可能为下游库区被迫上迁的个体。尽管如此,向家坝蓄水后,库区圆口铜鱼产卵场全部被淹没(高少波等,2015),因此2014年YSH的1龄个体应为溪洛渡截流后(2013年5月)从溪洛渡库区进入向家坝库区的个体,表明单一的大坝和水库对圆口铜鱼1龄个体的下行阻隔有限。同时,YB的1龄个体数比例呈逐年下降趋势,表明与单一的大型大坝相比,多个梯级的大型大坝对圆口铜鱼1龄个体会产生更为严重的下行阻隔效应。
尽管2龄及以上年龄个体受前一年低1龄个体数量较少的影响,但是YB所有年龄组的CPUE均显示出逐年下降或波动下降的趋势,表明向家坝和溪洛渡蓄水对圆口铜鱼所有年龄组的下行均产生了影响。就不同年龄个体受影响程度而言,3年间1龄个体CPUE的下降倍数(8.79倍)远大于其他年龄个体CPUE的下降倍数(0.40~4.99倍),表明1龄个体受向家坝和溪洛渡蓄水的影响程度最大。
CA和NMDS分析结果表明,向家坝蓄水后2个采样江段的年龄结构均发生了一定程度的改变,其中2012年YB的年龄结构与2013年和2014年YSH的年龄结构更相近,而2013年和2014年YB的年龄结构却与2012年YSH的年龄结构更相近,表明向家坝和溪洛渡蓄水后,原来不适合圆口铜鱼种群大量栖息的生境(急流峡谷河流)变为圆口铜鱼重要的栖息场所,而向家坝下原来圆口铜鱼主要的育肥区(危起伟等,2012)则因阻隔逐渐变成圆口铜鱼次要的栖息生境。尽管如此,CA在相似度64.2%水平分成的2组差异无统计学意义(R=0.74,P=0.10>0.05),表明在蓄水后的短期内,向家坝坝上和坝下江段的圆口铜鱼年龄结构较为相似。
总之,本文通过对向家坝和溪洛渡蓄水前后2个江段圆口铜鱼年龄结构变动的研究,揭示了以下内容:1)向家坝和溪洛渡蓄水对圆口铜鱼的下行产生了明显的阻隔效应;2)向家坝和溪洛渡蓄水对1龄个体的下行阻隔最明显且最严重;3)与单一的大型水库和大坝相比,多个梯级的大型水库和大坝对圆口铜鱼的下行产生更为严重的阻隔效应。
曹玉琼. 2003. 异鳔鳅鮀的年龄与生长、繁殖生物学研究[D]. 武汉: 华中农业大学.
程鹏. 2008. 长江上游圆口铜鱼的生物学研究[D]. 武汉: 华中农业大学.
丁瑞华. 1994. 四川鱼类志[M]. 成都: 四川科学技术出版社: 276-278.
高少波, 唐会元, 陈胜, 等. 2015. 金沙江一期工程对保护区圆口铜鱼早期资源补充的影响[J]. 水生态学杂志, 36(2): 6-10.
李雷, 危起伟, 吴金明, 等. 2013. 长江宜宾江段渔业资源现状调查[J]. 长江流域资源与环境, 22(11): 1449-1457.
刘乐和, 吴国犀, 王志玲. 1990. 葛洲坝水利枢纽兴建后长江干流铜鱼和圆口铜鱼的繁殖生态[J]. 水生生物学报, (3): 205-215.
马琴, 林鹏程, 刘焕章, 等. 2014. 长江宜昌江段三层流刺网对鱼类资源影响的分析[J]. 四川动物, 33(5): 762-767.
母红霞. 2014. 长江三峡水库库尾江段及三峡坝下鱼类早期资源生态学研究[D]. 北京: 中国科学院大学: 101.
唐会元, 杨志, 高少波, 等. 2012. 金沙江中游圆口铜鱼早期资源现状[J]. 四川动物, 31(3): 416-425.
涂志英, 李丽萍, 袁喜, 等. 2016. 圆口铜鱼幼鱼可持续游泳能力及活动代谢研究[J]. 淡水渔业, 46(1): 33-38.
危起伟, 王剑伟, 陈大庆, 等. 2012. 长江上游珍稀特有鱼类国家级自然保护区科学考察报告[M]. 北京: 科学出版社: 36, 156-157.
杨少荣, 马宝珊, 孔焰, 等. 2010. 三峡库区木洞江段圆口铜鱼幼鱼的生长特征及资源保护[J]. 长江流域资源与环境, 19(Z2): 52-57.
杨志, 唐会元, 朱迪, 等. 2015. 三峡水库175 m试验性蓄水期库区及其上游江段鱼类群落结构时空分布格局[J]. 生态学报, 35(15): 5064-5075.
杨志, 万力, 陶江平, 等. 2011. 长江干流圆口铜鱼的年龄与生长研究[J]. 水生态学杂志, 32(4): 46-52.
余志堂, 梁秩燊, 易伯鲁. 1984. 铜鱼和圆口铜鱼的早期发育[J]. 水生生物学报, (4): 371-388.
张轶超. 2009. 大坝建设对长江上游圆口铜鱼和长鳍吻鮈自然繁殖的影响[D]. 北京: 中国科学院水生生物研究所: 21-50.
Armstrong JD, Kemp PS, Kennedy GJA,etal. 2003. Habitat requirements of Atlantic salmon and brown trout in rivers and streams[J]. Fisheries Research, 62(2): 143-170.
Baxter RM. 1977. Environment effects of dams and impoundments[J]. Annual Review of Ecology and Systematics, 8(1): 255-283.
Banks JW. 2006. A review of the literature on the upstream migration of adult Salmonids[J]. Journal of Fish Biology, 1(2): 85-136.
Cheng F, Li W, Castello L,etal. 2015. Potential effects of dam cascade on fish: lessons from the Yangtze River[J]. Reviews in Fish Biology & Fisheries, 25(3): 1-17.
Gao X, Zeng Y, Wang JW,etal. 2010. Immediate impacts of the second impoundment on fish communities in the Three Gorges Reservoir[J]. Environmental Biology of Fishes, 87(2): 163-173.
Giorgi AE, Hillman TW, Stevenson JR,etal. 1997. Factors that influence the downstream migration rates of juvenile salmon and steelhead through the hydroelectric system in the mid-Columbia River Basin[J]. North American Journal of Fisheries Management, 17(17): 268-282.
Hahn L, Karl E, Carosfeld J,etal. 2007. Preliminary study on the application of radio-telemetry techniques to evaluate movements of fish in the Lateral canal at Itaipu Dam, Brazil[J]. Neotropical Ichthyology, 5(2): 103-108.
Hvidsten NA, Jensen AJ, Vivaas H,etal. 1995. Downstream migration of Atlantic salmon smolts in relation to water flow, water temperature, moon phase and social behavior[J]. Nordic Journal of Freshwater Research, 70: 38-48.
Jiménez-Segura LF, Palacio J, Leite R. 2010. River flooding and reproduction of migratory fish species in the Magdalena River Basin, Colombia[J]. Ecology of Freshwater Fish, 19(2): 178-186.
Kapuscinski KL, Farrell JM. 2014. Habitat factors influencing fish assemblages at muskellunge nursery sites[J]. Journal of Great Lakes Research, 40(1): 135-147.
Matthew LK, Mary LM, Charles TB,etal. 2009. Effects of body size and river environment on the upstream migration of adult Pacific lampreys[J]. North American Journal of Fisheries Management, 29(5): 1214-1224.
Mims MC, Olden JD. 2013. Fish assemblages respond to altered flow regimes via ecological filtering of life history strategies[J]. Freshwater Biology, 58(58): 50-62.
Mtada OSM. 1987. The influence of thermal stratification on pelagic fish yields in Lake Kariba, Zambia/Zimbabwe[J]. Journal of Fish Biology, 30(2): 127-133.
Murchie KJ, Hair KPE, Pullen CE,etal. 2008. Fish response to modified flow regimes in regulated rivers: research methods, effects and opportunities[J]. River Research & Applications, 24(2): 197-217.
Orell P, Erkinaro J, Svenning MA,etal. 2007. Synchrony in the downstream migration of smolts and upstream migration of adult Atlantic salmon in the subarctic River Utsjoki[J]. Journal of Fish Biology, 71(6): 1735-1750.
Pelicice FM, Pompeu PS, Agostinho AA. 2015. Large reservoirs as ecological barriers to downstream movements of Neotropical migratory fish[J]. Fish and Fisheries, 16(4): 697-715.
Pess GR, Mchenry ML, Beechie TJ,etal. 2016. Biological impacts of the Elwha River dams and potential Salmonid responses to dam removal[J]. Northwest Science, 82(Special 1): 72-90.
Sommer TR, Nobriga ML, Harrell WC,etal. 2001. Floodplain rearing of juvenile chinook salmon: evidence of enhanced growth and survival[J]. Canadian Journal of Fisheries & Aquatic Sciences, 58(2): 325-333.
Sloane RD. 1984. Upstream migration by young pigmented freshwater eels (AnguillaaustralisaustralisRichardson) in Tasmania[J]. Marine & Freshwater Research, 35(1): 61-73.
Walters DM, Zuellig RE, Crockett HJ,etal. 2013. Barriers impede upstream spawning migration of flathead chub[J]. Transactions of the American Fisheries Society, 143(1): 17-25.
Effect of the Barrier Caused by the Impoundments of the Xiangjiaba and Xiluodu Hydropower Plants on the Downstream Movement of Different Age Groups ofCoreiusguichenoti(Sauvage & Dabry de Thiersant, 1874)
YANG Zhi*, TANG Huiyuan, GONG Yun, DONG Chun, GAO Shaobo, XIONG Meihua, CHEN Xiaojuan
(Key Laboratory of Ecological Impacts of Hydraulic-projects and Restoration of Aquatic Ecosystem of Ministry of Water Resources,Institute of Hydroecology, Ministry of Water Resources and Chinese Academy of Sciences, Wuhan 430079, China)
Fishes depend upon unrestricted upward and downward movements between the habitats of different key life-history stages for the completion of the life cycle. The dams and diversion structures can hinder the movements causing the so-called “barrier effect” which is a key factor affecting fish migration. The migration route ofCoreiusguichenoti(Sauvage & Dabry de Thiersant, 1874), an important migratory fish species in the upper reaches of the Yangtze River, is inevitably affected by the builds of the Xiangjiaba and Xiluodu hydropower plants located on the lower reaches of Jinsha River. However, whether the impoundments of the Xiangjiaba and Xiluodu Reservoirs can significantly block the downward movements ofC.guichenotiindividuals, and whether display different barrier degrees for different age groups, are still remain unknown. Based on theC.guichenotiindividuals that sampled from the Yongshan and Yibin sections in the upper reaches of the Yangtze River from 2012 to 2014, the barrier effect caused by the impoundments of the Xiangjiaba and Xiluodu hydropower plants on the downstream movement of different age groups ofC.guichenotiwere studied by using the method of relative abundance comparison (number percentage and catch per unit effort). The results showed that: 1) the impoundments of the Xiangjiaba and Xiluodu Reservoirs had caused obvious blocking effect for downward movement ofC.guichenoti; 2) the barrier effect resulted from the impoundments of the Xiangjiaba and Xiluodu Reservoirs was the most obvious and serious for the downward movements of 1 year-old individuals; 3) compare to a single large reservoir and dam, a cascade of large reservoirs and dams had a more serious barrier effect for the downstream movement ofC.guichenoti. This study can provide basic data for the resource protection ofC.guichenotiin the lower reaches of Jinsha River.
huge hydropower plant; barrier effect; cascade cumulative effect;Coreiusguichenoti; catch per unit effort
2016-09-21 接受日期:2016-12-01
国家自然科学基金项目(51379134; 51209151); 水利部公益性行业科研专项经费项目(201501001); 中国三峡集团公司项目(JGJ/0382013)
杨志, 男, 硕士, 助理研究员, 研究方向:鱼类生态学
*通信作者Corresponding author, E-mail:yangzhi4626@163.com
10.11984/j.issn.1000-7083.20160253
Q959.4; S932.4
A
1000-7083(2017)02-0161-07
