中国荷斯坦奶牛Nramp1基因多态性与泌乳性状及产奶量的关联性分析
2017-04-08刘丽霞李强子刘吴鑫
张 丽,刘丽霞,陈 红,李强子,刘吴鑫
(西北民族大学 生命科学与工程学院,甘肃 兰州730030)
中国荷斯坦奶牛Nramp1基因多态性与泌乳性状及产奶量的关联性分析
张 丽,刘丽霞,陈 红,李强子,刘吴鑫
(西北民族大学 生命科学与工程学院,甘肃 兰州730030)
为寻找与乳房炎相关的分子标记,为荷斯坦牛的抗病育种提供理论基础,试验采用PCR-SSCP技术和测序的方法对宁夏农垦303头中国荷斯坦奶牛的Nramp1基因进行了遗传多态性分析,利用一般线性模型分析Nramp1基因c.200C>G突变对泌乳性状及产奶量影响。结果显示,Nramp1基因c.200C>G突变与乳脂率、日产奶量和体细胞评分值存在显著(P<0.05)或极显著(P<0.01)关联。因此,可以把该位点作为中国荷斯坦奶牛体细胞评分、测定日产奶量和日乳脂率的遗传标记进行进一步研究。
荷斯坦牛;Nramp1基因;遗传多态性;泌乳性状;产奶量
奶牛乳腺炎在泌乳期牛群体中发病率极高,其发病率与抗病候选基因的多态性相关。因此,利用分子标记辅助选择技术选育乳腺炎抗性的奶牛,有望成为控制和降低乳腺炎发生的有效途径。天然抗性相关巨噬蛋白基因(natural resistance associated macrophage protein,Nramp1)首次在小鼠中被发现并克隆[1],其主要在巨噬细胞和多核型白细胞中特异表达,通过转运细菌自身合成防御酶系所必需的Mn2+或Fe2+等金属离子使细菌无法合成防御酶系,从而使动物抵抗病原菌的侵染[2-3]。Nramp1在家畜机体中具有重要的抵抗胞内寄生菌活性,已经成为家畜抗病育种的研究热点之一。研究表明,Nramp1基因与牛布氏杆菌病、结核病等传染病的抗性相关。Nramp1基因3’UTR区遗传变异对荷斯坦奶牛布氏杆菌、分枝杆菌的抗性差异显著[4-8]。吴宏梅等[9]研究表明,猪Nramp1基因内含子6多态性与中性粒细胞及单核巨噬细胞吞噬功能显著相关。Hebert等[10]报道,Nramp1基因可抵抗细胞内乳腺炎病原金黄色葡萄球菌的感染。Joo等[11]报道,乳腺炎抗性奶牛Nramp1基因mRNA表达量高于易感牛群,可根据Nramp1基因表达量的差异选育乳腺炎抗性奶牛群,从而揭示Nramp1基因多态性与乳腺炎抗性相关。胡海川[12]研究表明,荷斯坦奶牛Nramp1基因多态性与体细胞评分(somatic cell score,SCS)、305 d产奶量存在显著或极显著相关性,且SCS数值越高,产奶量下降越明显,牛场效应和胎次效应对乳腺炎的影响也很大。因此,可将Nramp1基因作为奶牛乳腺炎候选基因应用于分子标记辅助选择育种。但是,牛Nramp1基因的研究多局限于3’UTR区与布氏杆菌病、结核杆菌病的相关性研究,对其他位点的单核苷酸多态(single nucleotide polymorphism,SNP)及其与泌乳性状及产奶量的研究未见报道。本研究采用PCR-SSCP和测序技术对Nramp1基因的SNP进行了筛选,并结合乳脂率、乳蛋白率、体细胞评分及产奶量数据,分析其多态性与中国荷斯坦奶牛泌乳性状和乳腺炎间的相关性,找到对泌乳性状和乳腺炎间有显著影响的SNP位点,为奶牛抗病育种提供参考。
1 材料与方法
1.1 试验牛血样采集、产奶量和乳成分测定
本试验样本采集于2013年3月—2014年5月在宁夏农垦贺兰山奶业有限公司完成。选择体况相近、无临床乳腺炎、胎次在 3~4 胎具有完整系谱资料的中国荷斯坦奶牛303头,经尾静脉采血10 mL·头-1,医用采血管低温保存带回实验室冷冻备用。试验牛每日采集一次奶样,记录日产奶量,全天按照早∶中∶晚=4∶3∶3的比例混合奶样100 mL送宁夏 DHI 测定中心进行个体牛乳蛋白率、乳脂率及乳中体细胞数测定。对泌乳天数多于305 d的个体只取其305 d的产奶量,对泌乳天数少于305 d的个体根据校正系数校正成305 d产奶量。
1.2 血样DNA提取和引物设计
采用常规苯酚-氯仿抽提法从备用冻存血样中提取荷斯坦奶牛基因组DNA,超纯水溶解,保存母液,取部分DNA母液样品稀释至100 ng·μL-1,-20 ℃保存备用。
根据GenBank公布的荷斯坦奶牛Nramp1基因DNA序列(登录号:DQ493965),应用Primer6.0软件设计2对特异性引物用于扩增荷斯坦奶牛Nramp1基因第10外显子和第11外显子序列,其引物序列见表1,该引物由大连宝生物公司合成,双蒸水溶解,-20 ℃保存备用。
1.3 PCR-SSCP检测与等位基因序列测定
PCR扩增体系总体积为20 μL:基因组DNA模板2.0 μL,0.25 μmol·L-1上下游引物各1.0 μL,2×TaqPCR MasterMix 10.0 μL,双蒸水6.0 μL。PCR扩增程序为:94 ℃预变性4 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸5 min,降温至4 ℃保存,1%琼脂糖凝胶对其扩增结果进行检测。
取3 μL无非特异性条带的PCR产物,加入7 μL变性上样缓冲液(0.025%溴酚蓝、98%去离子甲酰胺、10 mmol·L-1EDTA、0.025%二甲苯氰),98 ℃变性10 min后再立即冰浴10 min。将变性后的PCR产物依次上样到10%的非变性聚丙烯酰胺凝胶孔中(Acr∶Scr=39∶1),室温160 V电压下分别电泳4 h(exon10)和6 h(exon11)。电泳结束后用硝酸银染色法染色确定PCR产物的基因型。
表1 引物信息
Table 1 The information of primers

引物名称Primername引物序列Primersequence(5’-3’)退火温度Annealingtemperature/℃扩增区域Amplifiedregion目的片段长度Productsize/bpP1F:5’-TGTCGGGCTGGATTCAGACT-3’R:5’-CCTGCCGTTGGCTTGCTTAC-3’60exon10231P2F:5’-GACCGTGGCAGTGGACATT-3’R:5’-CTGCCTTGTGCTCAGACACC-3’60exon11327
PCR产物经SSCP电泳判型后,如果新发现的等位基因是纯合型个体,其PCR产物直接送北京华大公司测序。如果新发现的等位基因是杂合型个体,可从聚丙烯酰胺凝胶中切下等位基因中的一条带,放于1.5 mL离心管中,用200 μL 1×TE(10 mmol·L-1Tris-HCl,0.1 mmol·L-1EDTA)缓冲液洗涤两次,并用枪头压碎后加入50 μL 1×TE,置于50~60 ℃水浴中孵化1~2 h左右,该溶液可作为DNA模板并使用原有的PCR扩增体系和条件进行再扩增,第二次PCR扩增产物用琼脂糖凝胶检测后,与原PCR产物或其他含有该等位基因的样品同时进行SSCP电泳,以确保第二次扩增产物为新发现的等位基因。然后用PCR纯化试剂盒对第二次扩增产物纯化并测序[13]。
1.4 数据分析
利用GenePop和PIC生物软件计算突变位点的遗传参数。因体细胞数(somatic cell count,SCC)呈非正态分布,可将体细胞数转换为体细胞评分,公式为:SCS=[log2(SCC/100)]+3[14]。
荷斯坦奶牛群均为舍饲群体,饲养环境基本一致,可忽略场效应对性状的影响。因此,应用SPSS 23.0 统计软件中一般线性模型分析荷斯坦奶牛Nramp1基因突变对测定日乳脂率、测定日乳蛋白率、日产奶量、305 d 产奶量和体细胞评分进行差异显著性检验。不同基因型间的多重比较用LSD 法。模型如下:Yijkl=μ+Ci+Tj+Gk+Sl+eijkl,其中Yijkl为个体性状表型值;μ为群体均值;Ci为环境的固定效应;Tj为第j胎次的固定效应;Gk为Nramp1基因第k个标记基因型的固定效应;Sl为产犊季节的固定效应;eijkl为随机误差效应。
2 结果与分析
2.1Nramp1基因PCR扩增产物质量
荷斯坦奶牛Nramp1基因第10、11外显子PCR扩增产物经1%琼脂糖凝胶(160 V,30 min)电泳检测条带清晰且特异性较好(图1),大小范围分别为200~300 bp、300~400 bp,与预期片段长度基本相符,可以用于SSCP检测。
2.2 PCR-SSCP检测分析和序列测定
荷斯坦奶牛Nramp1基因第10、11外显子PCR扩增产物经SSCP分析,结果表明,荷斯坦奶牛Nramp1基因第10外显子无多态性;第11外显子区域检测到2种等位基因A和B,形成AA、BB、AB共3种带型(图2),其中等位基因A和B均发现纯合型个体。第11外显子PCR扩增产物测序结果通过与普通牛Nramp1基因(GenBank No. DQ493965)第11外显子序列比对,发现扩增序列的200 bp处发生了G到C的错义突变(图3),从而导致氨基酸由原来的半胱氨酸(Cys)变为丝氨酸(Ser)(图4)。

M, 100 bp DNA Marker; 泳道1为Exon10 PCR产物;泳道2为Exon11 PCR产物M, 100 bp DNA marker; Lane 1, PCR product of Exon10; Lane 2, PCR product of Exon11图1 荷斯坦奶牛Nramp1基因第10和11外显子PCR扩增产物Fig.1 Detections of PCR products of Nramp1 gene exon 11 in Holstein cattle

图2 荷斯坦奶牛Nramp1基因第10/11外显子PCR产物SSCP检测结果Fig.2 SSCP analvsis of PCR amplification of Nramp1 exon10/11 in Holstein cattle
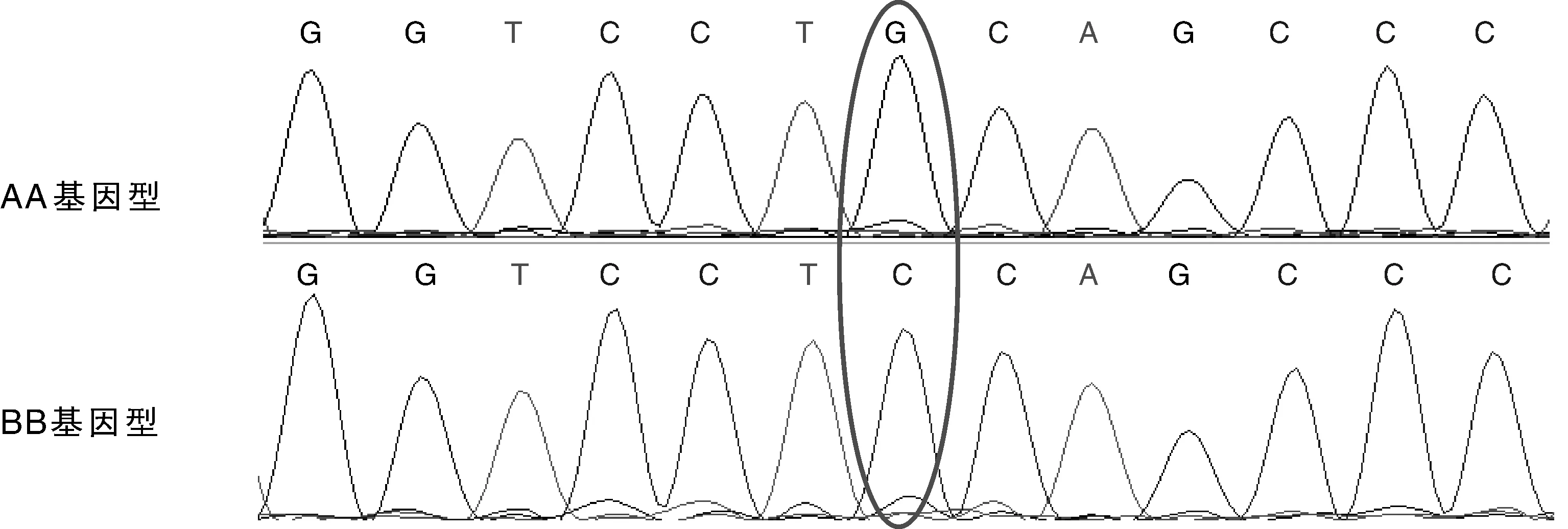
图3 荷斯坦奶牛Nramp1基因第11外显子区域AA/BB基因型碱基突变Fig.3 Base mutations of AA/BB genotype of Nramp1 exon11 area in Holstein cattle

图4 荷斯坦奶牛Nramp1基因第11外显子区域AA/BB基因型编码蛋白序列Fig.4 Encoding protein sequence of AA/BB genotype of Nramp1 exon11 area in Holstein cattle
2.3 荷斯坦奶牛Nramp1基因群体遗传特性分析
对荷斯坦奶牛Nramp1基因第11外显子的各遗传参数指标进行了分析,其中等位基因A的频率为0.566 0,为优势等位基因;基因型AA的频率为0.445 6,为优势基因型。等位基因B的频率为0.434 0,基因型BB和AB的频率分别为0.313 5和0.240 9。纯合度(Ho)、杂合度(He)、有效等位基因数(Ne)分别为0.507 9、0.492 1和1.965 7;多态信息含量(PIC)为0.370 6,即0.25
2.4 荷斯坦奶牛Nramp1基因第11外显子突变与泌乳性状和产奶量的关联分析
303头荷斯坦奶牛群体的Nramp1基因第11外显子AA、BB、AB基因型对日产奶量、测定日乳脂率、测定日乳蛋白率、SCS值及305 d产奶量5个生产性状的影响见表2。方差分析结果表明,荷斯坦奶牛的乳脂率、日产奶量、体细胞评分在基因型间有显著或极显著差异(P<0.05,P<0.01)。多重比较结果表明,BB基因型乳脂率、日产奶量分别为(3.83±0.08)%、(35.38±1.42)kg,显著(P<0. 05)和极显著(P<0.01)高于AA基因型个体相应性状(3.57±0.07)%、(28.73±1.16)kg,BB基因型体细胞评分(2.35±0.10)显著低于AA基因型(P<0.05)。测定日乳蛋白率和305 d产奶量在不同基因型间无显著差异,但AB型个体介于AA型和BB型两者之间。
表2 荷斯坦奶牛Nramp1基因第11外显子基因型对泌乳性状及体细胞评分的关联分析
Table 2 Influence ofNramp1 gene exon11 genotype on milk traits and SCS of Holstein cattle

基因型Genotype数量Number乳脂率Fatpercentage/%乳蛋白率Proteinpercentage/%日产奶量Dailymilkyield/kg305d产奶量305dmilkyield/kg体细胞评分SCSAA1353.57±0.07b3.17±0.0528.73±1.16B8412.66±393.052.90±0.20aAB953.83±0.09a3.27±0.0632.58±1.79AB8304.04±646.282.86±0.18abBB733.83±0.08a3.22±0.0535.38±1.42A7851.42±512.922.35±0.10b
同列数据后无相同大写字母表示差异极显著(P<0.01),无相同小写字母表示差异显著(P<0.05)。
Values in each column without the same capital or lowercase letters are significantly different at the probability level of 0.01 or 0.05, respectively.
3 讨论
3.1 荷斯坦奶牛Nramp1基因多态性分析
大多数高等哺乳动物Nramp1基因外显子和内含子间变异很小,但是其3’和5’非编码区存在很大变异,因此有关荷斯坦奶牛Nramp1基因多态性的研究主要集中3’UTR区[4-8]。本研究仅在荷斯坦奶牛Nramp1基因第11外显子中发现扩增片段的第200位发生的C→G碱基突变,该突变导致蛋白质氨基酸序列由半胱氨酸(Cys)转变为丝氨酸(Ser),而在第10外显子中未发现多态位点。同胡海川[12]研究对比发现,扩增片段相同却出现了不同的结果。胡海川[12]研究发现,荷斯坦奶牛Nramp1基因第10外显子存在2个等位基因3种基因型,第11外显子第200位、254位分别存在C→G、T→G的碱基突变,造成这种差异可能是由于所研究的荷斯坦奶牛群体的遗传背景和基因与环境相互作用不同而造成的差异,再者我们也应扩大样本容量,避免偶然情况发生;另外第10外显子突变位点的PIC低于0.25,说明该位点低度多态,遗传变异较小,可望获得的遗传进展不大。
本研究中荷斯坦奶牛Nramp1基因第11外显子多态信息含量(PIC)介于0.25和0.50之间,说明该群体多态信息含量已达到中度多态,且该群体未偏离Hardy-Weinberg平衡(P>0.05),因此荷斯坦奶牛群体在此位点的多态性相对较高,遗传变异相对较大,可望获得更多的遗传进展,可以很好地利用这一位点在本试验群体中表现出良好的多态性选择。马捷琼等[15]研究表明,奶牛Nramp1基因3′UTR区具有丰富的多态性,多态信息含量为0.950,处于高度多态,该群体未偏离Hardy-Weinberg平衡,这可能与人工选择和饲养环境有关。
3.2 荷斯坦奶牛Nramp1基因多态性与泌乳性状及产奶量的关联性
Nramp1基因是动物体内残余固有免疫反应的重要调节因子。候选基因作为寻找筛选畜禽重要经济性状的遗传连锁标记有效方法,可以直接研究该基因的多态性与个体经济性状的关系。由于牛乳中SCC能准确反映奶牛乳腺炎的发病程度,同时SCS与乳腺炎的遗传相关为0.6~0.8,并且SCS的增加可降低产奶量,因此本试验以SCS为乳腺炎的参数,研究各基因型与SCS、产奶量之间的相关性。马捷琼等[16]研究表明,Nramp1基因3′UTR区多态性与奶牛305 d产奶量和乳房炎检出率均达到显著相关(P<0.05)。郭洋等[17]研究发现,乳中SCC越低,305 d产奶量较高。
本研究发现,Nramp1基因第11外显子G→C的突变位点对荷斯坦奶牛体细胞评分的影响显著(P<0.05),对测定日产奶量影响极显著(P<0.01),对测定日乳脂率影响显著(P<0.05),但对305d产奶量影响不显著(P>0.05),因此可以把该位点作为中国荷斯坦奶牛体细胞评分、测定日产奶量和测定日乳脂率遗传标记进行研究。中国荷斯坦奶牛Nramp1基因第11外显子的突变与泌乳性状的关联分析结果表明,AA基因型个体305 d产奶量最高,为8 412.66 kg,但其乳脂率(3.57±0.07)%、乳蛋白率(3.17±0.05)%和日产奶量(28.73±1.16)kg却是各种基因型中最低的。中国荷斯坦奶牛不同基因型个体泌乳性状的分析结果和突变检测情况提示,Nramp1基因第11外显子的G→C突变对奶牛的泌乳性状可能存在重要影响。
[1] VIDAL S, GROS P, SKAMENE E. Natural resistance to infection with intracellular parasites: molecular genetics identifies Nramp1 as the Bcg/Ity/Lsh locus[J].JournalofLeukocyteBiology,1995,58(4):382-390.
[2] SUPER F, SUPEKOVA L,NELSON H, et al. A yeast manganese transporter related to the macrophage protein involved in con-ferring resistance to mycobacteria[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1996,93(10):5105-5110.
[3] FLEMING M, TRENOR C, SU M A, et al. Microcytic anaemia mice have a mutation in Nramp2, a candidate iron transporter gene[J].NatureGenetics,1997,16(4):383-386.
[5] BARTHEL R, FENG J, PIEDRAHITA J A, et al. Stable transfection of the bovine NARMP1 gene into murine RAW264.7 cells: Effect onBrucellaabortussurvival[J].InfectionandImmunity, 2001, 69(5): 3110-3119.
[6] KUMAR N, MITRA A, GANGULY I, et al. Lack of association of brucellosis resistance with(GT)(13)microsatellite allele at 3’UTR of NRAMP1 gene in Indian zebu (Bosindicus) and crossbred (Bosindicus×Bostaurus) cattle[J].VeterinaryMicrobiology,2005,111(l):139-143.
[7] PAIXAO T A, FERREIRA C, BORGES A M, et al. Frequency of bovine Nramp1 alleles in Holstein and Zebu breeds[J].VeterinaryImmunologyandImmunopathology, 2006, 109(1): 37-42.
[9] 吴宏梅, 王立贤, 程笃学, 等. 猪Nramp1基因多态性与免疫功能的相关性[J].中国农业科学, 2008, 41(1): 215-220. WU H M,WANG L X,CHENG D X, et al. Relationship between polymorphisms ofNramp1 gene and immune function of pig[J].ScientiaAgriculturaSinica, 2008,41(1):215-220.(in Chinese with English abstract)
[10] HÉBERT A, SAYASITH K, SÉNÉCHAL S, et al. Demonstration of intracellularStaphylococcusaureusin bovine mastitis alveolar cells and macrophages isolated from naturally infected cow milk[J].FEMSMicrobiologyLetters, 2000, 193(1): 57-62.
[11] JOO Y S, MOON J S, FOX L K, et al. Comparison of natural resistance-associated macrophage protein (NRAMP) 1 expression between cows with high and low milk somatic cells counts[J].AsianAustralasianJournalofAnimalSciences, 2003, 16(12): 1830-1836.
[12] 胡海川.中国荷斯坦牛Nramp1基因部分序列分析及其与乳腺炎关联研究[D].雅安:四川农业大学, 2008. HU H C. Sequence analysis of partial NramP1 gene and the association with mastitis in Chinese Holstein cattle[D].Ya’an: Sichuan Agricultural University, 2008. (in Chinese with English abstract)
[13] HU J, ZHOU H, SMYTH A, et al. Polymorphism of the bovine ADRB3 gene[J].MolecularBiologyReports, 2010, 37(7): 3389-3392.
[14] SHOOK G E. Genetic improvement of mastitis through selection on somatic cell count[J].TheVeterinaryClinicsofNorthAmericanFoodAnimalPractice,1993,9(3):563-581.
[15] 马捷琼, 陈宏, 陈宗芳, 等. 徐州荷斯坦牛Nramp1基因多态性与乳腺炎通径分析[J].黑龙江畜牧兽医, 2007,42(4):1-2. MA J Q, CHEN H,CHEN Z F, et al. Path Analysis of the polymorism ofNramp1 gene and mastitis in Xuzhou Holstein cattle[J].HeilongjiangAnimalScienceandVeterinaryMedicine, 2007,42(4):1-2. (in Chinese)
[16] 马捷琼,刘缠民,陈宏,等. 徐州荷斯坦牛Nramp1基因多态性与产奶量通径分析[J].江苏农业科学, 2007(1):116-118. MA J Q, LIU C M, CHEN H, et al. Path analysis ofNramp1 gene polymorphism and milk productivity of Holstein cattle in Xuzhou, Jiangsu Province[J].JiangsuAgriculturalSciences, 2007(1):116-118. (in Chinese with English abstract)
[17] 郭洋, 王洪梅, 侯明海, 等. 中国荷斯坦牛SLC11A1基因多态性与乳腺炎的相关性研究[J]. 中国农业科学, 2010, 44(19): 4072-4080. GUO Y, WANG H M, HOU M H, et al. Polymorphisms ofSLC11A1 gene and their association with mastitis in Chinese Holstein[J].ScientiaAgriculturaSinica,2010, 44(19): 4072-4080. (in Chinese with English abstract)
(责任编辑 张 韵)
Genetic polymorphismNramp1 gene and its associations with milk traits and milk yield in Chinese Holstein cattle
ZHANG Li, LIU Lixia, CHEN Hong, LI Qiangzi, LIU Wuxin
(CollegeofLifeScienceandEngineering,NorthwestMinzuUniversity,Lanzhou730030,China)
To search the molecular markers that are associated with mastitis and to provide a theoretical basis for the Holstein cattle breeding and disease resistance, the polymoprhisms ofNramp1 gene in 303 Holstein cattle in Ningxia were detected by the PCR-SSCP technique and the effect ofNramp1 gene c.200C>G locus mutation on milk traits and milk yield was analyzed using a general linear model. The results showed that there was a significant relationship betweenNramp1 gene c.200C>G locus mutation and milk fat, milk yield and somatic cell score at the probability level of 0.05 or 0.01. Therefore we can put the site as cattle somatic cell score, daily milk yield measurement and daily milk fat genetic markers in Chinese Holstein.
Holstein cattle;Nramp1 gene; genetic polymorphism; milk traits; milk yield
10.3969/j.issn.1004-1524.2017.03.06
2016-09-16
西北民族大学引进人才科研项目(xbmuyjrc201316);西北民族大学基本科研业务费专项资金资助项目(31920140077)
张丽(1980—),女,宁夏石嘴山人,博士,副教授,主要从事奶牛分子育种研究。E-mail: zhangli2008@aliyun.com
S823.2
A
1004-1524(2017)03-0389-06
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(3): 389-394
http://www.zjnyxb.cn
张丽,刘丽霞,陈红,等. 中国荷斯坦奶牛Nramp1基因多态性与泌乳性状及产奶量的关联性分析[J].浙江农业学报,2017,29(3): 389-394.
