有机垃圾热解炭对紫色土细菌群落结构的影响
2017-04-08张尚毅刘国涛谢梦佩
张尚毅,刘国涛,谢梦佩
(重庆大学,三峡库区生态环境教育部重点实验室,重庆 400045)
有机垃圾热解炭对紫色土细菌群落结构的影响
张尚毅,刘国涛*,谢梦佩
(重庆大学,三峡库区生态环境教育部重点实验室,重庆 400045)
以700℃热解制得城市有机垃圾(OFMSW)生物炭,为研究该生物炭对氮素缺乏的紫色土有机质、氮营养元素以及微生物群落结构的影响,设计了为期12个月的土壤盆栽培养试验.试验共设置生物炭添加量分别为0%、1%、3%和5%(w/w)的4个处理.采用高通量测序技术分析土壤的微生物群落结构.试验表明:3%和5%的生物炭添加量显著提高了土壤有机质和全氮含量,同时显著降低了紫色土中细菌的α-多样性;主成分分析显示,0%与1%添加量处理的细菌群落组成相似,3%与5%添加量处理的细菌群落组成相似. Illumina测序从24个土样中鉴定出了42门细菌,其中主要的6个菌门为变形菌门、酸杆菌门、拟杆菌门、放线菌门、绿弯菌门和芽单胞菌门,它们序列数占序列总数的83.7%~94.3%.各菌门对不同的生物炭添加量响应不同.从24个土壤样本中鉴定出642个菌属,相对丰度大于1%的有105个.部分主要菌属对3%和5%的生物炭添加量的响应与0%和1%的不同.
城市有机垃圾(OFMSW);生物炭;紫色土;细菌群落结构
紫色土是我国特有的土壤资源,分布面积有2000多万hm2[1].由于成土快、发育浅、透气性好、矿物营养丰富、酸碱适中,紫色土中的好养微生物十分活跃,造成土壤有机质(SOM)的矿化势和矿化率均较高,加之垦植率高,腐蚀严重,导致SOM和土壤全氮(TN)含量均较低[1].与此同时生物炭作为一种有潜力的土壤改良剂被越来越多的运用到农业生产中.研究表明,生物炭能提高SOM和土壤TN含量,有助于提升土壤的肥力和促进农业增产[2-5].生物炭对土壤微生物群落结构和酶活性的影响是引起SOM和土壤TN含量增加的一个重要原因[6-7].生物炭引起土壤中微生物群落结构和相对丰度的变化已有众多报道.Xu等[8]通过高通量测序技术发现水稻秸秆生物炭增加了酸性土壤的菌群多样性. Anderson等[9]通过TRFLP和454测序发现450℃热解得到的辐射松生物炭能使50%的微生物相对丰度得以增加,包括关键的NO—2氧化菌和NO—3还原菌.
目前,关于生物炭对于土壤微生物群落的研究较多[8-11],但所用的生物炭原料主要为农林废物,而关于城市有机垃圾(OFMSW)热解生物炭的研究较少[12].本研究采用OFMSW生物炭改良重庆地区的紫色土,通过1a的培养试验,考察生物炭对紫色土中微生物群落结构的影响,为OFMSW生物炭改良紫色土提供微生态的研究基础.
1 材料与方法
1.1 试验材料
试验土壤为重庆市沙坪坝区虎溪镇(29.53N, 106.45E)的农田紫色土,采集表层0~15cm的土壤.将采集的新鲜紫色土置于室内通风处风干,去除较大的石砾、树叶、草根及其他侵入体,碾碎,过8目筛后保存备用.

表1 生物炭及供试土壤的基本性质Table 1 Characteristics of biochar and base soil
生物炭原料及制备方法见文献[13].每次称取(1000±1)g的原料于坩埚中,设定热解终温为700°C,制得的生物炭研磨后过0.25mm筛,装入密封袋备用.供试土壤和生物炭的基本性质见表1.
1.2 试验方法
试验装置采用塑料培养盆,口径160mm,底径110mm,高140mm.试验设计4个处理:对照组,添加1%、3%和5%(w/w)的生物炭处理组,分别表达为0%BC、1%BC、3%BC和5%BC.每个处理设置3个重复,考虑取样需要(每盆1次,需6次),共设置72个培养盆.试验前将生物炭按各处理的设计添加量与土壤均匀混合.各取1000g试样加入到培养盆中,并播撒1g黑麦草种子,在自然温度下培养.培养试验于2014年12月10日启动,为期12个月.培养期间保持土壤含水量为田间持水量的60%.
各处理组每2个月选择3盆(共计12盆)土壤进行破坏性取样,每盆取100g土样于室内通风处风干后装袋,以备SOM和TN含量的测试.同时每盆取0.5g新鲜土壤于15mL无菌离心管中混合均匀后-80°C保存,以备DNA提取.
1.3 分析方法
1.3.1 土壤有机质和TN含量 SOM含量采用重铬酸钾容量法进行测定,土壤TN含量采用半微量开氏法进行测定.
1.3.2 pH值和阳离子交换量 土壤pH值采用《NY/T1377-2007》[14]方法测定,生物炭pH值采用《GB-T12496.7-1999》[15]方法测定, CEC采用《NY/T1121.5-2006》[16]方法测定.
1.3.3 孔隙结构 生物炭的比表面积和微孔体积采用ASAP2020M型比表面和微孔分析仪测定,样品在100℃下真空干燥12h,测定77K氮气吸附等温线,利用BET方程计算比表面积, 根据相对压力P/P0=0.99时吸附的氮气量计算微孔体积.
1.3.4 元素分析 原料和热解炭的C、H、O、N、S采用vario ELLⅢ-CHNS-O型元素分析仪测定, Cl采用《GB/T3558-1996》[17]中的艾士卡混合剂熔样-硫氰酸钾滴定法测定.
1.3.5 土壤DNA提取及PCR扩增 每份土样取0.25g,使用试剂盒PowerLyzer PowerSoil DNAIsolation kit (MO Bio Laboratories, Inc., Carlsbad, CA)进行DNA提取,测定DNA含量以及A260/A280和A260/A230的比值.
PCR扩增由美吉生物医药科技有限公司(中国上海)完成.所用引物对为带有条形码的特异引物338F(5’-ACTCCTACGGGAGGCAGCA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’),反应条件为:95℃预变性2min;94℃变性30s(25个循环),55℃退火30s,72℃延伸1min(35个循环);最后72℃延长10min.将同一处理的3个PCR产物混合后用2%的琼脂凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒切胶回收, Tris-H Cl洗脱,用QuantiFluorTM-SM定量(Promega公式)系统进行定量检测.检测后的PCR产物与“Y”接头相连,利用PCR扩增进行文库模板的富集,构建测序文库.然后在Illumina Miseq PE300平台上进行测序.
1.3.6 MiSeq测序数据处理 对原始数据结果进行质控过滤处理,得到优化序列.优化序列在97%相似度水平进行OTU(Operational Taxonomic Units)分布统计,选出与OTU代表序列相似性在97%以上的序列,生成OTU表格.用Mothur进行α-多样性(Shannon指数及Simpson指数)分析.使用Qiime和RDP,对97%相似水平的OTU代表序列进行分类学分析,并在各个水平(界、门、纲、目、科、属、种)统计每个样品的群落组成.测序数据已提交至NCBI SRA基因数据库(SRP075841).
2 结果与讨论
2.1 土壤有机质与TN含量的变化
如图1所示,供试紫色土初始SOM含量为14.03g/kg.培养期间,3%BC和5%BC的SOM含量显著比0%BC的高,分别提高了1.72~4.32, 3.21~7.58g/kg.与对照组相比,1%BC的SOM含量无显著提升.各处理的SOM含量由低到高的顺序为0%BC≈1%BC<3%BC<5%BC.3%BC和5%BC的SOM含量能够长期高于对照组的原因,首先可能是由于生物炭携带的难以被微生物所降解的有机质进入土壤从而直接提高了SOM水平.试验生物炭在700℃终温热解制得,H/C非常低,芳香性强,检测到的生物炭表面的官能团以芳环=C-H、芳香族/脂肪族甲基和亚甲基官能团为主[18],难以被化学和生物作用所分解.其次可能是因为生物炭提高了SOM的形成速率,同时降低了有机质矿化为CO2的速率(负激发效应).高雪[5]发现700℃的OFMSW热解生物炭在施入土壤的第10周后开始降低土壤CO2排放通量;陆海楠等[19]也发现水洗后的玉米秸秆生物炭能增加SOM含量但不会增加CO2的释放量;相关的同位素研究直接证明了当生物炭添加到土壤6个月以后,它开始替代部分土壤原有有机质作为微生物的碳源,从而抑制土壤原有有机质的矿化[20];生物炭对土壤本身有机质矿化的抑制作用在其他多个研究中也被报道[21-23].

图1 试验期间紫色土中SOM和TN含量变化Fig.1 Changes of SOMand TN concentration相同小写字母表示处理在P<0.05水平上无显著性差异
图1显示,供试紫色土的初始TN含量为430mg/kg.在试验期间,3%BC和5%BC的TN含量较0%BC的提高了184~367,250~580mg/kg; 1%BC只在第2和4月与对照组存在显著差异, TN含量分别提升了70,130mg/kg. 3%BC和5%BC的土壤TN含量长期高于对照组的原因可能有以下几方面:第一,生物炭自身含有的氮素提高了土壤TN含量.研究供试生物炭含有大量芳香性氮[14],这种形式的氮难以被微生物利用,可以长期存在于土壤中,提高土壤TN含量.第二,生物炭提高了土壤有机氮的形成速率,降低了有机氮的水解、氨化和矿化速率,从而提高了土壤TN含量.生物炭促进土壤有机氮的积累在之前的研究中也有报道[24].第三,生物炭降低了NOx的形成与损失,特别是N2O的排放.研究表明,OFMSW热解生物炭能够有效的降低土壤N2O排放量[5],其他多个研究也有相似的报道[25-27].
2.2 生物炭对土壤总细菌群落多样性的影响
从表2可见,试验期间,3%BC和5%BC的Shannon指数都显著比对照组的低,且5%BC低于3%BC;1%BC的Shannon指数只在第2月比对照组低.试验期间,3%BC和5%BC的Simpson指数(表征物种均匀度)比对照组高,且5%BC高于3%BC;1%BC的Simpson指数并未比对照组高.
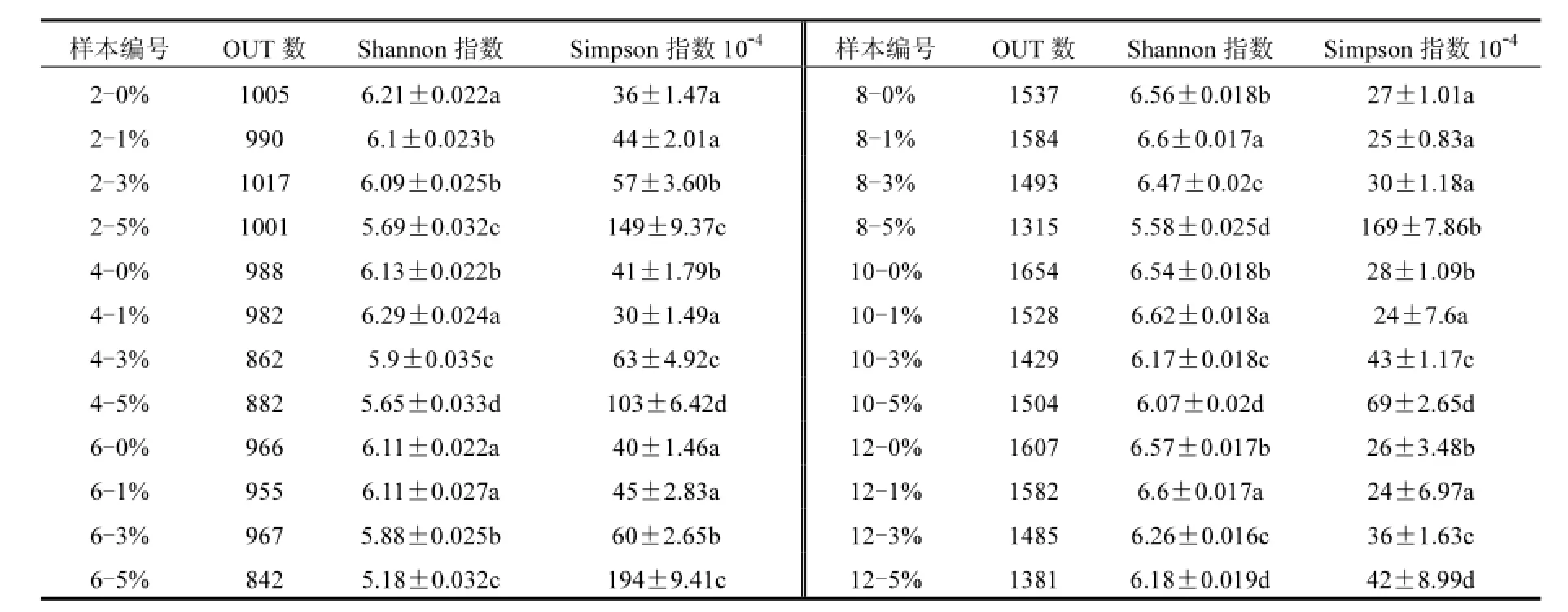
表2 细菌的α-多样性指数Table 2 A lpha diversity indices of bacterial communities

图2 土壤细菌Simpson指数与土壤C:N的回归分析Fig.2 Regression relationship between Simpson index of bacterial communities and C:N ratios in soil samples
表2显示,无论是用Shannon指数还是Simpson指数对土壤细菌α-多样性进行评价, 3%BC和5%BC的都比0%BC的低,同时5%BC的又低于3%BC的,而1%BC的却几乎没有降低土壤细菌的α-多样性.这表明添加生物炭会降低紫色土细菌的α-多样性,且降低量随着添加量的上升而增加.陈俊辉[11]则报道秸秆生物炭增加了水稻田中细菌的多样性.本研究生物炭改良土壤细菌α-多样性降低的原因可能是生物炭的添加改变了细菌在土壤中的生长情况.回归分析(图2)表明土壤C/N与供试土壤细菌Simpson多样性指数符合指数函数分布(R2= 0.615, P<0.01),细菌的物种均匀度随C/N比的下降而上升.养分组成是影响土壤微生物群落结构的主要因素,低C/N的土壤中可供微生物生长的营养较为丰富,有利于细菌的生长[28],各细菌种群之间竞争减弱,生长比较平均进而提升了物种的均匀度.生物炭的添加降低了土壤C/N比从而提升了细菌的均匀度.
2.3 细菌群落结构的差异分析
通过对各样品的菌属组成进行主成分分析(PCA),可以反映样品间的差异和距离,样品组成越相似,在PCA图中的距离越近.PCA结果(图3)显示,24个土壤样本中,0%BC与1%BC的细菌群落组成相似,3%BC与5%BC的细菌群落组成相似.同时试验前半年土样中的细菌群落组成与后半年的分布不同.

图3 生物炭对紫色土细菌群落结构影响的主成分分析Fig.3 Principal component analysis of the influence of biochar on bacterial communities of purple soils
2.4 细菌相对丰度在门水平上的变化
24个土壤样本共鉴定出42门细菌,其中6个主要门为:变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和芽单胞菌门(Gemmatimonadetes),它们总的相对丰度占所有序列的83.7%~94.3%,各菌门的相对丰度见图4.变形菌门是最主要的菌门,其相对丰度在大部分土样中(除6-0%、8-1%和12-0%的分别为29.9%、29.5%和26.6%外)高于30.0%,最高为42.6%(6-1%).在第2、4、6和12月,3个试验组的变形菌门相对丰度均比对照组的高,最多的增加了12.7%.总体来说,3%BC和5%BC的放线菌门相对丰度比对照组的高,分别提高了0.8%~ 11.6%和1.4%~7.9%;与对照组相比,1%BC的放线菌门相对丰度仅在第2和6月提高了11.6%和5.2%,其他月降低了0.22%~7.3%. Khodadad等[29]也发现在含有丰富火成炭的土壤中的放线菌门更为丰富,与本研究的结果一致.变形菌门对反硝化过程有一定影响.其中的δ-变形菌纲能携带膜质硝酸盐还原酶(Nar),另外,厚壁菌门和放线菌门也会携带Nar;变形菌门也是唯一携带周质硝酸还原酶(Nap)的菌门[30],Nar和Nap在大部分土壤中起相似或互补作用[31].这些菌门在生物炭改良土壤中相对丰度的增加可能增加着土壤中narG和napA相对丰度.但是,Bai等[32]研究发现木质生物炭降低了酸性土壤中narG的丰度.这可能是由于本研究供试土壤和生物炭与Bai等的不同.
在整个培养期间, 3%BC和5%BC的酸杆菌门相对丰度比对照组的分别降低了3.7%~22.0%和2.9%~25.9%;除第8和10月外,1%BC的酸杆菌门相对丰度也比对照组的低.一般来说酸杆菌门是贫营养细菌[33],根据Lopes-Lozano等[34]的报道,酸杆菌门在营养丰富的农业土壤中丰度更低.在本研究中,生物炭明显提高了SOM含量,其他研究也表明生物炭能提高土壤肥力[35-36],这可能导致了酸杆菌门相对丰度的降低.大部分1%BC和3%BC的拟杆菌门相对丰度都比对照组的低,分别降低了0.7%~2.8%和0.1%~4.3%; 5%BC的拟杆菌门相对丰度在第2、10和12月比对照组的降低了1.0%~3.0%,而在第4、6和8月却升高了3.7%~8.3%.
在培养前8个月,5%BC的芽单胞菌门相对丰度比0%BC和1%BC的低.芽单胞菌门更适宜在干燥土壤中生长[37].试验期间发现每次需往0%BC和1%BC中加入更多蒸馏水以恢复土壤含水量,说明这2个处理的土壤水分更易散失而变得干燥,这可能是导致其中的芽单胞菌门相对丰度高于5%BC的原因.5%BC的绿弯菌门相对丰度比对照组的低,而1%BC和3%BC的影响则不统一.在0%BC、1%BC及部分3%BC土壤样本中鉴定出了硝化螺旋菌门(Nitrospirae),相对丰度多位于1.0%~2.5%,最高达到2.7%(编号10.0%中);而5%BC中则未发现硝化螺旋菌门.
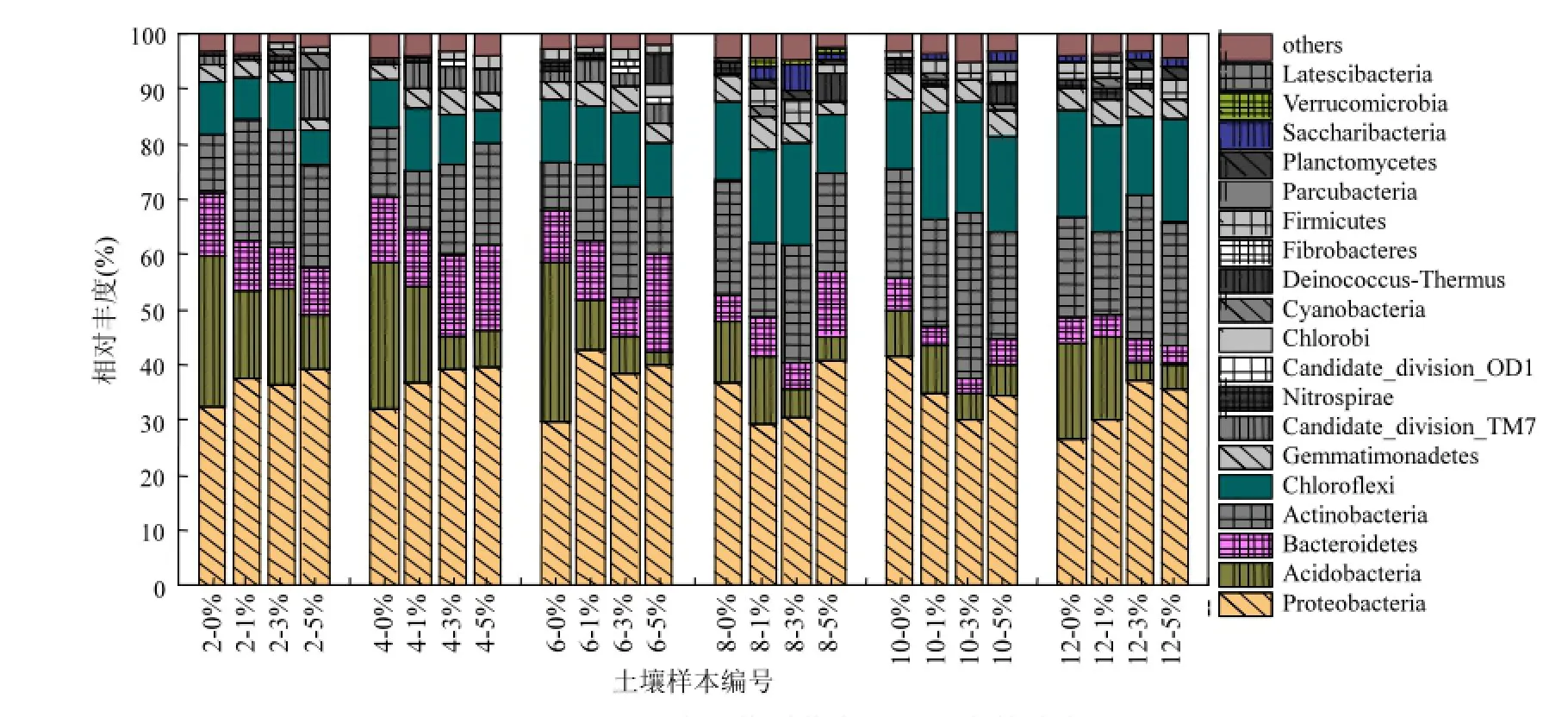
图4 土壤细菌群落在门水平上的分布Fig.4 Taxonomic compositions of bacterial communities at a phyla level

图5 土壤细菌群落在属水平上的分布Fig.5 Taxonomic compositions of bacterial communities at a genera level

2.5 细菌相对丰度在属水平上的变化
24个土壤样本中共鉴定出642个菌属,其中相对丰度大于1%的菌属105个.如图5所示,对照组的Subgroup_6_norank菌属的相对丰度明显比试验组的高,比5%BC的高约10%(除第10月外);同时3%BC和5%BC的也明显比1%BC的低.同属该纲的Blastocatella的相对丰度在试验组中也出现了降低,且该菌属只在试验的前半年出现.全噬菌纲的Subgroup_7_ orank菌属只出现在0%BC和1%BC中,相对丰度为1.0%~1.5%.
放线菌纲大理石雕菌属(Marmoricola)基本不出现在0%BC中,却以1%~2.5%的相对丰度出现在3%BC和5%BC中.β-变形菌纲的亚硝化单胞菌科Nitrosomonadaceae_uncultured菌属的相对丰度在不同处理之间变化较大,在1.33%~7.04%之间波动,且3%BC和5%BC的相对丰度比对照组的低.而γ-变形菌纲的溶杆菌属(Lysobacter)的情况则相反,其在3%BC和5%BC中的相对丰度比对照组的高,且该菌属在试验的后半年中几乎没有出现.
前4个月,厌氧绳菌纲Anaerolineaceae_ uncultured菌属在3%BC和5%BC中的相对丰度比对照组的低,之后这种趋势消失了,这可能与培养前期生物炭改良土壤的透气性好,不利于厌氧细菌的生长有关;有研究显示,加入生物炭后的前90d,土壤容重显著降低[38],有利于土壤中空气的流通.绿弯菌纲的玫瑰弯菌属(Roseiflexus)未在5%BC中检测到,而在其他处理中均有出现.芽单胞菌纲Gemmatimonadaceae_uncultured菌属在5%BC中的相对丰度一直比其他3个处理中的低.
3 结论
3.1 3%和5%的生物炭添加量显著提高了紫色土的SOM和TN含量.1%的生物炭添加量对紫色土SOM和TN含量无显著提升.
3.2 3%和5%的生物炭添加量显著降低了紫色土中细菌的α-多样性;0%BC与1%BC的细菌群落组成相似,3%BC与5%BC的细菌群落组成相似.
3.3 试验土壤主要的6个菌门为变形菌门、酸杆菌门、拟杆菌门、放线菌门、绿弯菌门和芽单胞菌门,它们总的相对丰度占所有序列的83.7%~94.3%.生物炭添加量对这些菌门相对丰度产生了影响.
3.4 大多数菌属对3%和5%的生物炭添加量的响应与0%和1%的不同.
[1] 艾应伟.土壤生态系统氮素循环 [M]. 北京:化学工业出版社, 2008:27-44.
[2] Woolf D, Lehmann J. Modelling the long-termresponse to positive and negative priming of soil organic carbon by black carbon [J]. Biogeochemistry, 2012,111(1-3):83-95.
[3] Flessa H, Amelung W, Helfrich M, et al. Storage and stability of organic matter and fossil carbon in a Luvisol and Phaeozemwith continuous maize cropping: a synthesis [J]. Journal of Plant Nutrition and Soil Science, 2008,171(1):36-51.
[4] Bruun S, El-Zehery T. Biochar effect on the mineralization of soil organic matter [J]. Pesquisa Agropecuaria Brasileira, 2012, 47(5):665-671.
[5] 高 雪.城镇有机垃圾热解生物炭改良土壤与减排温室气体研究 [D]. 重庆:重庆大学, 2014.
[6] Jin H Y. Characterization of microbial life colonizing biochar and biochar amended soils [D]. Ithaca: Cornell University, 2010.
[7] Lehmann J, Rillig MC, Thies J, et al. Biochar effects on soil biota-a review[J]. Soil Biology and Biochemistry, 2011,43(9):1812-1836.
[8] Xu H, Wang X, Li H, et al. Biochar impacts soil microbial community composition and nitrogen cycling in an acidic soil planted with rape [J]. Environmental Science & Technology, 2014,48(16):9391-9399.
[9] Anderson C R, Condron L M, Clough T J, et al. Biochar induced soil microbial community change: implications for biogeochemical cycling of carbon, nitrogen and phosphorus [J]. Pedobiologia, 2011,54(5/6):309-320.
[10] Li M, Liu M, Li Z, et al. Soil N transformation and microbial community structure as affected by adding biochar to a paddy soil of subtropical China [J]. Journal of Integrative Agriculture, 2016,15(1):209-219.
[11] 陈俊辉.田间试验下秸秆生物质炭对农田土壤微生物群落多样性的影响 [D]. 南京:南京农业大学, 2013.
[12] Bian R, Joseph S, Cui L, et al. A three-year experiment confirms continuous immobilization of cadmiumand lead in contaminated paddy field with biochar amendment [J]. Journal of Hazardous Materials, 2014,272:121-128.
[13] 张尚毅,刘国涛,唐利兰,等.温度对城市有机垃圾热解焦油成分的影响 [J]. 中国环境科学, 2016,36(3):827-832.
[14] NY/T1377-2007 土壤pH的测定 [S].
[15] GB-T12496.7-1999 木质活性炭试验方法: pH值的测定 [S].
[16] NY/T1121.5-2006 土壤检测:石灰性土壤阳离子交换量的测定 [S].
[17] GB/T3558-1996 煤中氯的测定方法 [S].
[18] 唐利兰.城市生活垃圾热解产物性质及元素分布规律研究 [D].重庆:重庆大学, 2015.
[19] 陆海楠,胡学玉,陈 威.生物炭添加对土壤CO2排放的影响 [A].第五届全国农业环境科学学术研讨会 [C]. 天津:农业部环境保护科研监测所、中国农业生态环境保护协会, 2013:629-633.
[20] Stewart C E, Zheng J Y, Botte J, et al. Co-generated fast pyrolysis biochar mitigates green-house gas emissions and increases carbon sequestration in temperate soils [J]. Global Change Biology Bioenergy, 2013,5(2):153-164.
[21] Zimmerman A R. Abiotic and microbial oxidation of laboratory-produced black carbon (biochar) [J]. Environmental Science & Technology, 2010,44(4):1295-1301.
[22] Zimmerman A R, Gao B, Ahn M. Positive and negative carbon mineralization priming effects among a variety of biochar- amended soils [J]. Soil Biology and Biochemistry, 2011,43(6):1169-1179.
[23] Keith A, Singh B, Singh B P. Interactive priming of biochar and labile organic matter mineralization in a smectite-rich soil [J]. Environmental Science & Technology, 2011,45(22):9611-9618.
[24] Prommer J, W anek W, Hofhansl F, et al. Biochar decelerates soil organic nitrogen cycling but stimulates soil nitrification in a temperate arable field trial [J]. Plos One, 2013,9(1):812-813.
[25] Kammann C, Ratering S, Eckhard C, et al. Biochar and hydrochar effects on greenhouse gas (carbon dioxide, nitrous oxide, and methane) fluxes fromsoils [J]. Journal of Environment Quality, 2012,41(4):1052.
[26] Zhang A, Cui L, Pan G, et al. Effect of biochar amendment on yield and methane and nitrous oxide emissions froma rice paddy fromTai Lake plain, China [J]. Agriculture, Ecosystems & Environment, 2010,139(4):469-475.
[27] Case S D C, Mcnamara N P, Reay D S, et al. The effect of biochar addition on N2O and CO2emissions froma sandy loamsoil-the role of soil aeration [J]. Soil Biology and Biochemistry, 2012,51:125-134.
[28] Swift MJ, Heal O W, Anderson J M. Decomposition in terrestrial ecosystems [J]. Applied Physics Letters, 1979,83(14):2772-2774.
[29] Khodadad C L M, Zimmerman A R, Green S J, et al. Taxa-specific changes in soil microbial community composition induced by pyrogenic carbon amendments [J]. Soil Biology and Biochemistry, 2011,43(2):385-392.
[30] Richardson D J, Berks B C, Russell D A, et al. Functional, biochemical and genetic diversity of prokaryotic nitrate reductases [J]. Cellular and Molecular Life Sciences, 2001,58(2):165-178.
[31] Bru D, Sarr A, Philippot L. Relative abundances of proteobacterial membrane-bound and periplasmic nitrate reductases in selected environments [J]. Applied and Environmental Microbiology, 2007,73(18):5971-5974.
[32] Bai S H, Reverchon F, Xu C, et al. W ood biochar increases nitrogen retention in field settings mainly through abiotic processes [J]. Soil Biology & Biochemistry, 2015,90:232-240.
[33] Zhang Y, Cong J, Lu H, et al. Community structure and elevational diversity patterns of soil A cidobacteria [J]. Journal of Environmental Sciences-China, 2014,26(8):1717-1724.
[34] Lopez-Lozano N E, Heidelberg K B, Nelson W C, et al. Microbial secondary succession in soil microcosms of a desert oasis in the Cuatro Cienegas Basin, Mexico [J]. Peerj, 2013,1(1):e47.
[35] Galvez A, Sinicco T, Cayuela ML, et al. Short termeffects of bioenergy by-products on soil C and N dynamics, nutrient availability and biochemical properties [J]. Agriculture, Ecosystems & Environment, 2012,160:3-14.
[36] Ghosh S, Yeo D, W ilson B, et al. Application of char products improves urban soil quality [J]. Soil Use and Management, 2012, 28(3):329-336.
[37] Debruyn J M, Nixon L T, Fawaz MN, et al. Global biogeography and quantitative seasonal dynamics of Gemmatimonadetes in soil [J]. Applied and Environmental Microbiology, 2011,77(17):6295-6300.
[38] Felber R, Leifeld J, Horak J, et al. Nitrous oxide emissionreductionwith greenwaste biochar: comparisonof laboratory and field experiments [J]. EuropeanJournal of Soil Science, 2014,65(1):128-138.
Influence of organic fraction of municipal solid waste-based biochar on microbial community structure in a purplesoil.
ZHANG Shang-yi, LIU Guo-tao*, XIE Meng-pei
(Key Laboratory of Three Gorges Reservoir Region’s Eco-Environment, Ministry of Education, Chongqing University, Chongqing 400045, China). China Environmental Science, 2017,37(2):669~676
Organic fraction of municipal solid waste (OFMSW) was pyrolyzed at 700℃ to produce biochar, which was used to amend an organic and nitrogen deficient purple soil in Chongqing. Twelve month pot incubation experiments were conducted to investigate effects of the OFMSW-based biochar on the content of organic matter (OM) and total nitrogen (TN) as well as microbial community structure of the purple soil. The experiments were performed with four treatments of 0%, 1%, 3% and 5% (w/w) of biochar addition, and the microbial communities of the amended soils were analyzed by high throughput sequencing technology. The results showed that the addition of 3% and 5% of biochar significantly increased the content of OMand TN and reduced the alpha diversity of bacteria in purp le soils. The principal component analysis showed that the bacterial communities in the 0% and 1% treatments were similar, and the bacterial communities in the 3% and 5% treatments were similar. The Illumina sequencing from24soil samples identified 42bacteria phyla, 6of which were the main bacterial phyla Proteobacteria, Acidobacteria, Bacteroidetes, Actinobacteria, Chloroflexi and Gemmatimonadetes, accounting for 83.7%~94.3% of the total number of sequencing. The bacteria phyla varied in their response to the addition levels of biochar. In 24soil samples, 642genera were identified, among which 105genera had a relative abundance greater than 1%. The responses of some major bacterial genera to 3% and 5% addition of biochar were different fromtheir responses to 0% and 1% biochar addition.
organic fraction of municipal solid waste (OFMSW);biochar;purple soil;microbial community structure
X705
A
1000-6923(2017)02-0669-08
张尚毅(1965-),男,重庆人,教授,博士,主要从事固体废物处理与资源化研究.发表论文20余篇.
2016-06-16
重庆市自然科学基金重点项目(2011BA7020)
* 责任作者, 副教授, liu-guotao@163.com
