中压紫外对碘酸根的降解及后续氯胺化I-THM生成特性
2017-04-10王安琪
张 帆,徐 斌,王 震,王安琪
(同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室 上海 200092)
中压紫外对碘酸根的降解及后续氯胺化I-THM生成特性
张 帆,徐 斌,王 震,王安琪
(同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室 上海 200092)
以碘酸根为研究对象,研究中压紫外对碘酸根的降解速率,天然有机物及共存碘离子对其降解速率影响,在此基础上,采用氯胺消毒方式,考察溶液pH、氯胺投加量及溴离子浓度对碘代消毒副产物的生成影响.研究发现,饮用水中压紫外消毒工艺对碘酸根具有明显降解作用,其光反应产物为碘离子.降解过程符合拟一级反应动力学方程,中压紫外光强为8.5mW/cm2时,其拟一级反应速率常数为(0.403±0.059)× 10-3s-1.水中天然有机物(NOM)可促进紫外光对碘酸根的降解,而初始碘离子浓度会抑制碘酸根降解.含碘酸盐原水经中压紫外光照射后,后续氯胺消毒工艺将大量产生碘代三卤甲烷(I-TH Ms).因此在采用中压紫外/氯胺联合消毒的净水工艺中,碘酸根转化后形成碘代消毒副产物的风险应当引起关注.
碘代消毒副产物;中压;紫外辐照;氯胺化
溶解性的碘主要包含碘离子,有机碘和碘酸根[1].通过测定水中几种碘的分化,得出自来水中碘酸根的浓度可高达10.6µg/L,而对应碘离子只有0.3µg/L,海水中碘的主要种类也是热力学稳定的碘酸根[1].而在我国一些省份的高碘乡镇,水源中的碘酸根含量可达200~500µg/L[2].一般来说,碘酸根被认为是无毒的,不过有研究表明,在低压紫外辐照条件下,碘酸根可以部分转化为碘离子,并在后续氯胺化消毒过程中生成高致毒性碘代消毒副产物[3].然而自来水厂普遍采用中压紫外的消毒方式.因其有永久灭活微生物的效果,并且相比低压系统,需要更少的紫外灯管、更少的作用时间以及更高的效率.所以中压紫外辐照条件下,碘酸根降解速率如何,后续氯胺组合消毒过程中高致毒性碘代副产物生成风险是否更大尚待进一步研究.为此,本文研究了中压紫外降解碘酸根的动力学规律,同时考察了后续氯胺化过程碘代消毒副产物生成风险,以期能为净水工艺中碘酸盐的风险识别与控制提供一定的技术和理论支持.
1 材料与方法
1.1 实验试剂与仪器
碘仿(CHI3,99.0%)、碘化钾(KI≥99.0%)、碘酸钾(KIO3≥99.0%)、次氯酸钠购于美国Sigma-Aldrich公司. 5种碘代消毒副产物混标购于加拿大CanSyn Chemical公司.磷酸二氢钾、氯化铵、溴化钾、氢氧化钠、亚硫酸钠等试剂购于国药集团化学试剂有限公司(上海).腐殖酸和富里酸购于国际腐殖酸协会(IHSS).有机溶剂甲基叔丁基醚(MtBE)、甲醇和乙腈均为色谱纯,购于J.T.Baker公司(USA).气相色谱仪GC-2010购自岛津(日本).紫外辐照反应器为南京胥江机电厂生产的XPA-7型多试管搅拌光化学反应仪,中压紫外灯的功率为500W,光强I=8.5mW/cm2.
1.2 水样采集
不同水质背景实验采用腐殖酸(HA)和富里酸(FA)作为水中天然有机物背景,同时也采集了上海长江青草沙水库原水和黄浦江原水作为实际水体背景.各水样水质条件如表1所示.

表1 实验水样水质参数Table 1 Characteristics of water samples
1.3 试验方法
1.3.1 碘酸根、碘离子和三碘阴离子分析方法 碘酸根和碘离子均采用 UPLC进行检测.采用的流动相及比例为43%的0.1%磷酸溶液和57%的乙腈,流量为0.8mL/min,紫外检测器的波长为209nm.三碘阴离子通过在352nm处测定其吸光度确定.
1.3.2 紫外降解碘酸根的实验方法 取50mL超纯水,加入碘酸钾母液,使碘酸根浓度分别达到100,75,50,25µmol/L,混合均匀后接受中压紫外灯辐照;辐照进行到30s和1,5,10,15,20,30,45,60min时,分别取样测定碘酸根与碘离子浓度.
1.3.3 紫外降解碘酸根后氯胺化生成 IT H Ms的实验方法取50mL黄浦江水,加入碘酸钾母液使碘酸根浓度为50µmol/L,混合均匀后接受中压紫外灯辐照,辐照60min,在辐照后的样品中加入指定体积的氯胺溶液,于黑暗恒温25℃环境培养3d,反应完毕的样品经一定量的亚硫酸钠淬灭后取10mL,加入2mL的MtBE萃取,震荡3min,静置3min后取上层有机相进气相色谱仪分析.
2 结果与讨论
2.1 中压紫外对碘酸根的降解规律
2.1.1 碘酸根的降解速率

图1 中压紫外条件下不同初始浓度碘酸根随时间的降解及碘离子的生成Fig.1 Degradation of iodate and formation of iodide under the irradiation of MP UV lamps
由图1可知,碘酸根可被中压紫外降解,这与Farkas等[4]关于卤酸根离子的光降解研究结果一致.照射30min后,100µmol/L碘酸根剩余42.62µmol/L,降解了57%;25µmol/L的碘酸根剩余9.67µmol/L,反应了约62%.
对图1结果进行拟一级反应拟合,结果如图2所示.拟合结果线性良好,相关系数R2均大于0.99,说明碘酸根的紫外降解符合拟一级反应.经计算,拟一级反应速率常数为(0.403±0.059)×10-3s-1.

图2 碘酸根降解的拟一级反应拟合Fig.2 Pseudo-First-order reaction fitting of iodate degradation

由图2可知,当碘酸根初始浓度不同时,拟一级反应速率常数都在同一个数量级.当碘酸根初始浓度为50µmol/L时,降解反应速率最大,为0.4613×10-3s-1;25µmol/L时最小,为0.3403×10-3s-1.速率不同可能与碘酸根降解生成的碘离子及其他形态产物对紫外光的吸收产生影响有关[5].
图1结果显示,碘酸根紫外降解产物碘离子的浓度随辐照时间逐步增加.对于100µmol/L的碘酸根,60min辐照后生成44.11µmol/L的碘离子,约45%的碘源转化成碘离子.而75,50和25µmol/L的初始浓度对应的转化率分别为47%、49%和42%.
2.1.2 天然有机物对碘酸根降解速率的影响 取1.2节提到的4种天然有机物背景及超纯水50mL,加入初始浓度为100µmol/L的碘酸根离子,经紫外辐照,分析天然有机物对碘酸根降解过程的影响.
图3结果显示,在4种不同水样环境中,天然有机物的加入可促进碘酸根的降解.其促进作用从强到弱满足:SR腐殖酸>SR富里酸>黄浦江原水>长江原水.在超纯水中,中压紫外辐照60min后还有约33%的碘酸根没有降解,而在腐殖酸背景中,碘酸根被降解了90%.即使是促进作用最弱的长江原水背景,60min后也只有约23 %的碘酸根未被降解.

图3 不同NOM背景对中压紫外降解碘酸根及生成碘离子速率的影响Fig.3 Effect of different NOMon iodate degradation and formation of iodide
根据碘酸根和腐殖酸的光感还原机制[6],腐殖酸在紫外光的辐照下产生的水合电子可还原碘酸根生成次碘酸(式1).之后水合电子转移到碘酸根的水合层(式2).结合水合电子的碘酸根经过紫外光辐照后进一步产生次碘酸根和氧气(式3).次碘酸根经过紫外光辐照后最终形成碘离子(式4).

不同天然有机物的性质不同,会影响水合电子的形成,因此造成不同的反应速率.而腐殖酸作为有机的载色体,对光非常敏感,并且有拦截光子的能力,能参与很多水中的光化学反应.所以腐殖酸显著促进了碘酸根的降解,可能正是因为其光敏特性而产生了更多的水合电子[6].而富里酸相比腐殖酸更容易在紫外光条件下降解[7],可能意味着富里酸比腐殖酸吸收了更多紫外光,影响了水合电子的形成,因此碘酸根的紫外降解相对腐殖酸要慢.黄浦江原水的UV254(0.101)比长江原水(0.042)大,意味着黄浦江原水中含有更多的腐殖酸类天然有机物,这可能是碘酸根在黄浦江原水背景下比长江原水背景下中压紫外降解稍快的原因.
图3也描述了不同前体物背景下碘酸根降解对应碘离子的生成情况.对于降解较快的腐殖酸和富里酸背景,对应的碘离子生成也相对更快.但是在30min之后,腐殖酸和富里酸环境中的碘离子就不再大幅增加,而黄浦江水和长江水环境中的碘离子却保持了相对稳定的生成速率.在60min时生成碘离子大于60µmol/L,而腐殖酸和富里酸环境中生成的碘离子都小于50µmol/L.这说明当碘酸根降解越来越快,即产生的活性碘越来越多时,活性碘可能不再以生成碘离子为主,活性碘若与有机物结合,可能生成有机碘.
2.1.3 共存碘离子对碘酸根降解速率的影响 在自然水体中,碘酸根通常与碘离子共存[1],为探讨碘酸根与碘离子共存条件下的降解规律,调节碘酸根浓度为100µmol/L,然后投加碘化钾母液,使碘离子的初始浓度分别为20,50, 100µmol/L.接受紫外辐照.碘酸根降解和碘离子生成随时间的变化如图4所示.

图4 不同初始碘离子浓度下碘酸根的降解及碘离子的增加Fig.4 Degradation of iodate and formation of iodide under different initial iodide concentration
因初始碘离子的存在有利于三碘阴离子的生成[8],故反应60min后,测定了3种样品中三碘阴离子的吸光度,初始碘离子浓度为20µmol/L的样品中,三碘阴离子的吸光度为0.48,而100µmol/L的样品中三碘阴离子的吸光度为0.97.三碘阴离子具有很大的摩尔吸光系数[9],它的吸光会阻碍碘酸根的吸光,使得碘酸根降解和碘离子的增加都减少,所以随着初始碘离子浓度的增加,碘酸根的降解速度减慢,生成碘离子速率却更快.
2.2 含碘酸根原水中压紫外辐照后氯胺化产生I-TH Ms特性
含碘酸根原水经中压紫外处理后,进行氯化或者氯胺化消毒时,极有可能产生高致毒性的碘代消毒副产物.研究者普遍认为碘代消毒副产物的生成偏好于氯胺消毒方式[10-11].
2.2.1 溶液pH值的影响 碘酸根浓度为50µmol/L时碘酸根的降解速率最快,所以采用碘酸根浓度为50µmol/L, pH值为5~9,投加氯胺浓度为1mg/L,紫外辐照60min后进行氯胺化培养.

图5 溶液pH值对生成I-THMs的影响Fig.5 Effect of solution pH on I-THMs formation
图5结果显示,除二氯一碘甲烷外,其余5种I-THM均有生成.在酸性条件下,主要生成碘仿,pH =5时生成碘仿63.4µg/L,占总量的65.6%.在中性和碱性条件下,只有一氯一溴一碘甲烷和碘仿这2种I-THM产生,一氯一溴一碘甲烷是主要的产物.
碘酸根的降解不随pH值的变化而改变[12].因此,pH值影响氯胺化过程造成I-TH Ms生成变化.然而,有研究表明,碱性条件下更易生成碘仿[13].这与本研究的结果并不相同,说明碘酸根在中压紫外处理后碘的形态并不完全是碘离子,可能是生成了有机碘等其他形态.
2.2.2 氯胺浓度的影响 为探讨氯胺投加量对I-TH Ms生成的影响,在pH = 7条件下,氯胺投加量分别为2,3,4,5mg/L时,I-TH Ms的生成如图6所示.
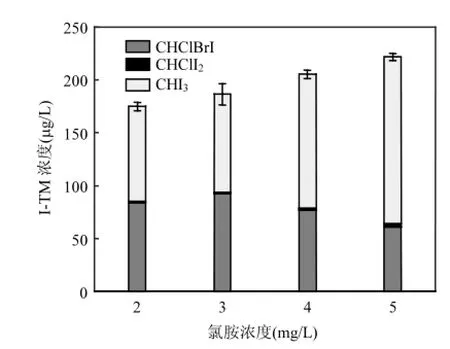
图6 氯胺投加量对生成I-THMs的影响Fig.6 Effect of chloramine dosage on I-THMs formation
在4种氯胺投加量下,均只有3种I-THMs被检测到.因为原水中溴离子的浓度仅为70μg/L,所以二溴一碘甲烷和一溴二碘甲烷均未生成.又因50μmol/L碘酸根紫外辐照30min后生成的碘离子约有25μmol/L,所以碘仿大量生成.溴离子在氯胺条件下可生成氯溴氨[14-15],而氯溴氨可同步脱去溴和氯,使得一氯一溴一碘甲烷大量产生.随着氯胺投加量的增大,生成I-THMs的总量不断增加,是因为高浓度的氯胺可生成更多次碘酸,而氯胺无法进一步氧化次碘酸,故随着活性碘的增多,碘仿生成更多,一氯一溴一碘甲烷生成量略微下降.
2.2.3 溴离子浓度的影响 图7为投加不同浓度的溴离子,对紫外辐照后氯胺化产生I-TH Ms的影响.反应pH = 7,氯胺的浓度为5mg/L.
由图7可知,当溴离子浓度升高时,I-TH Ms变化并不明显,并且碘仿占70%以上.投加溴离子后,生成了一溴二碘甲烷,可能是投加溴离子大大增加了溴离子浓度.但随着溴离子浓度的逐渐增加,I-TH Ms的变化不大,是因为次碘酸与有机物结合的能力要比次溴酸弱[16],所以活性溴首先与有机物结合,更多的产生了常规的溴代三卤甲烷,而非溴代的I-THM.

图7 溴离子浓度对生成I-THMs的影响Fig.7 Effect of bromide concentration on I-THMs formation
3 结论
3.1 碘酸根可被中压紫外光降解,且降解动力学符合拟一级反应,反应速率常数为(0.403 ± 0.059) ×10-3s-1.
3.2 天然有机物的存在对碘酸根的降解有促进作用,而腐殖酸的促进效果最为明显.
3.3 碘酸根与碘离子共存时,初始碘离子的存在会降低碘酸根的紫外降解效率.
3.4 紫外辐照碘酸根后,后续氯胺化过程在酸性条件下副产物以碘仿为主,在中性和碱性条件下以一氯一溴一碘甲烷为主.
3.5 含碘酸根原水经紫外/氯胺工艺处理后,生成碘代消毒副产物的风险应当引起关注.
[1] Gong T, Zhang X. Determinationof iodide, iodate and organoiodine inwaters with a newtotal organic iodine measurement approach [J]. Water research, 2013,47(17):6660-9.
[2] 刘列钧,王海燕,李秀维,等.我国水源型高碘地区水碘形态的研究 [J]. 疾病监测, 2012,(11):891-3.
[3] Zhang T Y, Lin Y L, Wang A Q, et al. Formation of iodinated trihalomethanes during UV/chloramination with iodate as the iodine source [J]. Water Research, 2016,98:199-205.
[4] Farkas L, K lein F. On the Photo-Chemistry of Some Ions in Solution [J]. The Journal of Chemical Physics, 1948,16(9):886-93.
[5] Rahn R O, Bolton J, Stefan MI. The lodide/lodate actinometer in UV disinfection: Determination of the fluence rate distribution in UV reactors [J]. Photochemistry and photobiology, 2006,82(2): 611-5.
[6] Saunders R W, Kumar R, Macdonald S M, et al. Insights into the photochemical transformation of iodine in aqueous systems: Humic acid photosensitized reduction of iodate [J]. Environmental Science & Technology, 2012,46(21):11854-61.
[7] Kulovaara M, Corin N, Backlund P, et al. Impact of UV 254-radiation on aquatic humic substances [J]. Chemosphere, 1996,33(5):783-90.
[8] Ye T, Xu B, Lin Y L, et al. Formation of iodinated disinfection by-products during oxidation of iodide-containing water with potassiumpermanganate [J]. Journal of Hazardous Materials, 2012,241:348-54.
[9] Rahn R O. Potassiumiodide as a chemical actinometer for 254nmradiation: use of lodate as an electron scavenger [J]. Photochemistry and Photobiology, 1997,66(4):450-5.
[10] Bichsel Y, Von Gunten U. Oxidation of iodide and hypoiodous acid in the disinfection of natural waters [J]. Environmental Science & Technology, 1999,33(22):4040-5.
[11] 黄 河,徐 斌,朱文倩,等.长江沿线城市水源氯(胺)化消毒副产物生成潜能研究 [J]. 中国环境科学, 2014,34(10):2497-504.
[12] Phillip N H, G Rten E, Diyamandoğlu V. Transformation of bromine species during decomposition of bromate under UV light fromlowpressure mercury vapor lamps [J]. Ozone: Science and Engineering, 2006,28(4):217-28.
[13] Wang Z, Xu B, Lin Y-L, et al. A comparison of iodinated trihalomethane formation fromiodide and iopamidol in the presence of organic precursors during monochloramination [J]. Chemical Engineering Journal, 2014,257:292-8.
[14] Trofe T W, Inman G W, Johnson J D. Kinetics of monochloramine decomposition in the presence of bromide [J]. Environmental Science & Technology, 1980,14(5):544-9.
[15] Bousher A, Brimblecombe P, Midgley D. K inetics of reactions in solutions containing monochloramine and bromide [J]. Water Research, 1989,23(8):1049-58.
[16] Hua G, ReckhowD A, KimJ. Effect of bromide and iodide ions on the formation and speciation of disinfection byproducts during chlorination [J]. Environmental Science & Technology, 2006, 40(9):3050-6.
Photodegradation of iodate by medium-pressure U Virradiation and formation of I-TH Min sequential chloramination.
ZHANG Fan, XU Bin*, WANG Zhen, WANG An-qi
(State Key Laboratory of Pollution Control and Resource Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China). China Environmental Science, 2017,37(2):592~597
Effects of Natural Organic Matter (NOM), iodide on the degradation of iodate by medium-pressure UV were investigated. Effects of solution pH, chloramine dosage, and bromide concentration on the formation of iodinated trihalomethanes (I-TH Ms) during post-chloramination were also studied. It was found that iodate can be degraded by mediumpressure UV irradiation. The pseudo-first-order reaction rate constant was determined to be (0.403±0.059) ×10-3s-1when the UV intensity was 8.5mW/cm2. The reaction could be promoted by the addition of NOM but impeded by the addition of iodide. I-TH Ms could be formed if water containing iodate was treated with UV/chloramination process. Therefore, special attention should be paid to iodate as a kind of I-THMprecursor in drinking water treatment plants when medium-pressure UV/chloramination disinfection process was applied.
iodinated disinfection by-products (I-DB Ps);medium-pressure;UV irradiation;chloramination
X131.2
A
1000-6923(2017)02-0592-06
张 帆(1992-),男,河北石家庄人,同济大学硕士研究生,主要研究方向为饮用水消毒副产物.
2016-06-05
水体污染控制与治理科技重大专项水体污染控制与治理科技重大专项(2015ZX 07406004)
* 责任作者, 教授, tjwenwu@tongji.edu.cn
