α-硫辛酸对四氯化碳诱导小鼠肝纤维化的保护作用
2017-04-08杨志勇蔡维维邱丽颖
杜 斌 杨志勇 蔡维维 冯 磊 邱丽颖
(江南大学无锡医学院,江苏 无锡 214122)
α-硫辛酸对四氯化碳诱导小鼠肝纤维化的保护作用
杜 斌 杨志勇1蔡维维 冯 磊 邱丽颖
(江南大学无锡医学院,江苏 无锡 214122)
目的 研究α-硫辛酸(LA)对四氯化碳(CCl4)诱导小鼠肝纤维化的保护作用及机制。方法 75只ICR雄性小鼠随机分为正常组、模型组、阳性对照组(水飞蓟素)和LA低、高剂量组。自造模之日起,除正常组外,其余各组以2.5 ml/kg腹腔注射20%CCl4,每周2次,连续6 w。自造模之日起,LA低、高剂量组分别给予(100,300 mg·kg-1·d-1)灌胃,正常组和模型组小鼠给予1.0 g·kg-1·d-1的生理盐水灌胃,阳性对照组给予水飞蓟素(200 mg·kg-1·d-1)灌胃,连续给药42 d。末次给药2 h后乙醚麻醉,从眼内眦静脉取血,摘取肝脏,比较各组小鼠肝功能指标和肝脏组织病理学特征的差异。结果 LA低、高剂量组谷草转氨酶(AST)、谷丙转氨酶(ALT)活性明显低于模型组(P<0.01);肝组织中超氧化物歧化酶(SOD)活性较模型组明显升高(P<0.01);丙二醛(MDA)含量显著下降(P<0.01);通过Masson、HE染色光镜下观察组织病理学变化,观察到LA低、高剂量组可使炎细胞浸润程度、肝细胞水肿程度及肝脏纤维化程度较模型组有所减轻。结论 LA可明显减轻CCl4诱导的小鼠肝纤维化及肝脏炎症反应,其机制可能与抗氧化损伤有关。
α-硫辛酸;肝纤维化;四氯化碳
α-硫辛酸(LA)是一种万能抗氧化剂。有研究表明抗氧化作用可在细胞膜、细胞浆、细胞质和脂蛋白中得到发挥,可清除体内螯合金属离子、自由基等〔1〕,可促进机体能量产生,调节免疫系统,促进细胞自我修复,缓解炎症〔2〕。本实验利用腹腔注射四氯化碳(CCl4)的方法进行造模,建立小鼠肝纤维化动物模型,并灌胃不同剂量的LA,通过观察小鼠体重、血清中谷丙转氨酶(ALT)和谷草转氨酶(AST),肝组织中丙二醛(MDA)和超氧化物歧化酶(SOD)的水平,并观察肝脏病理组织学变化,以检测LA的保肝作用机制。
1 材料和方法
1.1 材料、药品与试剂 ICR小鼠,体质量18~22 g,购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2012-0002,合格证书号:2007000564424。标准饲料,自由饮水。适应饲料后开始实验。LA(Sigma公司,批号12705243);水飞蓟素(Sigma公司,批号BCBF9631V);AST(批号20131226)、ALT(批号20131225)、SOD(批号20131025)、MDA(批号20131024)、考马斯亮蓝蛋白试剂盒(批号20140326),试剂盒均购自南京建成生物工程研究所。TG16A-WS台式离心机(上海卢湘仪离心机仪器有限公司);TS-8型漩涡混匀器(江苏海门其林贝尔仪器制造有限公司);DK-8B型电热恒温水浴槽(上海精宏实验设备有限公司);ME204E电子天平(梅特勒-托利多仪器上海有限公司);ELX800全自动酶标仪(美国伯腾仪器有限公司);5804R多功能台式离心机(德国艾本德公司)。
1.2 实验动物分组与模型制作方法 ICR小鼠75只,随机分为5组,每组15只:即正常组,模型组,LA低、高剂量组,阳性对照组(水飞蓟素组)。自造模之日起,除正常组外,其余各组以2.5 ml/kg腹腔注射20%CCl4〔3〕,每周2次,连续6 w。自造模之日起,除正常组、模型组外,LA低、高剂量组分别给予LA100,300 mg·kg-1·d-1灌胃,正常组和模型组小鼠给予1.0 g·kg-1·d-1的生理盐水灌胃,阳性对照组给予水飞蓟素200 mg·kg-1·d-1灌胃〔4〕,连续给药42 d。末次给药2 h后乙醚麻醉,从眼内眦静脉取血并离心出血清。在肝右叶位置切取小块肝组织,置入10%中性甲醛缓冲液固定。其余肝组织分装于离心管中-80℃冰箱保存。
1.3 小鼠体重 给药第1天称重并记录,给药第42天称重并记录。1.4 肝脏组织学观察 另取肝右叶相同部位放入10%甲醛溶液中固定,常规HE染色,Masson染色光镜下观察组织病理学变化。
1.5 血清中AST、ALT活性的测定 眼眶取血,37℃水浴1 h,3 000 r/min离心15 min,取血清用于测定AST、ALT活性,各指标测定按照试剂盒说明书进行操作。
1.6 肝组织指标的测定 取肝右叶相同部位的一小块肝组织,用冰盐水漂洗,剔除脂肪及结缔组织,吸水纸吸干,称重,然后放入10 ml离心管中;加入适量的冷生理盐水,2 000 r/min匀浆10 s,间歇30 s,反复3次制成10%的组织匀浆;使用冷冻离心机,4℃,3500 r/min离心10 min,取上清液测定肝组织中SOD、MDA的活性。各指标测定方法严格按照试剂盒说明书进行操作。
1.7 统计学方法 采用SPSS17.0统计学软件对数据的组间比较进行单因素方差分析。
2 结 果
2.1 对小鼠体重的影响 给药后第1天体重与给药后第42天体重相比,正常组小鼠体重升高,模型组小鼠体重下降,水飞蓟素组、LA高剂量组小鼠体重升高(P<0.01,P<0.05),LA低剂量组小鼠体重无明显变化(P<0.05),见表1。
2.2 组织病理学检查 (1)HE染色:正常组肝小叶形态结构完整,肝窦及汇管区无异常,肝索排列规则,肝细胞形态正常,无炎性细胞。模型组肝索排列异常,肝细胞呈气球样变性肿胀,胞质疏松,染色较淡。LA低剂量组、高剂量组、水飞蓟素组较模型组肝窦明显,肝细胞的胞质均匀,气球样变性逐渐显著减少。LA对CCl4所致急性肝损伤的病理改变有恢复作用,可减轻炎性细胞浸润、肝细胞浊肿,促进肝细胞再生,表明LA对CCl4所致肝纤维化小鼠具有一定的保护作用。见图1。(2)Masson染色:正常组小鼠肝组织正常,肝小叶组织结构完整,未见胶原纤维增生。模型组小鼠肝组织与正常组比较,胶原纤维明显增多,形成胶原沉积且向门管区延伸明显,互相连结,未见假小叶形成,但肝组织的正常结构破坏显著。LA低剂量组、高剂量组、水飞蓟素组与模型组比较,肝胶原纤维减少明显,表明LA对CCl4所致肝纤维化小鼠具有一定的保护作用。见图2。
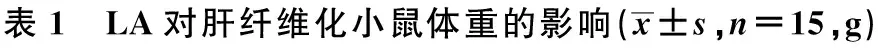

组别给药后第1天给药后第42天正常组25.9±0.743.1±1.62)模型组25.7±0.822.4±2.12)LA低剂量组24.4±0.734.4±1.0LA高剂量组23.4±2.034.2±2.71)水飞蓟素组24.7±1.235.3±1.32)
与给药后第1天比较:1)P<0.05,2)P<0.01

图1 肝组织HE染色(×100)
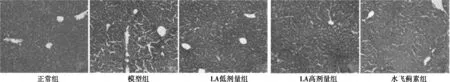
图2 肝组织Masson染色(×100)
2.3 对血清AST、ALT活性的影响 与正常组相比,模型组小鼠血清AST、ALT的活性均升高(P<0.01),说明肝功能有损伤。与模型组相比,LA低剂量组、高剂量组、水飞蓟素组小鼠血清AST、ALT的活性均降低(P<0.01)。见表2。
2.4 对肝组织SOD、MDA含量的影响 与正常组相比,模型组小鼠肝组织中SOD含量降低,MDA含量升高(P<0.01),说明模型比较成功。与模型组相比,LA低剂量组、高剂量组、水飞蓟素组小鼠肝组织中SOD含量升高,MDA含量降低(P<0.01)。见表3。


组别ASTALT正常组41.3±1.750.3±2.2模型组88.6±2.81)108.2±2.51)LA低剂量组60.1±2.22)63.4±2.62)LA高剂量组47.8±2.02)54.4±4.22)水飞蓟素组44.4±2.42)50.6±3.42)
与正常组比较:1)P<0.01;与模型组比较:2)P<0.01,下表同
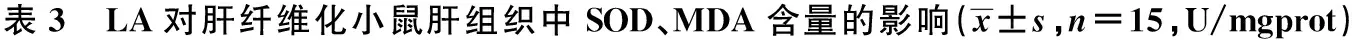

组别SODMDA正常组28.1±0.90.60±0.05模型组22.4±0.51)0.88±0.061)LA低剂量组24.8±0.82)0.70±0.052)LA高剂量组25.5±0.72)0.65±0.042)水飞蓟素组26.7±1.12)0.62±0.042)
3 讨 论
肝纤维化是肝脏对细胞膜破坏、脂质过氧化反应、坏死组织机化再生等反复损伤修复的结果,是介于临床上各种慢性肝炎与进展至肝硬化的病理过程。CCl4是已知的经典肝纤维化诱导剂,有关CCl4诱导小鼠肝纤维化模型的方法已很成熟,已广泛用于保肝药物的筛选、肝细胞损伤及机制及血清学标志物的研究等。人肝损伤与诱导的动物肝损伤模型较为相似。ALT、AST分别主要存在于肝细胞质及肝细胞线粒体内,是肝功能异常的敏感指标。当肝脏发生炎症时会引起 ALT、AST 的升高〔5〕。自由基参与肝纤维化等多种病理过程,了解自由基反应、脂质过氧化与疾病的关系,可作为疾病的诊断、预后和抗氧化治疗的一个有用指标〔6~8〕。
本研究表明LA对炎细胞的浸润、肝细胞的肿胀坏死都有明显改善作用。α-LA干预可以有效降低肝组织MDA 浓度,提高SOD活性,对肝组织的氧化损伤具有保护作用〔9〕。α-LA干预组可降低肝损伤标志性酶AST、ALT活性,表明α-LA可拮抗镉致肝脏的损伤作用〔10〕。LA通过阻断转化生长因子(TGF)-β信号通路抑制肝脏PAI-1表达和纤维化〔11〕。LA通过弱化血小板源生长因子(PDGF)和TGF-β激活性肝星状细胞中的活性氧(ROS)-触发性信号通路抑制肝纤维化〔12〕。本实验研究发现,LA在小鼠肝纤维化实验保护作用中存在量效关系,这种量效关系的存在,可能与肝纤维化损伤的程度有关。LA可能通过减轻肝脂质过氧化损坏,致使胶原合成减少,纤维化程度减轻,保护了CCl4诱导小鼠肝纤维化。
1 Holmquist L,Stuchbury G,Berbaum K,etal.Lipoic acid as a novel treatment for Alzheimer′s disease and related dementias〔J〕.Pharmacol Therap,2007;113(1):154-64.
2 Ghibu S,Richard C,Delemasure S,etal.An endogenous dithiol with antioxidant properties:alpha-lipoic acid,potential uses in cardiovascular diseases〔J〕.Ann Cardiol Angeiol,2008;57(3):161-5.
3 Rowe RG,Lin Y,Shimizu-Hirota R,etal.Hepatocyte-derived Snail1 propagates liver fibrosis progression〔J〕.Mole Cell Biol,2011;31(12):2392-403.
4 Li CC,Hsiang CY,Wu SL,etal.Identification of novel mechanisms of silymarin on the carbon tetrachloride-induced liver fibrosis in mice by nuclear factor-κB bioluminescent imaging-guided transcriptomic analysis〔J〕.Food Chem Toxicol,2012;50(5):1568-75.
5 Yu J,Wang Y,Qian H,etal.Polyprenols from Taxuschinensis var.mairei prevent the development of CCl4-induced liver fibrosis in rats〔J〕.J Ethnopharmacol,2012;142(1):151-60.
6 张超贤,郭李柯,郭晓凤.电针联合贞芪扶正颗粒对肝纤维化大鼠自由基反应、NF-κB活化、TGF-β1 和CTGF、mRNA 表达的影响〔J〕.中国老年学杂志,2014;34(9):2512-6.
7 王志旺,王瑞琼,郭 玫,等.甘肃产藏药五脉绿绒蒿有效部位对肝纤维化大鼠抗氧化系统的影响〔J〕.中国老年学杂志,2013;33(20):5043-6.
8 王国贤,康雅萍,魏慧芳,等.α-硫辛酸对糖尿病大鼠肝脏损伤保护作用〔J〕.中国公共卫生,2013;29(5):704-7.
9 丁 倩,董 媛,张福东,等.α-硫辛酸对高糖诱导GK大鼠肝氧化损伤的影响〔J〕.环境与职业医学,2013;30(10):774-6,779.
10 陆 江,朱道仙,刘 静,等.α-硫辛酸对镉致大鼠肝脏脂质过氧化损伤保护作用试验〔J〕.中国兽医杂志,2012;48(3):34-6.
11 Foo NP,Lin SH,Lee YH,etal.α-lipoic acid inhibits liver fibrosis through the attenuation of ROS-triggered signaling in hepatic stellate cells activated by PDGF and TGF-β〔J〕.Toxicology,2011;282(1):39-46.
12 Min AK,Kim MK,Seo HY,etal.Alpha-lipoic acid inhibits hepatic PAI-1 expression and fibrosis by inhibiting the TGF-β signaling pathway〔J〕.Biochem Biophys Res Commu,2010;393(3):536-41.
〔2015-04-19修回〕
(编辑 苑云杰/曹梦园)
中央高校基本科研业务费专项资金资助(No.JUSRP51412B)
邱丽颖(1965-),女,博士,教授,硕士生导师,主要从事药理学研究。
杜 斌(1983-),男,实验师,主要从事药理学研究。
R572.2
A
1005-9202(2017)06-1320-03;
10.3969/j.issn.1005-9202.2017.06.007
1 阜阳市人民医院特需病房
