罗格列酮对大鼠局灶性脑缺血葡萄糖再灌注性损伤的影响
2017-04-08谢晓燕吉训明
谢晓燕 于 斌 孙 冰 闫 峰 吉训明
(济宁医学院第一临床学院内科学教研室,山东 济宁 272067)
罗格列酮对大鼠局灶性脑缺血葡萄糖再灌注性损伤的影响
谢晓燕 于 斌1孙 冰 闫 峰2吉训明2
(济宁医学院第一临床学院内科学教研室,山东 济宁 272067)
目的 探讨血糖水平和胰岛素反应状态在局灶性脑缺血大鼠再灌注性脑损伤中的作用。方法 将雄性SD大鼠随机分为局灶性脑缺血/再灌注模型生理盐水对照组、罗格列酮(RSG)高、中、低剂量预处理组(4、2、1 mg·kg-1·d-1)、假手术组,每组8只。线栓法制备大鼠大脑中动脉闭塞2 h再灌注22 h模型(MCAO)。测定空腹血糖(FPG)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、血压、血清胰岛素水平,计算胰岛素敏感指数(IAI)。观察RSG对大鼠脑梗死体积和神经功能评分的影响。结果 IAI与梗死体积和神经功能评分存在相关性。与生理盐水对照组比较,RSG各剂量组脑梗死体积显著缩小,神经功能评分显著改善(P<0.05或P<0.01),胰岛素敏感性显著增高(P<0.05 或P<0.01),脑缺血后高血糖显著减轻(P<0.05),并呈剂量依赖性。结论 高血糖和胰岛素抵抗共同作用加重局灶性脑缺血葡萄糖再灌注性脑损伤,且胰岛素抵抗更持久;RSG对脑缺血葡萄糖再灌注性脑损伤的神经保护,单纯降低血糖是不够的,改善胰岛素抵抗更重要。
罗格列酮;PPARγ;葡萄糖再灌注损伤;胰岛素抵抗;高血糖
高血糖是非糖尿病性急性脑缺血患者高并发症和高死亡率的重要独立危险因素,同时也可能是导致局部或广泛缺血后不良预后的危险因素。脑缺血后再灌注血糖和胰岛素抵抗(IR)对神经功能造成的影响众说不一,葡萄糖在神经干细胞缺血缺氧损伤中的作用存在争议。目前认为,高浓度的葡萄糖对神经干细胞缺血缺氧性脑损伤是有害因素〔1~3〕。也有学者认为一定浓度的葡萄糖可减轻其缺血缺氧损伤〔4〕。因此,本实验建立大鼠脑缺血再灌注损伤模型,进一步探讨血糖水平和胰岛素反应状态在缺血葡萄糖再灌注性脑损伤中的作用,通过高血糖和胰岛素敏感性干预观察脑神经功能恢复的影响。
1 材料与方法
1.1 实验动物和分组 健康清洁级雄性SD大鼠40只,体质量280~320 g,由北京维通利华实验动物技术有限公司提供,动物许可证号:SCXK(京)2008-0013。实验前采用数字表法随机分为假手术组、生理盐水对照组以及罗格列酮(RSG)低、中和高剂量预处理组,每组8只。生理盐水对照组制作模型前给予生理盐水2 ml灌胃,1次/d,共1 w;低、中、高剂量RSG预处理组制作模型前1 w分别给予等量生理盐水稀释的RSG(英国葛兰素史克公司,商品名文迪雅,批号:07040062)1、2和4 mg·kg-1·d-1,1次/d,共1 w。最后1次灌胃后30 min制作大脑中动脉闭塞(MCAO)模型。参照Belayev等〔5〕提出的12分评分法,在模型制作前、模型制作后清醒以及再灌注后3个时间点(0、2和22 h)对实验大鼠进行神经功能评分。
1.2 局灶性脑缺血再灌注模型制作 采用改良ZeaLonga法制备MCAO模型〔6〕:术前禁食,自由饮水12 h;大鼠称体质量后用5%恩氟烷(河北九派制药有限公司)混合30%O2/70%N2O诱导麻醉,1%~2%恩氟烷混合30%O2/70%N2O维持麻醉大鼠,颈正中切口,分离、结扎并切断右侧颈外动脉;由颈外动脉残端沿颈总和颈内动脉缓慢插入头端直径约0.38 mm的尼龙栓线(北京科海军舟生物科技发展中心)约20 mm,阻塞大脑中动脉入口造成缺血;缺血 2 h后拔出栓线再灌注22 h。术中使用反馈性控温毯检测大鼠肛温,将大鼠体温维持在36.5℃~37.5℃。应用无创血压检测仪(Siemens SC600C)采用尾套法监测心率及血压,使各项生理参数保持在正常范围。假手术组仅分离颈总动脉、颈外动脉和颈内动脉,但不插入栓线。动物苏醒后出现手术侧Horner征和对侧肢体运动障碍即成功。
1.3 生化指标测定 在模型制作前和模型制作后各取血1滴进行血气分析,以确保术中血气稳定。在大鼠模型制作前、后和处死前采集股动脉血标本1 ml,4℃离心(1 500 r/min)5 min,取血清,-80℃冰箱冻存。利用全自动生化分析仪(日立7170 型)测定各组动物血糖和血甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)水平,采用固相夹心酶联免疫吸附法测定血清胰岛素水平。参照文献〔7〕计算胰岛素敏感指数(IAI)。
1.4 TTC染色 再灌注24 h后大鼠经腹腔注射水合氯醛处死,断头取脑,横断面由前向后,取视交叉前4 mm及其后大脑做连续冠状切片,片厚2 mm,将切片置于1%TTC溶液中,37℃避光孵育20 min,正常脑组织呈玫红色,梗死区呈白色。数码相机拍照,应用Image J软件分析梗死体积,为避免因脑水肿产生数据误差,我们使用梗死面积=健侧半球面积-患侧正常脑组织面积,并计算梗死体积占大脑半球总体积百分比。
1.5 统计学方法 采用SPSS16.0统计软件包进行SNK法及配对t检验。
2 结 果
2.1 生理学指标 各组大鼠模型制作前、后生理学指标均维持正常,各组间无显著差异(模型制作前:F=0.911,P=0.563;模型制作后:F=3.250,P=0.112),说明制模过程中操作环境稳定,无人为因素影响,见表1。
2.2 平均动脉压 各组大鼠模型制作前平均动脉压无显著差异(P=0.537)。除假手术组外,其他组模型制作后和处死前平均动脉压显著高于模型制作前(P<0.05);各时间点假手术组平均动脉压显著低于其他各组(均P<0.05),生理盐水对照组平均动脉压与RSG组差异有统计学意义(P<0.05)。见表2。

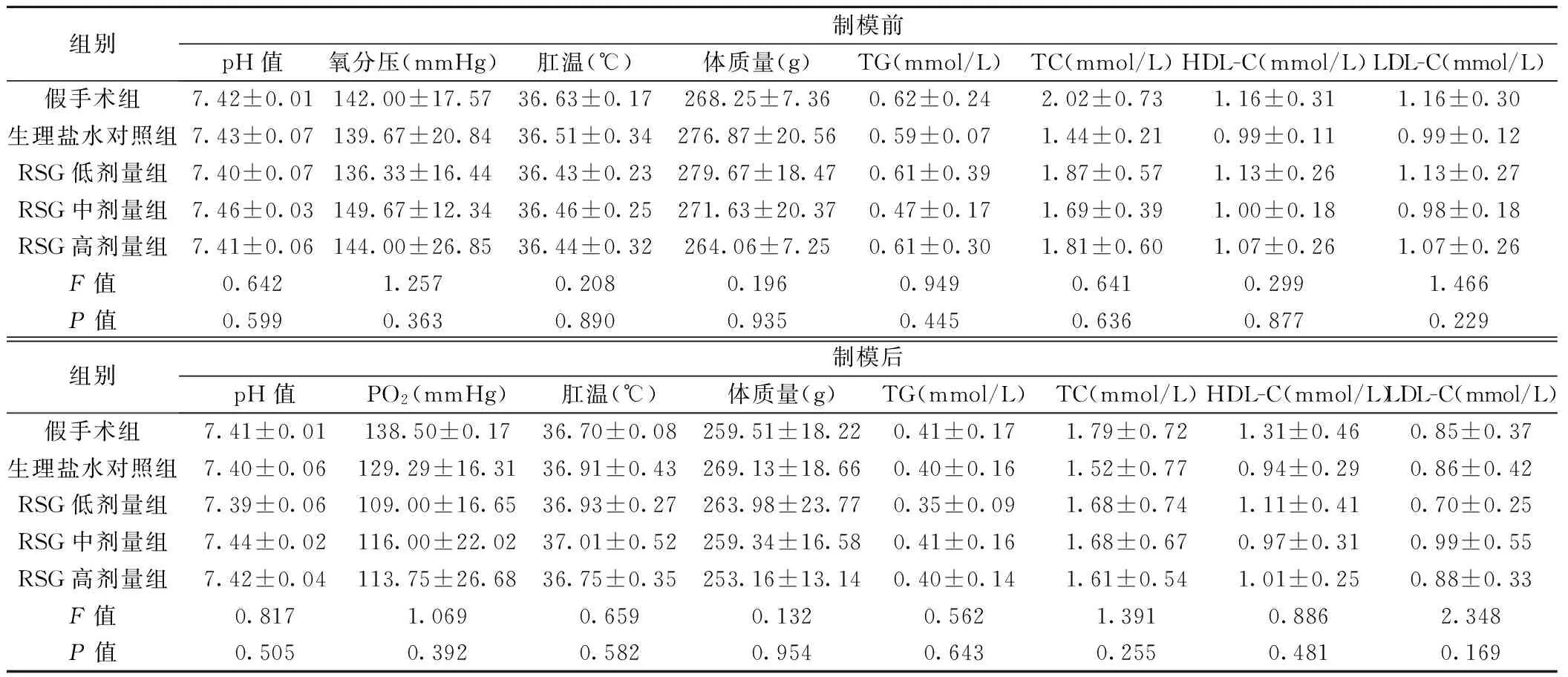
组别制模前pH值氧分压(mmHg)肛温(℃)体质量(g)TG(mmol/L)TC(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)假手术组7.42±0.01142.00±17.5736.63±0.17268.25±7.360.62±0.242.02±0.731.16±0.311.16±0.30生理盐水对照组7.43±0.07139.67±20.8436.51±0.34276.87±20.560.59±0.071.44±0.210.99±0.110.99±0.12RSG低剂量组7.40±0.07136.33±16.4436.43±0.23279.67±18.470.61±0.391.87±0.571.13±0.261.13±0.27RSG中剂量组7.46±0.03149.67±12.3436.46±0.25271.63±20.370.47±0.171.69±0.391.00±0.180.98±0.18RSG高剂量组7.41±0.06144.00±26.8536.44±0.32264.06±7.250.61±0.301.81±0.601.07±0.261.07±0.26F值0.6421.2570.2080.1960.9490.6410.2991.466P值0.5990.3630.8900.9350.4450.6360.8770.229组别制模后pH值PO2(mmHg)肛温(℃)体质量(g)TG(mmol/L)TC(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)假手术组7.41±0.01138.50±0.1736.70±0.08259.51±18.220.41±0.171.79±0.721.31±0.460.85±0.37生理盐水对照组7.40±0.06129.29±16.3136.91±0.43269.13±18.660.40±0.161.52±0.770.94±0.290.86±0.42RSG低剂量组7.39±0.06109.00±16.6536.93±0.27263.98±23.770.35±0.091.68±0.741.11±0.410.70±0.25RSG中剂量组7.44±0.02116.00±22.0237.01±0.52259.34±16.580.41±0.161.68±0.670.97±0.310.99±0.55RSG高剂量组7.42±0.04113.75±26.6836.75±0.35253.16±13.140.40±0.141.61±0.541.01±0.250.88±0.33F值0.8171.0690.6590.1320.5621.3910.8862.348P值0.5050.3920.5820.9540.6430.2550.4810.169
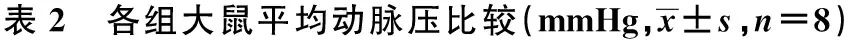
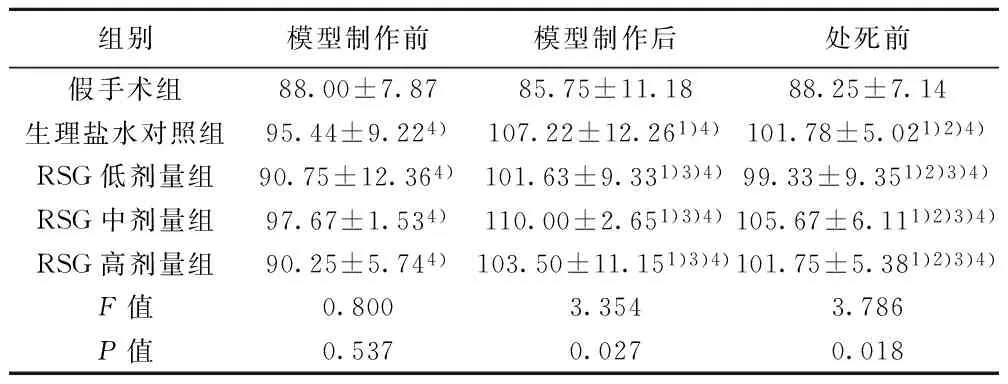
组别模型制作前模型制作后处死前假手术组88.00±7.8785.75±11.1888.25±7.14生理盐水对照组95.44±9.224)107.22±12.261)4)101.78±5.021)2)4)RSG低剂量组90.75±12.364)101.63±9.331)3)4)99.33±9.351)2)3)4)RSG中剂量组97.67±1.534)110.00±2.651)3)4)105.67±6.111)2)3)4)RSG高剂量组90.25±5.744)103.50±11.151)3)4)101.75±5.381)2)3)4)F值0.8003.3543.786P值0.5370.0270.018
与本组模型制作前比较:1)P<0.05,与本组模型制作后比较:2)P<0.05;与同时点生理盐水对照组比较:3)P<0.05;与假手术组比较:4)P<0.05,表3、表4同
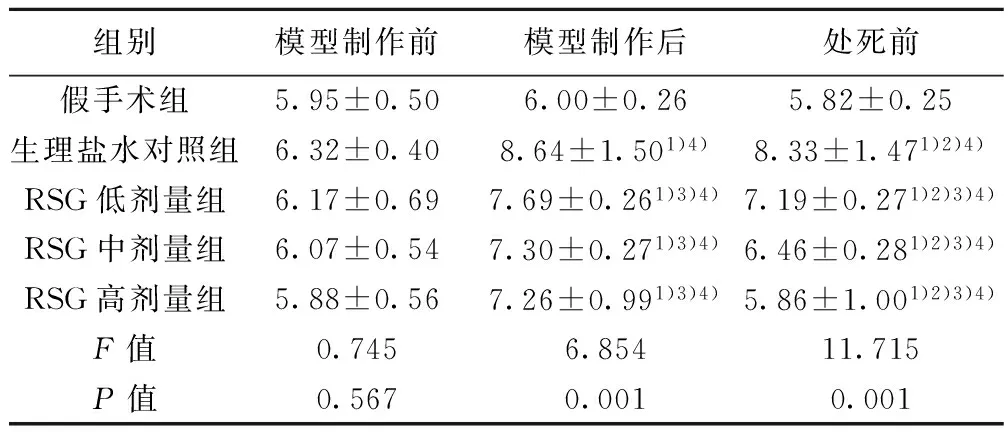
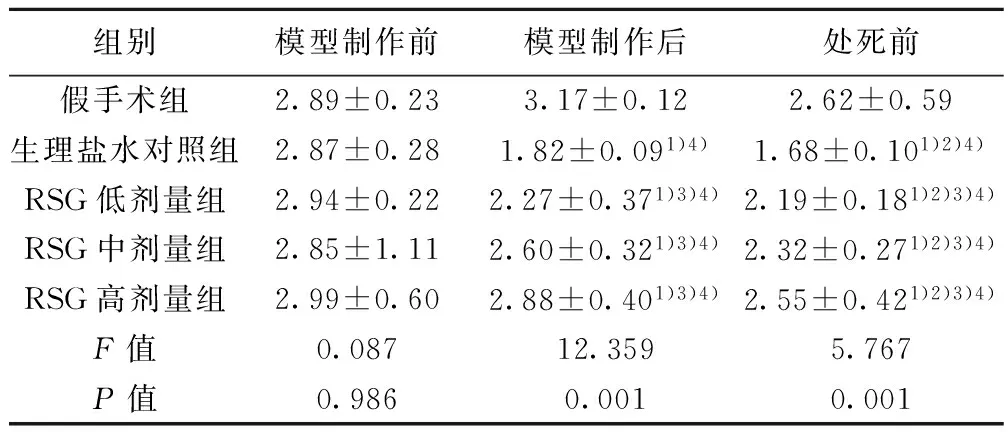
2.3 血糖 各组大鼠模型制作前血糖水平无显著差异(F=0.745,P=0.567)。除外假手术组模型制作前、后以及处死前血糖水平存在显著差异(P<0.05):模型制作前<处死前<模型制作后(P<0.05)。不同组间血糖水平有显著差异:假手术组 2.4 IAI 各组大鼠制模前IAI无显著差异(P=0.986)。除假手术组,其他各组模型制作前、后及处死前IAI有显著差异(F=36.614,P<0.001):处死前<模型制作后<模型制作前(P<0.05)。不同组间IAI存在显著差异:生理盐水对照组 2.5 神经缺损评分和梗死体积 各组大鼠模型制作后神经功能评分无显著差异(P=0.660)。处死前神经功能评分存在显著差异(P=0.008),生理盐水对照组>RSG低剂量组>RSG中剂量组>RSG高剂量组,见表5。 组别模型制作前模型制作后处死前假手术组5.95±0.506.00±0.265.82±0.25生理盐水对照组6.32±0.408.64±1.501)4)8.33±1.471)2)4)RSG低剂量组6.17±0.697.69±0.261)3)4)7.19±0.271)2)3)4)RSG中剂量组6.07±0.547.30±0.271)3)4)6.46±0.281)2)3)4)RSG高剂量组5.88±0.567.26±0.991)3)4)5.86±1.001)2)3)4)F值0.7456.85411.715P值0.5670.0010.001 组别模型制作前模型制作后处死前假手术组2.89±0.233.17±0.122.62±0.59生理盐水对照组2.87±0.281.82±0.091)4)1.68±0.101)2)4)RSG低剂量组2.94±0.222.27±0.371)3)4)2.19±0.181)2)3)4)RSG中剂量组2.85±1.112.60±0.321)3)4)2.32±0.271)2)3)4)RSG高剂量组2.99±0.602.88±0.401)3)4)2.55±0.421)2)3)4)F值0.08712.3595.767P值0.9860.0010.001 组别模型制作后处死前假手术组--生理盐水对照组9.26±0.238.17±1.37RSG低剂量组8.78±0.977.22±1.091)RSG中剂量组9.00±1.416.91±0.701)2)RSG高剂量组8.89±0.786.89±1.171)2)3)F/P值0.536/0.6604.398/0.008 与生理盐水对照组比较:1)P<0.05;与RSG低剂量组比较:2)P<0.05;与RSG中剂量组比较:3)P<0.05 2.6 TTC染色 假手术组脑组织未见梗死灶,生理盐水对照组以及各RSG预处理组右侧额顶叶、基底节和纹状体可见明显的苍白梗死灶,见图1。与生理盐水对照组(0.48±0.12)相比,RSG低剂量组(0.37±0.04)、中剂量组(0.35±0.06)和高剂量组(0.33±0.10)的梗死体积均显著缩小(F=3.783,P=0.033),且呈剂量依赖性。 图1 RSG对脑缺血再灌注大鼠脑梗死体积的影响(TTC染色) 2.7 IAI与神经功能评分、梗死体积的关系 对影响神经功能评分的相关因素,如平均动脉压、血糖、血脂和IAI进行筛选显示,神经功能评分与IAI存在依存关系,方程为Y(神经功能评分)=9.959-1.444×(IAI)(P=0.046)。对影响梗死体积的相关因素,如平均动脉压、血糖、血脂和IAI进行筛选显示,梗死体积与IAI存在依存关系,方程为Y(梗死体积)=0.735-0.174×(IAI)(P=0.005)。 缺血性脑损伤的病变机制十分复杂,而能量代谢障碍被认为是缺血性神经细胞损伤较早的始动因素。葡萄糖虽然作为脑细胞活动最重要的能量来源,但脑细胞无能量贮备,因此对血糖的依赖极大。血糖水平是限制缺氧后神经干细胞存活和自我更新能力的关键因素,其通过多种机制影响脑缺血损伤的发生、发展和转归。脑卒中患者多伴有高血糖,约40%的患者存在脑卒中后高血糖,重症脑卒中患者 60%在急性期有血糖增高,对预后不利。 血糖升高早期可使病情恶化,晚期则可影响脑组织恢复。Nedergaard等〔8〕认为,高血糖的短暂保护作用可能与其在局部短暂的能量供应有关,而后继的持久破坏作用则可能与其代谢产物过高引起损伤,特别是再灌注损伤有关。再灌注时高血糖导致的细胞或组织损伤称为葡萄糖再灌注损伤。现有一些作者认为〔1〕,对于缺血性脑卒中的症状和预后而言,病后高血糖较长期糖尿病更危险。高血糖可以导致机体氧自由基生成增多,ATP 酶活性下降,ATP 产生途径破坏,钠泵功能障碍,最终导致脑细胞水肿,同时糖原在体内无氧酵解也可加速产生乳酸,大量乳酸堆积也可以导致脑水肿加重和酸中毒,使脑梗死面积扩大,血脑屏障进一步破坏,增加脑出血转化的风险。 研究表明〔9〕,在脑缺血损伤的数天甚至数周内仍然存在神经细胞再生,这为治疗脑梗死提供了一个更长的“次级时间窗”。 而研究已证实〔10,11〕血糖水平是限制缺氧后神经干细胞存活和自我更新能力的关键因素。因此,使用降糖药物严格控制血糖得到一致的认可〔12〕。临床流行病学表明,控制血糖水平不仅有利于预防脑血管病发生,而且也是急性脑血管病处理的一项重要措施〔13〕。既往研究大都集中在降低血糖,采用胰岛素治疗成为主要手段。与此同时,伴随使用胰岛素造成的低血糖可能产生的危害也得到了进一步的认识〔14〕。因为低血糖不仅会引发不良情绪反应,还会导致患者低血糖昏迷,对激素失去反应〔15〕,低血糖还能影响大脑能量代谢,使葡萄糖扩散进入脑组织的速率减慢〔16〕低血糖与高血糖均是脑梗死的重要危险因素,两者在再发脑梗死防治中具有同等的重要性〔17,18〕,总之,血糖水平波动的控制对减少脑缺血再灌注引起的损伤具有一定的意义。应激性高血糖对葡萄糖的细胞摄取有促进作用,可以在组织发生低血糖时缓冲其诱导的脑损害。有研究认为〔4〕对于脑卒中后应激性高血糖的患者,适度的血糖水平升高是有益的。应激性高血糖相关血糖升高达8.9~11.1 mmol/L时,被认为无须治疗。对于脑卒中后血糖升高的患者,一般研究推荐血糖超过11.1 mmol/L时给予胰岛素治疗。除了对平均血糖进行有效控制,降低血糖的波动也被认为是血糖控制方向之一,它与预后相关并且可能更敏感。综合目前大多数文献的建议,重症脑卒中患者血糖控制达到7.8~9.9 mmol/L的目标,并且密切检测血糖水平,避免低血糖的发生。 因而,本实验用成年大鼠采用线栓法制备较符合人类常见缺血性卒中类型的大鼠大脑中动脉缺血/再灌注模型(MCAO),动物模型科研排除高血压、心脏病、年龄等危险因素的干扰,并能有效控制缺血范围、再灌注时间等一些参数,为高血糖对缺血性脑损伤的影响及其机制提供了有力的证据。本研究表明,模型制作本身虽可造成应激反应,但程度较轻且持续时间短暂。而在急性脑缺血再灌注的特定条件下,机体应激反应强烈而持久,因此各组大鼠血糖水平升高显著且持久。与假手术组相比,各组大鼠模型制作后IAI显著降低,提示脑梗死时存在高胰岛素血症和IR,与其他研究结果一致〔19〕。国外多项研究证明,在心脏〔20,21〕、肾脏〔22〕和肝脏〔23〕再灌注损伤中会出现IR。本研究表明,与模型制作后相比,处死前高血糖改善,但IR则进一步加重,出现所谓“分离现象”。理论上,高血糖应发生在IR之后,减轻IR可使血糖水平降低;而高血糖可因糖脂毒性加重IR。而“分离现象”似乎说明IR与高血糖之间的联系在卒中时的可变性较大,无论血糖是否升高,脑梗死本身均存在IR。在非应激环境下,血糖与胰岛素之间存在一种相互促进的关系;而在应激条件下,两者之间的这种一致性消失。这种分离性变化提示二者对脑组织的影响并不同步。这可能是由于脑梗死早期与血糖升高有关的应激激素大量释放以及体内胰岛素相对不足导致了血糖升高,因此机体持续性和代偿性增加胰岛素分泌以降低血糖水平。由于这些激素是短暂的一过性大量释放,因此血糖升高会出现一个峰值,而IR比应激性高血糖对脑损伤的恢复影响更为强烈和持久〔24〕。 IR已被证实是多种疾病的一种病理状态,已成为近年来医学多学科研究的热点。现证实IR是脑卒中的独立危险因素但对脑梗死造成的影响众说不一。本研究结果显示,高血糖和IR可显著加重神经功能缺损。多重线性回归分析显示,脑损伤与急性期血糖水平无显著相关性,而与IAI存在依存关系。这似乎说明IR改善较单纯降低血糖水平更为重要,而RSG的神经保护机制不依赖于血糖水平的降低。MCAO大鼠与动脉粥样硬化所致缺血性脑卒中存在一定程度的差异。缺血性脑血管疾病是一个缓慢而复杂的病理生理学过程,已存在IR基础,而健康大鼠模型与高危人群的反应性可能存在差异,加之脑卒中患者往往合并与IR密切相关的高血压,这些因素的共同作用可能是导致其神经功能恢复缓慢的原因之一〔25〕。 过氧化物酶体增殖物激活受体(PPAR)RSG为噻唑烷二酮类中作用最强的药物,是一种单纯的PPARγ激动剂〔26〕,能增强靶组织对胰岛素的敏感性〔27〕。本研究显示,RSG能以剂量依赖方式降低实验动物的血糖水平,高剂量RSG可将脑缺血后高血糖降至正常范围。另外,各RSG组IAI均显著高于生理盐水对照组,且呈剂量依赖性,高剂量RSG能使IAI恢复至正常范围。其机制可能是通过降低瘦素水平,调节胰岛素敏感性,促进信号转导,促进葡萄糖转运蛋白GLUT-1、GLUT-2和GLUT-4的表达,并且在转录水平抑制胰高血糖素的基因表达,从而削弱其对胰岛素的拮抗作用〔28〕。本研究还表明,无论是血糖水平、IAI、梗死体积还是神经功能评分,低剂量RSG组与对照组均存在显著差异,说明低剂量RSG即可通过降低血糖和IR发挥神经保护效应。在噻唑烷二酮类降糖药安全性备受质疑的今天〔26〕,低剂量用药的性价比更高,意义也更大。 虽然目前公认应对脑卒中后高血糖进行控制,但对采用何时何种降血糖措施及目标血糖值仅有少数随机对照试验(RCT),我国国内关于急性脑卒中血糖和预后的研究,缺乏多中心、前瞻性、大样本的研究,目前尚没有明确的指南指导我们制定目标血糖的控制范围,有待继续研究并完善。胰岛素的使用是否提高脑对葡萄糖的利用尚不清楚,有待于进一步的实验证实。而在临床上神经内科的脑卒中患者的血糖调控多由内分泌科医师会诊协同治疗,如何分工协作、精细管理、严格监测、控制热量摄入,亦是不容忽视的问题。 1 Martin A,Rojas S,Chamorro A,etal.Why does acute hyperglycemia worsen the outcome of transient focal cerebral ischemia? Role of corticosteroids,inflammation and protein O-glycosylation〔J〕.Stroke,2006;37(5):1288-95. 2 Kagansky N,Levy S,Knobler H.The role of hyperglycemia in acute stroke〔J〕.Arch Neurol,2001;58(8):1209-12. 3 李建民,赵雅宁,常学优,等.高血糖对全脑缺血再灌注大鼠学习记忆的影响及PD98059的干预作用〔J〕.中国老年学杂志,2014;34(20):5804-6. 4 Berthet C,Lei H,Thevenet J,etal.Neuroprotective role of lactate after cerebral ischemia〔J〕.J Cereb Blood Flow Metab,2009;29(11):1780-9. 5 Belayev L,Alonso OF,Busto R,etal.Middle cerebral artery occlusion in the rat by intraluminal suture neurological and pathological evaluation of an improved model〔J〕.Stroke,1996;27(9):1616-23. 6 谢晓燕,徐 勉,朱榆红,等.罗格列酮对局灶性脑缺血再灌注大鼠的保护作用〔J〕.国际脑血管病杂志,2011;19(3):214-9. 7 李光伟.检测人群胰岛素敏感性的一项新指数〔J〕.中华内科杂志,1993;32(10):656-60. 8 Nedergaard M,Gjedde A,Diemer NH.Hyperglycaemia protects against neuronal injury around experimental brain infarcts〔J〕.Neurol Res,1987;9:241-4. 9 Thored P,Arvidsson A,Cacci E,etal.Persistent production of neurons from adult brain stem cells during recovery after stroke〔J〕.Stem Cells,2006;24(3):739-47. 10 Lindvall O,Kokaia Z.Stem cell research in stroke:how far from the clinic〔J〕?Stroke,2011;42(8):2369-75. 11 Burns TC,Steinberg GK.Stem cells and stroke:opportunities,challenges and strategies〔J〕.Exp Opin Biol Ther,2011;11(4):447-61. 12 Kreisel SH,Berschin UM,Hammes HP,etal.Pragmatic management of hyperglycaemia in acute ischaemic stroke:safety and feasibility of intensive intravenous insulin treatment〔J〕.Cerebrovasc Dis,2009;27(2):167-75. 13 Paiboonpol S.Hyperglycemia in acute cerebral infarction〔J〕.J Med Assoc Thailand,2006;89(5):614. 14 Tiemessen CA,Hoedemaekers CW,van Iersel FM,etal.Intensive insulin therapy increases the risk of hypoglycemia in neurocritical care patients〔J〕.J Neurosurg Anesthesiol,2011;23(3):206-14. 15 Tam EW,Haeusslein LA,Bonifacio SL,etal.Hypoglycemia is associated with increased risk for brain injury and adverse neurodevelopmental outcome in neonates at risk for encephalopathy〔J〕.J Pediatr,2012;161(1):88-93. 16 Mccrimmon RJ.Update in the CNS response to hypoglycemia〔J〕.J Clin Endocrinol Metab,2012;97(1):1-8. 17 Kruyt ND,Biessels GJ,Devries JH,etal.Hyperglycemia in acute ischemic stroke:pathophysiology and clinical management〔J〕.Nat Rev Neurol,2010;6(3):145-55. 18 Baker L,Juneja R,Bruno A.Management of hyperglycemia in acute ischemic stroke〔J〕.Curr Treat Options Neurol,2011;13(6):616-28. 19 Swedberg K,Cleland J,Dargie H,etal.Guidelines for the diagnosis and treatment of chronic heart failure:executive summary(update 2005)The task force for the diagnosis and treatment of chronic heart failure of the european society of cardiology〔J〕.Eur Heart J,2005;26(11):1115-40. 20 Torigoe Y,Takahashi N,Hara M,etal.Adrenomedullin improves cardiac expression of heat-shock protein 72 and tolerance against ischemia/reperfusion injury in insulin-resistant rats〔J〕.Endocrinology,2009;150(3):1450-5. 21 Liang G,Cai Q,Niu Y,etal.Cardiac glucose uptake and suppressed expression/translocation of myocardium glucose transport-4 in dogs undergoing ischemia-reperfusion〔J〕.Exp Biol Med(Maywood),2008;233:1142-8. 22 Susa D,Mitchell JR,Verweij M,etal.Congenital DNA repair deficiency results in protection against renal ischemia reperfusion injury in mice〔J〕.Aging Cell,2009;8(2):192-200. 23 Liu C,Wang X,Chen Z,etal.Hepatic ischemia-reperfusion induces insulin resistance via down-regulation during the early steps in insulin signaling in rats〔C〕.Elsevier,2008. 24 牛亚利,赵建国.脑梗死后血糖升高的原因及其不利影响〔J〕.疑难病杂志,2004;3(1):52. 25 Megherbi S,Milan C,Minier D,etal.Association between diabetes and stroke subtype on survival and functional outcome 3 months after stroke data from the European BIOMED stroke project〔J〕.Stroke,2003;34(3):688-94. 26 Nissen SE,Wolski K.Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes〔J〕.N Eng J Med,2007;356(24):2457-71. 27 Campbell IW.The clinical significance of PPAR gamma agonism〔J〕.Curr Mole Med,2005;5(3):349-63. 28 谢晓燕,徐 勉,吉训明,等.过氧化物酶体增殖物激活受体对缺血性卒中的保护作用〔J〕.国际脑血管病杂志,2010;18(1):62-8. 〔2015-12-28修回〕 (编辑 苑云杰/曹梦园) Effect of rosiglitazone on rat focal cerebral ischemia reperfusion injury induced by glucose XIE Xiao-Yan,YU Bin,SUN Bing,etal. Department of Internal Medcine,the First Clinical College of Jining Medical College,Jining 272067,Shandong,China Objective To study the effect of blood glucose levels and insulin response state in rats with focal cerebral ischemia/reperfusion(I/R) in brain injury.Methods Male SD rats were randomly divided into focal cerebral I/R models of physiological saline control group (Control),high,middle and low dose rosiglitazone (RSG) drug preconditioning (4,2,1 mg·kg-1·d-1) and sham groups,8 rats in each group.All the rats except for those in the sham group were suffered from the middle cerebral artery embolism ischemia 2 h/reperfusion 22 h(MCAO).Fasting plasma glucose (FPG),blood lipid,serum insulin levels,insulin sensitivity index (IAI) were measured.The effect of RSG on the volume of cerebral infarction and the neurological deficits score of rats were observed.Results There was relation between IAI and infarct volume or neurological function score.RSG reduced infarct volume after ischemia and improved neurological function,at the same time it could increase insulin sensitivity,reduce high blood glucose after stroke in dose-dependent manner.Conclusions High glucose and insulin resistance could aggravate the focal cerebral I/R injury of brain,and insulin resistance is more durable.RSG has neuroprotective effects on cerebral I/R injury,simply reducing blood sugar is not enough,the improvement insulin resistance is more important. Rosiglitazone; PPARγ; Glucose reperfusion injury; Insulin resistance; Hyperglycemia 国家自然科学基金(No.81325007);济宁市科技发展计划项目(No.2008-25) 吉训明(1970-),男,主任医师,博士生导师,主要从事狭窄和闭合性脑血管病的研究。 谢晓燕(1967-),女,硕士,副主任医师,主要从事糖尿病并发症防治研究。 R587.2 A 1005-9202(2017)06-1316-05; 10.3969/j.issn.1005-9202.2017.06.006 1 济宁医学院第二临床学院中医教研室 2 首都医科大学宣武医院 北京市脑血管病转化医学重点实验室
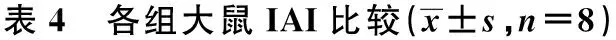


3 讨 论
