毕赤酵母生物转化制备四氢姜黄素的转化条件优化
2017-04-07郑彬彬张维宇罗杨春
郑彬彬,张维宇,罗杨春,黄 金,王 普
(浙江工业大学药学院,浙江杭州310032)
毕赤酵母生物转化制备四氢姜黄素的转化条件优化
郑彬彬,张维宇,罗杨春,黄 金,王 普
(浙江工业大学药学院,浙江杭州310032)
利用库德里阿兹威毕赤酵母ZJPH0802菌株生物转化姜黄素可制备得到四氢姜黄素,从而有效改善姜黄素水溶性差、生物利用度低等缺点。采用正交试验及单因素实验考察培养基组成和静息细胞转化条件对四氢姜黄素产率的影响,得到最佳培养基组成(g/L):葡萄糖25,酵母膏2.5,NH4Cl 6.5,MgSO4·7H2O 0.5,KH2PO41.0,K2HPO41.0;最佳转化工艺条件:pH 6.5,静息细胞质量浓度80 g/L,转化过程中加入无水乙醇作为底物溶媒,底物姜黄素质量浓度50 mg/L,生物转化24 h。在此条件下,四氢姜黄素产率由优化前的64.05%提高到77.43%,比优化前提高了21%。
库德里阿兹威毕赤酵母;姜黄素;四氢姜黄素;生物转化
姜黄素(curcumin)是从姜科姜黄属植物姜黄、莪术、郁金等的根茎中提取的一种天然有效成分,为橙黄色粉末,在水中溶解度较低 (0.03 μmol/L),易溶于碱、甲醇、乙醇、醋酸、氯仿和丙酮等有机溶剂。姜黄素主要用作食品添加剂,Cheng等研究发现,姜黄素具有优良的食品安全性,人体能耐受12 g/d 的剂量而不产生任何毒副作用。近年来,植物化学及药理学研究表明,姜黄素具有抗氧化、降血脂、降血糖、抗炎、抗动脉粥样硬化、抗癌和抗HIV等广泛的生物活性[3-6],且其分子量小、毒性低,具有很好的临床应用潜力,日益受到国内外学者的关注。
在姜黄素应用方面,由于其在机体内药效不持久、选择性低、被机体吸收的能力差、易被降解、生物利用度低等缺点,制约了其在临床的应用。因此,在保留姜黄素原有药效基础上,通过化学法或生物法制备得到其新的衍生物成为近年来研究的热点。微生物转化法具有区域选择性和立体选择性高、反应条件温和、操作简单、成本低廉和环境友好等优点,逐渐受到人们的关注[9-10]。Maehara等[11]从姜黄根茎中分离出13株内生真菌,分别对姜黄素进行微生物转化,从中筛选到1株可制得4种姜黄素衍生物的Diaporthesp.菌株,经结构鉴定,分别为四氢姜黄素、六氢姜黄素、(3S,5S)-八氢姜黄素和八氢姜黄素。Zeng等[12]利用球孢白僵菌(Beauveriabassiana) ATCC 7159对姜黄素进行结构修饰,获得了一种新的姜黄素衍生物——姜黄素-8′-O-4″-O-甲基-β-D-吡喃葡萄糖苷,产率为30%,并且新化合物的水溶性比姜黄素提高了39 000倍。Bharti等[13]采用紫红红球菌 (Rhodococcusrhodochrous) MTCC 265转化姜黄素制备香兰素,经优化培养基组分,产率由3.56 mg/L提高到29.02 mg/L。本课题组前期研究中通过菌种筛选,获得了对姜黄素具有较好转化能力的菌株——库德里阿兹威毕赤酵母 (Pichiakudriavzevii) ZJPH0802,利用该菌株转化姜黄素可得到两个主要转化产物,分别为六氢姜黄素和四氢姜黄素(其中四氢姜黄素为主要产物)[14]。据Natio等[15]研究发现,六氢姜黄素、四氢姜黄素及姜黄素的抗氧化能力(从大到小)顺序依次为四氢姜黄素、六氢姜黄素、姜黄素。因此,进一步提高该菌株合成四氢姜黄素的能力具有很好的研究价值。
本文中,笔者首先采用正交试验法对库德里阿兹威毕赤酵母 (Pichiakudriavzevii) ZJPH0802的发酵培养基组成进行优化,考察培养基中葡萄糖、蛋白胨、NH4Cl和MgSO4·7H2O等因素对四氢姜黄素产率的影响。随后,对静息细胞转化姜黄素的工艺条件进行优化,考察缓冲液pH、底物溶媒、底物浓度、细胞浓度和转化反应时间等因素对产物产率的影响,以期获得最佳的转化工艺条件。
1 材料与方法
1.1 试验菌株
库德里阿兹威毕赤酵母(Pichiakudriavzevii) ZJPH0802,由笔者所在实验室成员从土样中筛选得到并保藏[14]。
1.2 培养基及培养条件
斜面培养基:麦芽汁培养基,每升麦芽汁中加入20 g琼脂。pH自然。
种子及发酵培养基 (g/L):葡萄糖30,酵母膏2.0,NH4Cl 6.0,MgSO4·7H2O 0.4,KH2PO41.0,K2HPO41.0。pH自然。
细胞培养及姜黄素的生物转化:取一满环斜面种子接种至装有200 mL种子培养基的500 mL三角瓶,在30 ℃、200 r/min条件下,培养16 h,制得种子液。以10%接种量接种装有100 mL发酵培养基的250 mL三角瓶,在30 ℃、200 r/min条件下,培养16 h后,离心得到转化反应所用细胞。将2 g湿菌体悬浮于10 mL 磷酸缓冲液 (pH 6.6) 中,加入0.25 mg 姜黄素,于30 ℃、200 r/min条件下,转化24 h,实验中同时设立对照组,即转化体系中只加菌体不加姜黄素。
1.3 液相色谱分析
转化反应结束后,将转化液离心分离菌体,取上清液,用乙酸乙酯萃取3次,合并萃取液,于50 ℃减压蒸馏除去乙酸乙酯,残留物用色谱甲醇溶解后,用岛津LC-20A液相色谱仪分析,色谱柱为ZORBAX Eclipse XDB-C18 (5 μm,250 mm×4.6 mm,Agilent公司)。检测波长为280 nm,流速为0.5 mL/min,进样量为20 μL,流动相为乙腈-0.1%乙酸-水溶液,梯度洗脱,洗脱条件如表1所示。实验组:库德里阿兹威毕赤酵母ZJPH0802菌株转化产物;对照组:转化体系中只加菌体不加姜黄素。底物姜黄素标准品及四氢姜黄素标准品的HPLC图谱见图1。
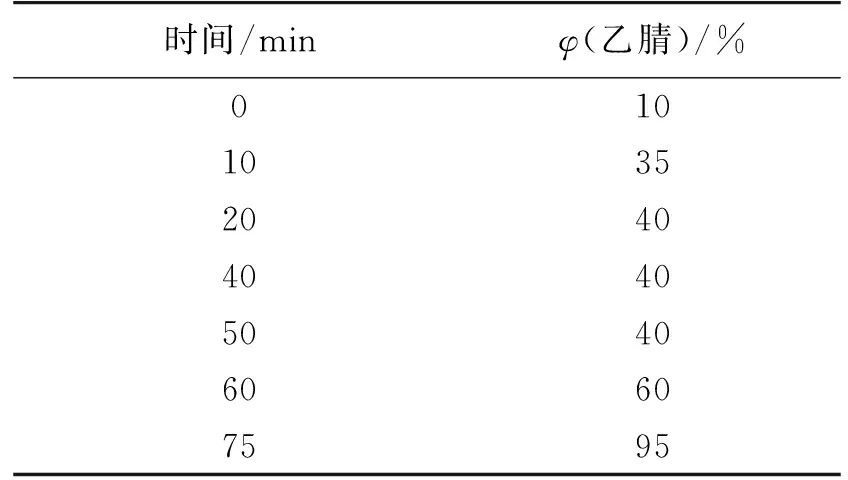
表1 HPLC液相色谱梯度洗脱条件

a—实验组:菌体加姜黄素;b—对照组:只加菌体不加姜黄素;c—姜黄素标准品;d—四氢姜黄素标准品图1 菌株ZJPH0802生物转化姜黄素的HPLC检测图谱Fig.1 HPLC analysis of microbial conversion with strain ZJPH0802
1.4 产率计算方法
菌株ZJPH0802转化姜黄素制备四氢姜黄素的产率按式(1)计算。

(1)
式中:c0、c产物分别为反应起始底物的浓度和反应结束时产物的浓度。
1.5 实验设计
1.5.1 正交实验设计
在单因素实验基础上,按正交设计表L9(34)优化培养基中葡萄糖、酵母膏、NH4Cl和MgSO4·7H2O这4个组分的浓度,每组设3个平行样,取平均值。
1.5.2 单因素实验设计
在正交设计获得的最优培养基配方基础上,对静息细胞转化条件进行优化,考察不同缓冲液pH、底物溶媒、底物浓度、细胞浓度和转化反应时间等因素对四氢姜黄素产率的影响,获得最佳的转化工艺条件。
2 结果与讨论
2.1 发酵培养基的优化
按正交设计表L9(34)优化培养基中葡萄糖、酵母膏、NH4Cl和MgSO4·7H2O这4个组分,结果见表2,极差及方差分析的结果见表3~4。由表3可知:葡萄糖的极差最大,为影响四氢姜黄素产率的主要因素,其次为酵母膏和NH4Cl浓度,MgSO4·7H2O是次要因素,其最佳组合为A1B1C3D3,即葡萄糖25 g/L,酵母膏2.5 g/L,NH4Cl 6.5 g/L,MgSO4·7H2O 0.5 g/L。采用优化后的发酵培养基培养得到的毕赤酵母ZJPH0802静息细胞转化姜黄素,当姜黄素质量浓度为25 mg/L时,四氢姜黄素产率可达72.46%。由表4方差分析可知:影响四氢姜黄素产率因素的主次顺序与极差分析结果一致。在考察的4个因素中,F(葡萄糖)>F0.05(2,2),即葡萄糖浓度对四氢姜黄素产率具有显著影响。
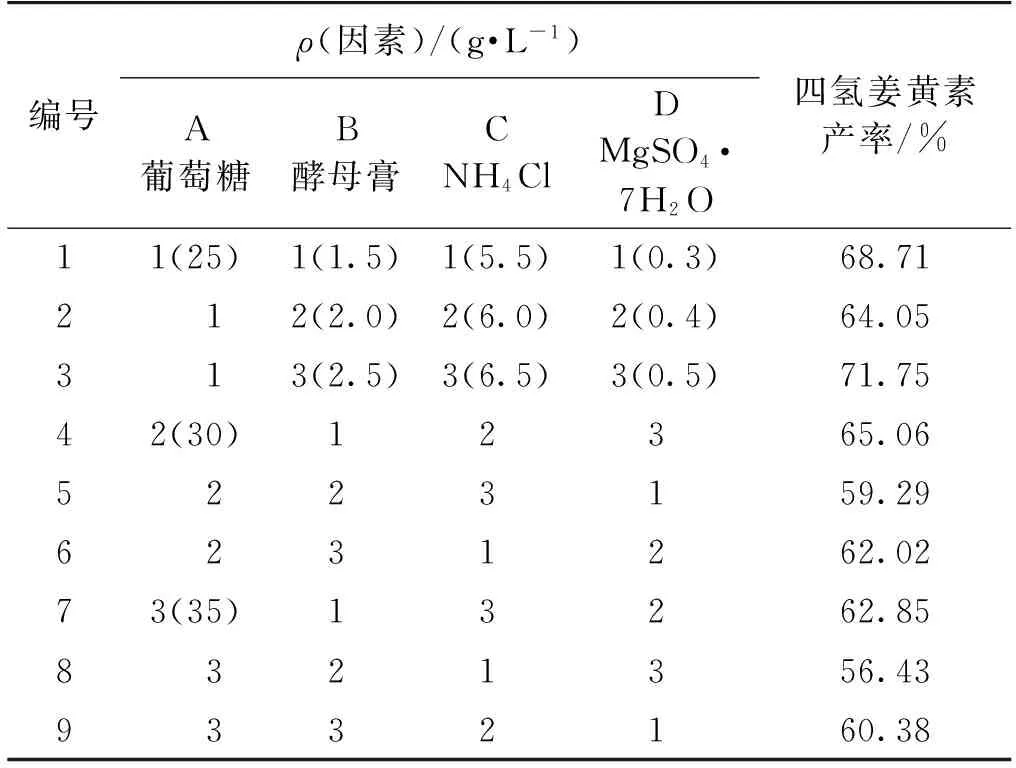
表2 正交实验L9(34) 设计及结果

表3 极差分析
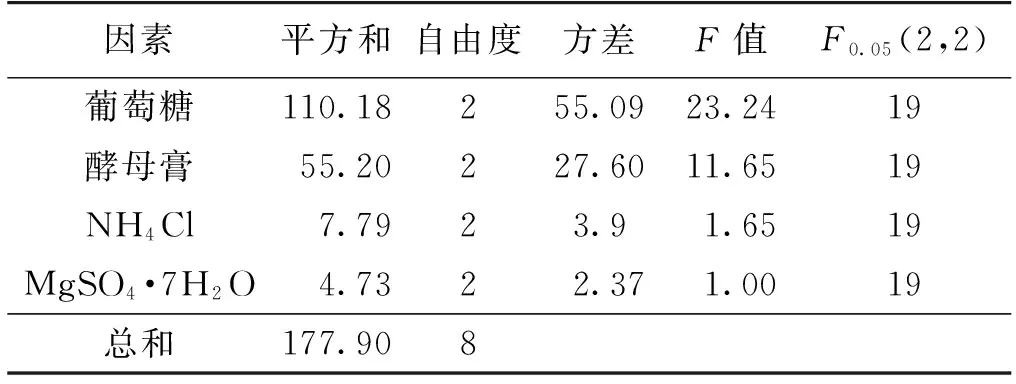
表4 方差分析
2.2 静息细胞转化工艺的优化
2.2.1 缓冲液pH对四氢姜黄素产率的影响
不同的缓冲体系pH会影响底物的解离度和菌体的酶活性,进而影响转化产物的产率。考察缓冲液pH对四氢姜黄素产率的影响,结果如图2所示。由图2可知:在pH为5.8~6.6时,四氢姜黄素产率呈上升趋势,随着pH继续升高,四氢姜黄素产率逐渐下降。当pH为6.6时,四氢姜黄素产率最大。因此,最佳缓冲液pH为6.6。
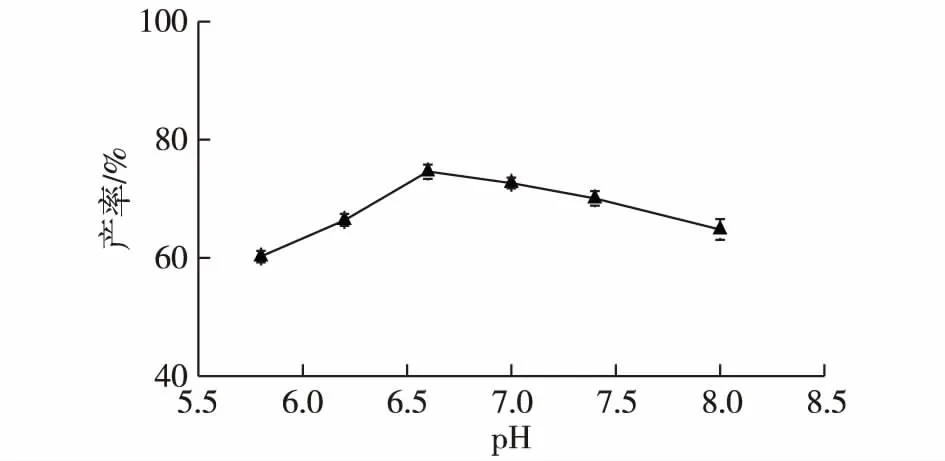
图2 缓冲液pH对四氢姜黄素产率的影响Fig.2 Effect of buffer pH on the yield of tetrahydrocurcumin
2.2.2 底物溶媒对四氢姜黄素产率的影响
姜黄素在水中的溶解度较低,仅为0.03 μmol/L。为解决底物的低溶解性问题,提高转化率,可考虑加入有机溶媒来增加底物在水中的溶解度,使底物与菌体充分接触转化。郭亚文等]利用新月弯孢霉(Curvularialunata)对水难溶性的17α-羟基孕甾-4-烯-3,20-二酮-21-醋酸酯(RSA)进行C11-β羟基化时,以甲醇、乙醇、二甲基亚砜、二甲基甲酰胺作为亲水性有机溶剂预溶解底物后加入到转化体系中,提高了转化率。Ren等]在缓冲液反应体系中加入15%的DMF,使脂肪酶Novozym 435酶法拆分外消旋2,2-二甲基环丙烷甲酸乙酯制备S-(+)-2,2-二甲基环丙烷甲酸的产率由45.6%提高至49.0%。为此,实验中分别采用甲醇、无水乙醇和丙酮作为溶媒溶解底物姜黄素,并考察不同底物溶媒对四氢姜黄素产率的影响,结果见图3。由图3可知:因为姜黄素易溶于丙酮、乙醇及甲醇,从而使姜黄素均匀分散,促进底物与细胞的接触。相比较而言,用无水乙醇溶解底物姜黄素后投料转化,所得四氢姜黄素的产率最高。故后续实验中选用无水乙醇作为底物溶媒。
2.2.3 底物浓度对四氢姜黄素产率的影响
当底物浓度较低时,底物基本可被细胞完全转化;而底物浓度过高时,底物会对菌体有抑制作用。因此,考察底物浓度对四氢姜黄素产率的影响,结果见图4。由图4可知:随着底物浓度的增加,四氢姜黄素产率逐渐下降。当底物质量浓度高于50 mg/L时,产率大幅下降。因此,确定50 mg/L为最佳底物质量浓度,此时四氢姜黄素产率为74.71%。
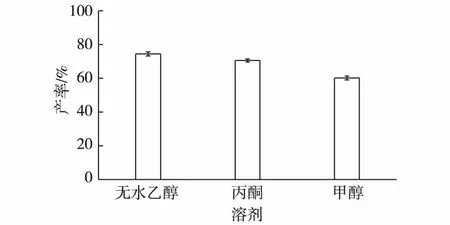
图3 底物溶媒对四氢姜黄素产率的影响Fig.3 Effects of substrate solvent on the yield of tetrahydrocurcumin
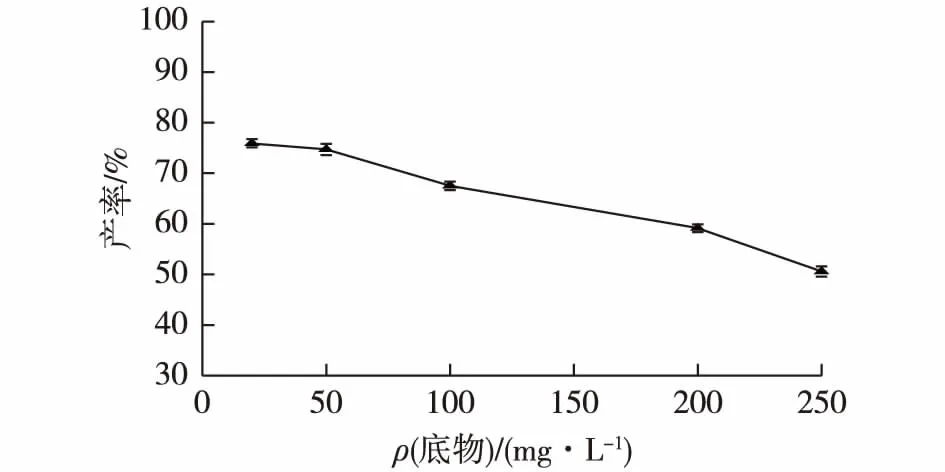
图4 底物质量浓度对四氢姜黄素产率的影响Fig.4 Effect of substrate concentration on the yield of tetrahydrocurcumin
2.2.4 静息细胞浓度对四氢姜黄素产率的影响
静息细胞的添加量会对产物的产率有影响,所以考察不同静息细胞浓度对四氢姜黄素产率的影响,结果如图5所示。由图5可知:随着静息细胞浓度的升高,四氢姜黄素产率逐渐上升。当细胞质量浓度为80 g/L时,产率达最大,为76.44%。继续增加细胞浓度,由于对反应体系传质效率的影响会阻碍转化进程,导致产率明显下降。故选择80 g/L静息细胞质量浓度为宜。
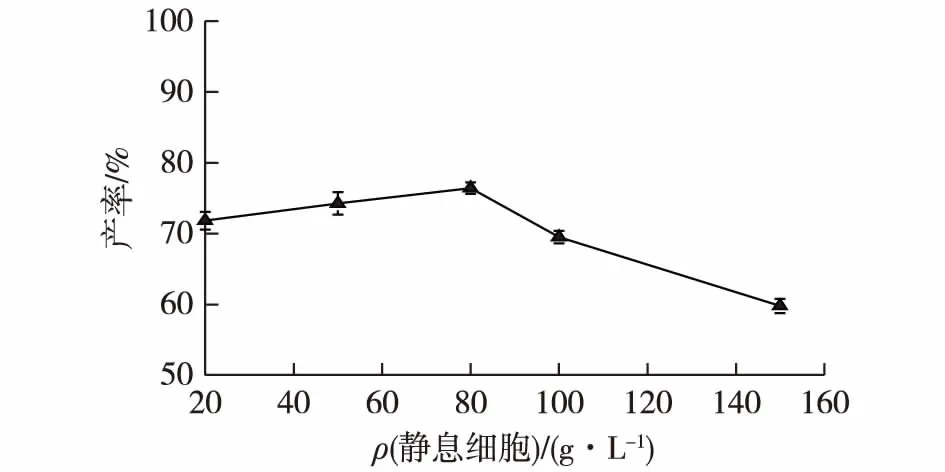
图5 静息细胞质量浓度对四氢姜黄素产率的影响Fig.5 Effect of cell concentration on the yield of tetrahydrocurcumin
2.2.5 转化反应时间对姜黄素转化的影响
在最佳反应条件下,考察菌株ZJPH0802对姜黄素转化的反应时间曲线,如图6所示。由图6可知:随着反应时间的延长,四氢姜黄素产率上升明显,而姜黄素含量呈相应下降趋势,转化24 h后,四氢姜黄素产率基本不再增加,较佳的转化时间为24 h,此时四氢姜黄素产率为77.43%,姜黄素含量为8.2%。菌株ZJPH0802转化姜黄素的主要产物为四氢姜黄素,除此外,还有少量的六氢姜黄素和其他未知产物[14]。
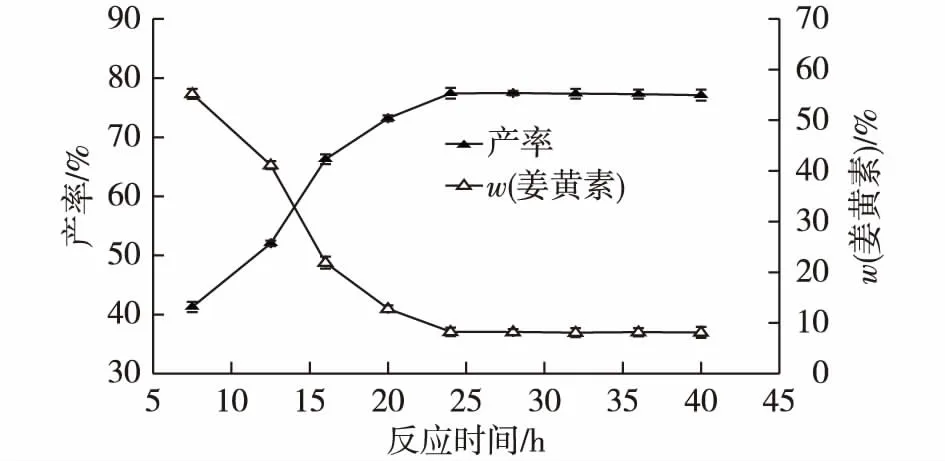
图6 转化反应时间对姜黄素转化的影响Fig.6 Effects of reaction time on the conversion of curcumin
3 结论
采用正交优化法对库德里阿兹威毕赤酵母ZJPH0802发酵培养基进行优化,考察了葡萄糖、酵母膏、NH4Cl和MgSO4·7H2O这4个因素对四氢姜黄素产率的影响。极差分析表明,各因素对产率的影响程度从大到小依次为葡萄糖、酵母膏、NH4Cl、MgSO4·7H2O。优化后的最佳培养基组成(g/L):葡萄糖25,酵母膏2.5,NH4Cl 6.5,MgSO4·7H2O 0.5,KH2PO41.0,K2HPO41.0;最佳转化工艺条件pH 6.6,静息细胞质量浓度80 g/L,以无水乙醇作为底物溶媒,底物姜黄素质量浓度50 mg/L,转化时间24 h。在此条件下,四氢姜黄素的产率由优化前的64.05%提高到77.43%,比优化前提高了21%。研究结果表明,利用微生物转化技术是制备得到姜黄素衍生物的有效途径。
[1] GOEL A,KUNNUMAKKARA A B,AGGARWAL B B.Curcumin as ″Curecumin″:from kitchen to clinic.Biochem Pharmacol,2008,75(4):787-809.
[2] CHENG A L,HSU C H,LIN J K,et al.Phase I clinical trial of curcumin,a chemopreventive agent,in patients with high-risk or pre-malignant lesions.Anticancer Res,2001,21:2895-2900.
[3] MAHESHWARI R K,SINGH A K,GADDIPATI J,et al.Multiple biological activities of curcumin:a short review.Life Sci,2006,78(18):2081-2087.
[5] NIU Y M,WANG X,CHAI S,et al.Effects of curcumin concentration and temperature on the spectroscopic properties of liposomal curcumin.J Agric Food Chem,2012,60(7):1865-1870.
[6] LIM T G,LEE S Y,HUANG Z,et al.Curcumin suppresses proliferation of colon cancer cells by targeting CDK2.Cancer Prev Res,2014,7(4):466-474.
[7] RATANAJIAJAROEN P,WATTHANAPHANIT A,TAMURA H,et al.Release characteristic and stability of curcumin incorporated inβ-chitin non-woven fibrous sheet using Tween 20 as an emulsifier.Eur Polym J,2012,48(3):512-523.
[8] 韦星船,杜志云,涂增清,等.姜黄素衍生物与类似物的构效关系研究进展.化学研究与应用,2010,22(5):527-538.
[9] 常军,胡娜,张铁军,等.响应面法优化獐牙菜苦苷生物转化条件.生物加工过程,2010,8(1):28-33.
[10] 贺赐安,余旭亚,孟庆雄,等.生物转化对天然药物进行结构修饰的研究进展.天然产物研究与开发,2012,24(6):843-847.
[11] MAEHARA S,IKEDA M,HARAGUCHI H,et al.Microbial conversion of curcumin into colorless hydroderivatives by the endophytic fungusDiaporthesp.associated withCurcumalonga.Chem Pharm Bull,2011,59(8):1042-1044.
[12] ZENG J,YANG N,LI X M,et al.4′-O-methylglycosylation of curcumin byBeauveriabassiana.Nat Prod Commun,2010,5(1):77-80.
[13] Bharti,Nagpure A A L,Gupta R K.Biotransformation of curcumin to vanillin.Indian J Chem,2011,50:1119-1122.
[14] ZHANG W,HUANG J,WO X,et al.Microbial transformation of curcumin to its derivatives with a novelPichiakudriavzeviiZJPH0802 strain.Appl Biochem Biotech,2013,170(5):1026-1037.
[15] NATIO M,WU X,NOMURA H,et al.The protective effects of tetrahydrocurcumin on oxidative stress in cholesterol-fed rabbits.J Atheroscler Thromb,2002,9(5):243-250.
[16] 郭亚文,卢文玉,王敏,等.甾体11-β羟化过程中底物溶解性的研究.药物生物技术,2004,11(1):29-33.
[17] REN F,WANG P,JIN H,et al.Enzymatic resolution of racemic ethyl-2,2-dimethylcyclopropanecarboxylate toS-(+)-2,2-dimethylcyclopropanecarboxylic acid in a polar organic solvent-water medium.Biotechnol Biotech Eq,2012,26(6):3412-3417.
(责任编辑 荀志金)
Optimization of microbial transformation conditions for tetrahydrocurcumincatalyzed byPichiakudriavzeviiZJPH0802 strain
ZHENG Binbin,ZHANG Weiyu,LUO Yangchun,HUANG Jin,WANG Pu
(College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310032,China)
Tetrahydrocurcumin was produced byPichiakudriavzeviiZJPH0802,with better water solubility and higher bioavailability.Orthogonal experiment and single factor experiments were used to evaluate the effects of medium components and biotransformation conditions on the yield of tetrahydrocurcumin.The optimal medium forPichiakudriavzeviiZJPH0802 was composed of (g/L):glucose 25,yeast extract 2.5,NH4Cl 6.5,MgSO4·7H2O 0.5,KH2PO41.0 and,K2HPO41.0; the optimal biotransformation conditions were as follows:pH 6.5,wet cell weight 80 g/L,dehydrated alcohol as substrate solvent,curcumin concentration 50 mg/L,bioconversion for 24 h.The yield of tetrahydrocurcumin was enhanced from 64.05% to 77.43%,an increase of 21% compared with the original medium.
Pichiakudriavzevii; curcumin; tetrahydrocurcumin; biotransformation
10.3969/j.issn.1672-3678.2017.02.005
2016-12-02
浙江省自然科学基金(LY16B060010)
郑彬彬(1991—),女,浙江温州人,研究方向:天然产物生物转化;王 普(联系人),教授,E-mail:wangpu@zjut.edu.cn
TQ426.97;R972
A
1672-3678(2017)02-0030-05
