白头翁皂苷提取方法比较及加压提取传质动力学
2017-04-07赵文英朱庆书徐艳丽孙彦妮
赵文英,朱庆书,徐艳丽,孙彦妮
(青岛科技大学化工学院,山东青岛266042)
白头翁皂苷提取方法比较及加压提取传质动力学
赵文英,朱庆书,徐艳丽,孙彦妮
(青岛科技大学化工学院,山东青岛266042)
采用加热回流、超声辅助、微波辅助以及加压热水等方法提取白头翁总皂苷,比较不同提取方法对白头翁皂苷提取率、抑菌活性、抗氧化活性的影响;同时采用电镜扫描观察提取方法对药材结构的影响;在此基础上,研究加压提取的传质动力学。结果表明:采用加压热水方法提取白头翁皂苷具有提取率高(提取率6.74%,质量分数)、提取物抗氧化、抑菌活性强的特点;电镜扫描表明采用加压热水进行提取时,不破坏药材的细胞结构;加压热水提取的传质过程符合二阶动力学模型,其动力学方程为ρt=t[(2.6exp(-331.04/T))-1+t(0.007 8T2-6.416 9T+1 329.3)-1]-1,提取过程活化能Ea为74.376 2 kJ/mol。
白头翁;皂苷;加压热水提取;动力学
中药白头翁(RadixPulsatillae)为毛莨科多年生草本植物白头翁的干燥根。中医认为其味苦性寒,有清热解毒、凉血止痢、燥湿杀虫的功效,为临床常用中药材。现代药理学实验也证明其有抗氧化、抗炎、杀虫和抑菌的作用,主要用于治疗各种痢疾、疖痈以及癌症等病症。虽然白头翁在临床上具有广泛的应用,但对其主要成分的提取研究并没有引起重视,目前只有少量有关白头翁中皂苷、多糖等成分的研究报道,所采取的提取方法主要是传统的水煎或加热回流法[2-4]等。由于中药有效成分药理作用的发挥与其所采取的提取方法有很大关系,甚至能决定其在临床上的应用价值,因而有必要对白头翁中有效成分的提取工艺进行深入研究。
目前,中药材有效成分的提取最常用的方法是回流提取,随着科技的不断发展,一些新型提取技术,如超声辅助提取、微波辅助提取以及加压提取[5-6]等方法也不断应用于中药成分的提取中并取得了良好的效果。为了确定适用于白头翁中皂苷成分的提取方法,笔者系统考察加热回流、超声辅助、微波辅助和加压等提取方法对白头翁中皂苷类成分提取的影响,并对加压提取的传质过程进行研究,以用于指导工业化生产,以期能够进一步提高白头翁临床应用价值。
1 材料与方法
1.1 仪器、材料及试剂
KQ-100型超声波清洗器,昆山市超声仪器有限公司;G80D23ESL-DN型微波炉,Galanz集团;加压溶剂提取器,自制;LabTech紫外分光光度仪,北京莱伯泰仪器有限公司;JSM-6700F型场发射扫描电子显微镜,日本电子公司;Q6J3-W1000A型高速万能粉碎机,天津泰斯特仪器有限公司。
白头翁,安徽海鑫中药材有限公司;白头翁皂苷B4对照品(纯度≥98%),中国药品生物制品检定所;大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、四联球菌,青岛科技大学药剂实验室提供;DPPH·试剂,Sigma公司;其余试剂均为市售分析纯。
1.2 白头翁总皂苷含量测定的波长选择及标准曲线绘制
采用分光光度法,以白头翁皂苷B4为标准品测定白头翁皂苷含量。按照文献中的方法配制对照品溶液,挥干溶剂后,依次加入现配的5%香草醛-冰醋酸溶液0.2 mL、高氯酸0.8 mL,摇匀后70 ℃水浴加热15 min,流水冷却后,再加入冰醋酸5.0 mL,振摇后静置10 min,在400~800 nm范围内扫描;取一定量的白头翁提取液,按上述方法配制并扫描。结果显示,白头翁皂苷B4在473 nm附近有最大峰,而白头翁提取液于475 nm附近有最大吸收。因此,本文选择测定波长为473 nm。
精密称取白头翁皂苷B4适量,经稀释后配制成不同浓度的对照品溶液,在473 nm处测定吸光度值A473。所得标准曲线回归方程为y=8.855 5A473+0.054 6(R=0.999 5),线性范围0.004~0.036 mg/mL。
采用分光光度法测定不同提取方法提取的白头翁皂苷的吸光度值,根据标准曲线回归方程,计算皂苷含量,同时皂苷的提取率计算见式(1)。
皂苷提取率 =(提取物中白头翁皂苷质量/提取药材质量)×100%
(1)
1.3 白头翁皂苷提取
分别采用加热回流、超声辅助、微波辅助和加压热水4种方法提取白头翁皂苷。取干燥、粉碎成粗粉的白头翁样品适量,按照料液比1∶ 10 (mg/mL)加入蒸馏水,其中加热回流提取2次,第一次提取120 min,第二次提取60 min;超声辅助提取30 min,超声频率为200 W;微波辅助提取采用中火,间歇提取10 min;加压提取温度120 ℃、压力0.3 MPa,提取30 min。提取完成后,将药液过滤,挥干溶剂后得浸膏,备用。浸膏得率计算见式(2)。
浸膏得率=(浸膏质量/提取药材质量)×100%
(2)
1.4 白头翁皂苷抗氧化活性测定
按文献方法做适当修改,测定白头翁皂苷抗氧化活性。分别取预先配制好的DPPH·溶液与提取物样品或空白对照样品混匀,室温下避光放置30 min,在400~600 nm范围内扫描,确定最大吸收波长为517 nm。然后在此波长处测定样品吸光值(A517),每组样品平行测定3次,取平均值。按式(3)计算DPPH·的清除率(SA)。
(3)
式中:A0为加空白对照溶液时DPPH·溶液的吸光度;Ai为加入提取物样品时DPPH·溶液的吸光度;Aj为未加DPPH·溶液时样品溶液的吸光度。
1.5 白头翁皂苷抑菌试验
按照文献采用打孔法测定白头翁皂苷抑菌活性。在已凝固的琼脂培养基上用直径4 mm打孔器等距离打孔(每孔间距为30 mm),每孔用移液枪定量加入0.5 mL药液(100 mg/mL),于37 ℃的恒温培养箱内培养24 h,取出后测定抑菌圈直径大小,比较抑菌效果。
1.6 加压提取传质机理
中药材的提取是一个复杂的非稳态、非平衡的传质过程,在前期分析加压提取过程特征及在查阅相关文献的基础上,本文确定采用二阶方程模型描述加压提取白头翁皂苷的传质过程。
根据二阶模型,白头翁皂苷提取的传质速率方程为
(4)
式中:k为提取速率常数(min-1);ρs为白头翁皂苷溶液饱和质量浓度(mg/mL);ρt为t时刻溶液中白头翁皂苷质量浓度(mg/mL)。
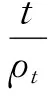
(5)
此即为二阶传质动力学方程,将式(5)两边同时取倒数,可得提取速率ρt/t的数学表达式
(6)
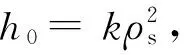
(7)
2 结果与讨论
2.1 白头翁皂苷含量及活性比较
采用4种不同方法提取白头翁皂苷,其提取率以及抑菌活性(抑菌圈)和抗氧化活性结果见表1。
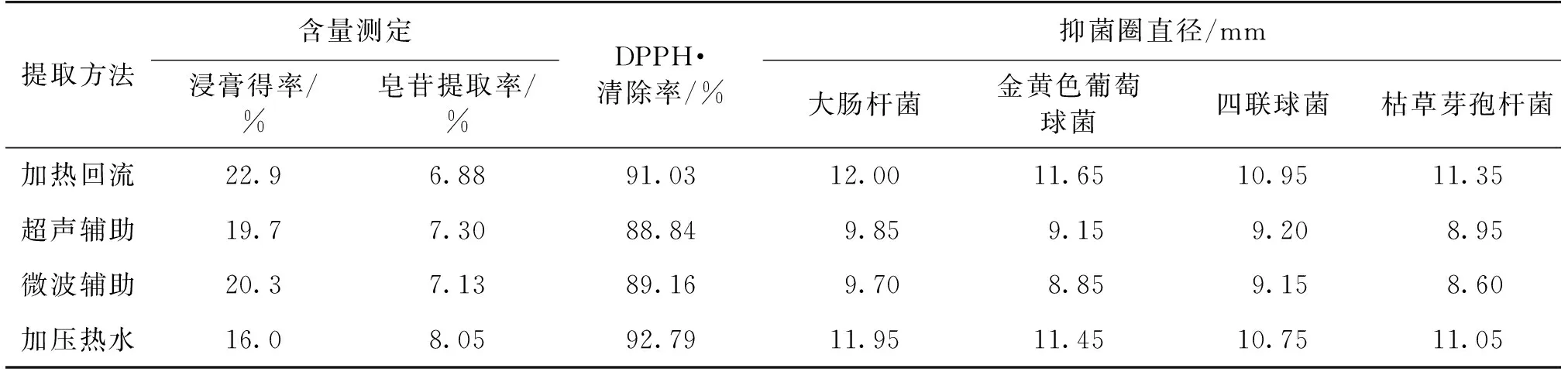
表1 不同提取方法对白头翁皂苷提取的影响
从表1可以看出:白头翁皂苷提取物浸膏得率最多的是加热回流提取,超声与微波辅助提取的浸膏量相差不大,加压提取的浸膏量最少;从皂苷提取率来看,加热回流皂苷提取率最少,但与超声、微波这两种方法比较,相差不大,而加压提取的皂苷提取率为8.05%,明显高于其他3种提取方法。通常,采用加热回流方法提取植物类药材中的有效成分时,由于热效应影响,除所需提取的成分外,还会同时将植物中的其他成分提取出来,特别是以水为提取溶剂时,高温时水的溶解能力较强,会将植物中的糖、鞣质、蛋白质等成分也同时提取出来,因此加热回流提取的浸膏量会最多;超声和微波提取这两种方法是借助于高能量使植物细胞壁破裂,有效成分易于溶出,但在提高有效成分提取率的同时,也会使植物细胞碎片混杂在提取物浸膏中,从而使浸膏量增加;加压提取方法是通过高温高压改变溶剂的溶剂性能,对中药材中有效成分选择性提取,而不破坏细胞结构,因而具有浸膏量少、纯度高、有效成分提取率高的特点。
从抑菌实验结果可以看出:加压提取的白头翁皂苷的抑菌活性略低于加热回流提取,但比超声辅助提取与微波辅助提取的抑菌活性高。加热回流提取的皂苷提取率最低,但其活性最高,可能是浸膏中含有的杂质,如糖、鞣质等成分也具有抑菌活性的原因,而加压提取的皂苷提取率较高,因而具有较强的抑菌活性。
抗氧化活性实验结果也说明,加压提取的白头翁皂苷由于提取率高,对DPPH·的清除活性也较强。
2.2 白头翁药材扫描电镜
将加热回流、超声辅助、微波辅助以及加压提取后的白头翁药材,和未提取的白头翁药材样品通过扫描电镜观察其微观结构变化,结果见图1。
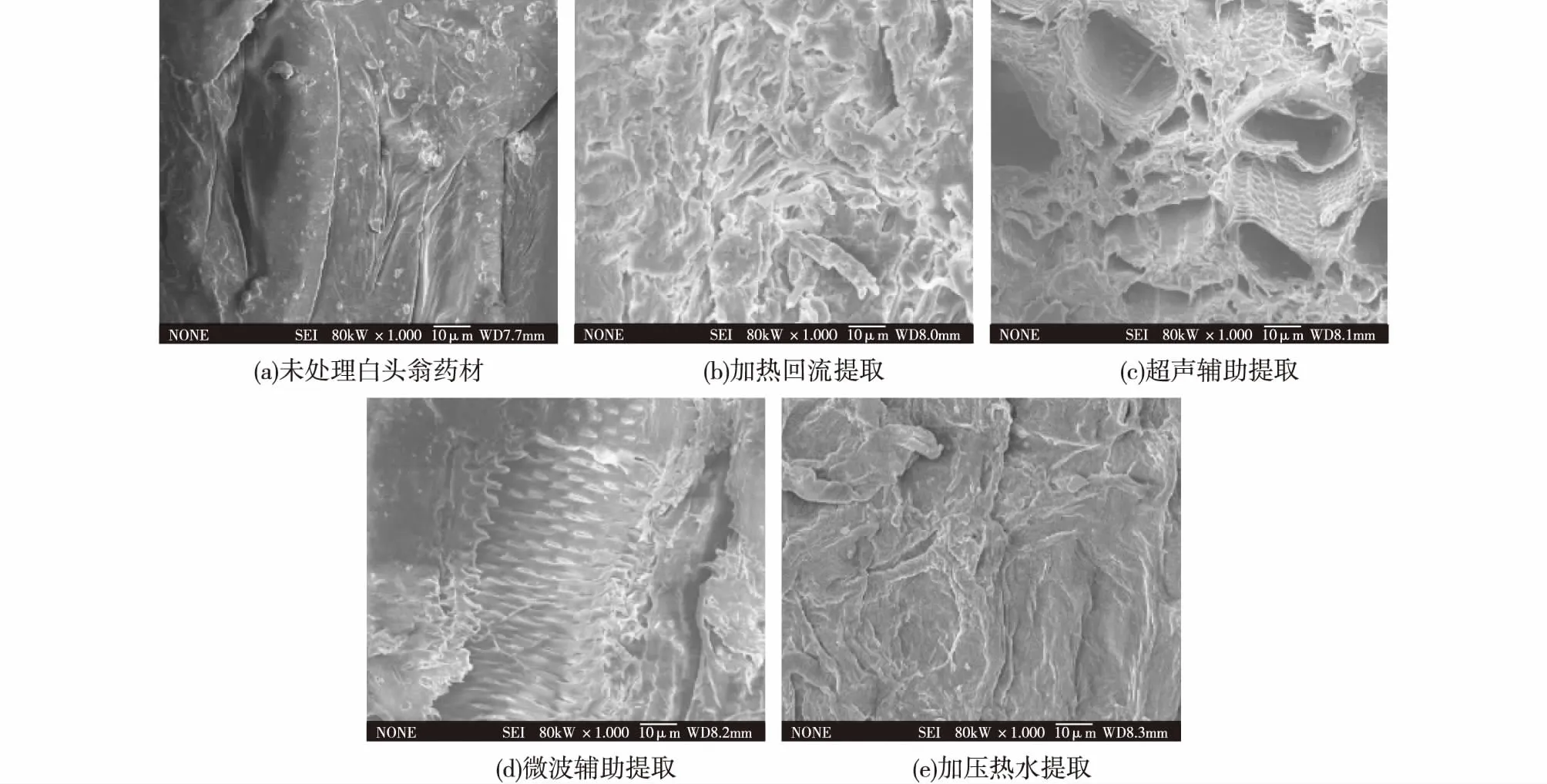
图1 白头翁药材电镜扫描图Fig.1 Scanning electron microscope images of Radix Pulsatillae
由图1可知:未经过提取的药材,表面自然、完整;经过加热回流提取后,药材整体组织结构疏松,有明显的破碎,但药材表面结构仍比较完整;经超声和微波辅助提取后的药材已观察不到完整的表面组织结构,药材细胞很明显已经被破坏,甚至可以看到一些细胞的内部组织结构;经加压热水提取后的药材,表面平整,没有明显的组织碎片,但有很明显经过压缩后的褶皱。由此可以推测,加压热水提取有效促进中药成分的传质效应,与加热回流提取的传质机理相似,与超声、微波辅助提取的传质过程有所不同。
2.3 加压提取的传质动力学
称取适量经干燥粉碎后的白头翁药材粗粉,按1∶ 10 (mg/mL)加入蒸馏水,加热至90~140 ℃,在0.3 MPa压力下提取90 min,每隔一段时间取样10 mL,挥干溶剂,用分光光度法测皂苷含量,结果见图2。
利用图2中数据,根据式(5)作t/ρt~t图,见图3。

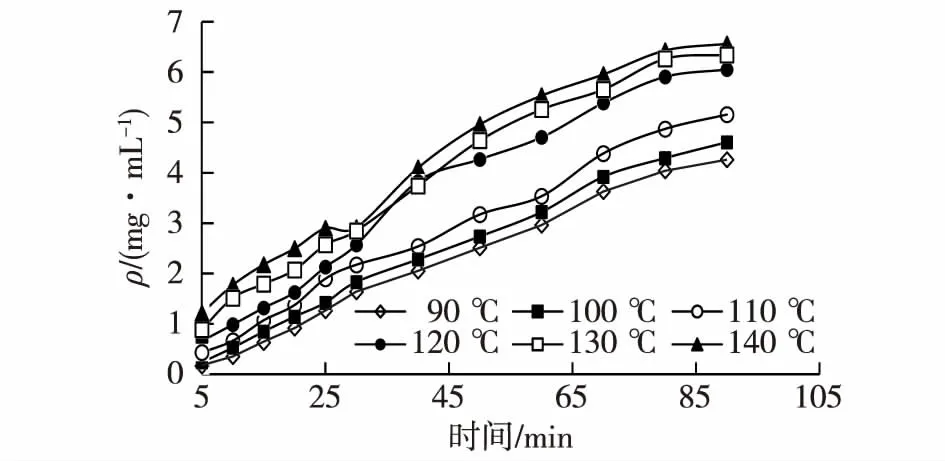
图2 不同温度下,加压提取白头翁皂苷含量随时间变化曲线Fig.2 Effects of temperature on saponins concentration from Radix Pulsatillae by pressurized extraction
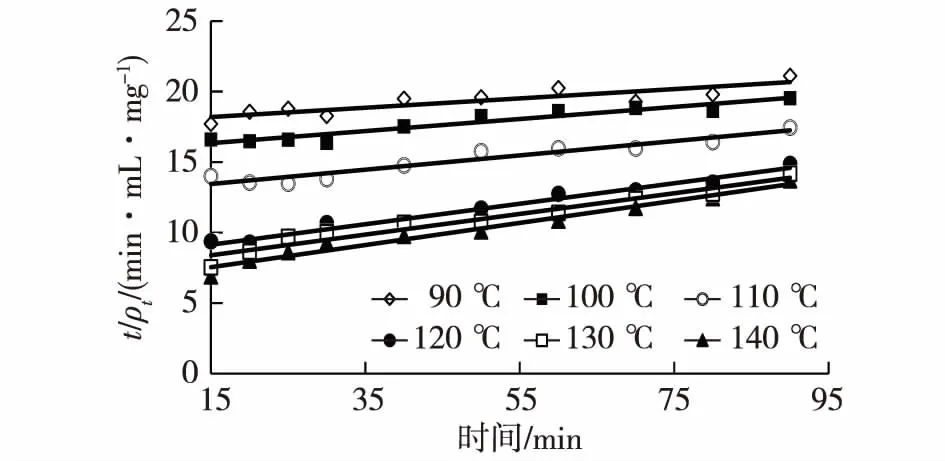
图3 不同温度下,加压提取白头翁皂苷成分的动力学关系Fig.3 Relationships of second-order extraction kinetics of saponins from Radix Pulsatillae by pressurized extraction at different temperatures
由表2可知:利用加压热水技术提取白头翁中的皂苷成分,除90 ℃外,温度在100~140 ℃时,提取时间15~90 min内,相关系数R值偏低,但均大于0.95,与二阶动力学模型相关性较强。因此,可用该动力学模型来描述加压热水提取白头翁中皂苷成分的传质过程。实验中选取15~90 min进行方程拟合,是由于实验设备的局限,需要先把药材样品放到提取罐中,加入提取溶剂后密闭,再逐渐升高温度。在升温过程中,药材与溶剂接触,已经开始对其中的有效成分进行浸提,但计时是从升到设定温度后开始,因此计时初期成分的提取率明显偏高。为减少提取设备所造成的误差干扰,我们选取15 min为方程拟合起始点。
根据公式(7),拟合加压提取白头翁皂苷的提取动力学方程。在一定温度下,t时刻提取物浓度ρt与h0和ρs相关,而h0与ρs又与提取温度T有关。用lnh0对1/T作图,采用最小二乘法做线性归回,则初始提取速率与温度的关系为h0=2.6exp(-331.04/T),R=0.978 2;用ρs对T作图,同样采用最小二乘法进行线性回归,饱和质量浓度与温度的关系为ρs=0.007 8T2-6.416 9T+1 329.3,R=0.992 9。
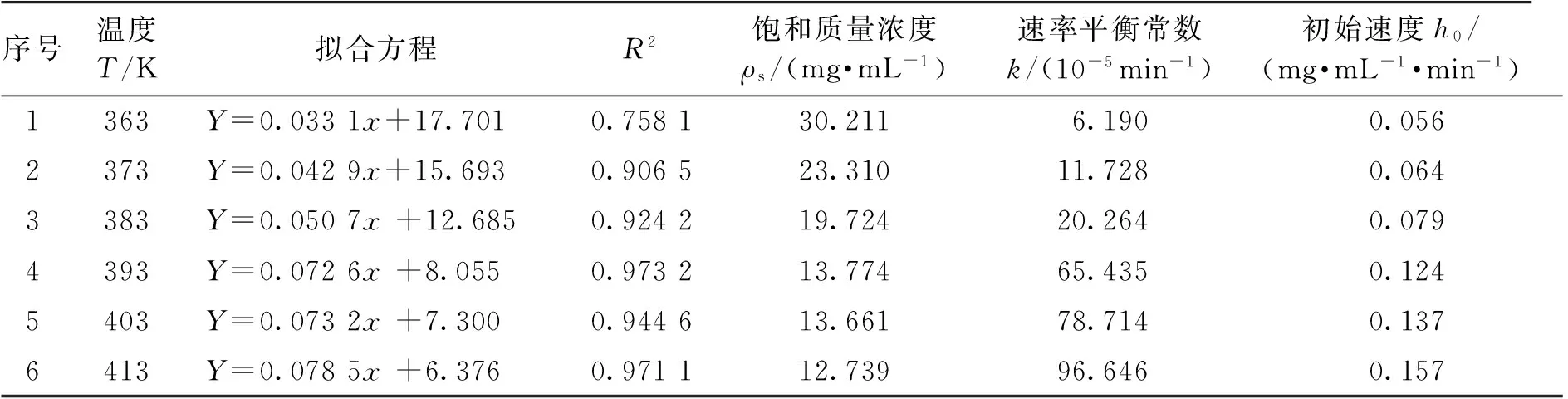
表2 不同温度下二阶动力学模型线性化数据
将h0和ρs带入式(7),可得白头翁皂苷成分的提取动力学方程
ρt=
(8)
式(8)给出了提取时间t和提取温度T与提取物质量浓度ρt之间的关系,利用Origin 9.1软件作图4。由图4可知:在一定范围内可用于预测任意时间、温度下提取物的浓度,便于调整提取工艺参数。由加压提取白头翁皂苷成分浓度预测图可以看出,在提取初期,提取物浓度随提取温度变化比较平缓,但随着提取时间的延长,在较低温度时,皂苷浓度有明显的提升,提高温度反而不利于白头翁皂苷类成分的提取,这可能与提取温度高会破坏皂苷类成分有关。
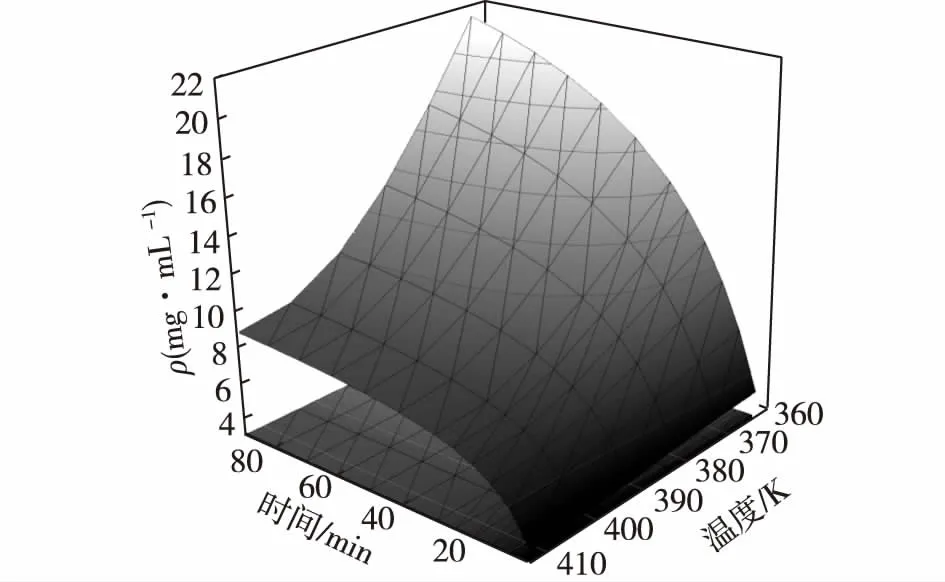
图4 任何温度与时间下,加压提取白头翁中皂苷成分浓度预测图Fig.4 Predictive model for saponins extraction from Radix Pulsatillae by pressurized extraction at different extraction time and temperature
2.4 提取过程的活化能
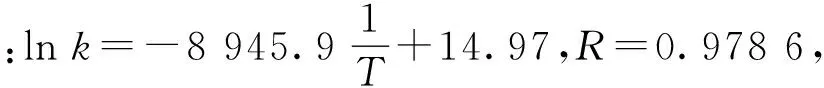

图5 温度(1/T)与二阶速率常数(ln k)间关系图Fig.5 Relationship between temperature and the second-order leaching rate constant
3 结论
系统比较了加热回流、超声辅助、微波辅助以及加压热水提取方法对白头翁皂苷的提取率、抗氧化活性以及抑菌活性等指标的影响,结果表明加压热水提取方法具有提取率高,提取物活性强的特点,而且用水代替有机溶剂做提取试剂,具有绿色环保的优势,是促进中药产业绿色发展的最具前途的技术之一。
对提取后药材的电镜扫描结果表明,加压热水提取技术与目前较常见的超声辅助和微波辅助的传质机理有所不同,通过对相关提取动力学模型拟合比
较,得到的二阶动力学模型ρt=t[(2.6exp(-331.04/T))-1+t(0.007 8T2-6.416 9T+1 329.3)-1]-1可以较好地说明加压提取过程传质机理,由此推导出的动力学方程可用于指导加压热水提取白头翁皂苷的工业化生产。
[1] 陈静,朴钟云,刘显军,等.白头翁的生物学功能及应用现状.江苏农业科学,2011,39(3):4-6.
[2] 李海燕,郝宁,许永男,等.朝鲜白头翁总皂苷提取工艺的优化.中药材,2010,33(4):617-620.
[3] 宋科标,时维静,周杰,等.白头翁提取方法比较.中兽医医药杂志,2011,13(4):19-21.
[4] 王宏军,王术德,马魏,等.白头翁水溶性多糖提取工艺的研究.现代畜牧兽医,2014(2):1-4.
[5] 黄巧燕,赵文英,戎晋华,等.加压提取菊花中黄酮类成分及其抗氧化活性研究.林产化学与工业,2013,33(5):83-87.
[6] KIM W J,LEE K A,KIM KT,et al.Antimicrobial effects of onion (AlliumcepaL.) peel extracts produced via subcritical water extraction againstBacilluscereusstrains as compared with ethanolic and hot water extraction.Food Sci Biotech,2011,20(4):1101-1106.
[7] LI J,ZU Y G,FU Y J,et al.Optimization of microwave-assisted extraction of triterpene saponins from defatted residue of yellow horn (XanthocerassorbifoliaBunge.) kernel and evaluation of its antioxidant activity.Innov Food Sci Emerg Technol 2010,11(4):637-643.
[8] TRUSHEVA B,TODOROV I,NINOVA M,et al.Antibacterial mono- and sesquiterpene esters of benzoic acids from Iranian propolis.Chem Central J,2010,4(1):8-11.
[9] DUTTA R,SARKAR U,MUKHERJEE A.Pseudo-kinetics of batch extraction ofCrotalariajuncea(Sunn hemp) seed oil using 2-propanol.Ind Crops Prod,2016,87:9-13.
(责任编辑 荀志金)
Comparison of techniques for extraction of triterpenoid glycosides fromRadixPulsatillaeand kinetics of pressurized hot water extraction
ZHAO Wenying,ZHU Qingshu,XU Yanli,SUN Yanni
(College of Chemical Engineering,Qingdao University of Science and Technology,Qingdao 266042,China)
Triterpenoid glycosides fromRadixPulsatillaewere extracted by hot water extraction,ultrasonic assisted extraction,microwave assisted extraction,and pressurized hot water extraction (PHWE).The extraction yield of triterpenoid glycosides as well as antibacterial and antioxidant activity of the extracts from four methods were compared.Scanning electron microscope images of the plant cells after four treatments were obtained to provide visual evidence of the extraction effect.The results show that the extraction yield of triterpenoid glycosides by PHWE was the highest,and the extracts obtained with PHWE also showed the higher antibacterial and antioxidant activity.The extraction model of a second-order mechanism was developed to predict the concentration of triterpenoid glycosides under various extraction temperatures.The extraction kinetic equation was described asρt=t[(2.6exp(-331.04/T))-1+t(0.007 8T2-6.416 9T+1 329.3)-1]-1,theEawas 7.437 62 kJ/mol.
RadixPulsatillae; triterpenoid glycosides; pressurized hot extraction; kinetics
10.3969/j.issn.1672-3678.2017.02.006
2016-11-25
山东省中青年科学家科研奖励基金(BS2009SW033)
赵文英(1969—),女,山东蓬莱人,博士,副教授,研究方向:天然产物成分提取,E-mail:wyzhao0059@aliyun.com
TQ35
A
1672-3678(2017)02-0035-06
