苦参素胶囊联合重组人干扰素对高AFP(甲胎蛋白)慢性乙肝患者纤维化指标及炎症因子的影响
2017-04-07魏越
魏 越
(鞍山市中心医院 传染科,鞍山 114000)
苦参素胶囊联合重组人干扰素对高AFP(甲胎蛋白)慢性乙肝患者纤维化指标及炎症因子的影响
魏 越
(鞍山市中心医院 传染科,鞍山 114000)
目的:研究苦参素胶囊联合重组人干扰素对高甲胎蛋白(AFP)慢性乙肝患者纤维化指标及炎症因子的影响及治疗 效果。方法:将2012年3月~2015年3月于我院接受诊治的96例慢性乙肝肝硬化伴高甲胎蛋白患者,根据治疗方式的不同,随机平均分为A、B、C三组,所有患者均接受复方鳖甲软肝片、水飞蓟宾葡甲胺片、甘草酸二铵保肝抗炎治疗,恩替卡韦抗乙肝病毒治疗,维生素、能量合剂等常规乙肝治疗,A组患者在此基础上给予苦参素胶囊治疗,B组患者给予干扰素-γ治疗,C组患者给予两种药物联合治疗,治疗9个月,观察三组患者治疗前后肝功能、肝纤维化指标以及炎症因子表达。结果:经过治疗后,三组患者AFP、ALT、AST、TBil、PT均显著降低,白蛋白显著上升;A组HBV-DNA阴转率40.63%,HBeAb阳转率31.25%,HBeAg阴转率34.38%,B组37.50%、28.13%和31.25%,C组65.63%、56.25%和59.38%;三组LN、PCⅢ、PⅣP、HA均显著降低;脾脏厚度、内径,脾静脉宽度,门静脉内径均显著降低;炎症因子IL-6、TNF-α、BFGF及TGF-β1含量均显著降低。A、B两组差异不显著,与C组差异显著。结论:苦参素胶囊联合重组人干扰素可显著降低慢性乙肝患者甲胎蛋白含量,改善肝纤维化状态,降低炎症反应,促进肝功能恢复。
苦参素;干扰素;甲胎蛋白;慢性乙型肝炎;纤维化
乙型肝炎是由乙型肝炎病毒(HBV)所致的肝部炎症病变,可致使体内多种脏器功能紊乱,具有世界流行趋势,据报道,我国慢性HBV感染者已达9300万人,而慢性乙型感染患者约2000万例[1]。肝纤维化是乙肝患者病情恶化至肝癌的中间环节,许多研究表明,乙肝硬化患者常伴高AFP表达,时刻动态监测患者血清APF可了解肝脏损伤情况及药物治疗效果[2]。苦参素具有抗肝纤维化、免疫调节、抗炎等作用,可逆转或阻止肝纤维化的进一步发展[3]。高海丽等[4],赵世印等[5]均证实苦参素对乙肝患者治疗有效。干扰素是治疗乙肝的常规有效药物,具有抗病毒、抗炎症作用,对肝纤维化治疗有明显疗效[6]。付文娟等[7]应用重组α干扰素治疗5例乙型患者,发现其除具有较好抗病毒效果外,对半途症状也有所缓解。联合用药治疗乙肝是近期诸位专家学者提倡的治疗方式,本研究选取我院96例慢性乙肝肝硬化伴高甲胎蛋白患者进行治疗,探讨联合用药治疗效果及其对乙肝患者肝纤维化和炎症因子的影响。现报道如下。
1 资料与方法
1.1 一般资料 将2012年3月~2015年3月于我院接受诊治的96例慢性乙肝肝硬化伴高甲胎蛋白患者作为治疗对象。纳入标准:诊断结果符合《传染病学》[8]及《慢性乙型肝炎防治指南(2010年版)》[9]诊断标准,确诊为慢性乙型肝炎患者;肝纤维化四项检测结果符合肝硬化指标者;AFP值≥400ng/mL者;HBV-DNA及HBeAg均呈阳性者;SB<34.2μmol/L者;丙氨酸转氨酶(GPT)水平处于100-400U/L者;凝血酶原活动度(PTA)>60%者;情书知情同意书,配合治疗者。排除标准:肝脏检查确诊为肝癌者;甲肝、丙肝、戊肝等其他病毒性肝炎者;因酒精或药物至肝损伤者;艾滋病患者;慢性肝衰竭者;其他原因导致GPT上升、血小板、红细胞、白细胞下降者;免疫治疗、抗纤维化治疗或抗病毒治疗<半年者;妊娠及哺乳期妇女。所有患者根据治疗方式的不同,随机平均分为A、B、C三组,A组苦参素胶囊治疗,B组干扰素-γ治疗,C组苦参素胶囊联合重组人干扰素治疗。A组男19例,女13例,平均病程(12.5±6.4)年,年龄(49.51±7.51)岁,肝硬化患者10例;B组男20例,女12例,平均病程(12.4±5.9)年,年龄(48.59±8.15)岁,肝硬化患者11例;C组男18例,女14例,平均病程(12.6±6.1)年,年龄(49.56±6.54)岁,肝硬化患者10例。三组患者一般资料无显著性差异(P> 0.05)。
1.2 治疗方法 所有患者均接受复方鳖甲软肝片(内蒙古福瑞医疗科技股份有限公司,国药准字Z19991011)和水飞蓟宾葡甲胺片(江苏中兴药业有限公司,国药准字H32026145)保肝抗炎治疗,恩替卡韦(中美上海施贵宝制药有限公司,国药准字H20052237)抗乙肝病毒治疗,维生素、能量合剂等常规乙肝治疗。A组患者在此基础上给予苦参素胶囊(天晴复欣,江苏正大天晴药业股份有限公司,国药准字H20010763,0.1g)治疗,剂量0.2g/次,一日三次;B组患者给予干扰素-γ(上生雷泰,上海生物制品研究所,国药准字S19990059,100万IU)治疗,剂量100万IU,肌肉注射,前3个月每日一次,后6个月两日一次;C组患者给予苦参素胶囊联合干扰素-γ治疗。所有组均治疗9个月或以原发肝癌为结束点。
1.3 检测指标 ①AFP检测:于治疗前后,采用酶联免疫法每两周检测一次AFP含量;②肝功能指标:于治疗前后每两周检测所有患者血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、胆红素(TBil)、凝血酶原时间(PT)和白蛋白水平变化;③HBV标记物:HBeAb与HBeAg采用酶联免疫吸附法检测,HBV-DNA采用荧光定量PCR法检测,治疗前后每月检测一次;④血清肝纤维化指标:选取放射免疫法于治疗前后期间每两周检测所有患者血清层黏蛋白(LN),Ⅲ、Ⅳ型前胶原(PCⅢ与PⅣP)和透明质酸(HA),⑤超声检测:采用彩超、肝脏CT或MRI于治疗前后每月检测所有患者脾脏厚度与长泾,脾静脉宽度以及门静脉内径。⑥炎症因子:采用放射免疫法检测所有患者治疗前后白介素-6(IL-6)与肿瘤坏死因子(TNF-α)变化,采用免疫组化法检测碱性成纤维细胞生长因子(bFGF)和转化生长因子-β1(TGF-β1)变化。
2 结果
2.1 三组甲胎蛋白及肝功能各项指标检测比较 由表1可以看出,经过治疗后,所有患者AFP含量显著下降(P< 0.05),ALT、AST、TBil、PT显著下降(P< 0.05),白蛋白含量显著上升(P< 0.05),A、B两组差异不显著(P>0.05),与C组差异显著(P< 0.05)。
2.2 三组HBV-DNA阴转率和HBeAb、HBeAg转换率变化 由表2可以看出,经过9个月的治疗后,A组HBV-DNA阴转率40.63%,HBeAb阳转率31.25%,HBeAg阴转率34.38%,B组则分别为37.50%、28.13%和31.25%,C组则达65.63%、56.25%和59.38%,且C组与A、B两组存在显著性差异(P> 0.05)。
表1 三组治疗前后甲胎蛋白及肝功能各项指标检测比较(±s)
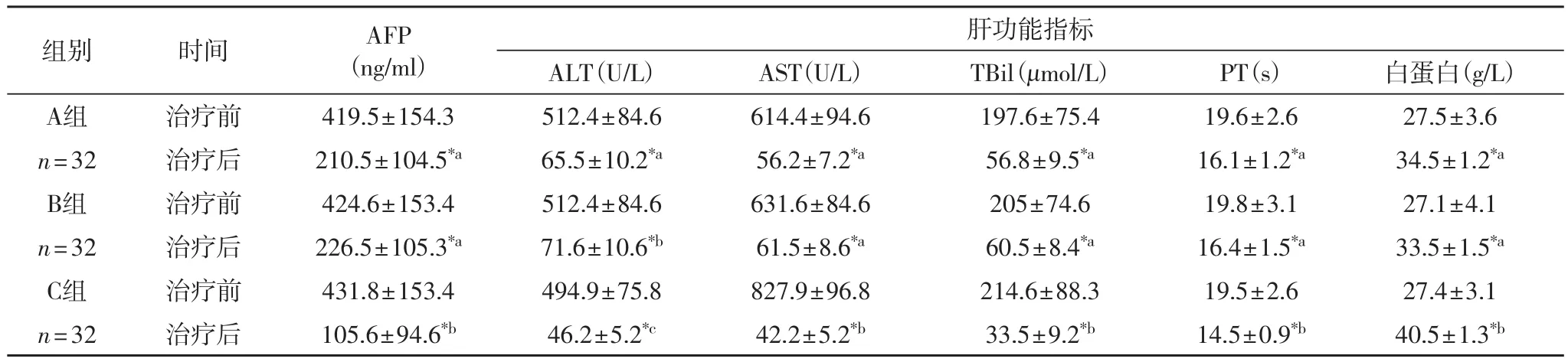
表1 三组治疗前后甲胎蛋白及肝功能各项指标检测比较(±s)
注:*组内比较存在显著差异,组间不含相同字母者差异显著,P< 0.05
肝功能指标ALT (U/L) AST(U/L) TBil (μmol/L) PT (s) 白蛋白(g/L)A组 治疗前 419.5±154.3 512.4±84.6 614.4±94.6 197.6±75.4 19.6±2.6 27.5±3.6 n=32 治疗后 210.5±104.5*a65.5±10.2*a56.2±7.2*a56.8±9.5*a16.1±1.2*a34.5±1.2*aB组 治疗前 424.6±153.4 512.4±84.6 631.6±84.6 205±74.6 19.8±3.1 27.1±4.1 n=32 治疗后 226.5±105.3*a71.6±10.6*b61.5±8.6*a60.5±8.4*a16.4±1.5*a33.5±1.5*aC组 治疗前 431.8±153.4 494.9±75.8 827.9±96.8 214.6±88.3 19.5±2.6 27.4±3.1 n=32 治疗后 105.6±94.6*b46.2±5.2*c42.2±5.2*b33.5±9.2*b14.5±0.9*b40.5±1.3*b组别 时间 AFP(ng/ml)
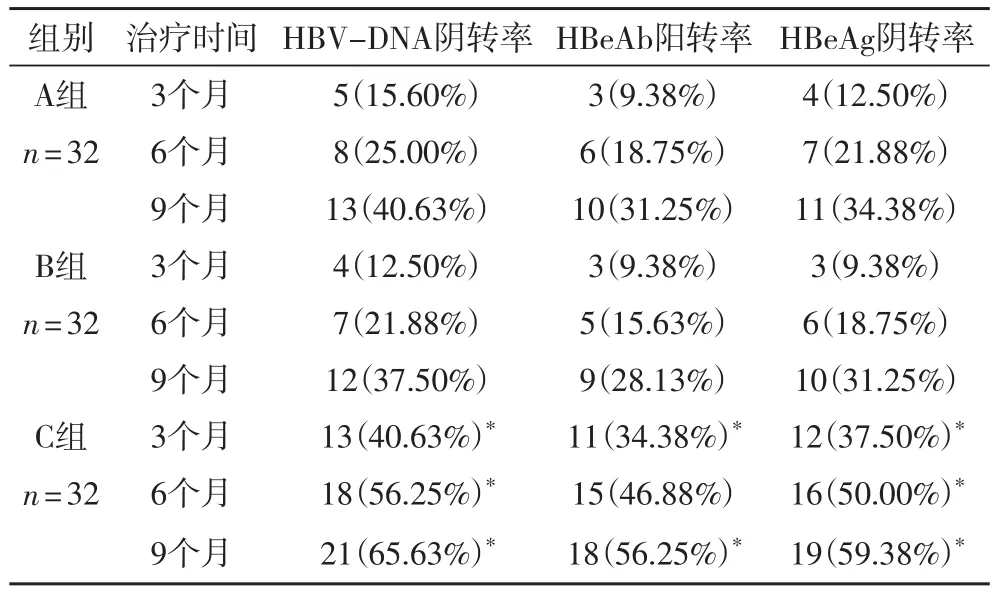
表2 三组HBV-DNA阴转率和HBeAb、HBeAg转换率变化 [n(%)]
2.3 三组血清肝纤维化指标比较 由表3可以看出,经过治疗后,三组LN、PCⅢ、PⅣP、HA均显著降低(P< 0.05),A、B两组无显著性差异(P> 0.05),C组与其他两组差异显著(P< 0.05)。
表3 三组治疗前后血清肝纤维化指标比较(±s)
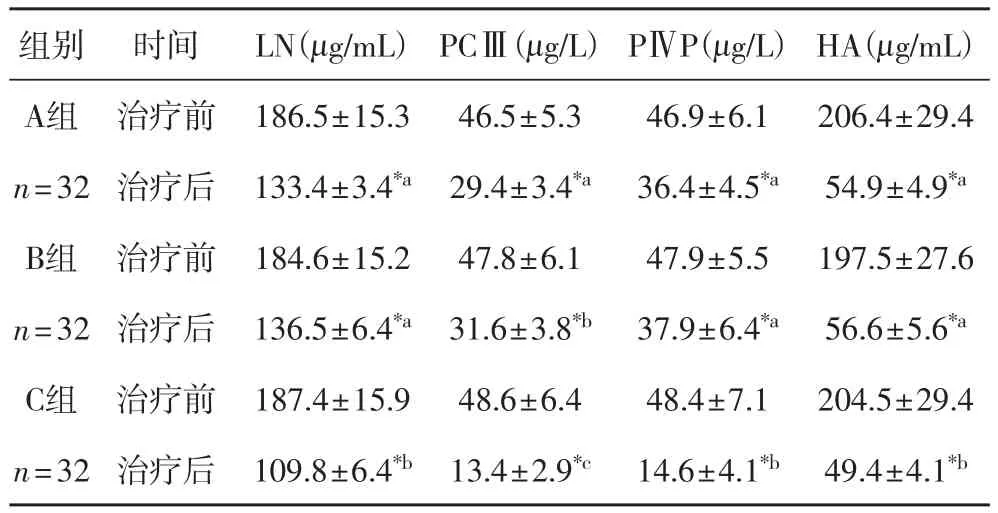
表3 三组治疗前后血清肝纤维化指标比较(±s)
注:*组内比较存在显著差异,组间不含相同字母者差异显著,P< 0.05
组别 时间 LN(μg/mL) PCⅢ(μg/L) PⅣP(μg/L) HA(μg/mL)A组 治疗前 186.5±15.3 46.5±5.3 46.9±6.1 206.4±29.4 n=32 治疗后 133.4±3.4*a29.4±3.4*a36.4±4.5*a54.9±4.9*aB组 治疗前 184.6±15.2 47.8±6.1 47.9±5.5 197.5±27.6 n=32 治疗后 136.5±6.4*a31.6±3.8*b37.9±6.4*a56.6±5.6*aC组 治疗前 187.4±15.9 48.6±6.4 48.4±7.1 204.5±29.4 n=32 治疗后 109.8±6.4*b13.4±2.9*c14.6±4.1*b49.4±4.1*b
2.4 三组超声检测结果比较 由表4可以看出,经过治疗后,三组患者脾脏厚度、内径,脾静脉宽度,门静脉内径均显著降低(P< 0.05),A、B两组差异不显著(P>0.05),而C与其他两组有显著性差异(P< 0.05)。
表4 三组超声检测结果比较(±s,cm)
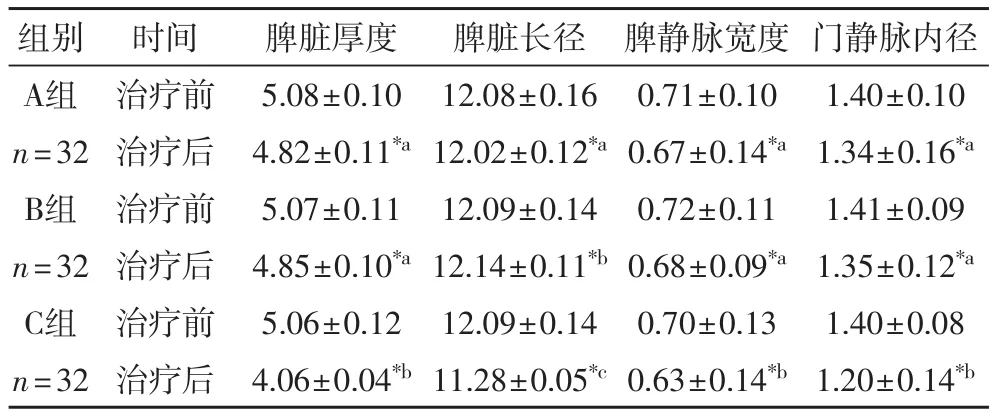
表4 三组超声检测结果比较(±s,cm)
注:*组内比较存在显著差异,组间不含相同字母者差异显著,P< 0.05
组别 时间 脾脏厚度 脾脏长径 脾静脉宽度 门静脉内径A组 治疗前 5.08±0.10 12.08±0.16 0.71±0.10 1.40±0.10 n=32 治疗后 4.82±0.11*a12.02±0.12*a0.67±0.14*a1.34±0.16*aB组 治疗前 5.07±0.11 12.09±0.14 0.72±0.11 1.41±0.09 n=32 治疗后 4.85±0.10*a12.14±0.11*b0.68±0.09*a1.35±0.12*aC组 治疗前 5.06±0.12 12.09±0.14 0.70±0.13 1.40±0.08 n=32 治疗后 4.06±0.04*b11.28±0.05*c0.63±0.14*b1.20±0.14*b
2.5 三组炎症因子比较 由表5可以看出,经过治疗后,三组IL-6、TNF-α、BFGF及TGF-β1均显著降低(P< 0.05),A、B两组差异不显著(P> 0.05),而C与其他两组有显著性差异(P< 0.05)。
表5 三组治疗前后炎症因子比较(±s)
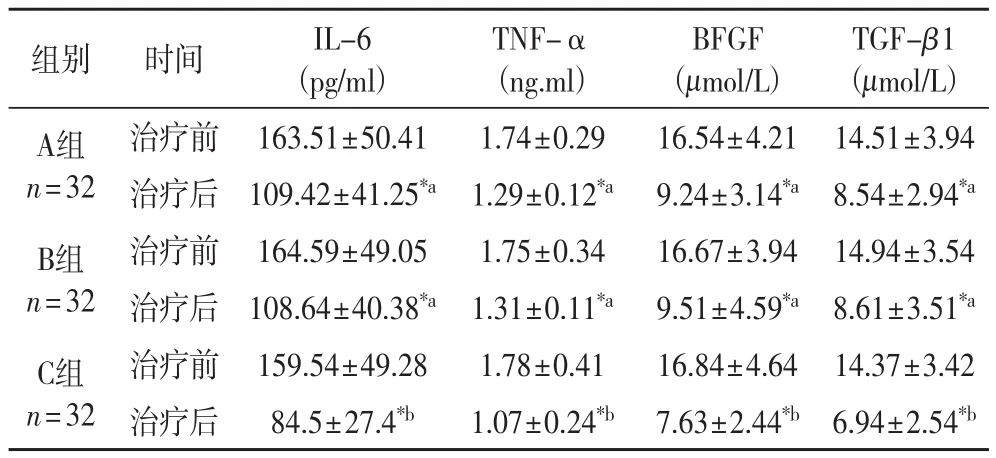
表5 三组治疗前后炎症因子比较(±s)
注:*组内比较存在显著差异,组间不含相同字母者差异显著,P< 0.05
TGF-β1(μmol/L)A组n=32组别 时间 IL-6(pg/ml)TNF-α(ng.ml)BFGF(μmol/L)治疗前 163.51±50.41 1.74±0.29 16.54±4.21 14.51±3.94治疗后 109.42±41.25*a1.29±0.12*a9.24±3.14*a8.54±2.94*aB组n=32治疗前 164.59±49.05 1.75±0.34 16.67±3.94 14.94±3.54治疗后 108.64±40.38*a1.31±0.11*a9.51±4.59*a8.61±3.51*aC组n=32治疗前 159.54±49.28 1.78±0.41 16.84±4.64 14.37±3.42治疗后 84.5±27.4*b1.07±0.24*b7.63±2.44*b6.94±2.54*b
3 讨论
重组人干扰素是乙型肝炎抗病毒治疗的常用药物,临床数据显示,干扰素治疗有效率仅达30-50%,停用药后存在复发现象,且费用昂贵[6]。苦参素具有抗肝纤维化、免疫调节、抗炎等作用,可逆转或阻止肝纤维化的进一步发展,许多临床资料报道其抗肝纤维化效果明显[3]。如高海丽等[4]临床结果证明苦参素能够改善乙肝患者肝纤维化状态,提高患者免疫力。赵世印等[5]临床试验证实苦参素可降低乙肝患者高AFP含量。干扰素与苦参素单独治疗乙肝报道颇多,但有关两类药物联合治疗的报道却并不多。本研究根据本院乙肝患者病情,采用苦参素胶囊联合重组人干扰素-γ治疗慢性乙肝纤维化伴高甲胎蛋白患者,发现联合用药较单独用药组疗效显著。
本研究结果中,AFP及肝功能五项指标经过治疗后,联合用药组比单独用药组表达量显著低,说明联合用药效果显著。AFP反应了肝脏损伤情况,可作为药物治疗乙肝的效果评定指标[2]。许多研究指出,AFP具有早期肝癌诊断意义,当AFP大于200ng/ml,时间大于8周,或者AFP大于400ng/ml,时间大于4周者,患者极有可能患原发性肝癌[10]。在接受治疗前,所有患者AFP均大于400ng/ml,单药治疗组治疗后降至200ng/ml左右,而联合用药组将至100ng/ml左右,说明联合用药抗病毒作用显著。HBV指标中,苦参素治疗组HBV-DNA阴转率40.63%,HBeAb阳转率31.25%,HBeAg阴转率34.38%,干扰素组分别为37.50%、28.13%和31.25%,而联合用药组却达65.63%、56.25%和59.38%,显著高于其他两组,说明苦参素联合重组人干扰素可以有效的抑制乙型肝炎病毒DNA复制,促进HBeAb与HBeAg转换。本研究结果与蒋蔚统计的干扰素联合苦参素治疗乙肝患者转换率结果具有一致性[11]。肝纤维化四项检测指标结果显示,三组患者经过治疗后LN、PCⅢ、PⅣP、HA均显著降低,肝纤维化症状均得到改善,根据超声检测标准[12],本研究结果中,所有患者脾脏厚度、脾脏内径、脾静脉宽度和门静脉内径值均下降,说明经过治疗后,三组肝纤维化状况均得到缓解,但联合用药组各项指标均更趋近于正常水平,与其他两组差异显著,说明联合用药治疗乙肝纤维化患者效果比单用药组效果更好。肝纤维化是慢性乙型肝炎向肝硬化、肝癌恶化的中间过程,及早确诊并治疗肝纤维化发展可阻断或逆转乙肝病情发展[13,14]。苦参素中的氧化苦参碱因其结构的四环的喹嗪啶类,可抑制胶原活动度,抗炎、调节免疫,从而发挥抗纤维化作用,而干扰素-γ具有明显抑制肝形状细胞作用,该细胞是肝硬化形成主要因素,故干扰素-γ是抗肝纤维化有效因子,两种药物联合使用,从抑制纤维细胞形成到抗炎、调节免疫,药效叠加,效果显著[3,15]。炎症因子是相关细胞分泌的免疫活性物质,乙肝患者因肝脏排毒能力减弱,肝功能损伤,体内炎症因子会大量表达[16]。IL-6与TNF-α可诱导肝脏细胞产生过多有害急性期蛋白,导致肝脏病变恶化,许多研究表明,体内过多的IL-6与TNF-α会造成机体炎性损伤[17]。bFGF为肝细胞主要分泌因子,表达主要集中在血管纤维化部位、肝脏炎性坏死部位、肝窦壁等,其含量的增加会加速肝纤维化进程,TGF-β1在肝纤维化晚期细胞中大量表达,是肝纤维化分期指标[18]。本研究中IL-6、TNF-α、BFGF及TGF-β1在治疗前含量均显著高于正常水平,经过治疗后均显著下降,说明体内炎症反应得到改善,且联合治疗组下降幅度显著高于单独用药组,说明苦参素联合干扰素可显著改善体内炎症反应。然两药联合虽疗效显著,但两种药物均有副作用,后续研究还需进展。
综述所述,苦参素胶囊联合重组人干扰素可显著降低慢性乙肝患者甲胎蛋白含量,改善肝纤维化状态,降低炎症反应,促进肝功能恢复,具有重要临床意义。
[1] 王鹏, 吕国涛, 明朗, 等. APRI、CDS指数在乙肝相关性肝癌中的应用[J]. 实用医学杂志, 2015; 7: 1085-1087.
[2] 郝明霞. 柔木丹颗粒联合拉米夫定治疗肝炎肝硬化45例临床观察.四川中医, 2007; 25(9): 53-54.
[3] 郭土深, 王辉. 苦参素治疗乙肝所致肝纤维化的临床药理研究[J].中国民族民间医药, 2016(1): 114-115.
[4] 高海丽, 杨道坤, 梁海军, 等. 苦参素对乙型肝炎患者免疫及纤维化状态的治疗研究[J]. 中华医院感染学杂志, 2016; 26(5): 985-987.
[5] 赵世印, 李芳, 谭华炳. 苦参素胶囊对乙型肝炎后肝硬化患者高甲胎蛋白影响研究[J]. 辽宁中医药大学学报, 2014(1): 179-181.
[6] 李曼, 孙学华, 周振华, 等. 慢性乙型肝炎病毒感染者外周血T细胞γ干扰素和白细胞介素4的水平变化[J]. 细胞与分子免疫学杂志, 2016, 32(2): 240-244.
[7] 付文娟, 刘佩佩, 刘翠芸, 等. 重组α干扰素抗乙型肝炎病毒致斑秃5例临床分析[J]. 广东医学, 2015(8): 1266-1266.
[8] 杨绍基, 任红. 传染病学[M].7版. 北京: 人民卫生出版社, 2010: 23-51.
[9] 中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2010年版)[J]. 中国肝脏病杂志(电子版), 2011; 3(1): 40-56.
[10] 王松, 方放, 潘剑, 等. 血清AFP和GP73在慢性乙型肝炎患者中的表达[J]. 胃肠病学和肝病学杂志, 2016, 25(2): 168-170.
[11] 蒋蔚, 占发先, 程光文. 干扰素联合苦参素治疗慢性乙型肝炎临床疗效的Meta分析[J]. 山东医药, 2013; 53(46): 34-38.
[12] 刘宏, 郭顺林, 毛小荣, 等.64层螺旋CT对肝纤维化、肝硬化肝脾体积变化的研究[J]. 中国CT和MRI杂志, 2012, 10(5): 41-44.
[13] 周俊卿, 程欣. 乙型肝炎病毒表面抗原定量检测的临床意义及研究进展[J]. 临床误诊误治, 2013, 26(3): 101-103.
[14] 杨勇, 王占科, 陈鑫, 等. 乙肝病毒DNA定量水平和乙型肝炎病毒标志物定量检测指标相关性研究. 解放军医药杂志, 2014; 10: 78-81.
[15] 罗翠华. 健康教育对接受干扰素治疗患者生活质量的影响研究[J].湖南师范大学学报(医学版), 2015(3): 84-86.
[16] 曾祥源, 孙克伟. 乙肝肝硬化抗病毒治疗期间进展为原发性肝癌35例临床分析[J]. 医学临床研究, 2016; 1: 180-181.
[17] 牟娜, 牟佳, 李宁, 等. 慢性乙型肝炎患者外周血趋化因子和炎症因子的水平[J]. 细胞与分子免疫学杂志, 2015; 31(7): 968-971.
[18] 杨静, 黄崇亚. 乙肝患者TGF-β及bFGF水平与肝纤维化程度相关性分析[J]. 昆明医科大学学报, 2014; 35(7): 128-130.
Effects of kushenin capsules combined with recombinant human interferon on fibrosis indexes and inflammatory factors in high AFP (alpha-fetoprotein)patients with chronic hepatitis B
Wei Yue
(Anshan Central Hospital, Anshan 114000, China)
Objective To study effects and treatment effect of kushenin capsules combined with recombinant human interferon on fibrosis indexes and inflammatory factors in high alpha-fetoprotein (AFP)patients with chronic hepatitis B. Methods 96 high alphafetoprotein (AFP)patients with chronic hepatitis B liver cirrhosis treated in our hospital from March 2012 to March 2015 were randomly divided into A, B, C three groups according to different treatment methods, all patients received compound Biejia Ruangan tablets, silibin meglumine tablets, diammonium glycyrrhizinate hepatoprotective anti-inflammatory treatment, anluohuaxian capsules jianpi yangwei treatment, entecavir anti-HBV treatment, vitamin, energy mixture and other conventional hepatitis B therapy, A group added kushenin capsules on the basis of the above for 9 months, B group added interferon-γ for 9 months, C group added kushenin capsules and interferon-γ for 9 months, liver function, liver fibrosis indexes and inflammatory factors expression in the three groups before and after the treatment were observed. Results After the treatment, AFP, ALT, AST, TBil, PT in the three groups were significantly decreased, albumin was increased significantly; negative conversion rate of HBV-DNA in A group was 40.63%, positive transfer rate of HBeAb was 31.25%, negative conversion rate of HBeAg was 34.38%, B grouo were 37.50%, 28.13% and 31.25%, C group were 65.63%, 56.25% and 59.38%; LN, PCⅢ, PⅣP, HA in the three groups were significantly decreased; spleen thickness, internal diameter, splenic vein widen, internal diameter of portal vein were significantly decreased; inflammatory factor IL-6, TNF-α, BFGF andTGF-β1 content were significantly decreased. There was no significant difference in A and B groups, there was a significant difference compared with C group. Conclusion Kushenin capsules combined with recombinant human interferon can reduce alpha-fetoprotein content in patients with chronic hepatitis B significantly, improve hepatic fibrosis status, reduce inflammatory reaction, promote liver function recovery.
kushenin; interferon; alpha-fetoprotein; chronic hepatitis B; fibrosis
R512.62
A
1673-016X(2017)01-0098-04
2016-12-21
魏越,E-mail:2726854677@qq.com
