白蛋白结合型紫杉醇联合奈达铂化疗治疗晚期、复发转移性宫颈癌近远期疗效及安全性
2017-04-07姚威
姚 威
(辽宁省营口市妇产儿童医院,营口 115000)
白蛋白结合型紫杉醇联合奈达铂化疗治疗晚期、复发转移性宫颈癌近远期疗效及安全性
姚 威
(辽宁省营口市妇产儿童医院,营口 115000)
目的:观察白蛋白结合型紫杉醇联合奈达铂治疗晚期、复发转移性宫颈癌的临床疗效、安全性及预后情况,同时分析影响临床疗效和预后的影响因素。方法:前瞻性选取2014年1月~2016年1月期间45例确诊为宫颈癌患者,其中8例IV期;37例复发转移,均给予白蛋白结合型紫杉醇+奈达铂化疗化疗方案,观察近期疗效、不良反应及预后情况。结果:CR4.44%、PR51.11%、ORR 55.55%;病灶位于放射野情况(全部、部分、无)和末次化疗时间距本次治疗时间(>12月和≤12月)临床近期疗效差异具有显著统计学意义;III级毒性反应率28.89%,多为骨髓抑制,余毒性反应均较轻微;PFS 9.15±1.36月,OS 16.65±3.28月,影响预后因素为晚期和复发转移、入组前放化疗、病灶位于放疗野情况以及末次化疗距本次化疗间隔时间。结论:白蛋白结合型紫杉醇联合奈达铂治疗晚期、复发转移性宫颈癌疗效显著,安全性高,预后良好,但需充分考虑影响预后因素。。
白蛋白结合型紫杉醇;奈达铂;宫颈癌;疗效;安全性;预后
宫颈癌是女性生殖系统最常见的恶性肿瘤之一,居中国女性恶性肿瘤发病率首位,发病率呈逐年增长趋势且呈年轻化[1],死亡率居世界女性肿瘤四位。目前,随着我国诊疗技术不断提高,宫颈癌手术、放射治疗、化学治疗已经较为成熟,但对于某些晚期或复发转移性宫颈癌患者并未取得预期的效果[2],有效化疗方案可提高治愈率、降低复发和转移风险,进而提高患者生存率并改善生活质量[3],故探寻针对性有效的治疗方案是广大学者和专家致力研究的重点和热点领域。
宫颈癌化疗方案众多,常见化疗方案为紫杉醇联合顺铂,但疗效不佳且毒副作用大,尤其是对于晚期或/和复发转移性宫颈癌患者,临床应用受限,故探寻新型的化疗方案迫在眉睫。紫杉醇自红豆杉代谢物中提取而来,为细胞周期特异性制剂,常规紫杉醇为溶剂型紫杉醇,应用过程中需使用增溶剂可致系列性过敏反应,用药前必须进行脱敏预处理,给患者带来极大痛苦,同时限制其临床应用。白蛋白结合型紫杉醇(nanoparticle albumin-bound paclitaxel,NAB-P)是经纳米微粒蛋白结合技术以人血白蛋白为载体根据肿瘤细胞摄取营养物质的机制研制的平均直径为130nm颗粒状新型细胞毒类抗肿瘤药物,具有极高的靶向特异性,肿瘤组织中紫杉醇浓度得以明显提高,且无需助溶剂和过敏预处理[4],明显减少和减轻毒副作用,患者耐受剂量和依从性明显提高,在胰腺癌、乳腺癌、非小细胞肺癌、胃癌等恶性肿瘤中均取得了显著效果且安全性高[5]。奈达铂治疗指数明显高于顺铂,且毒副作用较少且轻微,与其他铂类抗肿瘤药物无完全交叉耐药性,可治疗对顺铂、卡铂等耐药肿瘤患者[6]。但目前国内外关于白蛋白型紫杉醇+奈达铂化疗方案在晚期或复发转移性宫颈癌中的应用鲜有报道,故本次研究笔者为进一步探析两种药物联合化疗对晚期、复发转移性宫颈癌的近远期疗效,为今后更有效且安全治疗晚期或/和复发转移性宫颈癌提供新的思路和参考,现将具体方法和结果报道如下。
1 资料与方法
1.1 一般临床资料 本项研究均在患者及家属之情同意并签署自愿接受拟定化疗方案且签署自愿参与研究协议书前提下进行,前瞻性选取肿瘤科2014年1月~2016年1月期间收治的晚期、复发转移性宫颈癌患者为研究对象,入选标准:①年龄30~70岁;②病理证实宫颈癌,妇科及影像学提示为晚期或者复发转移者;③肿瘤灶可测量和评估;④无颅内转移及伴神经压迫症状的椎体转移;⑤既往未使用过溶剂型紫杉醇或铂类药物;⑥实验室检查血液学、肝功能、肾功能指标水平均满足用药标准;⑦依从性良好,遵医嘱用药且定期完成随访;⑧临床资料和随访资料齐全者。排除标准:①不符合上述入选标准者;②处于感染活动期且不易控制者;③合并严重心肺功能障碍,全身状况较差,不能耐受化疗者;④不能控制大量胸水或者心包积液者;⑤合并其他肿瘤者或既往有其他恶性肿瘤史;⑥正在接受免疫治疗者;⑦过敏体质,对本次研究用药过敏者;⑧妊娠和哺乳期妇女以及有怀孕可能但不愿采取适当避孕措施者。脱落或退出标准:①患者自愿放弃治疗,要求退出试验;②用药期间发生严重不良事件,经评估需停止用药者;③用药期间怀孕者;④医学或者伦理学原因影响研究继续者。
1.2 临床资料 本次研究共入选45例晚期、复发转移性宫颈癌患者,年龄40~70岁,平均56.38±7.16岁。8例晚期参照国际妇科联盟(FIGO)分期均为IV期;复发转移37例;病理类型:鳞癌37例、腺癌6例、腺鳞癌2例。
1.3 治疗方法 本组患者均接受白蛋白结合型紫杉醇联合奈达铂化疗方案,注射用紫杉醇(白蛋白型)(企业名称:American Pharmaceutical Partners,Inc;批准文号:注册证号H20080338;规格:100mg*瓶)剂量选择175mg·m-2,首次疗程应用注射用紫杉醇(白蛋白型)前30min进行过敏预处理(静脉注射地塞米松20mg、肌肉注射苯海拉明40mg、静脉注射西咪替丁400mg),若未发生过敏反应则予以注射用紫杉醇(白蛋白型)100mg+20mL 0.9%氯化钠注射液,并使用专用输液器静脉滴注,30min滴完,用药期间若无明显异常反应则按同等比例配置剩余75mg,并于30min滴完,用药期间全程心电监护各项生命体征,输注完成后立即予以5mg托烷司琼静脉推注预防胃肠道反应,随后静脉滴注注射用奈达铂(生产企业:江苏奥赛康药业股份有限公司;批准文号:国药准字H20064294;规格:10mg;剂型:注射剂)80mg·m-2,滴注时间60~90min,21d为1疗程;第2疗程对无过敏反应者无需进行过敏预处理,按上述配比一次性滴注注射用紫杉醇(白蛋白型)175mg,余用药同首次方案。连续治疗2疗程,若有效者继续用药至肿瘤消退或者进展,若无效则根据患者病情重新制定方案。
1.4 观察指标和评价标准
1.4.1 近期疗效评价标准 参照实体肿瘤疗效评价标准(RECIST)[7]将其分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),客观有效率(ORR)=CR+PR。
1.4.2 安全性评价标准 遵照美国国立肿瘤研究所(NCI-CTC)制定的急性及亚急性毒性反应CTCAE3.0标准[8]将其按严重程度分为0~ IV度/级。
1.4.3 预后评价 无进展生存时间(PFS)和总体生存时间(OS)[9],PFS即入组至首次进展或者复发转移或者至末次随访;OS即自入组至至末次随访或死亡。
1.5 统计学处理 本研究将收集数据均录入SPSS18.0软件进行统计学处理,计量资料采用±s表示,若符合正态分布则采用t检验(组内比较行配对t检验,组间比较行成组t检验),若不符合正态分布则采用秩和检验,计数资料和等级资料采用构成比(%)表示,计数资料采用χ2检验,等级资料采用秩和检验,均采用双侧检验,P<0.05则具有统计学意义。
2 结果
2.1 近期疗效及影响因素 本组45例患者均完成2疗程治疗,CR2例(4.44%),PR23例(51.11%),ORR为55.55%;晚期或复发、入前是否化疗、入组前是否放疗患者临床近期疗效差异无统计学意义(P>0.05),病灶位于放射野情况(全部、部分、无)和末次化疗时间距本次治疗时间(>12月和≤12月)临床近期疗效差异具有显著统计学意义(P<0.05),详见表1。
2.2 不良反应发生情况 本组患者化疗毒性反应主要表现为骨髓抑制、胃肠道反应、乏力和周围神经感觉异常,III级中性粒细胞降低发生率为13.33%,但无1例伴发热,III级血小板降低和血红蛋白降低发生率分别为4.44%、6.67%;恶心呕吐、腹泻、便秘等胃肠道反应发生分别为80.00%、24.44%、22.22%,但均为I~II级,经对症处理后缓解甚至痊愈,不影响后续治疗;乏力发生率高达86.67%,III度发生率为2.22%;周围神经感觉异常发生率为37.78%,但均为I~II级,无1例发生过敏反应,详见表2。
2.3 预后情况 本组45例患者均随访至2016年9月31日,PFS 5月~16月,平均 9.15±1.36月,OS 7月~33月,平均 16.65±3.28月,单因素分析发现晚期或复发转移、入组前放化疗、病灶位于放疗野情况及末次化疗距本次化疗时间均为患者PFS和OS影响因素(P<0.05),详见表3。
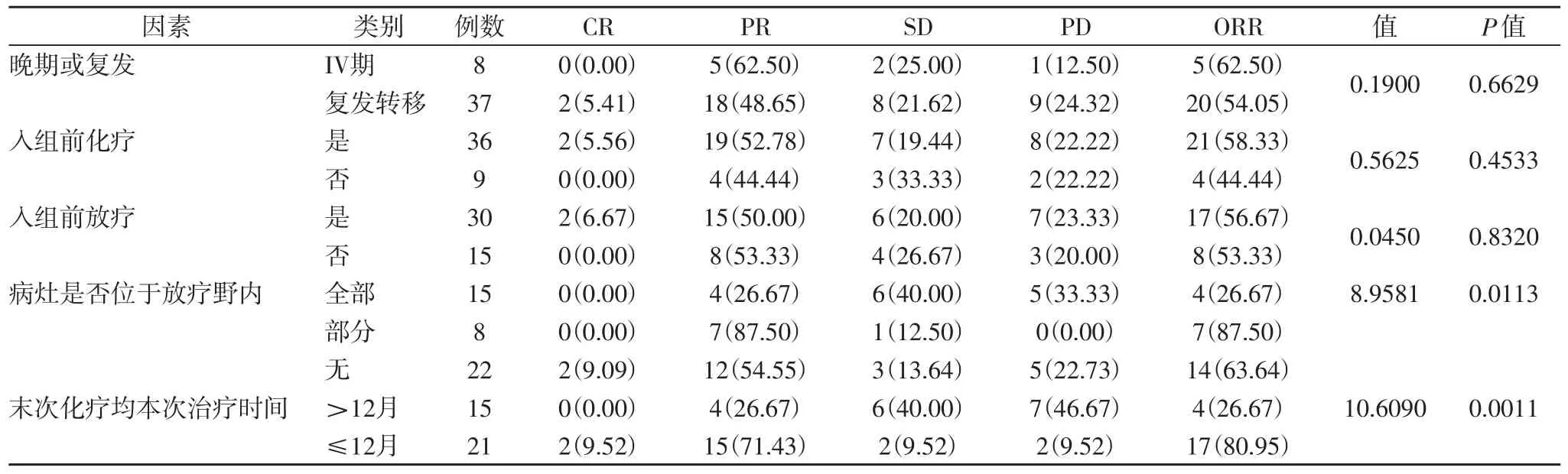
表1 本组患者近期临床疗效及影响因素分析[n(%)]
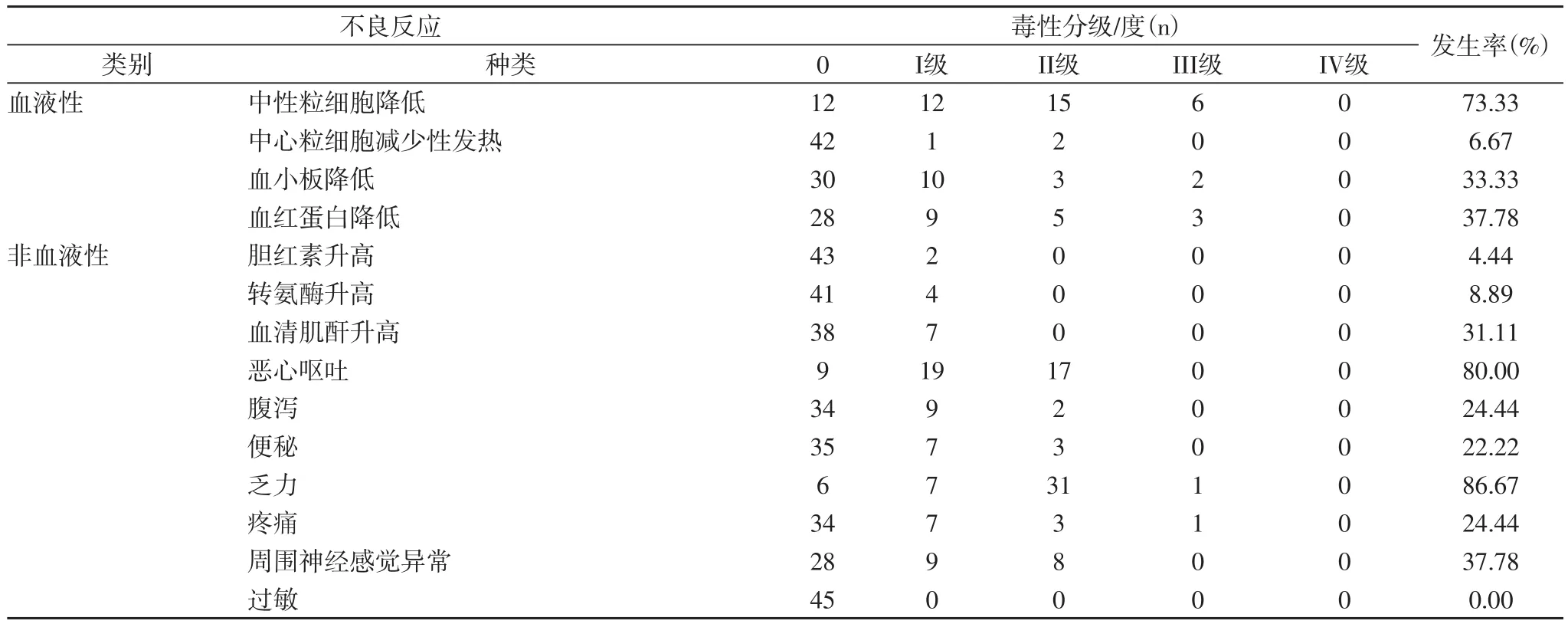
表2 本组患者化疗毒性反应情况及严重程度分析
表3 本组患者PFS和OS影响因素分析(±s,月)
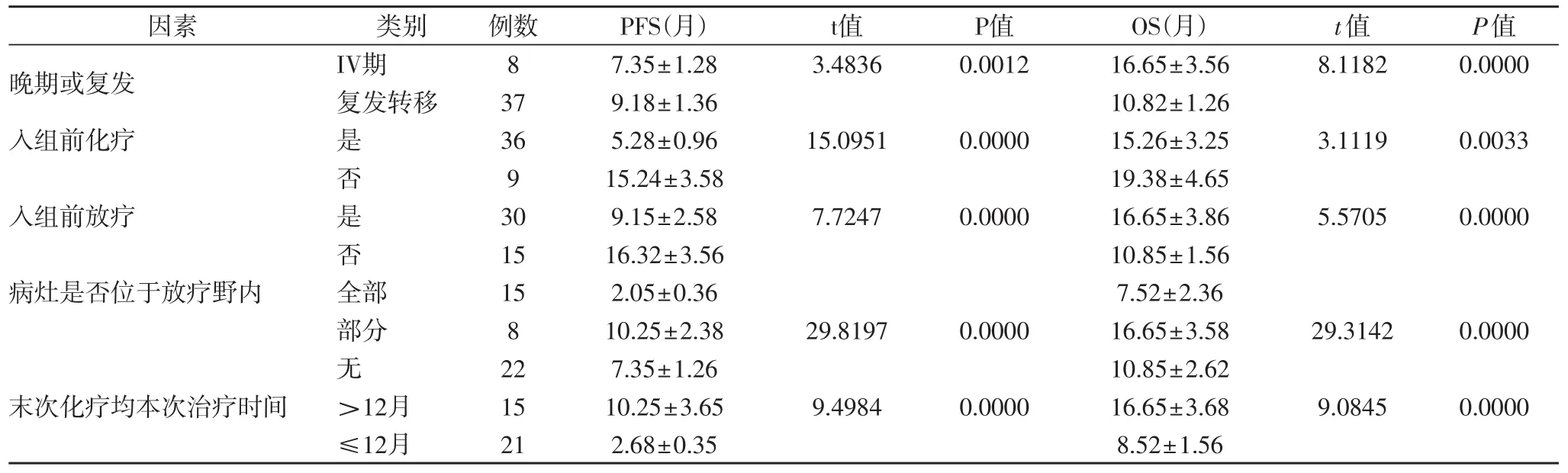
表3 本组患者PFS和OS影响因素分析(±s,月)
晚期或复发 IV期 8 7.35±1.28 3.4836 0.0012 16.65±3.56 8.1182 0.0000复发转移 37 9.18±1.36 10.82±1.26入组前化疗 是 36 5.28±0.96 15.0951 0.0000 15.26±3.25 3.1119 0.0033否9 15.24±3.58 19.38±4.65入组前放疗 是 30 9.15±2.58 7.7247 0.0000 16.65±3.86 5.5705 0.0000否15 16.32±3.56 10.85±1.56病灶是否位于放疗野内 全部 15 2.05±0.36 7.52±2.36部分 8 10.25±2.38 29.8197 0.0000 16.65±3.58 29.3142 0.0000无22 7.35±1.26 10.85±2.62末次化疗均本次治疗时间 >12月 15 10.25±3.65 9.4984 0.0000 16.65±3.68 9.0845 0.0000≤12月 21 2.68±0.35 8.52±1.56
3 讨论
宫颈癌作为女性一种常见恶性肿瘤,发病率逐年增高且呈年轻化,对于晚期宫颈癌患者采用根治性手术或同期放化疗治疗效果及预后效果尚未达到理想状态,故探索更为有效且耐受力较高的治疗方式来改善宫颈癌的疗效和预后是目前广大学者和专家致力研究的方向,引起广大临床医师和患者高度关注和重视。静脉化疗在晚期、转移性宫颈癌治疗中取得了良好的效果,具有极其重要的临床价值和意义。
紫杉醇属于紫杉烷类抗癌药物,对乳腺癌、非小细胞肺癌、卵巢癌等恶性肿瘤方面均具有良好的治疗效果,被广泛应用于恶性肿瘤临床治疗中[10]。目前临床上新型的紫衫醇为紫衫醇脂质体和白蛋白结合型紫杉醇,紫杉醇脂质体以脂质体为载体,实用卵磷脂等材料包裹紫杉醇,可促进微管聚合并稳定微管结构,进而诱导肿瘤细胞凋亡[11],不再使用聚氧乙基带蓖麻油和无水乙醇的混合溶媒,攻克了紫杉醇不溶于水的难关,避免因其诱发的毒性和过敏反应,多项研究均证实其具有低毒性和长效性[12],但对于复发性妇科肿瘤有效率较低,尚不能满足患者需求。白蛋白结合型紫杉醇为一种新型的细胞毒类抗癌药物,其应用纳米技术将紫杉醇和人血白蛋白形成直径约130nm颗粒,再结合纳米微粒蛋白结合技术平台和肿瘤摄取营养的生物机制,增加肿瘤间质中紫杉醇的浓度,药代动力学呈线性[13],将更多抗癌药物靶向性聚集到肿瘤病灶,进一步提高其抗肿瘤活性[14],无需使用助溶剂,在临床用药前无需应用抗组胺和类固醇药物进行过敏预处理,静脉滴注时间短(仅30min),疗效及安全性相对较高,逐渐被证实是治疗铂类敏感的晚期、复发转移性恶性肿瘤的有效药物之一[15]。Socinski MA等[16]报道单纯应用白蛋白型紫杉醇对复发或转移性中晚期宫颈癌患者PR仅达28.6%,尚不能达到预期的治疗效果及患者治疗需求。GOG169号和GOG179号研究证实顺铂联合紫杉醇化疗方案对复发和转移宫颈癌治疗有效,对局部晚期宫颈癌疗效显著[17]。Hisamatsu T等[18]采用紫杉醇联合卡铂治疗晚期或者复发宫颈癌,结果发现反应良好,中位生存期为14月,均证实紫杉醇联合铂类化疗方案在妇科肿瘤治疗中具有极其重要的地位[19]。
奈达铂作为新型铂类抗肿瘤药物其结构和抗肿瘤机制和顺铂极其相似,但其应用时无需水化,且水溶性明显增强,代谢产物的排泄率亦明显提高,进一步减轻或减少患者胃肠道毒副反应、细胞毒性以及肾毒性[20]。单纯应用奈达铂治疗宫颈癌有效率明显高于顺铂,对于晚期或/和复发转移性宫颈癌患者因肿瘤压迫乃至浸润输尿管可损伤肾功能,故奈达铂对可能潜在肾功能不全晚期或复发转移性宫颈癌患者较顺铂、卡铂等铂类抗肿瘤药物更具优势。Yin M等[21]对比奈达铂+紫杉醇和顺铂+紫杉醇治疗宫颈癌发现奈达铂+紫杉醇整体有效率和5年无病生存率均明显较高。本次研究选择晚期或/和复发转移性宫颈癌患者予以白蛋白型紫杉醇+奈达铂化疗方案,在设定白蛋白结合型紫杉醇剂量时考虑到中国人体质和欧美人体质差异仍采用标准剂量(175mg/m2),结果发现CR为4.44%,PR为51.11%,ORR为 55.55%,此结果和较姬时宇等[22]报道等白蛋白型紫杉醇治疗晚期宫颈癌2周期后ORR达69.6%,可能和本项研究选择病例中含复发转移者和样本量大小等因素有关,尚需进一步验证。复发转移者、入组前接受化疗和放疗、部分或者无病灶位于放疗野内、末次化疗至本次化疗时间≤12月患者ORR明显较高,但仅按病灶在放射野内分布情况和末次化疗至本次化疗时间分析ORR具有统计学意义,可能和入组病例较少及疗程较短等因素相关,再次证实白蛋白型紫杉醇联合奈达铂治疗晚期、复发转移性宫颈癌有效,但受病灶是否位于放疗野内和末次化疗至本次化疗时间等因素影响,故在临床治疗过程中要充分考虑患者综合情况,制定最佳的治疗方案,进而提高临床治疗效果。同时本次研究发现白蛋白型紫杉醇联合奈达铂方案主要毒性反应主要表现为骨髓抑制(中性粒细胞降低、血小板减少、血红蛋白降低)、胃肠道反应、周围神经感觉异常、肝肾功损害均较轻微,III级毒性反应率仅28.89%,无IV级毒性反应发生,经对症处理后痊愈不会影响后续治疗。另外,本次研究对患者均进行随访,PFS 9.15±1.36月,OS 16.65±3.28月,此结果和Kitagawa等[23]报道有所提高,同时分析其影响因素发现主要和复发转移、入组前放化疗、病灶位于放疗野情况、末次化疗距本次化疗时间相关,此结果Takekuma等[24]报道基本一致。
综上所述,白蛋白结合型紫杉醇联合奈达铂治疗晚期、复发转移性宫颈癌疗效显著,安全性高,预后良好,但在制定临床防治方案时要充分考虑患者是否为晚期或复发转移、是否接受放化疗、病灶是否位于放疗野、末次化疗距本次化疗时间间隔等情况,选择最佳的治疗方案进一步改善患者预后。
[1] 陈琪, 张虹. 新辅助化疗在宫颈癌治疗中的作用[J]. 国际妇产科学杂志, 2014, 41(6): 606-609.
[2] 甘露, 魏明, 寻倩. 宫颈癌的靶向药物治疗研究进展[J]. 国外医药抗生素分册, 2015, 36(4): 154-156.
[3] 杨莉, 程玺. 宫颈癌分子靶向治疗的研究进展[J]. 中国癌症杂志, 2015, 25(1): 73-80.
[4] 解李丽, 杨同江, 张翠平, 等. 白蛋白结合型紫杉醇的临床研究进展[J]. 药学研究, 2014, 33(5): 289-291.
[5] Von Hoff DD, Ervin T, Arena FP, et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine[J]. N Engl J Med, 2013, 369(18): 1691-1703.
[6] 张彬玉, 姜晓春, 张琳琳, 等. 奈达铂的临床应用新进展[J]. 现代生物医学进展, 2014, 14(23): 2569-2572.
[7] Jang HJ, Kim BC, Kim HS, et al. Comparison of RECIST1.0 and RECIST 1.1 on computed tomography in patients with metastatic colorectal cancer[J]. Oncology, 2014, 86(2): 117-121.
[8] NCI. Cancer therapy evaluation program, common terminology criteria for adverse events v3.0(CTCAE)[J]. Cancer, 2003, 1022: 1216.
[9] 刘太圣. 白蛋白结合型紫杉醇与紫杉醇脂质体治疗复发性卵巢癌近期疗效及对Twist蛋白和血管内皮生长因子表达的影响[J]. 中国医学前言杂志(电子版), 2015, 7(6): 168-171.
[10] Kraft JC, Freeling JP, Wang Z, et al. Emerging research and clinical development trends of liposome and lipid nanoparticle drug delivery systems[J]. J Phaem Sci, 2014, 103(1): 29-52.
[11] 程海荣, 关慧, 陈杰. 白蛋白结合型紫杉醇与紫杉醇脂质体治疗复发性卵巢癌近期疗效及安全性分析[J]. 实用妇产科杂志, 2015, 31(3): 229-232.
[12] Baruah U, Barmon D, Hazarika M, et al. Continuous low-dose oralchemotherapy in recurrent and persistent carcinoma of cervix following chemoradiation: a comparative study between prolonged oralcyclophosphamide and oral Etoposide[J]. Indian J Palliat Care, 2014, 20: 208-211.
[13] Hosein PJ, De Lima Lopes G Jr, Pastorini VH, et al. A phase II trial of nab-Paclitaxel as second-line therapy in patients with advanced pancreatic cancer[J]. Am J Clin Oncol, 2013, 36(2): 151-156.
[14] Neesse A, Frese KK, Chan DS, et al. SPARC independent drug delivery and antiumour effects of nab-paclitaxel in genetically engineered mice[J]. Gut, 2014, 63(6): 974-983.
[15] SEIDMAN A D, CONLIN A K, BACH A, et al. Randomized phase II trial of weekly vs every 2 weeks vs every 3 weeks nanoparticle albuminbound paclitaxel with bevacizumab as frist-line chemotherapy for metastatic breast cancer[J]. Clin Breast Cancer, 2013, 13(4): 239-246.
[16] Socinski MA, Bondarenko I, Karaseva NA, et al. Weekly nab-paclitaxel in combination with carboplatin versus solvent-based paclitaxel plus carboplatin as frist-line therapy in patients with advabced non-smallcell lung cancer: final results of a phase III trial[J]. J Clin Oncol, 2012, 30(17): 2055-2062.
[17] Chase DM, Huang HQ, Wenzel L, et al. Quality of life and survival in advanced cervical cancer: a Gynecologic Oncology Group study[J]. Gynecol Oncol, 2012, 125(2): 315.
[18] Hisamatsu T, Mabuchi S, Yoshino K, et al. Prediction of progressionfree survival and response to paclitaxel plus carboplatin in patients with recurrent or advanced cervical cancer[J]. Int J Gynecological Cancer, 2012, 22(4): 623.
[19] Yardley DA, Hart L, Bosserman L, et al. Phase II study evaluating lapatinib in combination with nab-paclitaxel in HER2-overexpressing metastatic breast cancer patients who have received no more than one prior chemotherapeutic regimen[J]. Breast Cancer Res Treat, 2013, 137(2): 457-461.
[20] 张彬玉, 姜晓春, 张琳琳, 等. 奈达铂的临床应用新进展[J]. 现代生物医学进展, 2014, 14(13): 2569-2572.
[21] Yin M, zhang H, Li X, et al. The toxicity and long-term efficacy of nadaplatin and paclitaxel treatment as neoadjuvant chemotherapy for locally advanced cervical cancer[J]. Journal of Surgical Oncology, 2012, 105(2): 206.
[22] 姬时宇, 胡毅. 白蛋白结合型紫杉醇治疗晚期宫颈癌的效果及安全性[J]. 中国医药导报, 2016, 13(12): 101-103.
[23] Kitagawa R, et al. Amulti-institutional phase II trial of paclitaxel and carboplatin in the treatment of advanced or recurrent cervical cancer[J]. Gynecologic oncology, 2012, 125(2): 307-311.
[24] Takekuma M, et al. Phase II trial of paclitaxel and nedaplatin in patients with advanced/recurrent uterine cervical cancer: a Kansai Clinical Oncology Group study[J]. Gynecology Oncology, 2012, 126(3): 341-345.
Clinical short-term and long-term efficacy and safety of nanoparticle albumin-bound paclitaxel combined with nedaplatin chemotherapy in treatment of advanced and recurrent and metastatic cervical cancer
Yao Wei
(Ying kou City Matet mity and Child Hospital, Yingkou 115000, China)
Objective Observation of nanoparticle albumin-bound paclitaxel combined with nedaplatin cisplatin in treatment of advanced and recurrent metastasis of cervical cancer in clinical efficacy, safety and prognosis are analyzed, and the factors that affect the clinical efficacy and prognosis. Methods Prospective selection 45 cases of cervical cancer patients during January in 2014 to January in 2016, 8 cases of IV phase; 37 cases of recurrence and metastasis, Were treated with nanoparticle albumin-bound paclitaxeland nedaplatin chemotherapy, to observe the curative effect, adverse reaction and prognosis. Results CR was 4.44%, PR was 51.11%, ORR was 55.55%. The lesions were located in radiation fields(in whole or in part, without)and the last chemotherapy time range the treatment time(> 12 months and less than or equal to 12 months)clinical efficacy difference has statistical significance; Grade III toxicities rate 28.89%, for the inhibition of bone marrow, vestiges of reactions were slight, which were mild; PFS 9.15 ±1.36 months, OS 16.65 ± 3.28 months, Prognostic factors for advanced and recurrent metastases, chemotherapy before entry into the group, lesions located in the field of radiotherapy and chemotherapy at the end of the interval between the chemotherapy interval. Conclusion Nanoparticle albumin-bound paclitaxelcombined with nedaplatin in the treatment of advanced and recurrent metastasis cervical cancer, Significant effect, high safety, good prognosis, but the need to fully consider the factors affecting the prognosis.
nanoparticle albumin-bound paclitaxel; nedaplatin; cervical cancer; efficacy; safety; prognosis
R737.33
A
1673-016X(2017)01-0084-05
2016-11-18
姚威,E-mail:yyp201206@126.com
