黑虎掌菌粗多糖制备及体外抗氧化活性研究
2017-04-07徐盼菊孟凡欣唐萌马虹宇李月和申斯乐
徐盼菊,孟凡欣,唐萌,马虹宇,李月和,申斯乐*
黑虎掌菌粗多糖制备及体外抗氧化活性研究
徐盼菊1,2,孟凡欣1,2,唐萌1,2,马虹宇1,李月和1,申斯乐1,2*
(1.吉林大学珠海学院,广东珠海519041;2.吉林大学生命科学学院,吉林长春130012)
以云南和四川黑虎掌菌子实体为原料,热水浸提黑虎掌菌子实体粗多糖,并采用响应面法优化提取工艺。结果表明,云南黑虎掌菌粗多糖(YSP)的最佳提取条件为提取时间3.1 h,提取温度91℃,水料比60∶1(mL∶g),多糖得率16.75%;四川黑虎掌菌粗多糖(SSP)的最佳提取条件为提取时间3.1 h,提取温度93℃,水料比58:1(mL:g),多糖得率13.93%。以YSP和SSP为实验样品,VC为阳性对照,羟基自由基、DPPH自由基以及超氧阴离子自由基清除率为检测指标,评价YSP与SSP的体外抗氧化活性。结果表明:SSP的羟基、DPPH及超氧阴离子自由基最高清除率分别为86.14%、71.78%和99.98%,均高于对应的YSP清除率76.54%、58.52%和99.93%,且其超氧阴离子自由基清除率均高于VC,但羟基自由基和DPPH自由基清除率均低于VC。
黑虎掌菌;响应面法;粗多糖;抗氧化活性
机体通过酶系统或者非酶系统产生氧自由基,而氧自由基可以攻击生物膜中的多不饱和脂肪酸(polyunsaturated fatty acid,PUFA),引发的脂质过氧化作用,并形成脂质过氧化物,如丙二醛(malondialdehyde,MDA)、酮基、羟基、过氧化物,以及新的氧自由基等。这些脂质过氧化物可以引起细胞损伤,引发各种疾病,包括帕金森氏病和阿尔茨海默氏病等[1-2]。抗氧化剂减少氧自由基产生已被证明是针对由脂质过氧化引发的细胞损伤的最佳治疗手段。然而,如今最常用的抗氧化剂大多是化学合成的,存在肝损伤以及引发癌症的安全隐患[3]。因此,寻找安全高效的抗氧化剂显得尤为重要。近几年来,随着人们对药用真菌越来越多的关注与认识,越来越多的研究发现药用真菌具有安全、无副作用,以及多种生物活性,如增强免疫力、抗肿瘤、抗凝血剂、抗炎、抗病毒等特点,是绝佳的调节机体、治疗疾病的天然药物[4]。
黑虎掌菌最早发现于日本,我国首先发现于云南景东,是一种著名的药用真菌,且在中国传统医学中,它作为重要的抗肿瘤、抗氧化以及提高免疫力药物已经被普遍应用[5-7]。本研究探究了四川与云南两产地黑虎掌菌粗多糖的提取工艺,主要涉及其提取时间、温度及不同水料比对其水溶性粗多糖得率的影响,并利用响应面法(response surface methodology,RSM)建立水溶性粗多糖得率与相关提取因素之间的回归模型,进行提取条件优化。此外,对两产地黑虎掌菌粗多糖体外抗氧化活性进行检测与比较,包括1,1-二苯-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl hydrazyl,DPPH)自由基、羟基自由基及超氧化物阴离子自由基清除率。研究结果可为选取黑虎掌菌资源及其体内抗氧化、抗肿瘤和增强免疫力研究奠定理论与实验基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
黑虎掌菌子实体干品:四川和云南市售。
1.1.2 试剂
无水葡萄糖对照品:上海源叶生物科技有限公司;蒽酮(分析纯):上海源叶生物科技有限公司;无水乙醇(分析纯):天津市大茂化学试剂厂;浓硫酸(分析纯):广州市东红化工厂;DPPH:上海源叶生物科技有限公司。
1.2 仪器与设备
752-P型紫外可见分光光度计:上海现科仪器有限公司;RE5298A型旋转蒸发器:上海亚荣生化仪器厂;HH-4型数显恒温水浴锅:江苏省金坛市荣华仪器制造有限公司;AR224CN型电子天平:奥豪斯仪器(上海)有限公司制造;Boxun型干燥箱:上海慧箭电子科技有限公司。
1.3 方法
1.3.1 多糖提取纯化
(1)热水浸提
取黑虎掌菌子实体,烘干至质量恒定,用粉碎机粉碎(过65目筛),准确称取0.5 g,按预先设定水料比加入蒸馏水,充分溶解混匀,放入恒定温度的水浴锅中热水浸提,到预定提取时间后,取出冷却,离心机离心(4 000 r/min,20 min)取上清液。
(2)多糖醇沉
取上述提取上清液,加入3倍体积的无水乙醇溶液,充分振荡混匀30 min,4℃冰箱静置过夜,离心去上清,沉淀冷冻干燥,得到粗多糖干品。
1.3.2 多糖含量测定
蒽酮-浓硫酸法测定多糖含量(蒽酮试剂:精密称取0.1 g蒽酮,加80%浓H2SO4100 mL使溶解,摇匀。当日配制使用)。
(1)葡萄糖标准曲线制作
精密称取无水葡萄糖对照品10 mg,用蒸馏水定容至10 mL;取7支具塞试管,按15 μg/mL、30 μg/mL、45 μg/mL、60 μg/mL、75 μg/mL、90 μg/mL精密配制一系列不同质量浓度的葡萄糖标准溶液,取上述各质量浓度溶液2 mL于干燥洁净试管中,在每支试管中立即加入蒽酮试剂6 mL,振荡混匀,置于沸水浴中加热15 min。取出,迅速浸于冰水浴中冷却15 min。以第1管为空白,在波长625 nm处测定其余各管吸光度值,每个浓度做3个重复。以标准葡萄糖含量(x)为横坐标,以吸光度值(y)为纵坐标,绘制葡萄糖标准曲线。
(2)样品含量测定
精确吸取2 mL样品多糖溶液置于干燥洁净试管中,加入蒽酮试剂6 mL,振荡混匀,置于沸水浴中加热15 min。取出,迅速浸于冰水浴中冷却15min,3个重复取平均值。在波长625 nm处迅速测定各管吸光度值。根据葡萄糖含量的标准曲线,由样品溶液吸光度值计算各样品溶液中糖的质量浓度,并计算多糖得率,其计算公式如下:

1.3.3 单因素试验[8-9]
(1)水料比对多糖得率的影响
利用不同水料比热水浸提黑虎掌菌粗多糖,水料比取值范围为20∶1~100∶1(mL∶g),提取温度为90℃,提取时间2 h,计算黑虎掌菌粗多糖得率。
(2)提取时间对多糖得率的影响
利用不同提取时间热水浸提黑虎掌菌粗多糖,提取时间(h)取值范围为1~4 h,提取温度为90℃,水料比为60∶1(mL∶g),计算黑虎掌菌粗多糖得率。
(3)提取温度对多糖得率的影响
利用不同的提取温度热水浸提黑虎掌菌多糖,提取温度(℃)取值范围为60~100℃,水料比为60∶1(mL∶g),提取时间为3 h,计算黑虎掌菌粗多糖得率。
1.3.4 Box-Behnken设计
利用Design-Expert7.0软件进行Box-Behnken设计,通过建立二次多项式模型确定最佳条件和最优得率,并进行验证试验[10]。
1.3.5 抗氧化活性测定
(1)DPPH自由基清除率测定[11-12]
制备不同质量浓度(0.01~0.50g/L)的黑虎掌菌多糖溶液,分别移取各样品溶液样品2 mL,再与2 mL 0.1 mmoL/L DPPH溶液混合,振荡,在温室下避光放置30 min,然后在波长517nm处测定吸光度值。以维生素C(vitaminC,VC)作为阳性对照,且用无水乙醇调零。DPPH自由基清除率计算公式如下:

式中:Ac为对照组吸光值,即2 mL蒸馏水加2 mL 0.1mmol/L DPPH溶液;Ai为样品组吸光值,即2 mL样品液加2 mL 0.1 mmol/L DPPH溶液;Aj为空白组吸光度值,即2 mL样品液加2 mL无水乙醇。
(2)羟基自由基清除率测定
采用邻二氮菲比色法,以VC作为阳性对照。取1 mL 0.75 mmol/L邻二氮菲的无水乙醇溶液加入2 mL 0.2 mol/L的磷酸盐缓冲液(pH=7.4)和1mL去离子水。充分混均后加入1 mL 0.75 mmol/L的FeSO4,混匀再加入1 mL0.01%(v/v)的H2O2。37℃水浴1 h后,在波长536 nm处测定其吸光度值为A1。以1 mL去离子水取代损伤管中的H2O2,设为对照管,重复上述步骤,测A2。1 mL样品液代替损伤管中的去离子水,设为样品管,测其吸光度值A3。取2 mL0.2 mol/L的磷酸缓冲液(pH=7.4)和1 mL样品液混合,加入3 mL去离子水,设为样品参比,测其吸光度值A4。羟基自由基清除率计算公式如下:
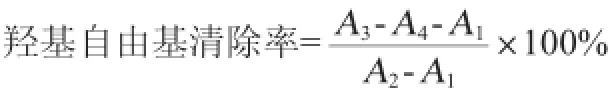
(3)超氧阴离子自由基清除率测定[13-14]
取pH=8.2 0.05 mol/L的Tris-HCl缓冲液4.6 mL于试管中,置25℃水浴预热20 min后,加不同浓度(0.01~5 g/L)的样品液1 mL,10 mmol/L邻苯三酚0.4 mL,混匀后25℃水浴4 min,立即用浓盐酸0.1 moL终止反应。以pH=8.2的Tris-HCl缓冲液调零点,并在波长325 nm处测定吸光度值,记为A。用水1mL取代样品液,设为模型对照组,测定的吸光度值记为A0。样品参比组为用0.4 mLTris-HCl缓冲液代替10 mmoL/L邻苯三酚,测定吸光度值记为A1。超氧阴离子自由基清除率计算公式如下:
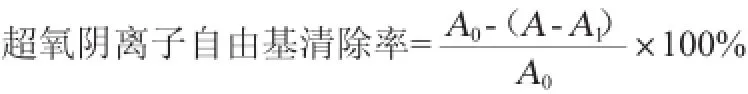
1.3.6 数据处理
每个实验都进行三次重复,实验数据均以平均值±标准差表示。采用Design-Expert7.0软件进行数据分析、统计及作图。
2 结果与分析
2.1 葡萄糖标准曲线
葡萄糖标准曲线与标准方程结果见图1。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
由图1可得,葡萄糖标准曲线方程为:y=0.008x+0.0054,其相关系数R2=0.9986,且在葡萄糖质量浓度为0~90μg/mL范围内二者线性关系良好。
2.2 单因素试验
2.2.1 水料比对黑虎掌菌多糖得率的影响
水料比对热水浸提黑虎掌菌提取多糖得率的影响见图2。由图2可知,当水料比由20∶1(mL∶g)增加到60∶1(mL∶g)后,云南黑虎掌菌多糖得率由12.28%增加到13.53%,而四川黑虎掌菌多糖得率由11.18%增加到12.58%,且之后随着水料比的增加其多糖得率均无明显变化。因此,确定黑虎掌菌粗多糖得率的最佳水料比为60∶1(mL∶g)。

图2 水料比对热水浸提黑虎掌菌粗多糖得率的影响Fig.2 Effect of water to material ratio on crude polysaccharides yield fromS.imbricatus
2.2.2 提取时间对多糖得率的影响
提取时间对热水浸提黑虎掌菌提取多糖得率的影响见图3。由图3可知,当提取时间由1 h增加到3 h后,云南黑虎掌菌多糖得率由12.83%增加到14.33%;四川黑虎掌菌多糖得率由11.23%增加到13.88%,且之后随着提取时间的增加其黑虎掌菌多糖的得率均减小。因此,黑虎掌菌多糖最佳提取时间为3.0 h。

图3 提取时间对热水浸提黑虎掌菌粗多糖得率的影响Fig.3 Effect of extraction time on crude polysaccharides yield fromS.imbricatus
2.2.3 提取温度对多糖得率的影响

图4 提取温度对热水浸提黑虎掌菌粗多糖得率的影响Fig.4 Effect of extraction temperature on crude polysaccharides yield fromS.imbricatus
提取温度对热水浸提黑虎掌菌提取多糖得率的影响见图4。由图4可知,当提取温度由60℃增加到90℃后,云南黑虎掌菌多糖得率由14.33%增加到15.38%;四川黑虎掌菌多糖得率由12.13%增加13.48%,且之后随着提取温度的增加其黑虎掌菌多糖的得率均减小。因此,黑虎掌菌多糖最佳提取温度为90℃。
2.3 Box-Behnken设计[15-16]
根据Box-Benhnken的中心组合试验设计原理,综合单因素试验结果,提取温度、提取时间和水料比为热水浸提黑虎掌菌多糖得率的三个主要影响因素,分别以X1、X2和X3代表,每一个自变量(即3个影响因素)的低、中、高实验水平分别以-1、0、1进行编码(结果见表1)。以黑虎掌菌多糖得率为响应值(Y),云南和四川的黑虎掌菌多糖提取试验方案及结果分别见表2和表3。

表1 Box-Behnken试验因素水平及编码Table 1 Factors and levels of Box-Behnken experiments

表2 云南黑虎掌菌粗多糖提取条件优化Box-Behnken试验设计及结果Table 2 Design and results of Box-Behnken experiments for YSP extraction conditions optimization
利用软件Design-Export7.0对表2与表3的试验结果进行二次多项回归拟合,得到黑虎掌菌多糖得率对提取温度(X1)、提取时间(X2)、水料比(X3)的二次多项回归模型分别为:
云南黑虎掌菌:Y=+16.82+0.19X1+0.31X2+0.11X3-0.15X1X2-0.27X1X3-0.17X2X3-0.74X12-1.64X22-0.96X32
四川黑虎掌菌:Y=+13.93+0.16X1+0.14X2-0.11X3-0.05X1X2+0.025X1X3-0.037X2X3-0.23X12-0.24X22-0.29X32
2.4 Box-Benhnken试验方差分析
对不同地区黑虎掌菌Box-Benhnken试验的模型进行方差分析,结果如表4、表5所示。

表4 Box-Behnken设计云南黑虎掌菌多糖得率方差分析结果Table 4 Variance analysis results of Box-Behnken experiments for YSP yield
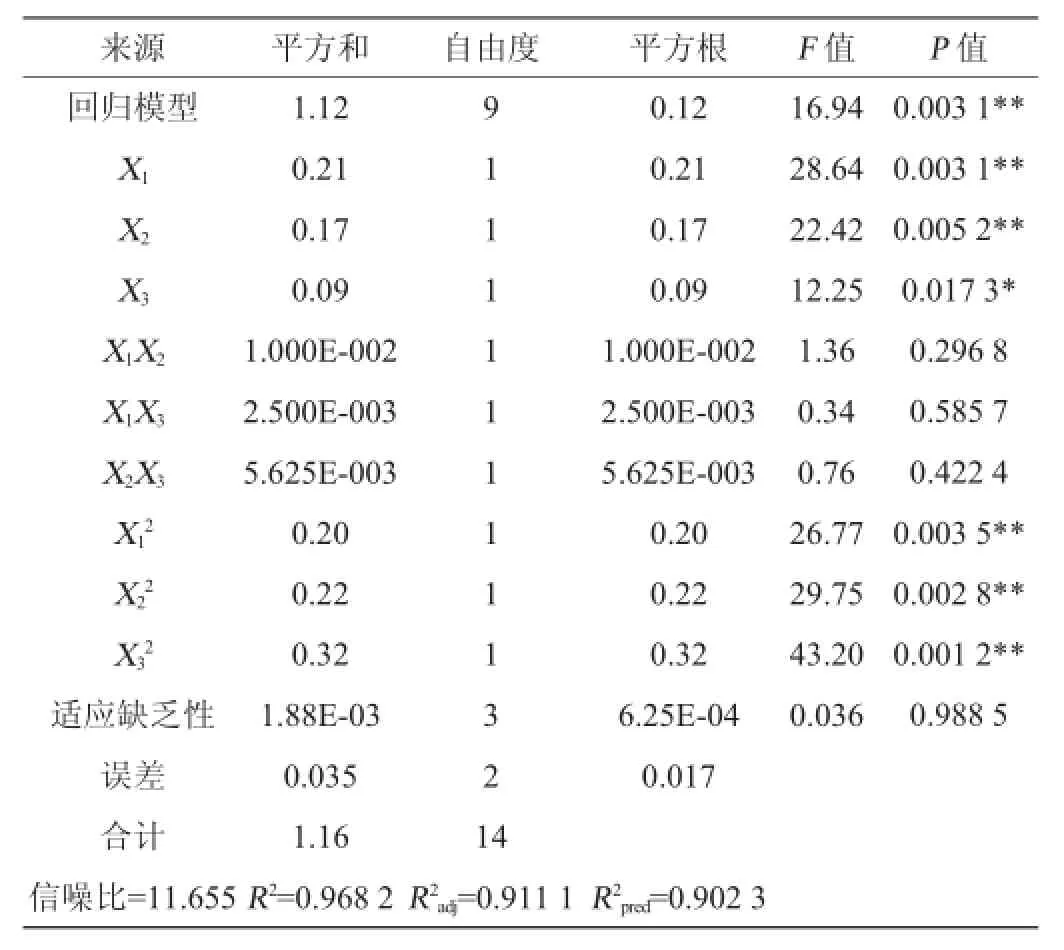
表5 Box-Behnken设计四川黑虎掌菌多糖得率方差分析结果Table 5 Variance analysis results of Box-Behnken experiments for SSP yield
由表4、5可知,回归方差分析显著性检验表明此两个模型回归极显著(P云南=0.001 1<0.01;P四川=0.003 1<0.01),其中提取温度、时间以及温度与时间之间的交互作用对云南黑虎掌菌粗多糖得率有显著的影响(P<0.05);而对于四川多糖得率,提取温度、时间以及水料比表现出显著的影响(P<0.05),且两个模型的决定系数R2云=0.979 1;R2四= 0.968 2,说明该模型与实际试验拟合较好,自变量与响应值之间线性关系显著,调整决定系数R2adj云=0.941 5;R2adj四= 0.911 1,说明该模型能解释94.15%云南黑虎掌以及91.11%四川黑虎掌菌响应值的变化,拟合程度良好,误差较小。以上结果表明,采用响应曲面法进行的优化试验所得回归方程模型可以用来分析预测虎掌菌多糖提取工艺结果。
2.4 响应曲面分析
各因素交互作用对云南和四川黑虎掌菌多糖得率影响的响应面和等高线结果见图5和图6。通过软件分析,得到云南黑虎掌菌粗多糖提取的最佳条件为时间3.09 h,提取温度91.12℃,水料比为60.33∶1(mL∶g),且在此条件下云南黑虎掌菌粗多糖得率理论值可达16.85%;四川黑虎掌菌粗多糖提取的最佳条件为时间3.14 h,提取温度93.11℃,水料比为58.15∶1(mL∶g),在此条件下四川黑虎掌菌粗多糖得率理论值可达13.99%。为验证此优化方案,根据实际操作条件,选择云南黑虎掌菌的提取时间为3.1 h,提取温度为91℃,水料比为60∶1(mL∶g);四川黑虎掌菌选择条件为提取时间为3.1 h,提取温度为93℃,水料比为58∶1(mL∶g)。在各最适条件下,云南黑虎掌菌的多糖得率为16.75%;四川黑虎掌菌为13.93%,因此采用Box-Behneken优化得到的水提取云南黑虎掌菌粗多糖条件参数准确可靠,具有实用价值。

图5 提取温度、时间、水料比交互作用对云南黑虎掌菌多糖得率影响的响应面和等高线Fig.5 Response surface plots and contour line of effects of interaction between extraction temperature,time,and liquid to solid ratio on YSP yield

图6 提取温度、时间、水料比交互作用对四川黑虎掌菌多糖得率影响的响应面和等高线Fig.6 Response surface plots and contour line of effects of interaction between extraction temperature,time,and liquid to solid ratio on SSP yield
2.5 抗氧化试验结果
不同地区的黑虎掌菌多糖以及VC对DPPH自由基、超氧阴离子自由基以及羟基自由基的影响见图7。由图7可知,黑虎掌菌粗多糖对DPPH自由基、超氧阴离子自由基以及羟基自由基清除率均表现出一种浓度依赖性,并在一定的浓度范围内,随着浓度的增加,其清除率不断升高。其中四川黑虎掌菌粗多糖对DPPH自由基、超氧阴离子自由基以及羟基自由基的最高清除率分别为86.14%、71.78%和99.98%,均高于对应的同浓度下云南黑虎掌菌多糖的清除率76.54%、58.52%和99.93%,且两产地粗多糖的羟基自由基最高清除率均高于VC,但是两产地黑虎掌菌粗多糖的DPPH自由基和超氧阴离子自由基最高清除率均低于VC。
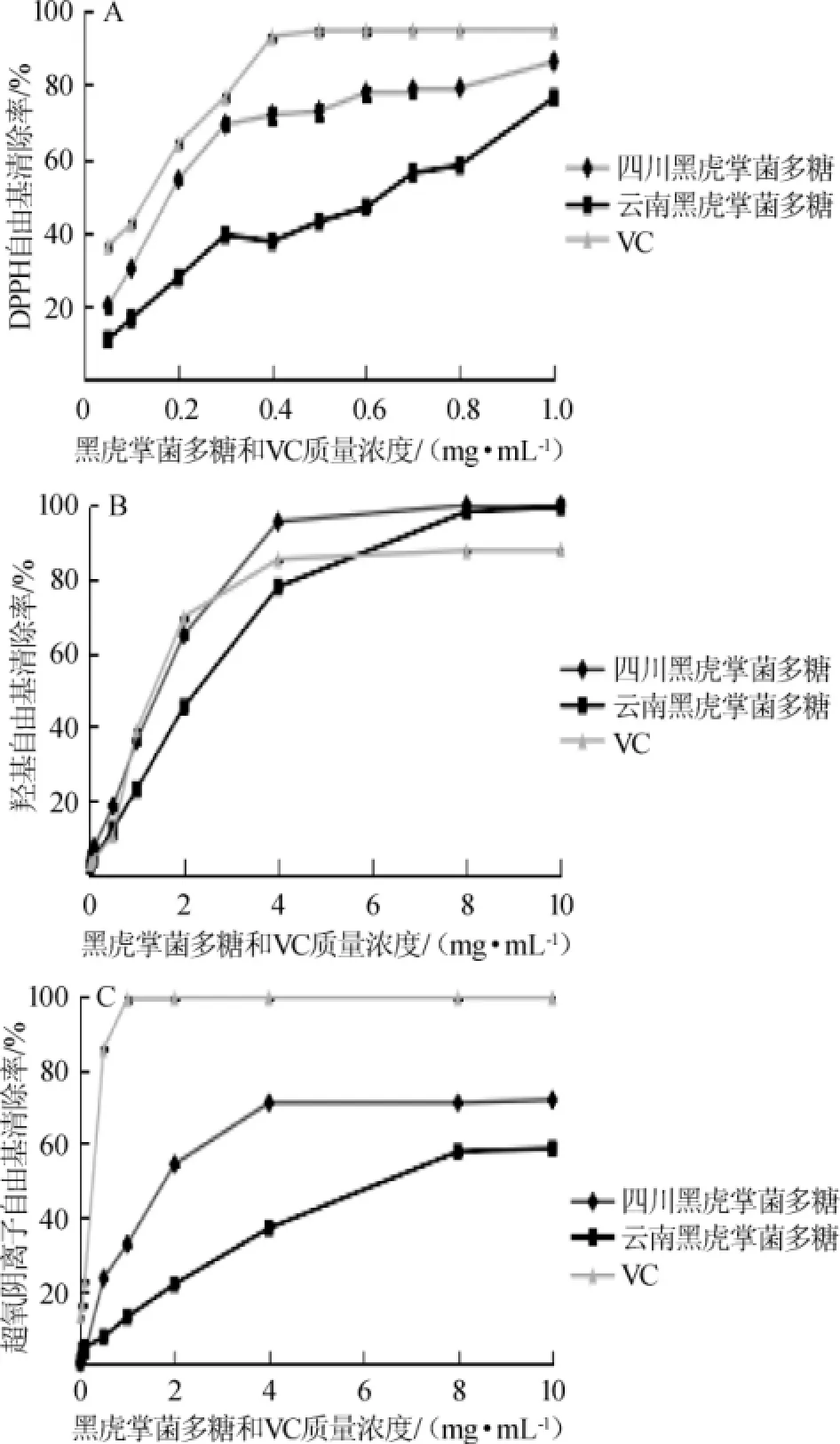
图7 黑虎掌菌粗多糖/VC对DPPH自由基(A)、羟基自由基(B)及超氧阴离子自由基(C)清除率Fig.7 Scavenging rate ofSarcodon imbricatuscrude polysaccharide and VC on DPPH free radical(A)hydroxyl free radical(B) superoxide anion free radical(C)
3 结论
本研究采用经响应面法优化黑虎掌菌子实体粗多糖热水浸提工艺,筛选出一个黑虎掌菌子实体粗多糖得率较高的条件组合,云南粗多糖:提取时间为3.1 h,提取温度为91℃,水料比为60∶1(mL∶g),经验证试验得到多糖得率为16.75%;四川粗多糖:提取时间为3.1 h,提取温度为93℃,水料比为58∶1(mL∶g),经验证试验得到多糖得率为13.93%。此外,体外抗氧化试验结果显示:黑虎掌菌子实体粗多糖对于DPPH自由基、超氧阴离子自由基和羟基自由基都具有较高的清除活性,是抗氧化剂的一个较好的潜在资源。本项研究为黑虎掌菌子实体多糖体内抗氧化活性及抗氧化作用机制的分析研究提供了实验和理论依据,是黑虎掌菌子实体粗多糖抗氧化、增强免疫及抗肿瘤活性研究的第一步。
[1]LIU C H,KANG J,ZHANG L.Purification and antioxidant activity of a polysaccharide from bulbs ofFritillaria ussuriensisMaxim[J].Int J Biol Macromol,2012,50(4):1075-1080.
[2]VALKO M,LEIBFRITZ D,MONCOL J,et al.Free radicals and antioxidants in normal physiological functions and human disease[J].Int J Biochem Cell Biol,2007,39(1):44-84.
[3]VALENTAO P,FERNANDES E,CARVALHO F,et al.Antioxidative propertiesofcardoon(Cynara cardunculusL.)infusion against superoxide radical,hydroxyl radical,and hypochlorous acid[J].J Agr Food Chem, 2002,50(17):4989-4993.
[4]CHOW J T N,WILLIAMSON D A,YATES K M,et al.Chemical characterization of the immunomodulating polysaccharide ofAloe veraL.[J]. Carbohyd Res,2005,340(6):1131-1142.
[5]张丙青,陈健.黑虎掌菌营养成分的测定与评价[J].食品科学,2011,32(9):299-302.
[6]徐盼菊,杨东生,孟凡欣,等.黑虎掌菌化学成分与药理作用的研究进展[J].山东医药,2015,23(55):99-101.
[7]赵雨霁,王琦.翘鳞肉齿菌化学成分和药理活性研究概况[J].食用菌学报,2014,21(3):77-82.
[8]YANG S,REN X D,SHENG J X,et al.Preparation and the antitumor activityin vitroof polysaccharides fromTricholoma matsutake[J].World J Microbiol Biotechnol,2010,26(3):497-503.
[9]顾华杰,孙燕,李良智,等.响应面法优化热水浸提灰树花多糖的工艺研究[J].食品工业科技,2013,34(19):234-243.
[10]王雪冰,赵天瑞,樊建.响应曲面法优化虎掌菌多糖提取工艺研究[J].西南大学学报:自然科学版,2011,33(7):146-151.
[11]郑义,王卫东,孙月娥,等.翘鳞肉齿菌多糖的抗氧化活性分析[J].天然产物研究与开发,2013,25(11):1582-1586.
[12]MAU J L,LIN H C,SONG S F.Antioxidant properties of several specialty mushrooms[J].Food Res Int,2002,35(6):519-526.
[13]CHEN Y,MAO W J,TAO H W,et al.Tructural characterization and antioxidant properties of an exopolysaccharide produced by the mangrove endophytic fungusAspergillussp.Y16[J].Bioresource Technonl, 2011,102(17):8179-8184.
[14]LIM H W,YOON J H,KIM Y S,et al.Free radical-scavenging and inhibition of nitric oxide production by four grades of pine mushroom (TricholomamatsutakeSing.)[J].Food Chem,2007,103(1):1337-1342.
[15]孟凡欣,吴丽艳,徐盼菊,等.甲壳素提取工艺优化及其辅助降血糖活性研究[J].食品研究与开发,2016,37(5):95-101.
[16]DU Y J,ZHAO Y Q,DAI S C,et al.Preparation of water-soluble chitosan from shrimp shell and its antibacterial activity[J].Inn Food Sci Emerg Technol,2009,10(1):103-107.
Preparation of polysaccharides fromSarcodon imbricatusand theirin vitroantioxidant activity
XU Panju1,2,MENG Fanxin1,2,TANG Meng1,2,MA Hongyu1,LI Yuehe1,SHEN Sile1,2*
(1.Zhuhai College,Jilin University,Zhuhai 519041,China;2.College of Life Science,Jilin University,Changchun 130012,China)
YunnanSarcodon imbricatuspolysaccharides(YSP)and SichuanS.imbricatuspolysaccharides(SSP)were extracted from fruit body of S.imbricatus,and the extraction process was optimized by response surface method.The optimum extraction conditions were confirmed as follows: for YSP:extraction time 3.1 h,temperature 91℃,liquid to solid ratio 60∶1(ml∶g),and the polysaccharide yield was 16.75%;For SSP:extraction time 3.1 h,temperature 93℃,liquid to solid ratio 58:1(ml∶g),and the polysaccharides yield was 13.93%.Furthermore,using YSP and SSP as experimental samples,VC as the positive control,thein vitroantioxidant activities of polysaccharides on hydroxyl free radical,DPPH free radical and superoxide anion free radical were investigated.The results showed that the highest scavenging rates of SSP to hydroxyl,DPPH and superoxide anion radicals were 86.14%,71.78%and 99.98%,respectively,which were higher than that of YSP(76.54%,58.52%and 99.93%).The superoxide anion free radical scavenging rate of both polysaccaride were higher than VC,but the DPPH free radical and hydroxyl free radical scavenging rate were lower than VC.
Sarcodon imbricatus;response surface method;crude polysaccharides;antioxidant activity
R284.1
0254-5071(2017)03-0150-06
10.11882/j.issn.0254-5071.2017.03.030
2017-01-24
徐盼菊(1990-),女,硕士研究生,研究方向为真菌活性成分药理活性。
*通讯作者:申斯乐(1963-),女,教授,博士,研究方向为分子与细胞生物学。
