慕萨莱思复配发酵剂的实验室研制
2017-04-07张佳斌王冠群陈彤国马泉朱丽霞
张佳斌,王冠群,陈彤国,马泉,朱丽霞*
(塔里木大学生命科学学院,新疆阿拉尔843300)
慕萨莱思复配发酵剂的实验室研制
张佳斌,王冠群,陈彤国,马泉,朱丽霞*
(塔里木大学生命科学学院,新疆阿拉尔843300)
针对传统慕萨莱思工艺发酵时间长、发酵过程不易控制,产品稳定性不足等缺陷,该研究对175株慕萨莱思酵母进行单株培养,初筛出具有优良香气特征的2株疑似酿酒酵母和20株非酿酒酵母,再进行不同菌株、不同比例复配,不同时序接种,微型发酵验证,获得一组复配菌N8∶F10(2∶1)。其酿制酒的降糖幅度(18°Bx)、CO2释放量(11.86 g/50 mL)、香气(2.22分)及口感(1.65分)优于商用菌株RV100,所酿制的酒残糖3.43 g/L、总酸1.97 g/L、酒精度11.66%vol,具有慕萨莱思红棕色泽、典型香气和口感特征,可作为慕萨莱思规模化生产的潜在优良发酵剂。通过WL形态和5.8-ITS鉴定,菌株N8为酿酒酵母(Saccharomyces cerevisiae),菌株F10为库德毕赤酵母(Pichia kudriavzevii)。该研究为慕萨莱思传统工艺改进及产品品质提高奠定了基础。
慕萨莱思;复配发酵剂;同步接种;香气;口感
慕萨莱思是新疆具有民族风味的传统饮品[1],具有增强人体免疫功能、降血脂、抗衰老等保健功能[2]。慕萨莱思工艺独特,将地方和田红葡萄,经过压榨取汁、浓缩、自然发酵而形成,传统酿造中表现出周期长、不易控制和产品品质不稳定等先天性不足。香气是评定葡萄酒品质的重要指标之一,葡萄酒中已超过400种挥发性成分是酵母发酵产生,不同酵母产生的香气成分不同[3-4]。葡萄酒发酵方式有纯种发酵与混菌发酵,纯种发酵菌株单一,污染少,其香气成分较少,而混复配菌发酵有多菌种共生,酶系丰富,会产生多种香气成分[5]。多菌种发酵是当前研究热点,其中非酿酒酵母被广泛运用于葡萄酒、白酒等行业,在酿造过程中有着极其重要的作用[6]。非酿酒酵母与酿酒酵母相互作用可赋予葡萄酒独特的浓郁香味与发酵香味,提高酒体品质[7-9]。
该研究旨在从菌库中筛选得到酿酒酵母与非酿酒酵母并进行不同菌株、不同比例及不同时序的复配,最终获得适合新疆特色慕萨莱思酿造用葡萄酒的复配发酵剂,缩短传统工艺发酵时间、提高成品品质,为慕萨莱思规模化生产奠定基础。
1 材料与方法
1.1 材料与试剂
和田红葡萄汁浓缩液(即慕萨莱思发酵液):取自刀郎慕萨莱思有限公司;优质慕萨莱思(商品名为慕萨莱思之乡):刀郎慕萨莱思有限公司赠;分离于慕萨莱思酿造生境的9株疑似酿酒酵母(YSc,编号为N1~N9)与166株非酿酒酵母(NSc,编号为F1~F166):保藏于塔里木大学食品系;活性干酵母(酿酒酵母RV100):安琪酵母公司;WL营养琼脂培养基:青岛日水生物有限公司。
1.2 仪器与设备
WYT-4手持糖度仪:上海精密仪器仪表有限公司;HPX-9162 MBE恒温培养箱:上海博迅实业有限公司医疗设备厂;JA5003电子天平:上海菁海仪器有限公司;MYCYCLER基因扩增仪:美国ABI Veriti公司;岛津GC-2014气相色谱仪:岛津国际贸易(上海)有限公司。
1.3 方法
1.3.1 复配发酵剂的研制
(1)复配菌株初筛
取9株YSc和166株NSc活化液接入50 mL萨莱思发酵液中,接种量为1%,置于(28±1)℃的培养箱中连续培养7 d,以未接菌的发酵液与成品酒作为标准,对接菌发酵后的样品只进行香气浓郁度评分,选出香气优良2株YSc和20株NSc备用。
(2)复配菌复筛
分别将初筛得到优良YSc和NSc经二次活化后按照1∶1进行复配,接种量均为1%,接入慕萨莱思发酵液中于(28±1)℃条件下恒温培养7 d,期间进行发酵样品的糖度及质量变化的监测,计算CO2释放量。发酵结束后进行香气浓郁度评分(香气浓郁度筛选标准同初筛)并结合降糖幅度(初始糖度-发酵结束时残糖量)与CO2生成量综合分析筛选优良复配菌3株。
(3)复配菌的复配比例筛选
将挑选出来的优良复配菌按照YSc∶NSc的不同比例接种(接种量分别为1%∶0.5%、1%∶1.0%、1%∶1.5%、1%∶2.0%、1%∶2.5%)经二次活化12 h后进行复配接种,置于(28±1)℃条件下恒温培养7d,期间进行糖度与三角瓶质量变化监测,并计算CO2释放量,发酵结束后只进行香气浓郁度评定。根据降糖幅度、CO2生成量和香气浓郁度评定的综合分析确定最佳复配比例。
(4)微型时序接种发酵实验
将筛出的复配菌株组按照不同时间段接入后进行发酵(N8-F10同时接入共同发酵、菌株N8发酵高泡期时接入菌株F10进行发酵,菌株F10发酵高泡期时接入菌株N8进行发酵、菌株N8与F10单独发酵),对各样品酒进行感官评定,包括香气浓郁度、口感和色泽的评分,确定最佳接种时序。
1.3.2 微型发酵验证试验
将挑选最优复配菌按照最优比例接至50 mL慕萨莱思发酵液,以安琪酵母RV100为参考菌,置于(28±1)℃恒温培养,对发酵结束样品进行总酸、总糖和酒精度测定以及感官评定,以证明所筛选目的菌株发酵结束样品的品质符合慕萨莱思成品。
1.3.3 相关指标的测定
(1)糖度测定
采用手持糖度仪测定糖度变化,发酵期间每隔1 d测定糖度,直至糖度稳定,确定为发酵结束。
(2)CO2生成量测定
CO2失重法[10]:记录样品初始质量,在发酵过程中每隔1 d测定样品质量,直至发酵结束(糖度稳定),样品减少的质量即为CO2生成量,发酵结束后测定其最终CO2生成量。
(3)酸度测定
根据国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》采用指示剂法测定发酵结束样品的总酸[11]。
(4)乙醇测定
乙醇含量的测定采用气相色谱法,检测器:SFID1;色谱柱:毛细管柱wax(30 m×0.25 mm×0.25 μm);检测器温度230℃,柱温230℃,柱箱温度40℃;气体:N2(载气)、氢气和空气;分流比为100∶1,进样体积1.0 μL。配制体积分数分别为2%、4%、8%、12%、16%、20%的乙醇溶液,以乙醇体积分数为X轴,峰面积为Y轴制作标准曲线为Y= 484 419X+59 170(R2=0.999 4)。
(5)感官评定
初筛与复筛只进行一轮香气浓郁度评定(按照香气浓郁度弱、稍弱、平均、稍强、强的分值分别为0~2、2~4、4~6、6~8、8~10)。菌种接种配比与微型时序发酵试验进行二轮感官评定包括香气、口感和色泽的评定。感官评分标准见表1(取平均值,满分10分)。感官评定数据进行统计得分,标准化[12]后利用SPSS进行方差分析及绘制均值图。

表1 发酵产品香气得分感官评价标准Table 1 Sensory evaluation standards of the fermentation product
对微型发酵实验样品进行第三轮厂内感官评定包括香气(浓郁度、协调性、优雅细腻度、复杂性、持久性、发展变化)、口感(平衡度、协调性、酒体、圆润度、清爽度、纯净度、复杂性、口香品质、余味)、整体风味特征(香气和口感的整体协调性、整体品质与风格和典型性)三个指标以5分尺度进行评定(各小分项的评定标准为弱、稍弱、平均、稍强、强,其分值分别为1、2、3、4、5)(评价标准由慕萨莱思厂家提供的内部资料)。
(6)复配菌株鉴定
总DNA的提取采用冻融法提取DNA[13];5.8-ITS PCR扩增[14]并委托上海生物工程有限公司进行测序,测序结果在Genbank数据库进行BLSAT相似性比对,相似度>99%即可确定其菌属[14]。
2 结果与分析
2.1 菌种筛选
2.1.1 优良复配菌的初筛结果
将9株YSc与166株NSc初筛发酵样品香气评定得分数据标准化,进行方差齐性检测和组间(各菌株发酵酒之间)分析,得到YSc之间差异显著(P<0.05),NSc之间的样品差异极显著(P<0.01)。
9株YSc香气得分前2名的为菌株N8和N7(得分均值分别为6.6、6.0),2株菌的发酵产气速率分别为8 h内产气1/2杜氏管和1/3杜氏管,证明2株菌具有良好的生长特性。166株NSc中,筛选8h内产气量达到1/3或1/4杜氏管且香气得分前20的菌株,分别为F129、F148、F1、F9、F40、F25、F44、F49、F10、F120、F36、F115、F52、F161、F164、F60、F163、F166、F6、F19。
2.1.2 优良复配菌的二次筛选结果
2株YSc与20株NSc分别按1∶1复配发酵结束,以降糖幅度和CO2产生量为主以香气评定为辅进行评价,结果分别见图1~图3。

图1 2株疑似酿酒酵母与20株疑似非酿酒酵母复配发酵慕萨莱思Fig.1 Sugar content decreases of Msalais fermented by compound strains of 2 suspectedSaccharomycesspp.and 20 suspected non-Saccharomycesspp.

图2 2株疑似酿酒酵母与20株疑似非酿酒酵母复配发酵慕萨莱思的CO2产生量Fig.2 CO2production of Msalais fermented by compound strains of 2 suspectedSaccharomycesspp.and 20 suspected non-Saccharomycesspp.

图3 2株疑似酿酒酵母与20株疑似非酿酒酵母复配发酵慕萨莱思的香气评定结果Fig.3 Aroma evaluation score of Msalais fermented by compound strains of 2 suspectedSaccharomycesspp.and 20 suspected non-Saccharomycesspp.
以降糖幅度和CO2产生量为主以香气评定为辅进行评价,得出以下3组最佳复配菌,分别是N7-F10(降糖幅度排名第4、CO2产生量第4、香气评定排名第9)、N7-F40(降糖幅度排名第4、CO2产生量排名第12、香气评定排名第9)、N8-F10(降糖幅度排名第2、CO2产生量排名第1、香气评定排名第5),以上三组复配菌株在发酵能力及香气馥郁度均优于其他组合,为后续筛选提供依据。
2.1.3 YSc菌和NSc菌最优复配比例筛选
二次筛选出来的三组复配菌株按照疑似酿酒酵母与非酿酒酵母不同比例复配进行慕萨莱思酿制,在接入菌株后开始每隔1 d测定糖度与三角瓶质量变化并且计算CO2产生量,得到降糖幅度、CO2产生量和产香得分结果分别见图4~图6。

图4 三种复配菌不同比例复配发酵慕萨莱思的降糖幅度Fig.4 Sugar content decreases of Msalais fermented by compound strains with different ratios

图5 三种复配菌不同比例复配发酵慕萨莱思的CO2释放量Fig.5 CO2production of Msalais fermented by compound strains with different ratios

图6 三种复配菌不同比例发酵慕萨莱思的香气评定Fig.6 Aroma evaluation score of Msalais fermented by compound strains with different ratios
15个处理中,以能够顺利启动发酵为主,香气得分经SPSS分析,在前3名的处理(N8-F10 1∶0.5、N8-F10 1∶1、N8-F10 1∶1.5)间进行筛选,得出N8-F10=1∶0.5为最好配比,CO2产生量为4.54 g/50 mL(第3),香气得分均值为5.71(得分第1),降糖幅度为23°Bx(并列第1)。
2.2 菌株N8与F10微型时序接种发酵实验
以不同时间段为变量,按照相同的接种量接入菌种,筛选最佳接种顺序,发酵结束样液的感官得分见表2。
由表2可知,对发酵结束样品进行感官评定,对其色泽单独分析得到菌株F10G和N8-F10的试样评分第1,香气与口感单独分析均得到菌株N8-F10评分第1、菌株N8单独培养评分第2、菌株F10G评分排名第3。综合以上指标分析,最优复配顺序为菌株N8与F10同步接入。

表2 N8和F10微型时序接种发酵与单独接种纯发酵的慕萨莱思样品感官评定Table 2 Sensory evaluation score of Msalais fermented by strains N8 and F10 sequence combined fermentation and pure fermentation
2.3 微型发酵验证实验结果
以安琪商用菌株RV100为对照组,检验实验中所选复配菌(其条件为同时接入2%N8-1%F10,(28±1)℃恒温培养)的可行性,以菌株N8与F10同时接入发酵,接菌量为2%∶1%;活性干酵母RV100接种量0.1 g/100 mL。对两者的CO2产生量、发酵结束样品的理化检测、香气、口感和综合性评分进行分析描述,结果分别见图7~图10、表3。

图7 微型发酵产品CO2产生量及降糖幅度Fig.7 CO2production and sugar content decreases of microfermentation products

图8 菌株N8-F10及RV100微型发酵样品香气得分Fig.8 Aroma scores of Msalais samples by strain N8-F10 and RV100 micro-fermentation

图9 菌株N8-F10及RV100微型发酵样品口感得分Fig.9 Mouthfeel scores of Msalais samples by strain N8-F10 and RV100 micro-fermentation

图10 菌株N8-F10及RV100微型发酵样品综合性得分均值Fig.10 Comprehensive scores mean value of Msalais samples by strain N8-F10 and RV100 micro-fermentation
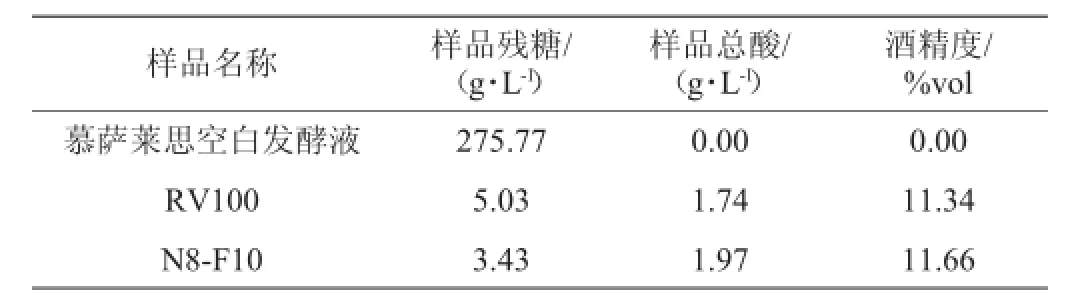
表3 微型发酵产品理化指标Table 3 Physicochemical indexes of micro-fermentation products
菌株N8和F10复配、及安琪酵母RV100的微型发酵试验中,结果表明菌株N8-F10同步接入发酵处理组的CO2产生量优于菌株RV100(见图7)。两处理的微型发酵慕萨莱思样品理化指标见表2,所选复配菌发酵样品与安琪酵母发酵样品残糖含量在相同范围内,均符合干型葡萄酒[15],且酒精度范围在9%vol~12%vol之间,符合葡萄酒酒精含量[16]。2个微型发酵样品的香气差异不显著,单项分比较,菌株N8-F10在浓郁度、协调性、优雅细腻度、复杂性、持久性优于菌株RV100,香气得分均值2.5分,同样优于商用菌菌株RV100(见图8),香气特征表现为:香气浓郁度中等偏上,香气类型不单调,各类香气均衡与无明显异味,香气整体愉悦,但持久性较差。比较两者口感得分的差异不显著,单项得分比较,菌株N8-F10在平衡度、协调性、复杂性、口香品质、余味上优于菌株RV100,得分均值为3.75分,同样优于菌株RV100(见图9)。菌株N8-F10的香气和口感的整体协调性、整体品质、风格和典型性得分区间为2.0~2.5,综合性评价均优于菌株RV100(见图10),表现为香气和口感无明显冲突,整体品质中等、基本具备慕萨莱思的独特风味特征。由上述结果证明,所选菌株N8-F10(接种量为2%N8-1%F10)的同步发酵具有酿造慕萨莱思优良特性,结合生产工艺,可进一步提升其品质特性,将会为慕萨莱思规模化生产提供有价值的发酵剂。
2.4 复配菌的分子鉴定
菌株N8在WL培养基上菌落呈圆形,表面光滑,乳白色,圆形微凸,奶油状。菌株F10在WL培养基上菌体呈灰绿色,边缘白色,呈毛绒放射状,表面粗糙无光泽,微凸。
对所挑选出来的两株菌进行5.8S-ITS扩增并测序,结果与GenBank数据库中的序列进行比较,结果(见表4)表明,菌株N8与酿酒酵母(Saccharomyces cerevisiae)相似度为100%;菌株F10与库德毕赤酵母(Pichia kudriavzevii)的相似度为99%。

表4 菌株N8和F10的鉴定结果Table 4 Identification results of strains N8 and F10
3 结论
在初步筛选中,通过对产香和产CO2释放量测试分析,得到了产香较好,产气较快的2株疑似酿酒酵母和20株疑似非酿酒酵母。
在复配试验中,获得一组复配菌N8-F10,并确定了最佳菌株复配比例为N8∶F10=1∶0.5的同步发酵,慕萨莱思酿造中体现出高的降糖幅度23°Bx和CO2生成量4.54 g/50 mL,及优良的香气特性(感官评定得分为5.71)。
以安琪活性干酵母为对照,对复配菌组N8-F10(同步接入2%N8-1%F10,(28±1)℃恒温培养)进行微型发酵实验所得慕萨莱思的酒精度、残糖含量与总酸均符合慕萨莱思标准,在香气、口感及整体品质等方面优于商用安琪酵母RV100;具备酿制慕萨莱思的优良特性,为比较理想的慕萨莱思复配发酵剂。
通过WL形态特征及5.8S-ITS测序鉴定,得到菌株N8为酿酒酵母(Saccharomyces cerevisiae),菌株F10为库德毕赤酵母(Pichia kudriavzevii)。
参考文献:
[1]冯姝,朱丽霞,侯旭杰,等.慕萨莱思酵母菌表型多样性及其酿酒酵母δ序列遗传多样性分析[J].中国酿造,2012,31(2):165-170.
[2]牛贵洋,包东东.慕萨莱思中功能成分含量的初步分析[J].中国新技术新产品,2014(22):6.
[3]杨莹,徐艳文,薛军侠,等.葡萄酒相关酵母的香气形成及香气特征[J].微生物学通报,2007,34(4):757-760.
[4]刘峻溪,张将,史涛涛,等.不同商品酵母对葡萄酒香气成分的影响[J].中国酿造,2015,34(4):42-46.
[5]赵德安.纯种发酵、混合发酵与传统发酵食品[J].中国酿造,2010,29(9):15-17.
[6]周世水,熊建春.酒曲中生香酵母的分离鉴定与产酯工艺优化[J].现代食品科技,2010,26(1):98-99,108.
[7]PISARNITSKILL A.Formation of wine aroma:tones and imperfections caused by minor components(review)[J].Appl Biochem Microbiol, 2001,37(6):552-560.
[8]崔艳,刘金福.非酿酒酵母在葡萄酒酿造中应用的研究现状[J].中国酿造,2010,29(11):13-16.
[9]范广璞.白酒中生香酵母的筛选及培养条件的研究[J].中国酿造,2008,27(14):44-47.
[10]刘学强,钱泓,周正,等.低产高级醇葡萄酒酵母菌株的筛选[J].食品与发酵工业,2016,42(3):73-78.
[11]中国国家标准化管理委员会.GB/T 15038—2006葡萄酒,果酒通用分析方法[S].北京:中国标准出版社,2006.
[12]李华,刘曙东,王华,等.葡萄酒感官评价结果的统计分析方法研究[J].中国食品学报,2006,6(2):126-131.
[13]冯姝,朱丽霞,侯旭杰,等.慕萨莱思酵母菌表型多样性及其酿酒酵母δ序列遗传多样性分析[J].中国酿造,2012,31(2):165-170.
[14]王冠群,韩培杰,杨文菊,等.新疆传统发酵乳制品及酵头中酵母菌的分离鉴定[J].食品与生物技术学报,2015,34(7):691-698.
[15]王俊,姚聪.基于电子舌技术的葡萄酒分类识别研究[J].传感技术学报,2009,22(8):1088-1093.
[16]杜广华.葡萄酒酒精度测试[J].北京农业,2015(17):3-4.
Laboratory-scale development of combined starter for Msalais production
ZHANG Jiabin,WANG Guanqun,CHEN Tongguo,MA Quan,ZHU Lixia*
(College of Life Science,Tarim University,Alar 843300,China)
Traditional Msalais fermentation has the defect of long period,hardly control and insufficient product stability.In the study,175 Msalais yeast strains were cultured individually.TwoSaccharomycesspp.strains and 20 suspected non-Saccharomycesspp.strains with better aroma characteristics were firstly screened,and then through a serial of experiments for different strains,combined proportion,sequenced inoculation,and microfermentation verification optimization,a compound strain N8∶F10 with inoculum ratio 2∶1 was screened.The compound strain had a better performance than commercial yeast RV100 in sugar decrease(18°Bx),CO2production(11.86 g/50 ml),aroma evaluation score(2.22)and mouthfeel score (1.65)during the Msalais fermentation.The residue sugar content,the total acid content,the alcohol content of fermented Msalais was 3.43 g/L, 1.97 g/L,and 11.66%vol,respectively.The Msalais wine had Msalais reddish brown color,typical aroma and taste characteristics.The compound strain was a potential starter for Msalais production.By WL morphology and 5.8-ITS sequence analysis,strains N8 and F10 were indentified as Saccharomyces cerevisiaeandPichia kudriavzeviirespectively.The study provided a foundation for the improvement of Msalais traditional fermentation process and product quality.
Msalais;compound starter;simultaneous inoculation;aroma;mouthfeel
TS262.7
0254-5071(2017)03-0115-06
10.11882/j.issn.0254-5071.2017.03.024
2016-10-15
国家自然基金项目(31660460,31260393);塔里木大学大学生创新创业训练计划项目(201510757002);塔里木大学校级研究生创新项目(TDGRI201606)
张佳斌(1996-),男,本科生,研究方向为慕萨莱思优良菌筛选与应用。
*通讯作者:朱丽霞(1975-),女,教授,硕士,研究方向为食品微生物与传统发酵食品。
