响应面法优化生香酵母C42增殖培养基
2017-04-07郭凯元亢春雨李志辉徐宏伟孙思明任蓓蕾马雯李英军檀建新
郭凯元,亢春雨,李志辉,徐宏伟,孙思明,任蓓蕾,马雯,李英军,檀建新*
(1.河北农业大学食品科技学院,河北省农产品加工工程技术中心,河北保定071001;2.河北农业大学理工学院,河北黄骅061100)
响应面法优化生香酵母C42增殖培养基
郭凯元1,亢春雨1,李志辉2,徐宏伟1,孙思明1,任蓓蕾1,马雯1,李英军1,檀建新1*
(1.河北农业大学食品科技学院,河北省农产品加工工程技术中心,河北保定071001;2.河北农业大学理工学院,河北黄骅061100)
在摇瓶水平上对生香酵母C42培养基进行响应面法优化。首先用单因子法筛选最优碳源、氮源及无机盐。采用Plackett-Burman法筛选影响生香酵母C42生长的主要因素、再利用最陡爬坡试验进行Box-Behnken设计,得到生香酵母C42的优化培养基配比。优化后的培养基组成为葡萄糖7.12%、酵母浸粉3.28%、KH2PO40.2%、(NH)2SO40.6%、NaCl 0.5%、MgSO40.03%。优化后的活菌数量可达到1.26×109CFU/mL,比优化前的活菌数7.65×108CFU/mL提高了64.7%。
生香酵母;培养基优化;响应面法
生香酵母又称产酯酵母,主要属于假丝酵母和产膜酵母,在发酵过程中能产生酸、酯、高级醇和醛等多种香味物质。对发酵产品的风味、质地和色泽的形成起到重要的作用[1]。目前在葡萄酒、白酒、食醋等发酵行业得到广泛应用[2-6]。在前期工作中,本实验室筛选到一株产酯能力较高的酵母菌C42,经鉴定为异常维克汉逊酵母(Wickerhamomyces anomalus),具有很好的潜在应用价值[7-8]。
Plackett-Burman设计是一种的两水平试验设计方法,可以用最少的试验次数从众多的因素中高效地筛选出影响最为显著的几个因素[9]。响应面法则是在此基础上,进一步对这几个重要因子水平及其交互作用进行优化,并寻求最优的参数,与传统优化方法相比所需的试验组数更少。目前已成为优化试验条件、节约试验成本的一种十分有效的方法,广泛应用于生产试验和科学研究[10-11]。本试验以生香酵母C42作为研究对象,以Plackett-Burman设计及响应面优化其培养基成分,提高酵母生物量,旨在为该菌种的后续研究和生产提供理论依据。
1 材料与方法
1.1 材料与试剂
异常维克汉姆酵母(Wickerhamomycesanomalus)C42:河北农业大学食品科技学院微生物试验室保存;葡萄糖、酵母浸粉、蛋白胨、琼脂糖、KH2PO4、(NH)2SO4、NaCl、MgSO4等(均为分析纯):北京奥博星生物技术有限责任公司。
酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose,YEPD):酵母膏1%,蛋白胨2%,葡萄糖2%。灭菌条件:121℃、20 min。
1.2 仪器与设备
TU-1810型紫外可见光分光光度计:北京普析通用仪器有限责任公司;SW-CJ-ID型单人净化工作台:苏州净化设备有限公司;ZHWY-2102C恒温振荡培养箱:上海智诚分析仪器制造有限公司;DSX-280A手提压力灭菌锅:上海申安仪表有限公司;SPX-250B-Z型生化培养箱:上海博迅有限公司。
1.3 方法
1.3.1 培养方法
将生香酵母C42接入YEPD液体培养基中活化2次,将活化过的菌种按以体积分数2%的接种量接入盛有各培养基的三角瓶(50 mL/250 mL),30℃、250 r/min振荡培养20 h。
1.3.2 试验设计
先用单因素试验筛选出合适的碳源、氮源和无机盐,然后用Plackett-Burman设计找出对生香酵母C42增殖有显著影响的因子,通过最陡爬坡试验和Box-Benhnken试验,利用Design-Expert软件对结果进行优化分析,获得培养基组分的最优添加量组合。通过比较生香酵母C42在普通YEPD培养基和响应面法优化后的培养基中的生长状况从而评价优化后的培养基[12]。
1.3.3 测定方法
比浊法:菌体生物量与吸光度值成正比,测定适当稀释的发酵液在波长560 nm处的吸光度OD值。
2 结果与分析
2.1 单因素试验
2.1.1 碳源种类及添加量优化
选择添加量均为2%葡萄糖、果糖、麦芽糖、蔗糖、淀粉、乳糖和β-环糊精7种不同碳源替换YEPD培养基中的碳源进行酵母发酵试验。考察不同碳源对生香酵母C42生长状况的影响,结果见图1。
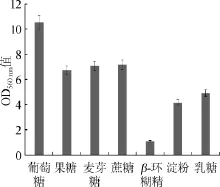
图1 不同碳源对酵母菌C42生长状况的影响Fig.1 Effects of different carbon sources on growth of yeast C42
由图1可知,不同的碳源对菌株的生长有不同的影响,其中葡萄糖最适合生香酵母C42的生长,因此接下来的优化培养选择葡萄糖作为碳源。
确定葡萄糖为最佳碳源后,考察不同葡萄糖含量对生香酵母C42生长的影响,结果见图2。

图2 不同葡萄糖含量对酵母菌C42生长状况的影响Fig.2 Effects of different glucose concentration on growth of yeast C42
由图2可知,菌液吸光度值随葡萄糖含量的增大呈先增大后减小的趋势,葡萄糖含量为10%时菌液吸光度值达到最大值,因此选择葡萄糖的最适含量为10%。
2.1.2 氮源种类及添加量优化
选择添加量均为2%酵母浸粉、蛋白胨、尿素、硝酸钾、硫酸铵、氯化铵6种不同氮源替换YEPD培养基中的氮源进行酵母发酵试验,考察不同氮源对生香酵母C42生长状况的影响,结果见图3。
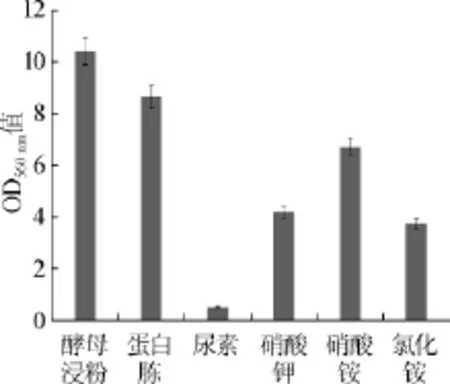
图3 不同氮源对酵母菌C42生长状况的影响Fig.3 Effects of different nitrogen sources on growth of yeast C42
由图3可知,生香酵母C42既可以利用有机氮源,又可以利用无机氮源。当用酵母浸粉作单一氮源时生物量最大,其次为蛋白胨,无机氮源中硫酸铵效果最好。由于酵母浸粉和蛋白胨价格昂贵,不适宜作单一氮源,因此接下来的优化中考虑用有机氮源酵母浸粉和无机氮源硫酸铵作为复合氮源。
确定酵母浸粉、硫酸铵作为复合氮源后,考察酵母浸粉和硫酸铵含量对生香酵母C42生长状况的影响,结果见图4。
由图4可知,酵母浸粉含量为2.5%、硫酸铵含量为0.5%时吸光度值达到最大值,因此选择酵母浸粉最适含量为2.5%、硫酸铵最适含量为0.5%。
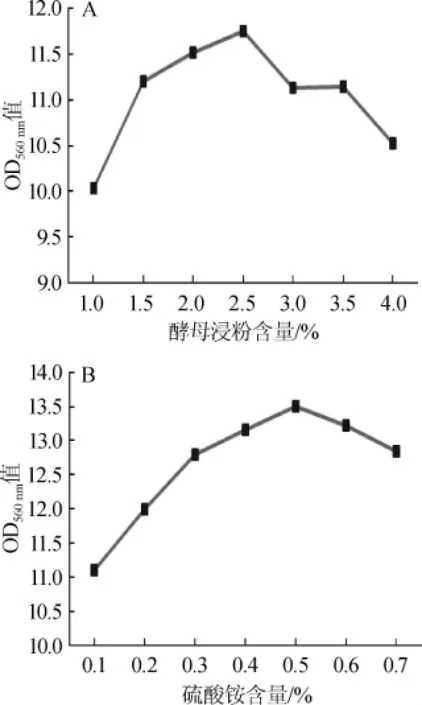
图4 不同酵母浸粉(A)及硫酸铵(B)含量对酵母菌C42生长状况的影响Fig.4 Effects of different concentration of yeast extract powder(A)and(NH)2SO4(B)on growth of yeast C42
2.1.3 无机盐种类及添加量优化
选择添加量均为0.5%硫酸镁、氯化钙、氯化钠、硫酸锌和磷酸二氢钾5种不同无机盐加入YEPD培养基中,以不加任何无机盐的培养基为对照(CK),进行酵母发酵试验,结果见图5。
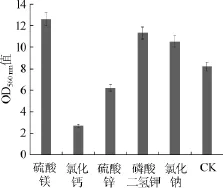
图5 不同无机盐对酵母菌C42生长状况的影响Fig.5 Effects of different inorganic salt on growth of yeast C42
由图5可知,硫酸镁,磷酸氢二钾、氯化钠对酵母的生长均有促进作用,因此选用以上3种无机盐进行下一步试验的无机盐。
硫酸镁、磷酸二氢钾和氯化钠含量对生香酵母C42生长状况的影响见图6。
由图6可知,硫酸镁、磷酸二氢钾、氯化钠的最适含量分别为0.5%、0.15%、0.4%。
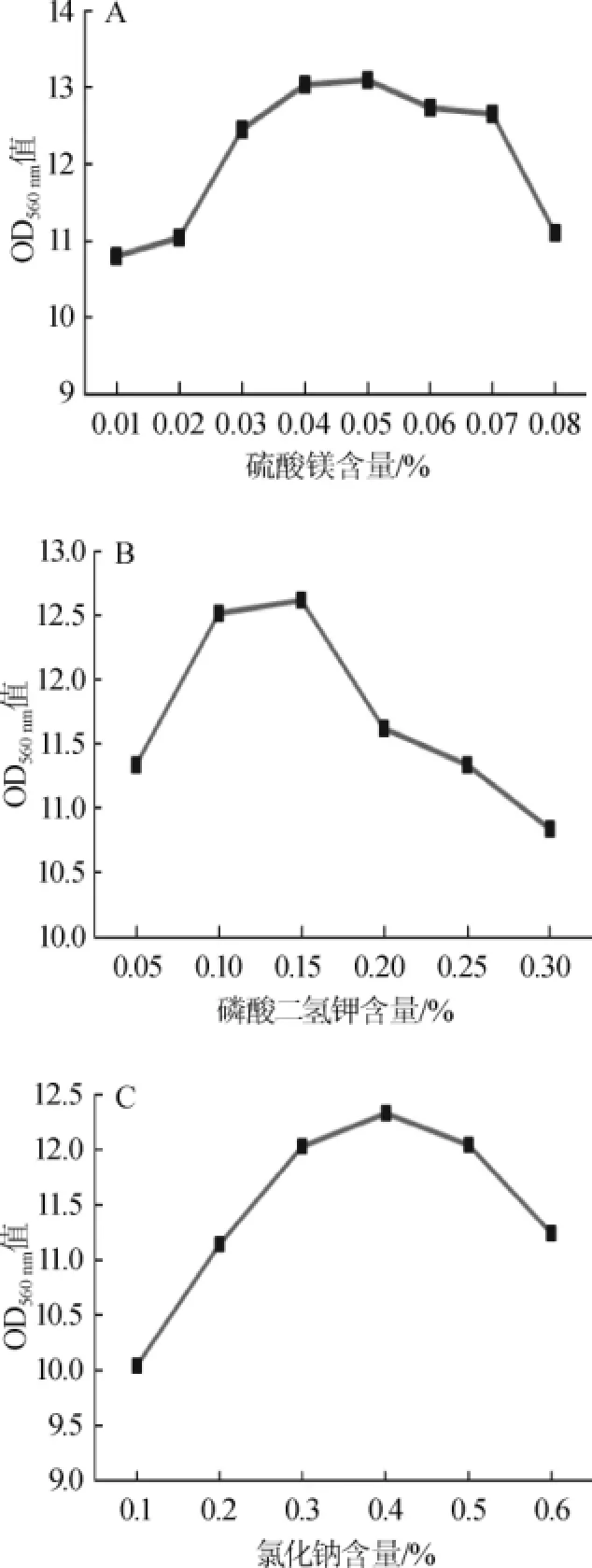
图6 不同浓度的硫酸镁(A),磷酸二氢钾(B)及氯化钠(C)含量对酵母菌C42生长状况的影响Fig.6 Effects of different concentration of MgSO4(A),KH2PO4(B) and NaCl(C)on growth of yeast C42
2.2 Plackett-Burman试验
根据单因素试验结果,采用葡萄糖(X1)、酵母浸粉(X2)、(NH4)2SO4(X3)、KH2PO4(X4)、NaCl(X5)、MgSO4(X6)6个因素作为研究对象,另外设置5项虚拟项(X7~X11),以考察误差。每个因子选取高低2个水平,其因素与水平设计见表1,试验设计与结果见表2。利用Design-Expert软件分析试验结果,结果如表3所示。

表1 Plackett Burman试验设计因素与水平Table 1 Factors and levels of Plackett-Burman experiments

表2 Plackett Burman试验设计与结果Table 2 Design and resutls of Plackett-Burman experiments
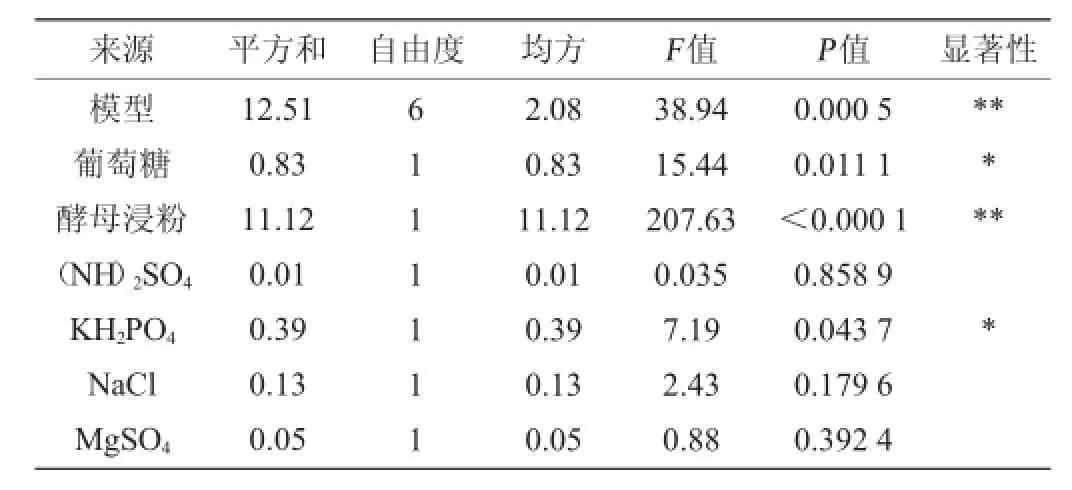
表3 Plackett-Burman试验结果与分析Table 3 Results and analysis of Plackett-Burman experiments
由表3可知,6个因素对应响应值影响的显著性顺序为酵母浸粉>葡萄糖>KH2PO4>NaCl>MgSO4>(NH4)2SO4,其中葡萄糖、酵母浸粉和KH2PO4对生香酵母C42具有显著影响,酵母浸粉具有极显著效应(P<0.01),葡萄糖和KH2PO4具有显著效应(0.01<P<0.05)。应针对以上3因素进行进一步优化,其他因素影响相对不显著,呈正效应的因素维持在高水平,呈负效应的维持在低水平[13]。酵母浸粉、KH2PO4、(NH4)2SO4、NaCl为正效应,说明这4个因素在高水平时对生香酵母C42的增殖更有利,因此选取酵母浸粉、KH2PO4、(NH4)2SO4、NaCl的含量分别为3%、0.2%、0.6%、0.5%。葡萄糖、MgSO4为负效应,说明这2个因素在低水平浓度时对生香酵母C42的增殖更有利,因此选取葡萄糖、MgSO4的含量为8%、0.03%。
2.3 最陡爬坡试验
在筛选出主要影响因素后,根据回归方程中各显著性因素对响应值的影响,减少葡萄糖的用量,增加酵母浸粉、KH2PO4的用量,根据这3个因素效应大小的比例确定它们的步长,设计最陡爬坡试验,以逼近最佳响应区域[14],试验设计与结果见表4。
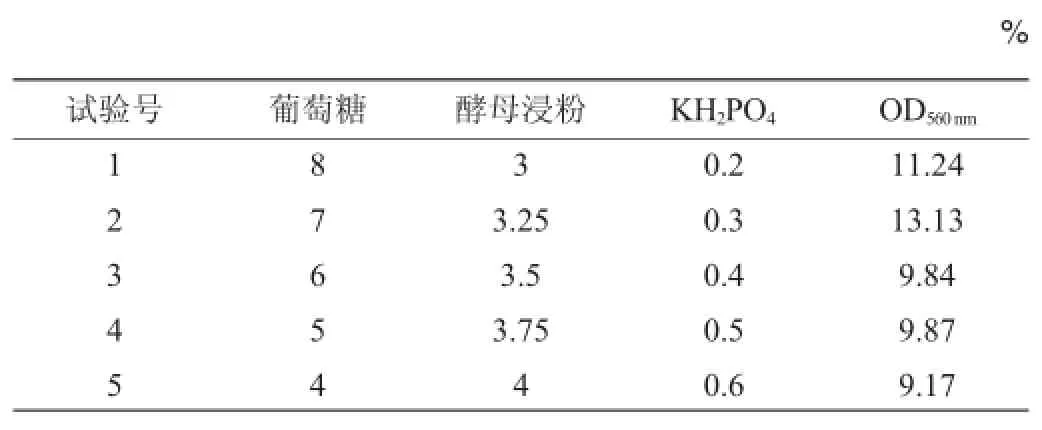
表4 最陡爬坡试验设计与结果Table4 Experimental design and results of the steepest ascent tests
由表4可知,当葡萄糖、酵母浸粉、KH2PO4含量分别为7%、3.25%、0.3%时最利于酵母生长,故以此组合试验条件作为响应面试验因素水平的中心点。
2.4 Box-Behnken响应面试验
根据PB试验设计获得的3个重要因素及最陡爬坡试验得到的最佳浓度分别选取3个水平,利用Design-Expert软件进行3因素3水平的Box-Behnken试验设计,因素及水平见表5,试验设计及结果见表6。
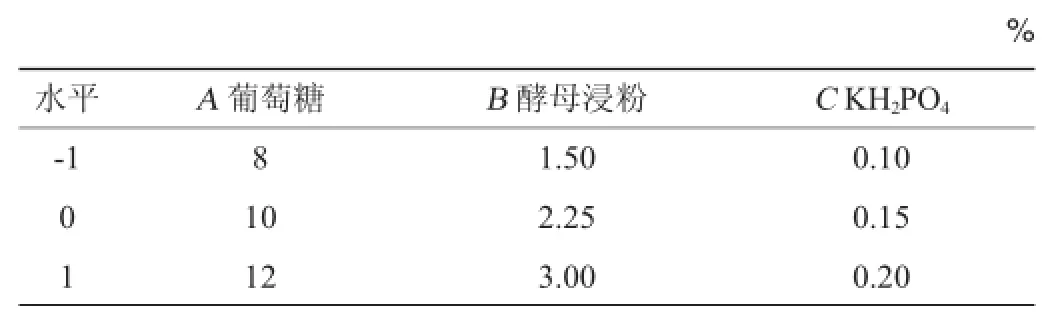
表5 培养基组成优化响应面试验因素与水平Table 5 Factors and levels of response surface methodology for medium composition optimization

表6 Box-Behnken试验设计与结果Table 6 Design and results of Box-Behnken experiments
利用Design-Expert软件对试验数据进行多元回归分析,三元二次回归拟合方程如下:
Y=14.54+0.12A+0.14B+0.24C-0.10AB+0.005AC+0.17BC-0.47A2-0.61B2-0.90C2。
回归系数显著性检验表7表明,模型的P值<0.000 1,说明模型极其显著。该模型的决定系数R2=0.983,校正决定系数R2Adj=0.961,说明该模型能解释98.3%的响应值的变化,只有变异2.2%不能由该模型来解释,表明预测值与实测值之间拟合度好。该模型的失拟项P=0.074 1>0.05,可知该模型失拟不显著[15]。变异系数(coefficient of variation,CV)的值越低表明试验的可靠性越高,试验中变异系数为1.68%,证明试验结果可信。因此可用此回归方程对试验结果进行分析预测。方程中一次项中A和B对结果有显著影响,C对结果具有极显著影响;二次项A2、B2、C2对结果均有有极显著影响,交互项中BC交互作用显著,表明试验因子对响应值不是简单的线性关系,而是呈二次抛物面关系。
3个因子交互作用对活菌数影响的响应曲图以及等高线图见图7。
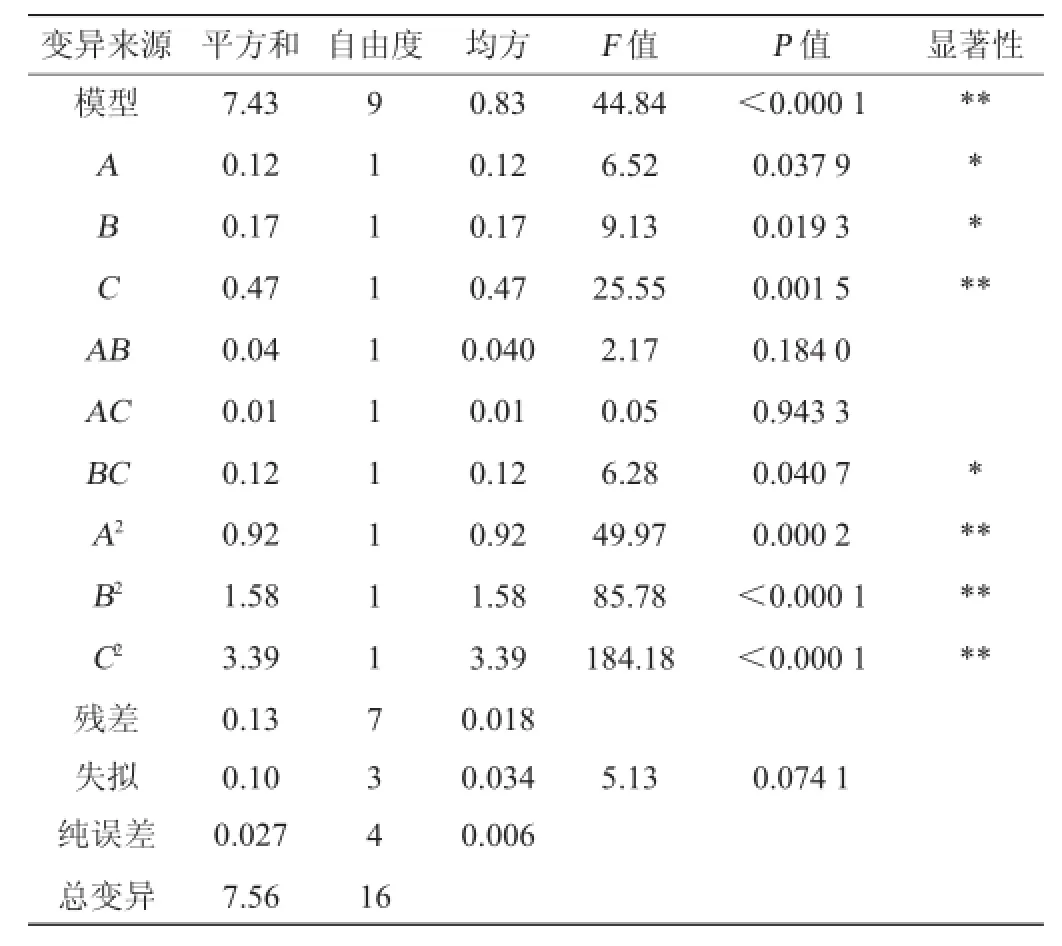
表7 Box-Benhnken试验回归模型方差分析Table7 Variance analysis of Box-Benhnken tests
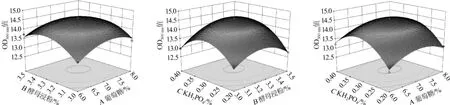
图7 葡萄糖、酵母浸粉和KH2PO4添加量交互作用对活菌数影响的响应曲面及等高线Fig.7 Response surface plots and contour line of effects of interaction between glucose,yeast extract and KH2PO4addition on viable counts
由图7可以看出,随着葡萄糖和酵母浸粉质量浓度的升高,OD560nm值表现为先升高后降低,葡萄糖和酵母浸粉对生香酵母C42的生长影响显著,说明碳源和氮源的增加有利于生酵母C42的生长,但是过高或者过低都不利于菌株的生长繁殖,因此合适的C/N比对于酵母菌的增长繁殖至关重要。葡萄糖、酵母浸粉和KH2PO4中任一种组分质量浓度较低时,适量增加其他组分的质量浓度均可促进菌体的生长,但在实验范围内葡萄糖、酵母浸粉和KH2PO4质量浓度之间存在最佳值,超过最佳值后,增加任一组分的质量浓度均不能提高菌体生物量,甚至使菌体生物量有所下降,为了使生香酵母C42快速增殖并形成最大生物量,选取适宜的葡萄糖浓度、酵母浸粉浓度和KH2PO4浓度都是至关重要的。
为求得模型极值点,对回归方程求解[16],得出在葡萄糖7.119%,酵母浸粉3.282%,KH2PO40.2%的条件下,生香酵母C42发酵液OD560nm值的预测值最高为14.59。
2.5 验证优化结果
为了方便实际操作,修改最佳培养基配方为葡萄糖7.119%,酵母浸粉3.282%,KH2PO40.2%,采取经过优化后的增殖培养基培养生香酵母C42,重复试验3次,培养后生香酵母C42的发酵液OD560nm值为14.57,与模型预测结果接近,说明预测结果能较好的反映实际情况,证明了模型的有效性,优化后的的酵母活菌数达1.26×109CFU/mL。
3 结论
试验结果证明,Plackett-Burman试验与响应面法相结合的试验统计方法能快速、有效地从众多影响生香酵C42增殖的因素中筛选出比较重要的影响因素,优化条件并得到最佳培养基配比。本研究通过Plackett-Burman试验筛选出具有显著效果的3个因素分别为葡萄糖、酵母浸粉、KH2PO4。在此基础上经最陡爬坡路径试验找出其峰值,快速逼近最佳值区域,利用Box-Behnken响应面法优化酵母菌培养基配方。最终确定其发酵培养基为:葡萄糖7.119%、酵母浸粉3.282%、KH2PO40.2%、(NH4)2SO40.6%、NaCl 0.5%,MgSO40.03%。在此优化的培养基中活菌数为最高(1.26×109CFU/mL),较优化前(7.65×108CFU/mL)提高了64.7%,为生香酵母C42的开发利用提供理论依据。
[1]LIU Y,LI W,ZHANG H,et al.Screening of aroma-producing yeast strains from traditional fermented food and research on their aroma-production and fermentation characteristics[J].J Chinese Inst Food Sci Technol,2015,15(4):63-70.
[2]CIANI M,COMITINI F.Non-Saccharomyceswine yeasts have a promising role in biotechnological approaches to winemaking[J].Ann Microbiol,2011,61(1):25-32.
[3]李学伟,陈强,朱新贵,等.添加生香酵母改善酱油风味的研究[J].中国酿造,2014,33(3):121-124.
[4]陈美竹,邱树毅,胡宝东,等.酱香型白酒酿造体系中酵母菌研究进展[J].中国酿造,2015,34(6):5-10.
[5]THIRUMURUGAN A,RAMACHANDRAN S,GOBIKRISHNAN S. Optimization of medium components for maximizing bacteriocin production byLactobacillus plantarumATM11 using statistical design[J]. Int Food Res J,2015,22(3):1272-1279.
[6]DWIVEDI G,SHARMA M P.Application of Box-Behnken design in optimization of biodiesel yield fromPongamia oiland its stability analysis [J].Fuel,2015,145(18):256-262.
[7]李志辉,任蓓蕾,朱健辉,等.一株产乙酸乙酯酵母C42的分离与鉴定[J].食品工业科技,2014,35(8):188-191.
[8]任蓓蕾,李志辉,田洪涛,等.生香酵母C42真空冷冻干燥保护剂的筛选和优化[J].食品工业科技,2015,36(10):158-162.
[9]CHANDRA M,BARATA A,FERREIRA-DIAS S,et al.A response surface methodologystudyon the role offactorsaffecting growth and volatile phenol production by Brettanomyces bruxellensis,ISA 2211 in wine[J]. Food Microbiol,2014,42(12):40-46.
[10]ALBERTI A,ZIELINSKI A A,ZARDO D M,et al.Optimisation of the extraction of phenolic compounds from apples using response surface methodology[J].Food Chem,2014,149(4):151-158.
[11]胡永红,沈树宝,欧阳平凯.响应面分析法用于微生物培养基浓度的优化[J].工业微生物,2002,32(1):9-12.
[12]张娅,冷一非,李建华,等.响应面法优化嗜酸乳杆菌增殖培养基[J].中国酿造,2011,30(9):134-137.
[13]郝学财,余晓斌,刘志钰,等.响应面方法在优化微生物培养基中的应用[J].食品研究与开发,2006,27(1):38-41.
[14]代志凯,张翠,阮征.试验设计和优化及其在发酵培养基优化中的应用[J].微生物学通报,2010,37(6):894-903.
[15]丛建民.二次回归通用旋转组合设计酶解法制备大豆肽的研究[J].食品科学,2008,29(5):319-323.
[16]杨迎凤,杨文娟,杨锟,等.响应面法优化酵母菌产胞外多糖培养基的研究[J].中国酿造,2014,33(9):115-119.
Optimization of aroma-producing yeast C42 culture medium by response surface method
GUO Kaiyuan1,KANG Chunyu1,LI Zhihui2,XU Hongwei1,SUN Siming1,REN Beilei1,MA Wen1,LI Yingjun1,TAN Jianxin1*
(1.Engineering Research Center of Hebei Province for Agricultural Products Processing,College of Food Science and Technology, Hebei Agricultural University,Baoding 071001,China;2.College of Science and Technology,Hebei Agricultural University, Huanghua 061100,China)
The fermentation medium for aroma-producing yeast C42 was optimized based on response surface method.Single-factor experiments were firstly performed to select the optimal carbon source,nitrogen source and inorganic salt.The significant factors which affect the growth of aromaproducing yeast C42 were filtered out through the Plackett-Burman experiments,and then the aroma-producing yeast C42 medium formula was obtained based on the steepest ascent tests and Box-Behnken design.Based on the statistical analysis,the optimal fermentation medium compositions were glucose 7.12%,yeast extract 3.28%,KH2PO40.2%,(NH)2SO40.6%,NaCl 0.5%,MgSO40.03%.After optimization,the number of viable yeast increased from 7.65×108CFU/ml to 1.26×109CFU/ml,which increased by 64.7%.
aroma-producing yeast;medium optimization;response surface methodology
TQ92
0254-5071(2017)03-0103-06
10.11882/j.issn.0254-5071.2017.03.022
2016-12-01
河北省食品科学与工程学科“双一流”建设资金项目(2016SPGCA18);河北省重点研发计划项目(16275505D)
郭凯元(1990-),男,硕士研究生,研究方向为食品微生物学。
*通讯作者:檀建新(1968-),男,教授,博士,研究方向为微生物资源开发与利用。
