左乙拉西坦可溶片的制备工艺及质量研究
2017-04-07孙家跃左靖宿州市立医院药剂科安徽宿州234000
孙家跃,左靖(宿州市立医院药剂科,安徽 宿州 234000)
左乙拉西坦可溶片的制备工艺及质量研究
孙家跃*,左靖(宿州市立医院药剂科,安徽 宿州 234000)
目的:制备左乙拉西坦可溶片并评价其质量。方法:通过考察原料药的流动性指标(堆密度、紧密度等)和制剂的中间体混合颗粒的粒径分布、流动性指标和水分等建立片剂制备工艺;采用高效液相色谱法测定左乙拉西坦含量,并评价可溶片的外观、崩解时限、主成分含量等质量指标。结果:确立了左乙拉西坦可溶片的制备工艺为湿法制粒压片法。所制可溶片规格为100 mg/220 mg,外观片面光洁,崩解时限均在1 min内,左乙拉西坦平均含量为100.1%,硬度为7.5 kg,脆碎度合格。结论:左乙拉西坦可溶片处方及制备工艺合理、可控,成品各项质量指标均符合要求。
左乙拉西坦;可溶片;流动性指标;处方;制备工艺;质量评价
近年来新研制的抗癫痫药物如氨己烯酸(Vigabatrin)、左乙拉西坦(Levetiracetam)、托吡酯(Topiramate)等在体内吸收均呈线性药动学,尤其是左乙拉西坦在抗癫痫药物中被列为“重磅炸弹”药物,是具有理想药动学性质的抗癫痫药,其口服易吸收、生物利用度高(几乎100%)、平均消除半衰期约为7 h[1-2]。左乙拉西坦上市剂型多种,主要有普通薄膜衣片、口服液、注射液、缓释片等[3-4],广泛用于婴幼儿、小儿、成人等。但在其口服片剂中,规格较大,每片含主成分有0.25、0.5、0.75、1 g多种,最小的片质量也有0.4 g,因此患者用药依从性较差;而口服液则由于其携带的不便,且因存在多次开启使用后极有可能发生染菌的风险而使处方制备时往往会考虑添加防腐剂,故限制了其使用。综合片剂和口服液剂型的优劣,近期国外开发了干糖浆剂型,其商品名为E-keppra,规格为每袋1 g,含活性成分500 mg[4]。但该剂型仍然存在每次服药用量较大、不利于剂量调整、需加水溶解冲服致患者使用不便的缺点。
因此,依据左乙拉西坦的理化性质等特点,综合其现有上市剂型的利弊,考虑到可溶片剂型具有快速溶解的特点,笔者研制了左乙拉西坦可溶片。其规格依据口服液规格设定为每片100 mg,解决了上述已有口服剂型规格较大的问题。本文主要介绍左乙拉西坦可溶片处方及制备工艺的初步研究,并对可溶片质量进行初步评价。
1 材料
1.1 仪器
GHL-10型湿法混合造粒机(重庆南方制药机械厂);ZP-30型单冲压片机(北京国药农立制药机械有限公司);Sh-10型快速水分测定仪(上海精密天平仪器有限公司);ZB-3A型崩解仪、YD-1型硬度测定仪、CS-2型片剂脆碎度测定仪(天津大学精密仪器厂);高效液相色谱仪(美国Agilent公司)。
1.2 药品与试剂
左乙拉西坦原料药(批号:XLT2014032119、XLT-2014032120、XLT2014032124,纯度:98.5%)、左乙拉西坦对照品(批号:XLT2014032119D,纯度:99.5%)均由武汉鑫芯原科技有限公司提供;交联聚乙烯吡咯烷酮(上海宇昂化工发展有限公司,批号:PL1501213985);硬脂酸镁(山西省太原晋阳制药厂,批号:2014032561);甘露醇(广州市恒竤贸易有限公司,批号:G2014050220);乳糖(冀州市华阳化工有限责任公司,批号:20150418-003);聚乙烯吡咯烷酮(上海运宏化工医药辅料有限公司,批号:YH1411024124);微粉硅胶(浙江湖州展望医药化工有限公司,批号:H2013120511);其他试剂均为分析纯。
2 方法与结果
2.1 左乙拉西坦原料药理化性质考察
左乙拉西坦易溶于水,且室温下在不同pH溶剂中溶解度均大于1 g/mL;于室温高湿度(相对湿度为85%)条件下,几乎不吸湿[4]。
依据文献[5-7]测定方法,考察并测定各批次左乙拉西坦原料药流动性的相关物理指标,即堆密度、紧密度、休止角,并计算H值(紧密度/堆密度,用以评价物料包括颗粒的压缩性和流动性),结果见表1。
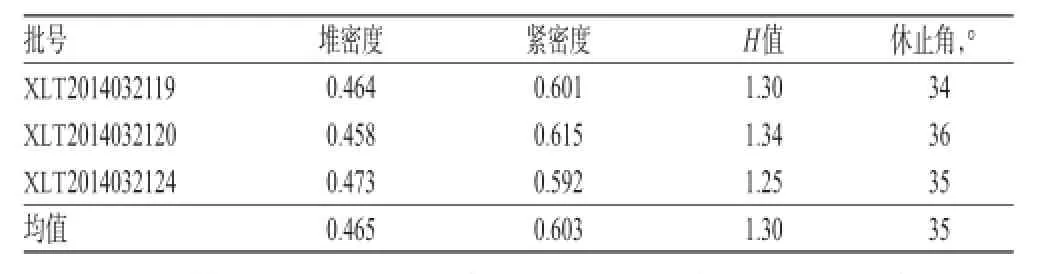
表1 原料药的流动性指标测定结果Tab 1 The results of liquidity indexes of crude drug
表1结果表明,左乙拉西坦原料药堆密度和紧密度批间略有差异;H值结果表明左乙拉西坦压缩性和流动性均符合湿法制粒工艺的原料药要求。由此初步判断左乙拉西坦制剂工艺宜选择湿法制粒工艺。
2.2 左乙拉西坦可溶片处方及制备工艺
2.2.1 处方组成 根据已上市的薄膜衣片和口服液处方信息[3-4],结合左乙拉西坦原料药前期研究数据,设计可溶片质量约220 mg,具体处方组成及各成分作用如下:左乙拉西坦(主药)100 mg,甘露醇(稀释剂)30 mg,乳糖(稀释剂)70 mg,交联聚乙烯吡咯烷酮(崩解剂)6 mg,聚乙烯吡咯烷酮(黏合剂)10 mg,微粉硅胶(助流剂)3 mg,硬脂酸镁(抗黏剂、润滑剂)1 mg。
2.2.2 颗粒粒径分布的测定 选用2015年版《中国药典》(四部)“凡例”规定的分样筛,称取3批处方颗粒50 g,分别通过二号筛(24目)、三号筛(50目)、五号筛(80目)、六号筛(100目),称取不能通过各号筛的原料药质量,计算质量百分比;以质量百分比为纵坐标、目数范围为横坐标绘制粒径分布图,结果见图1。
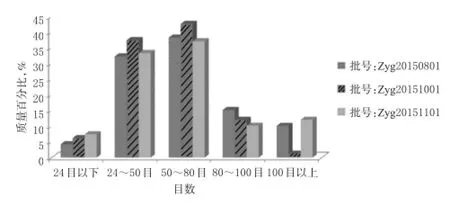
图1 3批处方颗粒粒径分布图Fig 1 The distribution of particle size of 3 batches of formula granules
图1结果表明,3批处方颗粒粒径分布在50~80目之间者占比为35%~40%,符合一般片剂制剂要求。
2.2.3 颗粒流动性指标的测定 对3批处方混合后颗粒(批号:Zyg20150801、Zyg20151001、Zyg20151101)进行堆密度、紧密度、休止角测定,并计算H值,结果见表2。
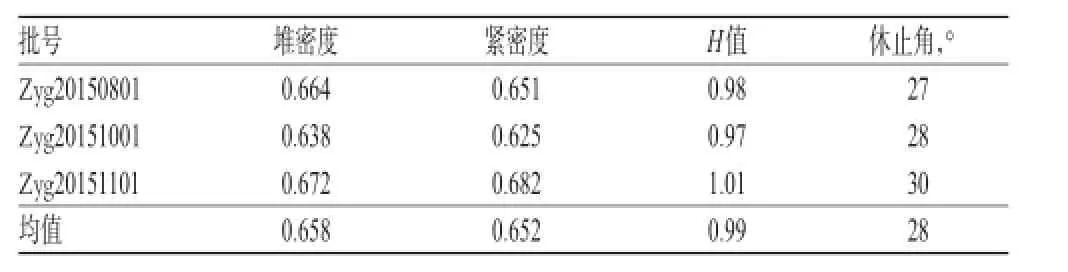
表2 3批处方颗粒流动性指标测定结果Tab 2 The results of liquidity indexes of 3 batches of formula granules
表2结果表明,选定的处方和制备工艺所制颗粒与原料药比较,堆密度和紧密度差值显著减小,且H值降低,流动性增加。因此,该处方颗粒具备良好的流动性和可压性。
2.2.4 水分的测定[5]分别称取3批处方颗粒,每份样品质量为10 g,置于快速水分测定仪中读数测定。结果,3批颗粒水分分别为3.1%、2.7%、3.5%,平均值为3.1%,均未超过4%,满足压片工艺的基本要求。
由上可知,原料药经混合后颗粒的各项指标满足混合均匀性等压片要求,可减少片质量差异并接近理论片质量。
2.2.5 制备工艺 按10 000片投料,称取左乙拉西坦1 kg、甘露醇300 g、乳糖700 g、交联聚乙烯吡咯烷酮30 g、聚乙烯吡咯烷酮100 g,加入湿法混合造粒机中,搅拌混合,以雾化方式对混合物料喷雾加水,搅拌混合;用40目筛制粒,置于烘箱中40~45℃干燥,时间约45 min;用30目筛整粒,加交联聚乙烯吡咯烷酮30 g、微粉硅胶300 g、硬脂酸镁10 g,混合,压片,包装,即得。
2.3 左乙拉西坦可溶片含量测定方法的建立
2.3.1 色谱条件确定 参考文献[8-10]确定色谱条件。以十八烷基硅烷键合硅胶为填充剂(250 mm×4.6 mm,5 μm),流动相为0.2%磷酸氢二钾溶液-乙腈(950∶50,用稀磷酸调pH至5.0),紫外检测波长为205 nm,流速为1.0 mL/min,进样体积为20 μL。理论板数按左乙拉西坦峰计应不低于5 000。
2.3.2 溶液的制备 (1)对照品溶液。取左乙拉西坦对照品50 mg,精密称定,置于50 mL量瓶中,用流动相溶解并稀释至刻度,摇匀;精密量取5 mL,置于50 mL量瓶中,再用流动相稀释至刻度,摇匀,即得。(2)供试品溶液。取本品20片,精密称定,研细,精密称取适量(约相当于左乙拉西坦50 mg),置于50 mL量瓶中,用流动相溶解,过滤,稀释至刻度,摇匀;精密量取5 mL,置于50 mL量瓶中,再用流动相稀释至刻度,摇匀,即得。(3)辅料溶液:精密称取左乙拉西坦可溶片辅料适量约100 mg,置于100 mL量瓶中,加流动相溶解并稀释至刻度,摇匀,滤过,即得。
2.3.3 专属性试验 取“2.3.2”项下3种溶液各20 μL注入色谱仪,记录色谱图。结果显示,辅料对主成分的测定无干扰。色谱图详见图2。
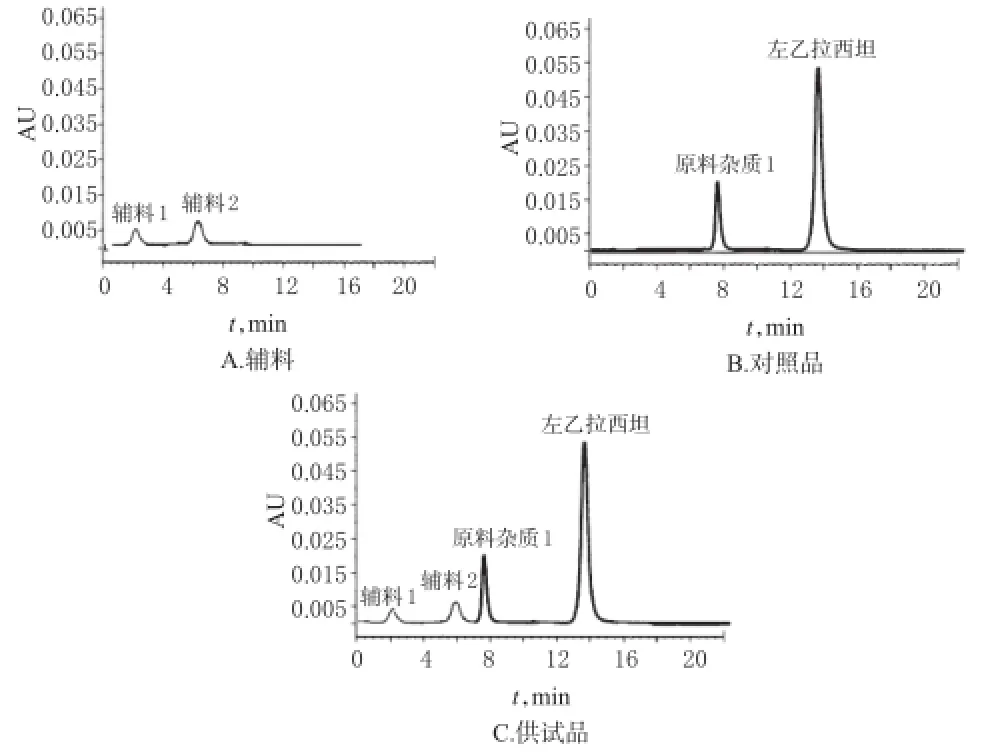
图2 高效液相色谱图Fig 2 HPLC chromatograms
2.3.4 线性关系考察 取质量浓度分别为0.08、0.09、0.1、0.108、0.12 mg/mL的对照品溶液,进样测定,记录色谱图。以质量浓度(x)横坐标、峰面积(y)为纵坐标,求得回归方程为y=41 460 223.421 9x+14 466.347 2(r=0.999 4),表明左乙拉西坦检测质量浓度线性范围为0.08~0.12 mg/mL。
2.3.5 定量限与检测限考察 称取左乙拉西坦对照品适量,用流动相制备成一定质量浓度的溶液,并逐步稀释,进样。在信噪比为10时测得定量限为0.03 μg/mL,在信噪比为3时测得检测限为0.01 μg/mL。
2.3.6 回收率考察 根据处方比例精密称取辅料9份,分别置于50 mL量瓶中,分别加入精密称定的左乙拉西坦对照品40、50、60 mg各3份,按供试品溶液制备方法制备;同时制备0.1 mg/mL的左乙拉西坦对照品溶液,进样测定,计算回收率。结果,平均回收率为99.67%(RSD=0.29%,n=3),表明本法测定准确度良好,符合含量测试要求。
2.3.7 重复性考察 取本品细粉适量,用流动相溶解并定量稀释制备成相当于左乙拉西坦0.1 mg/mL的溶液,连续进样6次,测定峰面积,结果峰面积的RSD为0.03%(n=6)。
2.3.8 精密度考察 称取同批次研细并混合均匀细粉适量,精密称定,用流动相溶解并稀释制成0.1 mg/mL的溶液,作为供试品溶液,平行制备6份。各溶液分别进样2次,测定峰面积。结果峰面积的RSD为0.33%(n=6)。
2.3.9 溶液稳定性考察 取本品细粉适量,用溶剂溶解并定量稀释制备成相当于左乙拉西坦0.1 mg/mL的溶液,分别于放置0、1、2、3、4、6、8 h后各进样分析,测定峰面积。结果峰面积的RSD为0.11%(n=7),表明溶液在8 h内稳定。
2.3.10 耐用性考察 对流动相pH、流速、流动相比例和色谱柱批号进行调整,分别在高限、正常、低限条件下,测定供试品溶液的含量,结果RSD均≤0.33%,详见表3。

表3 耐用性试验测定结果Tab 3 The results of serviceability test
表3结果表明,在对流速±0.2、流动相pH±0.2、流动相比例±2%范围和更换色谱柱批号等条件进行改变后,均对含量测定无影响。
2.3.11 含量测定 取本品20片,精密称定,研细,精密称取适量(约相当于左乙拉西坦50 mg),按“2.3.2”项下方法制备供试品溶液;同法制得对照品溶液。分别量取供试品溶液和对照品溶液20 μL,注入色谱仪中,记录色谱图,按照外标法以峰面积计算含量。
2.4 左乙拉西坦可溶片的质量评价
对3批可溶片(批号:Zyt20150801、Zyt20151001、Zyt20151101)进行外观、崩解时限[5]、溶化性[5]、硬度、脆碎度[5]及含量测定,结果见表4。

表4 左乙拉西坦可溶片的质量评价结果Tab 4 The quality evaluation result of Levetiracetam soluble tablets
3 讨论
左乙拉西坦生物学特征按生物药剂学分类系统分类为1类[9],在体内吸收完全,生物利用度高,因此,该药适合制备成口服制剂。
在制备研究过程中,笔者先对左乙拉西坦原料药的理化性质进行研究,再结合其化学性质稳定等特点选用工业适应性强的湿法制粒工艺制备颗粒。
通过对左乙拉西坦已有上市制剂的组成进行分析,笔者发现普通片剂组成多为微粉硅胶、交联羧甲基纤维素钠、硬脂酸镁、聚乙二醇3350、聚乙二醇6000、聚乙烯吡咯烷酮、滑石粉、二氧化钛等;颗粒剂组成多为D-甘露醇、阿斯巴甜、微粉硅胶、香料、聚乙烯吡咯烷酮等;口服液组成多为甘草酸铵、柠檬酸、甘油、麦芽糖醇、甲基苯酚、安赛蜜、水、柠檬酸钠、香精等。因此,基于上述分析,再通过相关试验并结合可溶片对颗粒剂的要求,筛选出适合左乙拉西坦可溶片的辅料组成。
对该制剂进行质量评价时尚未建立有关物质的考察项目,也未进行制剂稳定性试验,下一步尚需对此进行研究完善。
[1] 施安国,费艳秋,王平全.抗癫痫新药左乙拉西坦[J].中国新药杂志,2000,9(11):742-744.
[2] Abou-Khalil B,Lazenby B.Long-term experience with levetiracetam[J].Epileptic Disord,2003,5(Suppl 1):533-537.
[3] FDA.Center for drug evalution and research:labeling[EB/ OL].[2016-09-18].http://www.accessdata.fda.gov/drugsatfda_docs/nda/2015/207958Orig1s000lbl.pdf.
[4] 日本病院薬剤師会.医薬品インタビューフォーム[EB/ OL].[2016-09-18].http://www.pmda.go.jp/PmdaSearch/iyakuSearch/820110_1139010F1024_1_017_1F[1].
[5] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:附录7-8、103、118-119、120、133、324-326、378-379.
[6] 欧洲药品质量管理局.欧洲药典[S].7.0版.伦敦:欧洲药品质量管理局,2011:附录308-311.
[7] 欧洲药品质量管理局.欧洲药典[S].8.0版.伦敦:欧洲药品质量管理局,2013:附录4797-4799.
[8] 美国药典委员会.美国药典/国家处方集[S].USP 33-NF 28.华盛顿:美国药典委员会,2010:4521-4526.
[9] FDA.Center for drug evalution and research:Keppra_biopharmr[EB/OL].[2016-09-18].http://www.accessdata.fda.gov/drugsatfda_docs/nda/99/21035_Keppra_biopharmr_P1.pdf.
[10] Vermeij TA,Edelbroek PM.High-performance liquid chromatographic and megabore gas-liquid chromatographic determination of levetiracetam(ucb L059)in human serum after solid-phase extraction[J].J ChromatogrB Biomed Appl,1994,662(1):134-139.
(编辑:刘萍)
Study on Preparation Technology and Quality of Levetiracetam Soluble Tablets
SUN Jiayue,ZUO Jing(Dept.of Pharmacy,Suzhou Municipal Hospital,Anhui Suzhou 234000,China)
OBJECTIVE:To prepare Levetiracetam soluble tablets and evaluate its quality.METHODS:The liquidity indexes of raw material(bulk density,tap density,etc.)and the particle size distribution,liquidity indexes,moisture of the intermediate,that was mixed granules,were investigated to establish preparation method of tablet.The content of levetiracetam was determined by HPLC,and quality indexes of soluble tablets were evaluated,such as appearance,disintegration time,the content of main component.RESULTS:The wet granulation method was established to prepare Levetiracetam soluble tablets.The specification was 100 mg/220 mg of prepared tablets,it was bright in appearance,and disintegration time was less than 1 min;average content of levetiracetam was 100.1%,and rigidity was 7.5 kg;the friability of prepared tablets was up to the standard.CONCLUSIONS:The formulation and preparation technology of Levetiracetam soluble tablets are rational and controllable.The quality indexes of prepared tablets are all up to the requirements.
Levetiracet;Soluble tablet;Liquidity index;Formulation;Preparation technology;Quality evaluation
R943;971+.6
A
1001-0408(2017)04-0536-04
2016-08-26
2016-10-18)
*副主任药师。研究方向:药事管理、药物的开发与利用。电话:0557-3022635。E-mail:sjy0579@163.com
DOI10.6039/j.issn.1001-0408.2017.04.29
