复杂临床表现的幼年型粒单核细胞白血病1例
2017-04-07屈丽君路幼佳
程 杰 高 鑫 屈丽君 汪 俭 路幼佳 金 玲
·病案报告·
复杂临床表现的幼年型粒单核细胞白血病1例
程 杰1高 鑫1屈丽君1汪 俭1路幼佳1金 玲2
1 病例资料
男,2岁,因 “面色黄伴间断性发热1月余,咳嗽,加重3 d”于2015年4月9日收入安徽省立儿童医院(我院)。
G1P1,足月顺产,出生体重2.7 kg,出生时无窒息抢救史,生长发育正常。父母均体健,否认家族中有白血病史。入院前1个月,患儿无明显诱因发热(38.0℃),伴咳嗽、流鼻涕、面色发黄,当地诊所予退热(氨酚那敏)。热退后1~2 d再发热,反复多次。至入我院前3 d,咳嗽加重,当地医院行血常规检查(表1,4/6),WBC 67.8×109·L-1,转入我院。
体格检查:神志清楚,精神一般,反应可,面色黄,重度贫血貌,皮肤无皮疹,双足踝部位见散在瘀斑,双侧颈部及腹部可见多发牛奶咖啡斑,最大者直径约1 cm,双侧腹股沟见散在雀斑,双侧颌下可触及数枚肿大淋巴结,最大者直径约1.5 cm×1 cm,质韧,活动度差。颈软,两肺呼吸音粗,可闻及痰鸣音,心音有力,律齐,未闻及杂音,腹膨软,肝肋下6 cm,脾肋下5 cm,质硬,全腹无压痛,四肢活动可,肌力、肌张力正常,克氏征(-),布氏征(-),病理反射未引出。
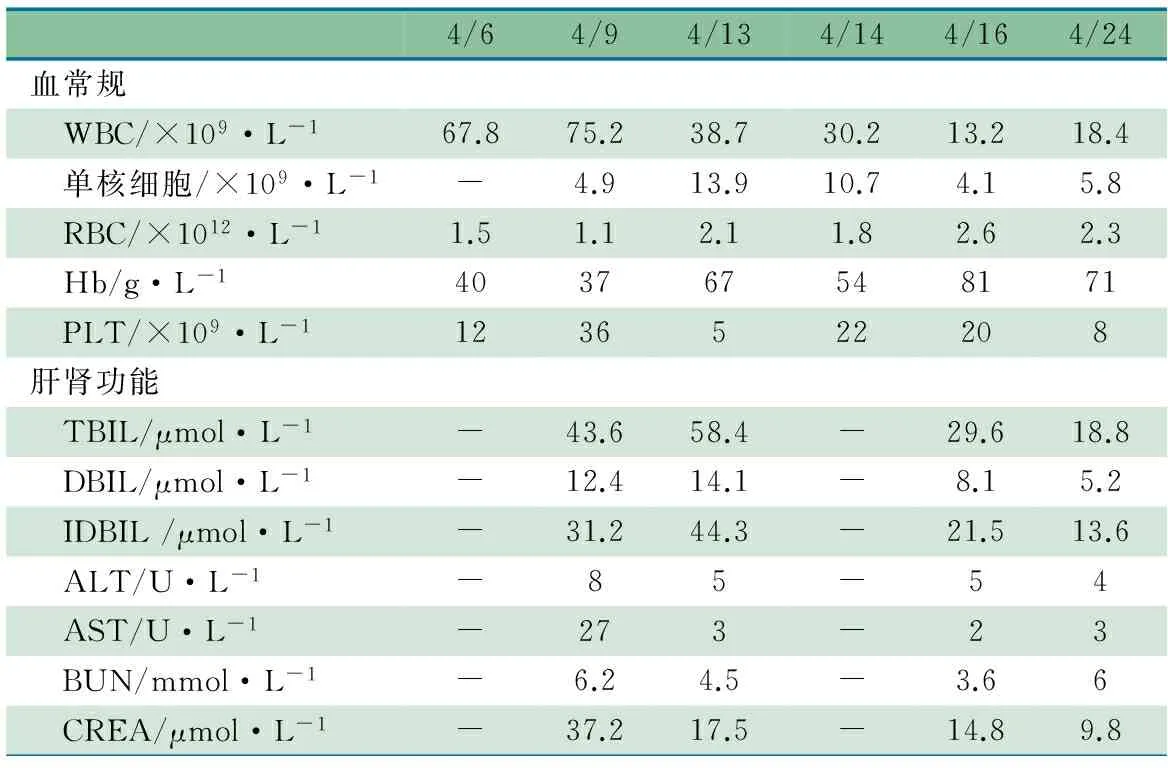
表1 血常规及肝肾功能检查结果
实验室检查:血常规及肝肾功能检查结果见表1(4/9),单核细胞6.6%,MCV 120 fL,Hct 12.8%,涂片见大量幼稚细胞。 CRP 26.7 mg·L-1。凝血指标PT 19.1 s,APTT 51.5 s,FIB 2.31 g·L-1,TT 18.8 s,INR 1.64。 大便常规(-), 血清铁蛋白 115.3 μg·L-1。Coomb's(-)。 TORCH(-)。 呼吸道病毒谱(-)。 血红蛋白F(HBF) 3%。尿常规白蛋白-,胆红素+ ,尿胆原 ++ ,白细胞每微升4个,RBC 每微升5个。
诊断与治疗:因患儿入院时有重度贫血貌、双下肢皮肤瘀斑,4月6日当地医院血常规提示重度贫血及PLT减少,故入院后即行血型鉴定,预约PLT治疗。血型鉴定困难,经多次抽取血标本后定性为AB型、RHO阳性,但交叉配血时出现主侧不凝集、次侧凝集现象。予对症支持治疗和头孢西丁抗感染。4月10日完善影像学检查。 胸部C T显示,双侧肺炎症,左下肺实变并累及胸膜;右侧气管-支气管发育畸形。 腹部B超肝脾肿大,腹水,胆囊胆泥淤积。头颅MRI、双眼球B超均未见明显异常。四肢长骨X线平片显示双侧股骨远端干骺端局部骨质密度减低。4月10~13日输注悬浮RBC、血浆和AB型单采PLT,患儿面色苍黄无改善,小便呈酱油色。4月12~13日患儿体温39.7~40℃,抗生素调整为注射用头孢哌酮钠舒巴坦钠。4月13日尿常规显示,尿液外观清,颜色淡红,白蛋白(-),胆红素+,尿胆原 +++,白细胞每微升4个,RBC 每微升5个。血常规(表1,4/13)显示贫血、PLT低,间接胆红素升高,考虑PLT无效输注、合并溶血性贫血。 当日再次输注PLT1 U及血浆200 mL。4月14日患儿面色黄加重,体温39.5℃,RBC 和Hb 较4月13日降低(表1,4/14),血培养结果未见细菌生长。鉴于应用头孢哌酮钠舒巴坦钠的过程中患儿仍发热,考虑该抗生素可能不能完全覆盖致病菌,故加用万古霉素联合抗感染;患儿病史较长,血象异常,外周血原始细胞比例增高,考虑为恶性血液病,免疫功能低下,不能排除合并真菌感染可能、故加用氟康唑抗
真菌治疗。给予洗涤RBC 2 U输注。患儿临床症状好转,面色转红润。4月15日患儿体温37.4℃。骨髓穿刺骨髓增生活跃,单核细胞占有核细胞22%,其中原幼单核细胞占13%左右,粒系增生减低,红系活跃,以中晚幼RBC为主,成熟RBC大小不等,考虑骨髓增生异常综合征/骨髓增殖性疾病骨髓象。 染色体:46,XY。 免疫分型:髓系原始细胞占全部有核细胞的4.1%,成熟单核细胞比例增高。 融合基因(-)。 根据国际幼年型粒单核细胞白血病(JMML)协作组2011诊断标准,临床诊断为JMML。因经济原因,家长拒绝行基因检查。 溶血性贫血检查结果:高铁Hb还原率 38.0%(参考范围>75%),葡萄糖6-磷酸脱氢酶弱荧光异常,异丙醇实验(-),RBC渗透脆性实验:正常。考虑为合并葡萄糖6-磷酸脱氢酶缺乏症。 COOM`S(-)。输PLT 1 U。4月20日复查胸部CT显示,肺部感染较前吸收,左下肺实变并累及胸膜,右侧气管-支气管发育不良 。经水化、碱化、抗感染治疗,患儿发热、咳嗽好转。 4月24日血复查血常规和肝肾功能(表1,4/24),提示与入院时及入院后早期比较贫血有所纠正,溶血停止。 建议行造血干细胞移植治疗,因经济原因,家长拒绝继续治疗。4月25日放弃治疗,出院。 出院诊断为JMML;I型神经纤维瘤病(NF-1);溶血性贫血;肺部感染。
2 讨论
JMML 是一种发病率极低的儿童恶性血液病,2008年WHO 将其定义为MDS/MPD (myelodysplastic/myeloproliferative neoplasm)。有报道该病从出现症状到诊断的平均时间是1.9(0~23)个月[1],诊断时平均年龄2岁[1,2]。Lee等[3]报道了1例新生儿出生时发病的JMML病例,患儿58日龄死亡。近20年来,随着JMML相关致病基因研究的发展,明确了RAS/MAPK信号转导路径异常活化是JMML的发病基础[4,5]。研究表明:90%的JMML患儿可检测到基因异常,其中35%为PTPN-11异常[6,7],20%~25%为N-RAS或者K-RAS异常,11%为NF-1异常[5]。诊断多采用2007年制定的JMML诊断标准,2011年做出少许调整[5、8]。JMML患儿如不经治疗,进展迅速。JMML对化疗不敏感,也无特效化疗药物,造血干细胞移植是治疗的有效手段,对所有的NF-1、PTPN-11、K-RAS突变患儿以及大部分的N-RAS突变患儿,建议造血干细胞移植治疗[9]。未经造血干细胞移植平均生存期10~12个月。研究表明,JMML的耐药机制与基因突变有关,近来,一项基于ddPCR技术的研究[10]显示30%的JMML患儿存在SETBP1突变,并且证明SETBP1突变与预后差有关。JMML的髓系祖细胞对G-CSF敏感。Nakazawa等[11]研究表明GM-CSF 受体相关嵌合抗原受体T细胞(GMR CART)对JMML干祖细胞有杀伤活性,而对正常的造血干细胞无杀伤活性。基于这个理论,CART细胞被尝试用于JMML的治疗。
本文JMML患儿除具有发病年龄小、反复感染和病程进展快等特点外,合并NFl,并且临床出现了溶血性贫血及输血治疗时输注无效现象。
NF-1是JMML相关的两种常见病之一,是一种常染色体遗传病,为多系统、多器官损伤,主要特征为皮肤牛奶咖啡斑和多发性皮肤软组织纤维瘤。NF-1由NF-1基因突变引起,NF-1基因编码的神经纤维瘤蛋白是一种RAS失活蛋白,属肿瘤抑制因子,当其突变时,NF-1表达量下降,从而削弱了活化的Ras通路的负反馈机制,使RAS信号通路过度活化,从而发病。NFl患儿患JMML的风险增加[12,13]。本例患儿的特点除了巨脾之外还包括皮肤多发的牛奶咖啡斑,以颈部和腹部为主,最大直径约1 cm,10余个,双侧腹股沟见散在分布的咖啡色雀斑。此外,四肢X线平片提示双侧股骨远端干骺端骨质密度减低。根据美国国家卫生协会(NIH)1998年提出的NF-1的诊断标准,该患儿可临床诊断为NF-1。因患儿家庭经济原因未行基因学检查,但符合临床诊断标准。
尽管JMML临床表现复杂多样,但合并溶血性贫血及无效输注现象鲜有报道。本例患儿实验室检查提示葡萄糖6-磷酸脱氢酶荧光弱阳性,高铁血红蛋白还原率降低,考虑合并有葡萄糖6-磷酸脱氢酶缺乏症,在感染、抗生素使用等诱因下出现溶血现象。赵伟莹等[14]通过临床分析表明:感染是继发性自身免疫性溶血性贫血的主要诱因。同时,在感染情况下,机体产生自身抗体,导致血型鉴定困难及血液无效输注。PLT抗体是直接影响PLT输注效果的重要免疫因素之一。通过输注洗涤RBC减少抗体的输入,输注效果有所提高。
本例患儿血型鉴定困难,经多次抽取血标本后定性为AB型,RHO阳性,但交叉配血时出现主侧不凝集、次侧凝集现象。吴敏华等[15]报道2000至2007年共发现5例恶性血液病患者ABO血型正反定型不相符合,均出现A或B抗原弱化。文献表明[16],血液病患者机体的造血功能减弱或遭到破坏使造血干细胞功能异常,特别是粒细胞系统呈病理性增生,RBC系统受抑制,成熟RBC显著减少或形态发生改变可能导致RBC表面血型抗原的抗原性减弱或改变,从而引起机体血型血清学发生变化。有报道部分恶性血液病引起血型血清学检查异常特征尤为多见[17]。
[1]Niemeyer CM,Arico M,Basso G ,et al.Chronic myelomonocytic leukemia in childhood:a retrospective analysis of 1 cases.European Working Group on Myelodysplastic Syndromes in Childhood (EWOGMDS).Blood,1997,89(10):3534-3543
[2]Aricò M,Biondi A,Pui CH.Juvenile myelomonocytic leukemia.Blood,1997,90(2):479-488
[3]Lee ML,Yen HJ,Chen SJ,et al .Juvenile Myelomonocytic Leukemia in a Premature Neonate Mimicking Neonatal Sepsis.Pediatr Neonatol.2016,57(2):149-152
[4]Yoshimi A,Kojima S,Hirano N.Juvenile myelomonocytic leukemia:epidemiology,etiopathogenesis,diagnosis,and management considerations.Paediatr Drugs,2010,12(1):11-21
[5]Lob MI.Recent advances in the pathogenesis and treatment of juvenile myelomonocytic leukaemia.Br J Haematol,2011,152(6):677-687
[6]Tartaglia M,Niemeyer CM,Fragale A,et al.Somatic mutations in PTPN11 in juvenile myelomonocytic leukemia,myelodysplastic syndromes and acute myeloid leukemia.Nat Genet,2003,34(2):148-150
[7]Kratz CP,Niemeyer CM,Castleberry RP,et al.The mutational spectrum of PTPN11 in juvenile myelomonocytic leukemia and Noonan syndrome/myeloproliferative disease.Blood,2005,106(6):2183-2185
[8]Hall J,Foucar K.Diagnosing myelodysplastic/myeloproliferative neoplasms:laboratory testing strategies to exclude other disorders.Int J Lab Hematol,2010,32(6 Pt 2):559-571
[9]杨文钰,陈晓娟,王书春,等.儿童幼年型粒单核细胞白血病突变 基因型与临床特征分析.中国当代儿科杂志,2015,17(1):1-5
[10]Stieglitz E,Troup CB,Gelston LC,et al.Subclonal mutations in SETBP1 confer a poor prognosis in juvenile myelomonocytic leukemia.Blood,2015,125(3) :516-524
[11]Nakazawa Y,Matsuda K,Kurata T,et al.Anti-proliferative effects of T cells expressing a ligand-based chimeric antigen receptor against CD116 on CD34(+) cells of juvenile myelomonocytic leukemia.J Hematol Oncol,2016,9:27
[12]Side LE,Emanuel PD,Taylor B,et al.Mutations of the NF1 gene in children with juvenile myelomonocytic leukemia without clinical evidence of neurofibromatosis,type 1.Blood,1998,92(1):267-272
[13]Steinemann D,Arning L,Praulich I,et al.Mitotic recombination and compound-heterozygous mutations are predominant NF1-inactivating mechanisms in children with juvenile myelomonocytic leukemia and neurofibromatosis type 1.Haematologica ,2010,95(2):320-323
[14]赵伟莹 徐酉华.105例儿童自身免疫性溶血性贫血的病因分析.重庆医学,2015,44(7):931-933
[15]吴敏华,陈活强,蔡葵.恶性血液病引起ABO血型鉴定困难的探讨.实验与检验医学,2008,26(6):690-690
[16]马文军,杨晓兰,赵新玉.由白血病引起的血型正反向定型不合一例.临床误诊误治,2005,18(9):679
[17]李志强,陈卫宾,徐文皓,等.急性白血病分型与红细胞ABO血型抗原强度相关性分析.临床荟萃,1999,14(19):893-894
(本文编辑:张崇凡,孙晋枫)
1 安徽医科大学儿科临床学院安徽省立儿童医院血液科; 北京儿童医院血液中心安徽分中心 合肥,230051;2 北京儿童医院血液肿瘤中心 北京,100045
屈丽君,E-mail:cheng.jieyu@163.com
10.3969/j.issn.1673-5501.2017.01.015
2016-07-18
2017-02-09)
